Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
ДНК, РНК и синтез белка
Трансляция
Трансляция осуществляется при участии мРНК, разных тРНК, «нагруженных» соответствующими аминокислотами, рибосом и множества белковых факторов, обеспечивающих инициацию, элонгацию и терминацию синтеза полипептидной цепи. Трансляция в прокариотических клетках инициируется формилметиониновой тРНК, которая так и называется — инициаторная тРНК. При участии белковых факторов антикодон 3'-UAC-5' инициаторной тРНKfMet (fMet — модифицированный метионин, аминогруппа которого формилирована) связывается с кодоном 5-AUG-3' мРНК, образующей комплекс с малой рибосомной субъединицей. Никакая другая тРНК соединиться с этим комплексом не может. В свою очередь связывание мРНК с малой рибосомной субъединицей осуществляется посредством образования нуклеотидных пар между последовательностью примерно из восьми нуклеотидов (последовательность Шайна-Дальгарно), которая расположена вблизи 5'-конца мРНК, и комплементарной 3'-концевой последовательностью рРНК, связанной с малой рибосомной субъединицей. К комплексу fMet-тРНКfMet-мРНК-малая субъединица присоединяется большая субъединица, и образуется инициаторный комплекс (комплекс инициации) (рис. 3.15).
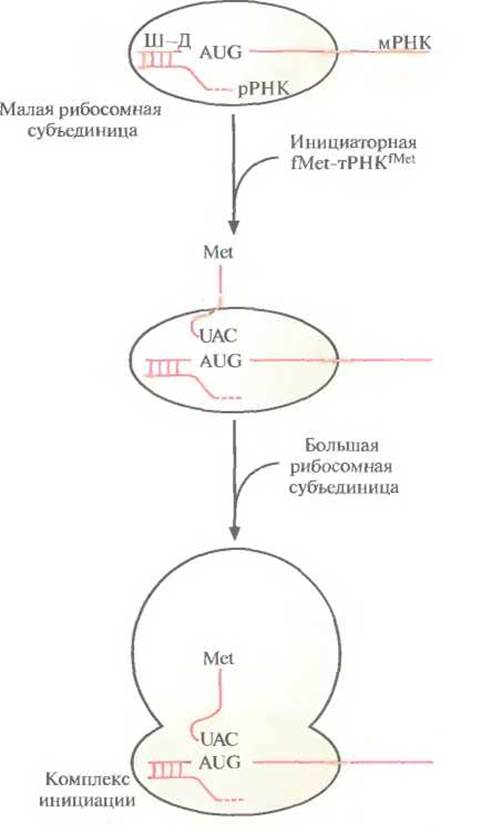
Рис. 3.15. Инициация трансляции в прокариотической клетке. Последовательность Шайна—Дальгарно (Ш—Д), находящаяся вблизи 5'-конца мРНК, связывается с комплементарной 3'-концевой последовательностью рРНК, образующей комплекс с малой рибосомной субъединицей. Антикодон (UAC) инициаторной fMet-тРНКfMet спаривается со старт-кодоном (AUG) мРНК. К образовавшемуся комплексу присоединяется большая рибосомная субъединица, и образуется комплекс инициации. Аминогруппа метионина, связанного с инициаторной тРНК, формилирована (СНО) (на рисунке не изображено). После трансляции формилметионин отщепляется от белковой цепи.
У эукариот трансляция инициируется связыванием специфической «нагруженной» инициаторной тРНК (Met-TPHKMet) и факторов инициации с малой рибосомной субъединицей. Затем мРНК присоединяется своим 5'-концом к комплексу тРНК — малая рибосомная субъединица, и комплекс продвигается по мРНК до старт-кодона (AUG). Далее антикодон UAC инициаторной Met rPHKMet спаривается с кодоном AUG мРНК. К комплексу присоединяется большая рибосомная субъединица, и образуется инициаторный комплекс (рис. 3.16.)
Этапы элонгации и терминации у про- и эукариот во многом сходны. Процесс элонгации включает образование пептидных связей между соседними аминокислотами, при этом очередность присоединяемых аминокислот определяется очередностью кодонов в мРНК (рис. 3.17). Рассмотрим процесс более подробно. После образования инициаторного комплекса кодон в молекуле мРНК, следующий за кодоном AUG, спаривается с комплементарным ему антикодоном соответствующей тРНК, определяя таким образом, какая из нагруженных тРНК присоединится к рибосоме (ненагруженные тРНК не связываются с рибосомами). Если вторым триплетом в мРНК оказывается CUG, то следующей к рибосомному комплексу присоединяется несущая лейцин тРНК с антикодоном 3'-GAC-5'. Когда эта тРНК оказывается на месте, между карбоксильной группой метионина и аминогруппой лейцина с помощью ферментативной активности, присущей" большой субъединице, образуется пептидная связь, при этом лейцин остается связанным со своей тРНК, а метионин отсоединяется от инициаторной тРНК, и последняя отделяется от рибосомы. Комплекс метионин—лейцин—tPHKLeu—мРНК «протягивается» через рибосому (транслокация), так что следующий кодон мРНК может связаться с нагруженной тРНК, несущей соответствующий антикодон. Если третьим кодоном мРНК является UUU, то следующей аминокислотой в растущей полипептидной цепи будет фенилаланин; его доставит к рибосоме тРНК с антикодоном ААА. Когда эта тРНК окажется на месте, между карбоксильной группой лейцина и аминогруппой фенилаланина образуется пептидная связь. tPHKLeu отделится от рибосомы, произойдет транслокация пептидил-тРНКPhe (тРНК с присоединенной к ней растущей полипептидной цепью), и следующий кодон мРНК сможет связаться с антикодоном соответствующей нагруженной тРНК. Эти события — связывание нагруженной тРНК с мРНК благодаря комплементарному спариванию кодона с антикодоном, образование пептидной связи, отсоединение «разгруженной» тРНК, транслокация — продолжаются до тех пор, пока не соединятся друг с другом все аминокислоты, закодированные в мРНК. Трансляция происходит в направлении 5'—3' со скоростью примерно 15 аминокислот в секунду. Когда 5'-конец мРНК высвобождается из рибосомного комплекса, он может связаться с другим таким же комплексом, так что одна молекула мРНК может одновременно транслироваться множеством рибосом.
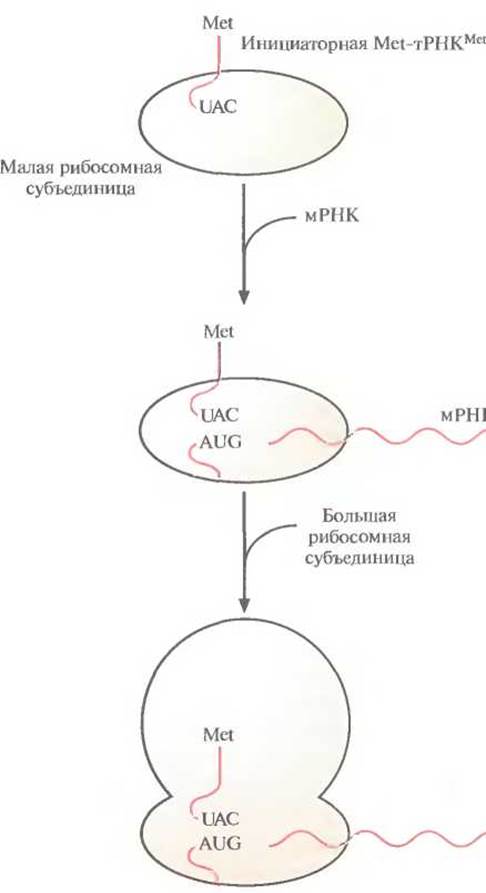
Рис. 3.16. Инициация трансляции в эукариотической клетке. Малая рибосомная субъединица связывается с инициаторной тРНК, «нагруженной» метионином (Met-TPHKMet), комплекс продвигается по мРНК, пока антикодон UAC инициаторной тРНК не спарится со старт-кодоном AUG мРНК. Далее к комплексу мРНК—тРНК—малая субъединица присоединяется большая субъединица и образуется комплекс инициации.

Рис. 3.17. Элонгация полипептидной цепи. А. Второй кодон (CUG) в мРНК связывается с антикодоном (GAC) Leu-тРНКLeu. Б. Метионин образует пептидную связь с лейцином, доставленным тРНКLeu, освободившаяся от аминокислоты инициаторная тРНК отсоединяется. В. Транслокация комплекса пептидил-тРНК—мРНК с экспонированием следующего кодона (UUU). Г. Третий кодон (UUU) спаривается с антикодоном ААА Рhe-тРНKPhe. Д Лейцин образует пептидную связь с фенилаланином, доставленным тРНКРhе, освободившаяся от аминокислоты тРНКLeu отсоединяется от рибосомы. E. Транслокация комплекса пептцидил-тРНК—мРНК с экспонированием следующего кодона, и т. д.
Элонгация продолжается до тех пор, пока рибосома не дойдет до кодона UAA, UAG или UGA (стоп-кодон, терминирующий кодон) (рис. 3.18). В норме в клетках отсутствуют тРНК с антикодонами, комплементарными сигналам терминации. Их узнают белковые факторы освобождения (терминации). При связывании фактора освобождения с рибосомой происходит гидролиз связи между последней тРНК и полипептидом, свободная тРНК, полипептидная цепь и мРНК отсоединяются от рибосомы. Рибосома диссоциирует на субъединицы, которые могут вновь участвовать в трансляции.
После трансляции многие полипептиды подвергаются различным модификациям. У большинства из них отщепляется N-концевой метионин, так что N-концевым остатком становится вторая аминокислота. У эукариот происходит так называемый процессинг некоторых белков, когда полипептвдная цепь расщепляется в определенных сайтах с образованием более коротких белковых молекул со специфическими функциями. В некоторых случаях, особенно в эукариотических клетках, к определенным аминокислотам ферментативным путем присоединяются фосфатные группы, липиды, углеводы или другие низкомолекулярные соединения. В результате этих химических модификаций образуются белки, выполняющие в клетке специфические функции. Генетический словарь состоит из 64 кодонов. Три из них — это стоп-кодоны, а один (AUG) — старт-кодон (табл. 3.2), кодирующий еще и аминокислоту метионин. Когда кодон AUG находится не на 5'-конце молекулы мРНК, а в ее внутренней области, то он распознается другой тРНК (Met-TPHKMet), к которой присоединен немодифицированный метионин. Аминокислота триптофан кодируется всего одним кодоном (UGG), остальные аминокислоты, из которых состоят белки, — по крайней мере двумя, чаще четырьмя, а иногда и шестью кодонами. Например, для лейцина существует шесть кодонов: UUA, UUG, CUU, CUC, CUA и CUG. Синонимичные кодоны используются различными организмами с разной частотой. Из четырех кодонов для глицина GGA используется в структурных генах человека в 26% случаев, а в Escherichia coli — в 9%. Такая же ситуация наблюдается и для стоп-кодонов. Так, у человека частота использования кодонов UAA, UAG и UGA составляет 0,22, 0,17 и 0,61 соответственно, а у Е. coli — 0,62, 0,09 и 0,30. Несмотря на все эти различия, генетический код у всех организмов, за редким исключением, одинаков.
Таблица 3.2. Генетический код и частота использования разных кодонов в геноме Е. coli и человека
|
Кодон |
Аминокислота Частота использования |
Кодон |
Аминокислота |
Частота использования |
|||
|
Е. coli |
человек |
Е. coli |
человек |
||||
|
GGG |
Глицин |
0,13 |
0,23 |
UAG |
Стоп |
0,09 |
0,17 |
|
GGA |
Глицин |
0,09 |
0,26 |
UAA |
Стоп |
0,62 |
0,22 |
|
GGU |
Глицин |
0,38 |
0,18 |
UAU |
Тирозин |
0,53 |
0,42 |
|
GGC |
Глицин |
0,40 |
0,33 |
UAC |
Тирозин |
0,47 |
0,58 |
|
GAG |
Глутаминовая кислота |
0,30 |
0,59 |
UUU |
Фенилаланин |
0,51 |
0,43 |
|
GAA |
Глутаминовая кислота |
0,70 |
0,41 |
UUC |
Фенилаланин |
0,49 |
0,57 |
|
GAU |
Аспарагиновая кислота |
0,59 |
0,44 |
UCG |
Серин |
0,13 |
0,06 |
|
GAC |
Аспарагиновая кислота |
0,41 |
0,56 |
UCA |
Серин |
0,12 |
0,15 |
|
GUG |
Валин |
0,34 |
0,48 |
UCU |
Серин |
0,19 |
0,17 |
|
GUA |
Валин |
0,17 |
0,10 |
UCC |
Серин |
0,17 |
0,23 |
|
GUU |
Валин |
0,29 |
0,17 |
AGU |
Серин |
0,13 |
0,14 |
|
GUC |
Валин |
0,20 |
0,25 |
AGC |
Серин |
0,27 |
0,25 |
|
GCG |
Аланин |
0,34 |
0,10 |
CGG |
Аргинин |
0,08 |
0,19 |
|
GCA |
Аланин |
0,22 |
0,22 |
CGA |
Аргинин |
0,05 |
0,10 |
|
GCU |
Аланин |
0,19 |
0,28 |
CGU |
Аргинин |
0,42 |
0,09 |
|
GCC |
Аланин |
0,25 |
0,40 |
CGC |
Аргинин |
0,37 |
0,19 |
|
AAG |
Лизин |
0,24 |
0,60 |
AGG |
Аргинин |
0,03 |
0,22 |
|
AAA |
Лизин |
0,76 |
0,40 |
AGA |
Аргинин |
0,04 |
0,21 |
|
AAU |
Аспарагин |
0,39 |
0,44 |
CAG |
Глутамин |
0,69 |
0,73 |
|
AAC |
Аспарагин |
0,61 |
0,56 |
САА |
Глутамин |
0,31 |
0,27 |
|
AUG |
Метионин, старт |
1,00 |
1,00 |
CAU |
Гистидин |
0,52 |
0,41 |
|
AUA |
Изолейцин |
0,07 |
0,14 |
САС |
Гистидин |
0,48 |
0,59 |
|
AUU |
Изолейцин |
0,47 |
0,35 |
CUG |
Лейцин |
0,55 |
0,43 |
|
AUC |
Изолейцин |
0,46 |
0,51 |
CUA |
Лейцин |
0,03 |
0,07 |
|
ACG |
Треонин |
0,23 |
0,12 |
CUU |
Лейцин |
0,10 |
0,12 |
|
АСА |
Треонин |
0,12 |
0,27 |
CUC |
Лейцин |
0,10 |
0,20 |
|
ACU |
Треонин |
0,21 |
0,23 |
UUG |
Лейцин |
0,11 |
0,12 |
|
ACC |
Треонин |
0,43 |
0,38 |
UUA |
Лейцин |
0,11 |
0,06 |
|
UGG |
Триптофан |
1.00 |
1,00 |
CCG |
Пролин |
0,55 |
0,11 |
|
UGU |
Цистеин |
0,43 |
0,42 |
CCA |
Пролин |
0,20 |
0,27 |
|
UGC |
Цистеин |
0,57 |
0,58 |
CCU |
Пролин |
0,16 |
0,29 |
|
UGA |
Стоп |
0,30 |
0,61 1 |
CCC |
Пролин |
0,10 |
0,33 |