Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Технология рекомбинантных ДНК
Векторы для клонирования крупных фрагментов ДНК
Векторы на основе бактериофага Я С помощью плазмидных векторов можно клонировать фрагменты ДНК длиной до 10 т. п. н. Однако при создании геномных библиотек час
то приходится работать с более крупными фрагментами. Для этого были разработаны векторы на основе бактериофага λ Е. coli.
После проникновения фага λ в клетку Е. coli события могут развиваться по двум сценариям. Если реализуется литический цикл, то фаг начинает интенсивно размножаться и примерно через 20 мин клетка разрушается (лизирует) с высвобождением до 100 новых фаговых частиц. При альтернативном варианте развития событий фаговая ДНК включается в хромосому Е. coli как профаг и реплицируется в клетке вместе с нормальными бактериальными генами (состояние лизогении). Однако при недостатке питательных веществ или иных неблагоприятных обстоятельствах интегрированная фаговая ДНК высвобождается, и запускается литический цикл развития. Размер ДНК фага X составляет примерно 50 т. п. н., причем значительная ее часть (около 20 т. п. н.) несущественна для размножения фага и отвечает за его встраивание в хозяйскую ДНК. В связи с этим возникла идея, что ее можно заменить фрагментом другой ДНК эквивалентного размера. Образующаяся рекомбинантная молекула будет реплицироваться в клетке как ДНК «рекомбинантного» фага X, «вставшего» на литический путь развития.
Чтобы понять, как функционирует векторная система на основе фага X, необходимо рассмотреть молекулярные аспекты литического цикла развития. Инфекционная фаговая частица имеет головку, в которой заключена плотно упакованная ДНК длиной примерно 50 т. п. н., и отросток с отходящими от него тонкими белковыми нитями (фибриллами). Сборка головки и отростка и упаковка ДНК четко скоординированы. ДНК фага X — это линейная двухцепочечная молекула длиной 50 т. п. н. с одноцепочечными 5'-«хвостами» из 12 нуклеотидов. Их называют липкими (cos) концами, поскольку они взаимно комплементарны и могут спариваться друг с другом. После того как фаговая ДНК проходит через отросток и попадает в Е. coli, cos-концы соединяются с образованием кольцевой молекулы. На раннем этапе литического цикла в результате репликации кольцевой молекулы ДНК образуется линейная молекула, состоящая из нескольких сегментов длиной 50 т. п. н. (рис. 4.16, А). Каждый из таких сегментов упаковывается в белковую головку, к последней присоединяется уже собранный отросток и образуется новая фаговая частица (рис. 4.16, Б). При упаковке молекулы ДНК длиной менее 38 т. п. н. получается неинфекционная фаговая частица, а фрагменты длиной более 52 т. п. н. не умещаются в головку. Сегменты длиной 50 т. п. н. в линейной молекуле ДНК разделены cos-сайтами, и именно по этим сайтам разрезается молекула, когда очередной сегмент заполняет головку. Разрезание осуществляет фермент, находящийся у входа в головку.
В результате исследований по изучению сборки фага X была разработана система упаковки молекул ДНК in vitro с образованием инфекционных фаговых частиц. Смешав в пробирке очищенные пустые головки, фаговую ДНК и собранные отростки, можно получить инфекционные фаговые частицы.
Один из множества λ-векторов для клонирования имеет два BamHI-сайта, фланкирующих участок длиной 20 т. п. н. При гидролизе очищенной фаговой ДНК рестриктазой ВаmHI образуется три фрагмента. Так называемое левое плечо (область L) содержит генетическую информацию о головке и отростке фага, правое плечо (область R) ведает репликацией ДНК и лизисом, а средний сегмент имеет гены, ответственные за процессы интеграции и исключения (сегмент I/Е, от англ. integration/excision). Задача исследователя состоит в том, чтобы заменить этот центральный участок нуклеотидной последовательностью длиной примерно 20 т. п. н. (рис. 4.17) нужной ДНК. ДНК, предназначенную для клонирования, тоже расщепляют с помощью BamHI и выделяют фрагменты размером от 15 до 20 т. п. н. Оба препарата — фаговую и чужеродную ДНК — объединяют и добавляют ДНК-лигазу фага Т4, а затем — пустые головки и уже собранные отростки. Фрагменты ДНК длиной 50 т. п. н. упаковываются в головки, к ним присоединяются отростки и образуются инфекционные фаговые частицы. Фрагменты большего (>52 т. п. н.) или меньшего (<38 т. п. н.) размера упаковываться не могут. Рекомбинантный фаг к может размножаться только в тех штаммах Е. coli, которые не обеспечивают размножения фага к с интактной областью 1/Е. Для сохранения рекомбинантного фага к его периодически пересевают на свежую культуру Е. coli.

Рис. 4.16. Литический путь развития бактериофага λ. А. При репликации кольцевой ДНК бактериофага λ образуется линейная молекула, состоящая из повторяющихся сегментов длиной примерно 50 т. п. н. Каждый из этих сегментов представляет собой полноразмерную фаговую ДНК. Б. Фаговая головка вмещает один такой сегмент, затем к головке присоединяется уже собранный отросток.
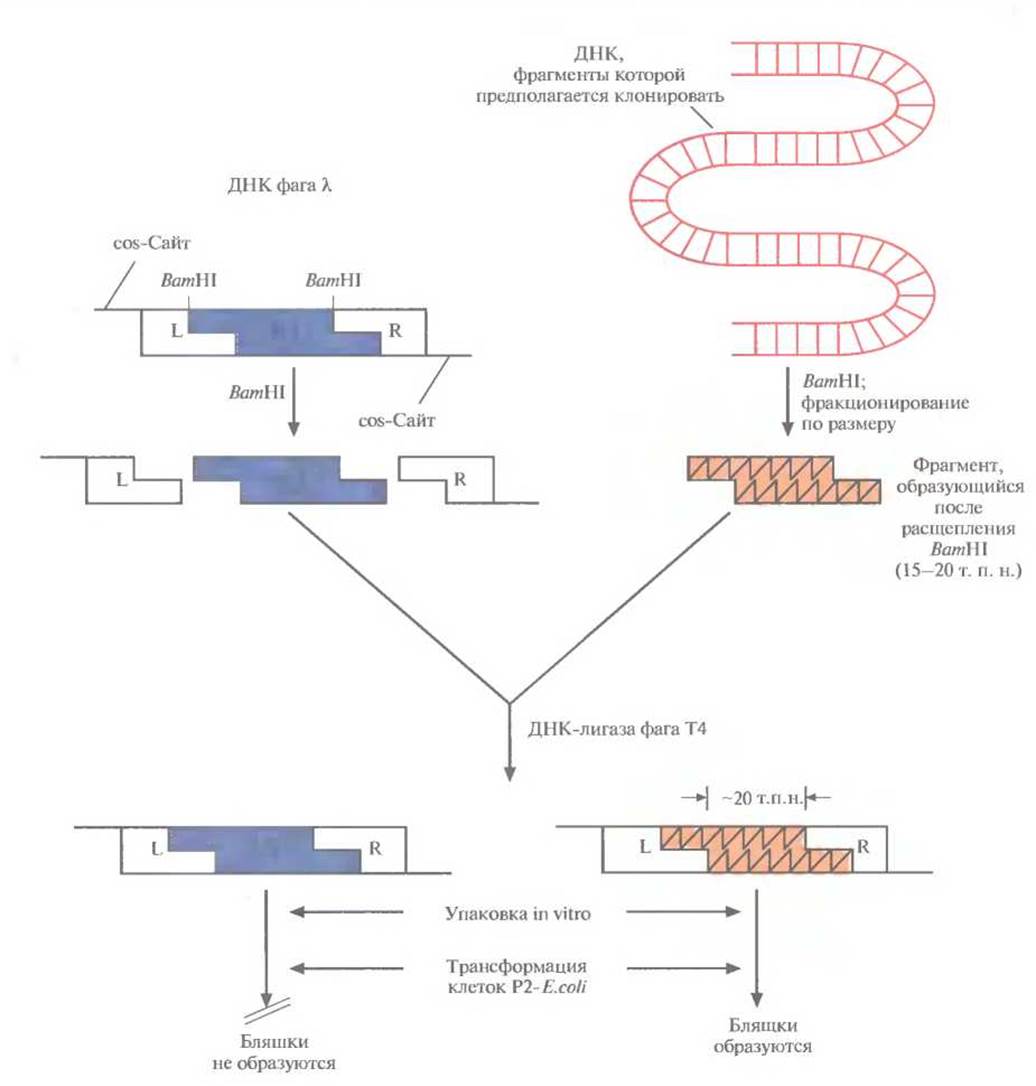
Рис. 4.17. Клонирующая система на основе бактериофага X. Фаговая ДНК имеет два BamНІ-сайта, фланкирующих ее I/Е-сегмент. Клонируемую ДНК расщепляют с помощью ВатHI, фракционируют полученные фрагменты по размеру и выделяют те из них, которые имеют размер от 15 до 20 т. п. н. Фаговую ДНК обрабатывают этим же ферментом. Оба препарата ДНК смешивают и обрабатывают ДНК-лигазой фага Т4. Лигированная смесь содержит самые разные комбинации ДНК, в том числе 1) восстановленную ДНК фага λ и 2) рекомбинантные молекулы, содержащие R- и L-области фаговой ДНК и вставку клонируемой ДНК размером ~20 т. п. н., занявшую место области I/Е фагового генома. Рекомбинантные молекулы упаковывают в головки бактериофага X in vitro, и после добавления отростков получают инфекционные фаговые частицы. В инфицированных рекомбинантным фагом клетках Е. coli, в хромосому которых интегрирована ДНК бактериофага Р2, могут реплицироваться и образовывать инфекционные частицы только молекулы ДНК, составленные из R- и L-областей фаговой ДНК и клонированной вставки размером ~20 т.п.н.
Для скрининга библиотек на основе фага к можно использовать ДНК-зонды или иммунологические методы. Зоны лизиса (бляшки) переносят на фильтр и соответствующим образом тестируют. Если используется ДНК-гибридизация, то вначале удаляют фаговые белки, затем ДНК денатурируют и фиксируют на фильтре. При тестировании иммунологическим методом белки, кодируемые клонированными генами, переносят и фиксируют на фильтре вместе с бляшкой. Сопоставив пятна на фильтре, дающие положительную реакцию, с бляшками на исходной чашке, отбирают позитивные бляшки и проводят субкультивирование. Субкультуры служат источником рекомбинантных бактериофагов, которые можно по отдельности культивировать в Е. coli.
Космиды
Векторы, называемые космидами, могут включать до 40 т. п. н. чужеродной ДНК и при этом активно амплифицироваться в Е. coli как плазмиды. Космиды объединяют в себе свойства плазмидных векторов и векторов на основе фага к. Например, широко применяемая космида pLFR-5 (приблизительно 6 т. п. н.) имеет два cos-сайта фага к, разделенных сайтом рестрикции для Seal, полилинкер с шестью уникальными сайтами рестрикции (HindIIl, Pstl, Sail, BamHl, Smal и EcoRI), точку начала репликации ДНК (ori) и ген устойчивости к тетрациклину (Tetr). Эта космида может интегрировать чужеродную ДНК длиной до 40 т. п. н. (рис. 4.18). Предназначенные для клонирования фрагменты ДНК длиной около 40 т. п. н. очищают центрифугированием в градиенте плотности сахарозы от продуктов частичного гидролиза донорной ДНК рестриктазой BamWl (рис. 4.18), a pLFR-5 сначала подвергают гидролизу с помощью Scal, а затем BamWl. Препараты ДНК смешивают и лигируют. Те продукты лигирования, которые содержат вставку длиной 40 т. п. н., имеют суммарный размер, близкий к 50 т. п. н., и следовательно, могут упаковываться in vitro в головки фага к. Реассоциировавшие молекулы pLFR-5, не содержащие вставок, упакованы не будут. После сборки фаговых частиц инфицируют ими Е. coli (рис. 4.18).
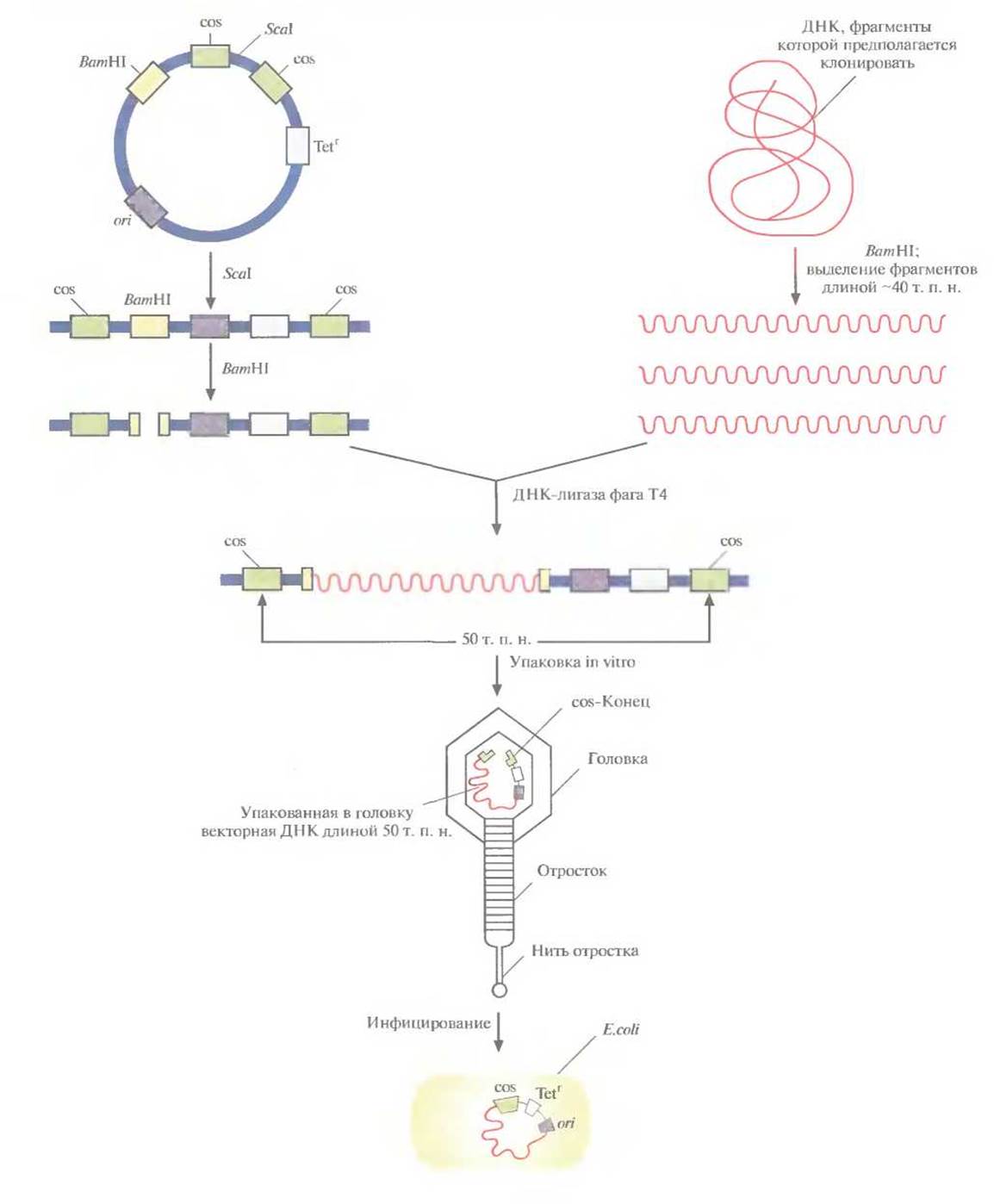
Рис. 4.18. Клонирование с помощью космидного вектора. Космида имеет точку начала репликации (ori). обеспечивающую ее существование в Е. coli в виде плазмиды; два интактных cos-конца, разделенных уникальным сайтом для Seal; BamHI-сайт вблизи одного из cos-сайтов и ген устойчивости к тетрациклину (Tetr). ДНК, которую хотят клонировать, расщепляют рестриктазой BamHI и фракционируют по размеру, чтобы выделить молекулы длиной примерно 40 т. п. н. Плазмидную ДНК расщепляют с помощью Seal и BamHI. Оба препарата ДНК смешивают и обрабатывают ДНК-лигазой фага Т4. Некоторые из гибридных молекул, образовавшихся после лигирования, содержат вставку размером около 40 т. п. н., так что их суммарная длина составляет примерно 50 т. п. н. Эти молекулы упаковываются in vitro в головки бактериофага к, затем к головкам прикрепляются отростки, и образуются инфекционные частицы. При инфицировании этим «фагом» Е. coli в бактериальной клетке оказывается линейная молекула ДНК с cos-концами, которые спариваются друг с другом ДНК-лигаза клетки-хозяина зашивает одноцепочечные разрывы, и образовавшаяся кольцевая молекула существует в клетке-хозяине как автономно реплицирующаяся единица. Трансформированные клетки можно идентифицировать по признаку устойчивости к тетрациклину.
Оказавшись в бактериальной клетке, линейная молекула pLFR-5 со вставкой замыкается в кольцо благодаря спариванию cos-сайтов. В такой стабильной конфигурации она может долгое время существовать в клетке и реплицироваться как гибридная плазмида, поскольку содержит все необходимые для этого элементы. Более того, ген устойчивости к тетрациклину обеспечивает рост колоний, несущих данную космиду, на среде с этим антибиотиком; нетрансформированные клетки при этом погибают. Существуют и другие космидные векторы на основе фага λ.
Космиды имеют большое преимущество по сравнению с плазмидами: в них можно встраивать более протяженные фрагменты ДНК, а это означает, что для создания геномной библиотеки нужно меньшее число клонов и потребуется меньше времени на их скрининг.
Векторные системы для клонирования очень крупных фрагментов ДНК Векторные системы, способные интегрировать крупные вставки (>100 т. п. н.), имеют большую ценность при анализе сложных эукариотических геномов. Без таких векторов не обойтись, например, при картировании генома человека или при идентификации отдельных генов. В отличие от библиотек с небольшими вставками, в геномной библиотеке с крупными вставками скорее всего будет представлен весь генетический материал организма. Кроме того, в этом случае уменьшается число клонов, которые нужно поддерживать, и увеличивается вероятность того, что каждый из генов будет присутствовать в «своем» клоне. Для клонирования фрагментов ДНК размером от 100 до 300 т. п. н. был сконструирован низкокопийный плазмидный вектор на основе бактериофага Р1 — химерная конструкция, называемая искусственной хромосомой на основе фага Рl. Был создан также очень стабильный вектор, способный интегрировать вставки длиной от 150 до 300 т. п. н., на основе F-плазмиды (F-фактора, или фактора фертильности) Е. coli, которая представлена в клетке одной или двумя копиями, с селекционной системой lacZ' векторов pUC. Эта конструкция называется бактериальной искусственной хромосомой (ВАС, от англ. bacterial artificial chromosomes).