Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Получение рекомбинантных белков с помощью эукариотических систем
Экспрессирующие векторы для работы с клетками млекопитающих
Внехромосомные экспрессирующие векторы млекопитающих используются для изучения функций и регуляции генов млекопитающих. Кроме того, с их помощью могут быть получены аутентичные рекомбинантные белки, которые потенциально могут использоваться в медицинских целях для лечения некоторых заболеваний человека. Уже сконструированные экспрессирующие векторы млекопитающих весьма многочисленны, но все они обладают сходными свойствами и похожи на другие эукариотические экспрессирующие векторы.
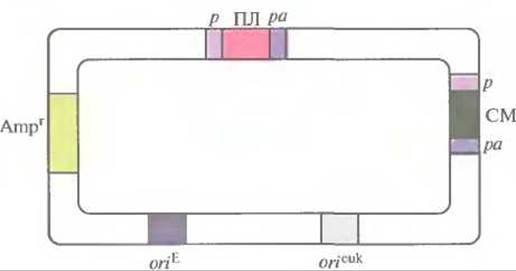
Рис. 7.13. Обобщенная схема экспрессирующего вектора млекопитающих. Полилинкер (ПЛ) и селективный маркер (СМ) находятся под контролем эукариотического промотора (р) и сигнала полиаденилирования (ра). Репликация вектора в Е. coli и в клетках млекопитающих обеспечивается сайтами инициации репликации оriЕ и orieuk соответственно Для отбора трансформированных клеток Е. coli используется ген устойчивости к ампициллину (Аmрr)
Вектор, представленный на рис. 7.13, содержит эукариотический сайт инициации репликации вируса животных (например, обезьяньего вируса 40 [SV40]). Промоторы клонированного и селективного маркерного генов, а также их сигналы терминации транскрипции (сигналы полиаденилирования) должны происходить из клеток эукариот; обычно используют регуляторные последовательности ДНК вирусов животных (например, цитомеголовируса человека, SV40 или HSV) или генов млекопитающих (например, гена ß-актина, металлотионеина, тимидинкиназы или бычьего гормона роста). При этом более предпочтительны сильные промоторы и эффективные сигналы полиаденилирования. Последовательности, необходимые для отбора и амплификации экспрессирующего вектора млекопитающих в Е. coli, происходят из стандартного клонирующего вектора Е. coli (например, плазмиды pBR322).
Селективные маркерные гены
Для отбора трансфицированных клеток млекопитающих часто используют бактериальный ген Neor, кодирующий неомицинфосфотрансферазу. В этой системе применяется токсичное соединение генетицин (G-418), блокирующее трансляцию в нетрансфицированных клетках млекопитающих. При этом в трансфицированных клетках G-418 фосфорилируется неомицинфосфотрансферазой и инактивируется. Следовательно, выживают и пролиферируют только клетки, синтезирующие продукт гена Neor.
Другая система отбора трансфицированных клеток млекопитающих основана на использовании гена, кодирующего фермент дигидрофолатредуктазу (DHFR). В этой системе используют клетки с дефектным геном DHFR, т. е. клетки, в которых функциональная DHFR не синтезируется. После трансфекции DHFR-клеток экспрессирующим вектором млекопитающих с функционирующим DHFR-геном в среду добавляют метотрексат. Не трансфицированные клетки не растут в его присутствии, а клетки, синтезирующие дигидрофолатредуктазу, выживают. После предварительного отбора клеток с DHFR-геном концентрацию метотрексата в среде увеличивают и отбирают клетки с большим числом копий вектора, синтезирующие в большом количестве рекомбинантный белок.
Разработаны и другие схемы отбора с доминантным маркером, например с использованием фермента глутаминсинтетазы (GS), обеспечивающей устойчивость к цитотоксическому действию метионинсульфоксимина. В этой системе применяется вектор, несущий GS-ген. Его вводят в культуру клеток млекопитающих и для отбора клеток, несущих большое количество копий вектора, повышают концентрацию метионинсульфоксимина в среде. При этом в хозяйских клетках тоже должна присутствовать GS, поскольку только множественные копии GS-гена могут обеспечивать устойчивость к метионинсульфоксимину. Такая схема обладает определенными преимуществами перед описанной выше.
В экспрессирующие векторы млекопитающих уже встроены гены самых разных белков и осуществлена их экспрессия в хозяйских клетках. Иногда выход продукта увеличивался, если между промотором и клонированным геном встраивали интрон. Механизм этого феномена неизвестен. Возможно, первичный транскрипт клонированного гена содержит скрытые сайты сплайсинга, по которым вырезается часть кодирующей области клонированного гена, а при наличии дополнительного интрона сплайсинг по ним происходит с меньшей вероятностью.
Высокий уровень экспрессии клонированного гена достигался при ее координации с экспрессией селективного маркерного гена. Для этого, например, ген DHFR встраивали поблизости от клонированного гена, так чтобы оба гена находились под контролем одного промотора и имели общий сигнал полиаденилирования, а ген DHFR был фланкирован сайтами сплайсинга интрона. DHFR и рекомбинантный белок транслировались с первичного транскрипта и сплайсированной мРНК соответственно (рис. 7.14).
Экспрессия двух клонированных генов в одной клетке млекопитающих
Некоторые ценные в коммерческом отношении белки в активной форме состоят из разных полипептидных цепей. Например, тиреотропный гормон человека — это гетеродимер, а гемоглобин — тетрамер, состоящий из двух субъединиц, по две копии каждая (a2ß2). Чтобы получить активный мультимерный белок, можно попытаться клонировать ген или кДНК каждой из субъединиц, синтезировать и очистить субъединицы, а затем смешать их в пробирке. Однако таким образом удается получить лишь немногие мультимерные белки, поскольку in vitro правильная укладка полипептидных цепей осуществляется редко. Сборка же димерных и тетрамерных белков in vivo протекает весьма эффективно. Поэтому были разработаны стратегии синтеза двух разных рекомбинантных белков в одной клетке.

Рис. 7.14. Координированная экспрессия генов дигидрофолатредуктазы (DHFR) и рекомбинантного белка. Ген DHFR встроен между донорным и акцепторным сайтами сплайсинга интрона (точки), перед геном-мишенью (ген а). И ген DHFR, и клонированный ген находятся под контролем одного эукариотического промотора (р) и имеют общий сигнал полиаденилирования (pa). DHFR транслируется с несплайсированного (первичного) транскрипта, а гетерологичный белок (белок а) — с транскрипта, подвергшегося процессингу (сплайсингу).
Для этого хозяйские клетки одновременно трансфицировали двумя экспрессирующими векторами млекопитающих, каждый из которых нес ген или кДНК одной из субъединиц и разные гены селективных маркеров (рис. 7.15). Трансфицированные клетки подвергали двойному отбору, соответственно и выжившие клетки несли оба вектора. Системы с двумя векторами успешно использовались для синтеза аутентичных димерных и тетрамерных рекомбинантных белков. К сожалению, дважды трансфицированные клетки часто утрачивают один из двух векторов. Кроме того, число копий каждого из векторов не всегда одинаково, так что одна субъединица может синтезироваться в большем количестве, чем другая, и выход конечного продукта может снижаться. Чтобы решить эти проблемы, были сконструированы векторы, содержащие оба клонированных гена. В некоторых случаях они были помещены под контроль независимых промоторов и сигналов полиаденилирования (рис. 7.16). А для того чтобы гарантировать синтез рекомбинантных белков в одинаковом количестве, были созданы так называемые двухцистронные векторы, в которых клонированные гены разделялись сегментом ДНК, содержащим внутренний сайт связывания рибосом. Такие сайты были обнаружены в геномах вирусов млекопитающих; они обеспечивают одновременную трансляцию различных белков с полицистронной мРНК. Транскрипция конструкции «ген—внутренний сайт связывания рибосом-ген» регулируется одним промотором и одним сигналом полиаденилирования. Синтезируется один транс крипт с двумя генами, трансляция начинается с 5'-конца мРНК и с внутреннего сайта, в результате синтезируются субъединицы димерного белка а и ß (рис. 7.17).
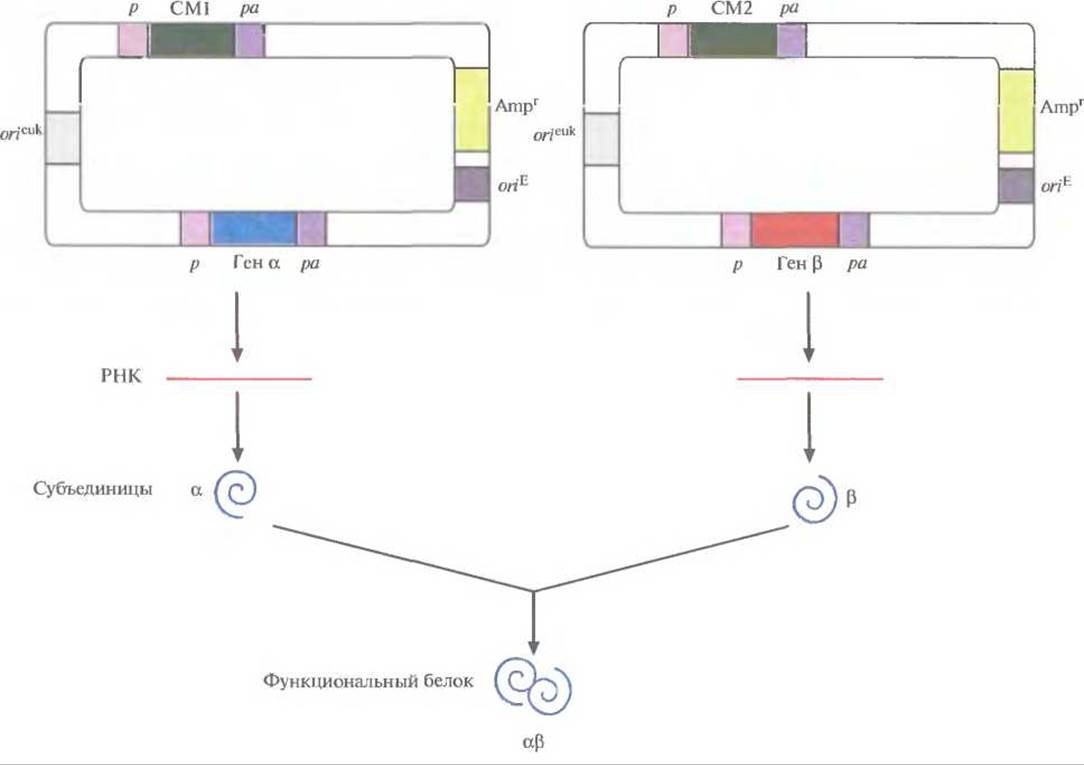
Рис. 7.15. Двухвекторная система экспрессии. Клонированные гены (а и ß) кодируют субъединицы димерного белка (aß). После одновременной трансфекции клетки двумя плазмидами в ней синтезируются обе субъединицы и собирается функциональный димерный белок. Оба вектора несут сайты инициации репликации, функционирующие в Е. coli (оriЕ) и в клетках млекопитающих (orieuk); маркерный ген (Ampr) для отбора трансформированных клеток Е. coli; эукариотический промотор (р) и сигнал полиаденилирования (ра), которые регулируют экспрессию селективного маркерного гена (СМ) и каждого из клонированных генов.
Суммируя, можно сказать, что экспрессирующие векторы млекопитающих столь же универсальны и эффективны, как и векторы для других эукариотических систем экспрессии, если речь идет о получении аутентичных рекомбинантных белков для исследовательских и медицинских целей. Однако промышленный синтез рекомбинантных белков с использованием модифицированных клеток млекопитающих обходится слишком дорого. В этом случае предпочтительны менее дорогие системы экспрессии, за исключением тех ситуаций, когда аутентичности рекомбинантного белка удается достичь только с помощью культуры клеток млекопитающих.

Рис. 7.16. Экспрессирующий вектор с двумя независимо транскрибируемыми генами. Клонированные гены (а и ß) кодируют субъединицы димерного белка (aß). Каждый ген встроен в вектор как часть отдельной единицы транскрипции и находится пол контролем эукариотического промотора (р) и сигнала полиаденилирования (ра). Каждая субъединица транслируется со своей мРНК; объединяясь, субъединицы образуют функциональный димерный белок (aß). Векторы содержат сайты инициации репликации, функционирующие в Е. coli (oriЕ) и в клетках млекопитающих (orieuk); маркерный ген (Аmрr) для отбора трансформированных клеток Е. coli, селективный маркерный ген (СМ), находящийся под контролем эукариотических промотора (р) и сигнала полиаденилирования (ра).
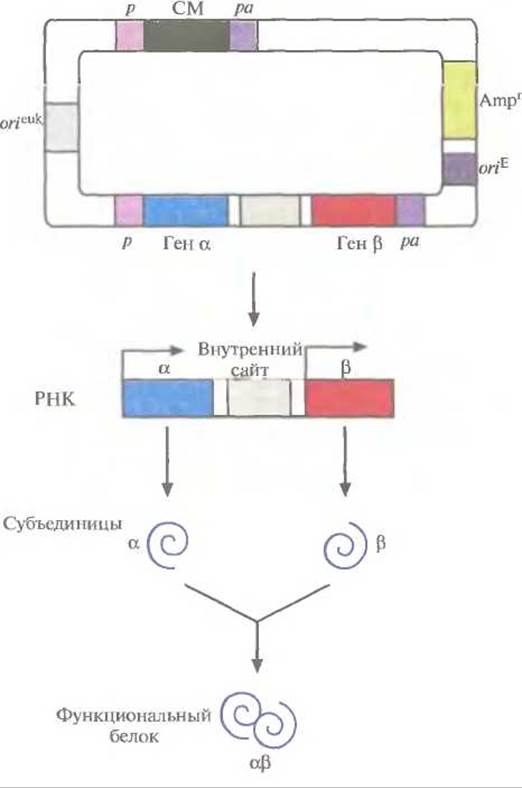
Рис. 7.17. Двухцистронный экспрессирующий вектор. Клонированные гены (а и ß) кодируют субъединицы димерного белка (aß). Они разделены сегментом ДНК, который после транскрипции, на уровне мРНК, играет роль внутреннего сайта связывания рибосом. Каждый ген находится под контролем эукариотических промотора (р) и сигнала полиаденилирования (ра). Трансляция мРНК начинается с 5'-конца и с внутреннего сайта (угловые стрелки). Синтезированные субъединицы объединяются с образованием функционального димерного белка. Вектор содержит сайты инициации репликации, функционирующие в Е. coli (оriЕ) и в клетках млекопитающих (orieuk); селективный маркерный ген (Аmрr) для отбора трансформированных клеток Е. coli; селективный маркерный ген (СМ), находящийся под контролем эукариотических промотора (р) и сигнала полиаденилирования (ра).