Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Получение рекомбинантных белков с помощью эукариотических систем
Системы экспрессии с использованием культур клеток насекомых
Бакуловирусы инфицируют только беспозвоночных, в том числе многих насекомых. В ходе инфекционного процесса образуются две их формы. Одна представлена отдельными вирионами, которые высвобождаются из инфицированной клетки хозяина, как правило клетки средней кишки, и способны инфицировать другие клетки этого органа. Вторая состоит из множества вирионов, заключенных в белковый матрикс. Белок этого матрикса называется полиэдрином, а сама структура — полиэдроном. Синтез полиэдрина начинается через 36—48 ч после инфекции и продолжается 4—5 сут, пока зараженные клетки не лизируют и хозяйский организм не погибнет. После этого множество таких частиц высвобождается и попадает в среду, где от инактивации их защищает белковый матрикс. Если восприимчивый хозяйский организм проглатывает такую частицу, то полиэдрин солюбилизируется и высвобождаются вирионы, способные инициировать новый инфекционный цикл.
Промотор гена полиэдрина чрезвычайно сильный, а цикл развития вируса не зависит от наличия самого гена. Следовательно, замена последнего геном чужеродного белка с последующей инокуляцией полученным рекомбинантным бакуловирусом культуры клеток насекомого может привести к синтеззу большого количества гетерологичного белка, который благодаря сходству систем внесения посттрансляционных модификаций у насекомых и млекопитающих будет близок (а возможно, и идентичен) к нативной форме того белка, который интересует исследователя. Исходя из этого на основе бакуловирусов были разработаны векторы для экспрессии генов, кодирующих белки млекопитающих и вирусов животных.
Наиболее широко используется вирус множественного ядерного полиэдроза Autographa californica (AcMNPV). Этот бакуловирус инфицирует более 30 других видов насекомых, а также хорошо растет в культуре многих клеточных линий. Линии клеток, обычно использующиеся для работы с рекомбинантным AcMNPV, получают из гусениц Spodoptera frugiperda. Промотор полиэдрина в этих клетках чрезвычайно активен, и при их заражении бакуловирусом дикого типа синтезируются большие количества белка.
Система экспрессирующих векторов на основе бакуловирусов
Первый шаг в конструировании рекомбинантного бакуловируса AcMNPV состоит в создании транспортного вектора. Транспортный вектор - это производная плазмиды Е. coli, содержащая фрагмент ДНК AcMNPV (рис. 7.8), который включает: 1) промоторную область и расположенную перед ней последовательность ДНК AcMNPV, необходимую для гомологичной рекомбинации с AcMNPV; 2) сайт для клонирования; 3) сайт терминации-полиаденилирования гена полиэдрина и прилегающую к нему последовательность ДНК AcMNPV — вторую область, обеспечивающую гомологичную рекомбинацию с AcMNPV (рис. 7.8). Кодирующая последовательность гена полиэдрина из этого фрагмента удалена. Интересующий исследователя ген встраивают между промотором и сигналом терминации гена полиэдрина и вводят конструкцию в Е. coli.
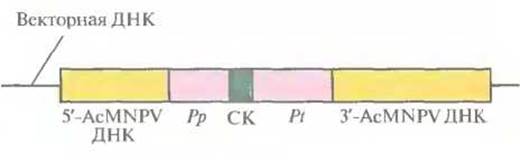
Рис. 7.8. Схематическое представление единицы экспрессии транспортного вектора на основе бакуловирусов (AcMNPV). Ген белка-мишени встраивают в сайт клонирования (СК) между промотором гена полиэдрина (Рр) и сайтом терминации его транскрипции (Pt). Перед промотором и после сайта терминации транскрипции встраивают фрагменты ДНК AcMNPV (5 -AcMNPV ДНК и З'-AcMNPV ДНК соответственно), обеспечивающие интеграцию единицы экспрессии в ДНК AcMNPV за счет гомологичной рекомбинации в клетках насекомого.
Культуру клеток насекомого, трансфицированную ДНК AcMNPV, трансфицируют затем транспортным вектором, несущим клонированный ген. В некоторых дважды трансфицированных клетках происходит двойной кроссинговер, в результате которого клонированный ген вместе с промотором и сигналом терминации транскрипции гена полиэдрина встраивается в ДНК AcMNPV (рис. 7.9), замещая ген полиэдрина. Вирионы, не содержащие этого гена, образуют зоны клеточного лизиса, из которых можно выделить рекомбинантный бакуловирус.
Визуальная идентификация зон лизиса — утомительная и субъективная процедура. Вместо нее для обнаружения рекомбинантных бакуловирусов можно использовать ДНК-гибридизацию или полимеразную цепную реакцию (ПЦР). Кроме того, если под контроль промотора бакуловируса, активного с ранних и до поздних стадий литического цикла, поместить ген lacZ Е. coli, кодирующий ß-галактозидазу, и такую конструкцию включить во фрагмент ДНК, встраивающийся в геном AcMNPV, то в присутствии хромогенного субстрата ß-галактозидазы зоны с рекомбинантными вирусами окрасятся в синий цвет.
Гетерологичный белок, синтезируемый культурой клеток насекомого-хозяина, зараженной рекомбинантным бакуловирусом, можно выделять через 4—5 сут. С помощью системы экспрессирующих векторов на основе бакуловирусов уже получено более 500 различных гетерологичных белков, при этом более 95% из них имели правильные посттрансляционные модификации (рис. 7.10).

Рис. 7.9. Замещение гена полиэдрина AcMNPV единицей экспрессии транспортного вектора в результате двойного кроссинговера в 5'- и 3'-фрагментах.
Получение рекомбинантных бакуловирусов
Исходная методика получения рекомбинантных бакуловирусов в дальнейшем была изменена по ряду причин. Во-первых, применение промотора гена полиэдрина имеет ограничения: белки, синтезирующиеся на поздней стадии литического цикла, часто оказываются модифицированными не до конца. Для решения этой проблемы промотор гена полиэдрина заменили одним из сильных промоторов AcMNPV, активно функционирующих с самого начала и до конца литического цикла. Во-вторых, линеаризация генома AcMNPV перед трансфекцией клеток насекомого увеличивает долю зон лизиса с рекомбинантными вирусами. Расщепление генома AcMNPV в одном сайте уменьшает число зон с нерекомбинантными вирусами, потому что линеаризованные геномы бакуловирусов обладают ограниченной инфицирующей способностью. В результате двойного кроссинговера между линеаризованной ДНК AcMNPV и кольцевым транспортным вектором образуется замкнутая кольцевая молекула, которая обладает инфицирующей способностью. Чтобы обеспечить стабильную линеаризацию в каждом эксперименте, в геном AcMNPV'дикого типа в ген полиэдрина встроили уникальный сайт для рестриктазы Bsu36I. В результате доля зон лизиса с рекомбинантными бакуловирусами увеличилась с <1% (когда использовались нерасщепленные кольцевые молекулы AcMNPV) до примерно 30%.

Рис. 7.10. Некоторые рекомбинантные белки, синтезированные в системе экспрессирующих векторов на основе бакуловирусов. HIV-1 — вирус иммунодефицита человека 1 типа; HSV — вирус простого герпеса.
Bsu36I-систему линеаризации далее модифицировали так, чтобы получить сверхвысокую частоту рекомбинантных бакуловирусов. Для этого в геном AcMNPV внесли два Bsu36I-сайта, по одному с каждой стороны гена полиэдрина (рис. 7.11). Один сайт находился в гене 603 (открытая рамка считывания 603 [ORF603]), а второй — в одном из генов (ORF 1629), необходимых для репликации вирусной ДНК. При трансфекции клеток насекомого с помощью ДНК модифицированного бакуловируса, инкубированного с Bsu36І, репликация вируса не происходила, поскольку отсутствовал фрагмент необходимого для этого гена (ORF1629). Далее был создан транспортный вектор, содержащий ген-мишень и, если это нужно, селективный маркерный ген между интактной копией гена 603 и необходимым для репликации геном. Таким вектором трансфицировали клетки насекомого, которые были предварительно трансфицированы линеаризованной ДНК AcMNPV с делецией участка между Дж36І-сайтами. В результате двойного кроссинговера восстанавливалась функциональная форма ORF1629 и происходило включение клонированного гена в геном AcMNPV'(рис. 7.11). С помощью этой системы доля зон лизиса, содержащих рекомбинантные бакуловирусы, была увеличена до 99%.

Создание челночного вектора на основе бакуловирусов для Е. coli и клеток насекомых
Разработана система, позволяющая осуществлять все генноинженерные манипуляции по созданию экспрессирующего вектора на основе бакуловируса в Е. coli. При этом трансфекция клеток насекомого нужна только для синтеза рекомбинантного белка. В системе используется фрагмент небольшой плазмиды Е. coli, фланкированный участками ДHК, расположенными с 5'- и 3'-концов гена полиэдрина. Он содержит ген устойчивости к канамицину, нуклеотидную последовательность, играющую роль сайта интеграции и встроенную в ген lacZ' без нарушения его функции, и сайт инициации репликации, активный в Е. coli. Интеграция плазмиды в геном AcMNPV происходит в результате двойного кроссинговера и сопровождается элиминацией гена полиэдрина (рис. 7.12, А). При этом образуется кольцевая ДНК, способная существовать в Е. coli как плазмида и ответственная за образование в трансфицированных клетках насекомого бакуловирусов. Челночные векторы на основе бакуловирусов для Е. coli и клеток насекомых называют бакмидами.
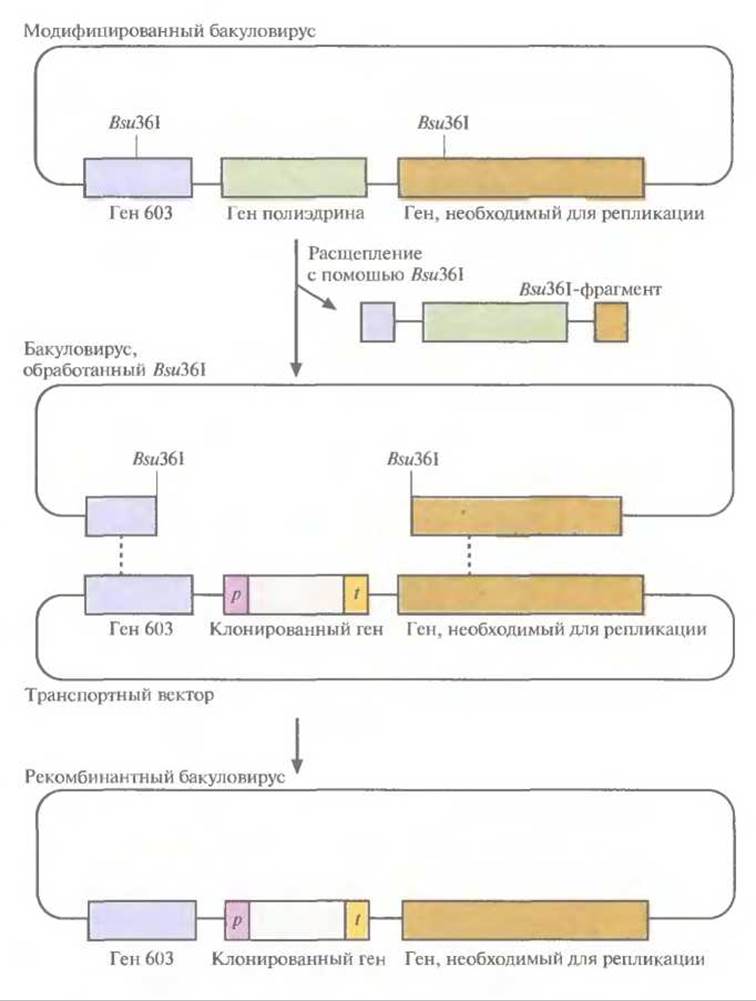
Рис. 7.11. Получение рекомбинантных бакуловирусов. В геном AcMNPV, а именно в ген 603 и ген ORF1629, необходимый для репликации бакуловируса в клетках насекомых, встраивают по одному Bsu36I-сайту. Эти гены фланкируют ген полиэдрина AcMNPV. Инкубируют рекомбинантный бакуловирус с Bsu36I, в результате чего выщепляется фрагмент, находящийся между Bsu36I-сайтами. Трансфицируют клетки насекомого, несущие бакуловирус, который был обработан Bsu36I, транспортным вектором с клонированным геном, фланкированным промотором (р) и сайтом терминации транскрипции (t) гена полиэдрина, а также с полноразмерным геном 603 и геном, необходимым для репликации. В результате двойного кроссинговера (пунктирные линии) образуется рекомбинантный бакуловирус с функционирующим геном, необходимым для репликации. Выход рекомбинантных бакуловирусов в такой системе составляет 99%.
Система на основе бакмид позволяет создать еще одну плазмиду Е. coli, в которой между промотором и сайтом терминации гена полиэдрина встроен ген-мишень (плазмида-донор). В донорной плазмиде ген устойчивости к гентамицину и единица экспрессии гена-мишени фланкированы нуклеотидными последовательностями, которые связываются с сайтом интеграции в бакмиде, а ген устойчивости к ампициллину находится вне двух сайтов встраивания (рис. 7.12, Б). Рекомбинация между соответствующими сайтами в донорной плазмиде и бакмиде может происходить только в присутствии специфичных белков (белков транспозиции), которые в этой системе кодируются третьей плазмидой Е. coli (плазмидой-помощницей), несущей еще и ген устойчивости к тетрациклину (рис. 7.12, Б).
Бактериальные клетки, несущие бакмиду, трансформируют одновременно плазмидой-помощницей и донорной плазмидой. В некоторых двойных трансформантах фрагмент ДНК, ограниченный двумя сайтами интеграции, встраивается в сайт интеграции бакмиды (рис. 7.12, Б и В). Встраивание фрагмента донорной плазмиды с единицей экспрессии и геном устойчивости к гентамицину в сайт интеграции бакмиды нарушает рамку считывания гена lacZ'. В результате бактерии, несущие рекомбинантные (со встройкой) бакмиды, образуют белые колонии в присутствии изопропил-ß-D-тиогалактопиранозида (ИПТГ) и 5-бром-4-xлор-3-индолил-ß-D-галактопиранозида (X-Gal). Те из них, которые устойчивы к канамицину и чувствительны к ампициллину и тетрациклину, несут только рекомбинантную бакмиду, но не донорную плазмиду и плазмиду-помощницу. В наличии вставки клонированного гена после всех этих манипуляций можно убедиться при помощи ПЦР. Далее рекомбинантной бакмидой можно трансфицировать клетки насекомого, в которых произойдет транскрипция клонированного гена и синтез рекомбинантного белка.
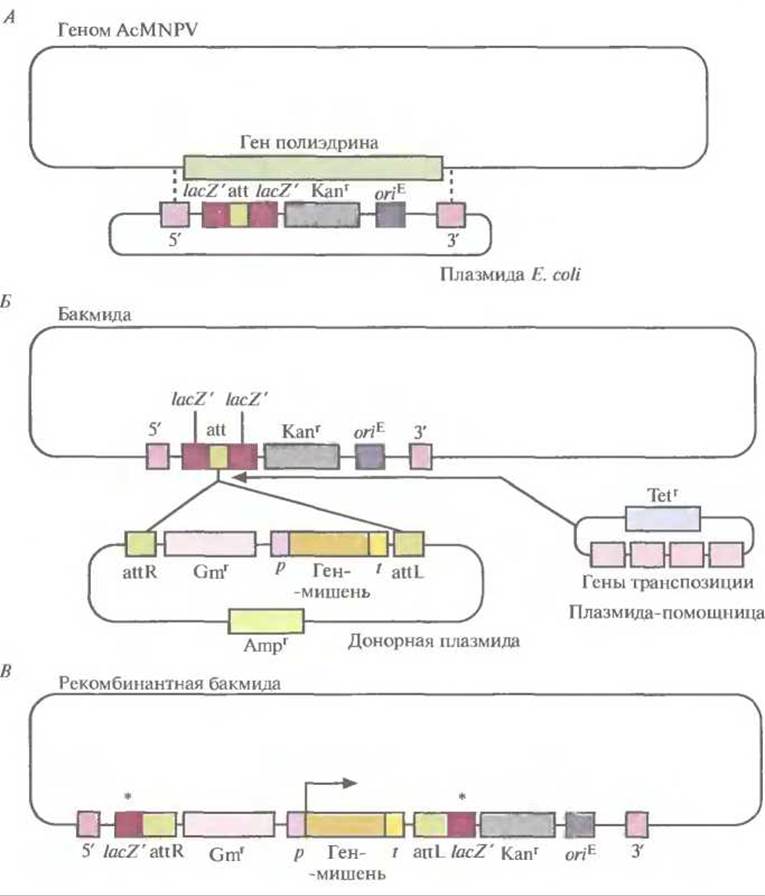
Рис. 7.12. Получение рекомбинантной бакмиды. А. Плазмиду Е. coli встраивают в геном AcMNPV с помощью двойного кроссинговера (пунктирные линии) между сегментами ДНК (5' и 3'), фланкирующими ген полиэдри- на, с образованием челночного вектора, способного к репликации как в Е. coli, так и в клетках насекомых. Встраиваемая плазмидная ДНК содержит ген устойчивости к канамицину (Каnr), сайт интеграции (att), клонированный без нарушения рамки считывания в последовательности lacZ', и сайт инициации репликации Е. coli (oriE). Б. Фрагмент донорной плазмиды, ограниченный двумя сайтами интеграции (attR и attL) и несущий ген устойчивости к гентамицину (Gmr) и ген-мишень под контролем промотора (р) и сайта терминации транскрипции (t) гена полиэдрина, встраивают в сайт интеграции (att) бакмиды с помощью белков транспозиции, кодируемых плазмидой-помощиицей. Плазмида-помощница и донорная плазмида несут гены устойчивости к тетрациклину (Tetr) и ампициллину (Ampr) соответственно. В. Рекомбинантная бакмида содержит дефектный ген lacZ'(*). Угловой стрелкой обозначен сайт инициации транскрипции клонированного гена после трансфекции клеток насекомого рекомбинантной бакмидой.
Для создания экспрессирующих векторов на основе бакуловирусов использовались и другие подходы. Один из них предполагал проведение всех генноинженерных манипуляций с геномом AcMNPV в дрожжевых клетках с использованием челночного вектора для дрожжей и клеток насекомых с последующим введением рекомбинантного бакуловируса в клетки насекомого. В другом для создания конструкции «клонированный ген—геном AcMNPV» использовали систему рекомбинации in vitro, основанную на вырезании-встраивании ДНК бактериофага Р1, после чего такой конструкцией напрямую трансфицировали клетки насекомого.
Выделение рекомбинантного белка из клеток насекомых с помощью аффинного связывания
Для выделения специфических гетерологичных белков из клеточных экстрактов и из смесей секретируемых белков можно использовать разные подходы. Один из них основывается на присоединении к клонированному гену — без нарушения рамки считывания — сегмента ДНК, кодирующего короткую аминокислотную последовательность, которая специфически связывается с каким-либо химическим элементом, соединением или макромолекулой. Такую конструкцию встраивают в экспрессирующий вектор между промотором и сайтом терминации транскрипции. Короткая аминокислотная последовательность в составе рекомбинантного белка, синтезируемого в хозяйской клетке, играет роль аффинной метки. В одном случае перед клонированным геном был встроен — без нарушения рамки считывания — сегмент ДНК, кодирующий шесть остатков гистидина (His6), спейсерный участок, кодирующий семь аминокислот, и сайт расщепления протеиназы из шести аминокислот; получившийся рекомбинантный белок выделяли хроматографией на колонке с никель-агарозой. Последовательность из шести остатков гистидина (гексагистидин) связывалась с ионами никеля, и рекомбинантный белок задерживался в колонке. Его элюировали добавлением конкурирующего соединения (например, имидазола), который вытеснял гексагистидин рекомбинантного белка из комплекса с ионами никеля, или понижением pH буфера для элюции. Аффинную метку отщепляли с помощью протеолитического фермента (протеиназы) и очищали рекомбинантный белок от нее и от протеиназы хроматографическими методами. Если рекомбинантный белок не предполагается использовать в медицинских целях, можно и не отщеплять гексагистидиновую последовательность, поскольку обычно она не влияет на структуру и функцию белка.
Было разработано несколько аффинных меток. Среди них — глутатионтрансфераза, белок, связывающий мальтозу, и короткие аминокислотные последовательности — антигенные детерминанты, которые связываются соответственно с глутатионом, мальтозой и специфическими антителами. Использовали и разные сайты расщепления, специфичные для тромбина, энтерокиназы и других протеиназ. Аффинная метка и сайт расщепления могут находиться как на N-, так и на С-конце рекомбинантного белка и использоваться в прокариотических системах экспрессии, а также в системах экспрессии на основе клеток насекомых, млекопитающих или грибов.