Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Промышленный синтез белков при участии рекомбинантных микроорганизмов
Типичные крупномасштабные системы ферментации
Рекомбинантные микроорганизмы широко используются для получения разнообразных белковых продуктов, применяющихся в медицине (например, инсулина), а также в качестве своего рода «фабрик» по производству имеющих коммерческую ценность метаболитов (например, антибиотиков). Белки синтезируются наиболее интенсивно в период от середины экспоненциальной фазы до ее завершения, а метаболиты — в период замедления роста и в стационарной фазе. Все это должно учитываться при выборе параметров крупномасшабных процессов ферментации.
Оптимизация синтеза необходимого продукта — серьезная научная проблема. Если речь идет о белках, то для ее решения обычно используют клонированные гены, находящиеся под контролем сильных регулируемых промоторов. Вначале полагали, что для получения нужного количества продукта будет достаточно конститутивной экспрессии клонированного гена. Однако опыт показал, что при непрерывной транскрипции и трансляции клонированного гена истощаются все энергетические ресурсы клетки и ее рост замедляется. Чтобы приурочить экспрессию клонированного гена к определенной фазе роста, можно использовать механизм индукции. Для этого вначале выращивают клетки в оптимальных условиях до относительно высокой плотности, а затем индуцируют транскрипцию, либо изменяя температуру, либо добавляя в среду тот или иной химический индуктор в зависимости от природы промотора (например, изопропил- ß-тиогалактоп иранозид).
Двухступенчатая ферментация в большом биореакторе (>100 л) встречается с определенными трудностями, поскольку технически очень сложно быстро повысить температуру (обычно с 30 до 42 °С) в большом объеме или обеспечить быстрое и равномерное распределение химического индуктора. Эту проблему можно решить, если использовать два сообщающихся биореактора (двухступенчатая ферментация): клетки выращивают в одном из них, а индукцию осуществляют в другом. Это позволяет оптимизировать процессы роста и индукции по отдельности и увеличить количество продукта, синтезируемого за единицу времени.
Двухступенчатая ферментация в тандемных эрлифтных биореакторах Штамм Е. coli NM989, несущий ген ДНК-лигазы Т4 под транскрипционным контролем промотора pL и температурочувствительного репрессора cl, выращивали и индуцировали в двухступенчатом эрлифтном биореакторе (рис. 16.5). Ген ДНК-лигазы был встроен в хромосомную ДНК, что снимало все проблемы, связанные с нестабильностью плазмид в ходе длительной ферментации. Клетки выращивали при 30 °С в эрлифтном биореакторе с внешней рециркуляцией и рабочим объемом 10 л. В этих условиях ген ДНК-лигазы не экспрессировался. Для индукции при 42 °С использовали эрлифтный биореактор с внешней рециркуляцией и рабочим объемом около 5 л. Биореакторы были соединены трубкой с насосом, который обеспечивал непрерывность подачи суспензии из первого биореактора во второй. Клеточную суспензию, достигшую определенной плотности, удаляли из биореактора, где проходила индукция, и подвергали дальнейшей обработке.
Максимальная удельная скорость роста культуры (μmах) составляла примерно 0,66 ч-1 в первом биореакторе и 0,54 ч-1 во втором, что соответствовало времени удвоения 63 и 77 мин. Свежую среду непрерывно добавляли в ферментер, где росли клетки, со скоростью 2 л/ч, а из ферментера, где происходила индукция, отбирали такой же объем суспензии. Поскольку рабочие объемы биореакторов различались, клетки находились примерно 5 ч в биореакторе, где происходил рост, и 2 ч в биореакторе, где осуществлялась индукция. Различие во времени пребывания клеток в биореакторах было необходимо для оптимизации числа клеток, выхода продукции и стабильности ДНК-лигазы. Само время пребывания клеток в разных реакторах можно варьировать изменением их относительного рабочего объема и объема поступающих в первый биореактор питательных веществ.
Использованный в этой работе эрлифтный ферментер с двойной наружной рециркуляцией (рис. 16.5) позволил упростить регуляцию относительных рабочих объемов ферментеров, а также повысить гибкость системы (обеспечивать разные условия роста для разных популяций рекомбинантных клеток). При синтезе ДНК-лигазы наилучшие результаты были получены при ежеминутном поступлении примерно 33 мл клеточной суспензии из первого биореактора во второй. Это эквивалентно всего 0,67% объема биореактора, где осуществлялась индукция, что обеспечивало практически мгновенный подъем температуры всей поступающей суспензии с 30 до 42 °С. Для поддержания роста клеток, находящихся во втором биореакторе, в экспоненциальной фазе в него непрерывно добавлялось нужное количество питательных веществ в концентрированной форме. Эго предотвращало расщепление ДНК-лигазы протеолитическими ферментами, которые обычно синтезируются клетками в фазе замедления и в стационарной фазе.

Рис. 16.5. Система из двух эрлифтных биореакторов, использующаяся для температурной индукции синтеза белкового продукта. Из ферментера, в котором осуществляется культивирование при 30 °С (слева), клетки поступают в ферментер с температурой 42 °С (справа), где происходит индукция. У обоих биореакторов имеется двойное внешнее рециркуляционное устройство, оснащенное задвижками. Изменяя положение задвижек, можно создавать рабочий объем, оптимальный для данных условий.
При росте в таком двухступенчатом биореакторе непрерывного действия культура штамма
Е. coli NM989 может достигать плотности 4 г (сухого вещества) на 1 л, а на долю ДНК-лигазы Т4 может приходиться до 4% суммарного белка в клетке, что соответствует примерно 25 000 ЕД ферментативной активности на 1 г (сухого вещества). Вообще же с помощью описанного подхода можно синтезировать примерно 100 000 ЕД ферментативной активности на 1 л культуры, т. е. до 4 800 000 ЕД в сутки. С учетом того что после очистки фермента уровень активности уменьшается до 20% и что стоимость единицы активности равна примерно 0,25 долларов, получаем, что ежедневно можно синтезировать количество фермента на сумму 240 000 долларов. Мы не учли всех затрат на само производство белка, однако ясно и так, что прибыль от реализации ценных продуктов, полученных при непрерывной ферментации в биореакторах малого или среднего размера, значительно превышает затраты.
Двухступенчатая ферментация в одном реакторе с механическим перемешиванием
Трехкомпонентный рекомбинантный белок AGßgal, использующийся при проведении иммунологических тестов, синтезировали в промышленных масштабах в одном биореакторе с механическим перемешиванием. Ген этого белка был сконструирован методами генной инженерии и содержал сегменты, кодирующие пять сайтов связывания иммуноглобулина G (JgG) А-белка Staphylococcus aureus, два сайта связывания IgG G-белка штамма G148 Streptococcus к ß-галактозидазу Е. coli. Он находился под контролем промотора рк бактериофага λ, регуляция которого осуществляется так же, как регуляция pL- промотора, и был встроен в плазмиду, несущую ген устойчивости к ампициллину; этой конструкцией трансформировали клетки Е. coli. Штамм с плазмидой, несущей ДНК AGßgal, содержал вторую плазмиду, несущую ген температурочувствительного белка-репрессора сl и ген устойчивости к канамицину. Культуру в объеме 5 л выращивали при 30 °С в присутствии ампициллина и канамицина, с тем чтобы обеспечить условия для сохранения обеих плазмид, а затем использовали в качестве посевного материала для инициации роста культуры без антибиотиков при 30 °С в реакторе с рабочим объемом 45 л. Суспензия клеток из 45-литрового ферментера в свою очередь служила посевным материалом для культивирования в биореакторе на 600 л, в котором клетки продолжали выращивать при 30 °С без антибиотиков (рис. 16.6). (Вообще говоря, для уменьшения стоимости процесса антибиотики при крупно-масштабном культивировании в среду не добавляют.) Как только плотность культуры в биореакторе на 600 л достигала примерно 4 г/л, температуру повышали с 30 до 40 °С, чтобы индуцировать экспрессию гена белка AGßgal. На повышение температуры в этих условиях уходило около часа. Индукцию проводили при 40, а не при 42 °С, поскольку при более низкой температуре синтезировалось такое же количество белка AGßgal, но клетки могли расти в течение более длительного периода. Иными словами, при более низкой температуре индукции (40 °С) выход белкового продукта был больше.
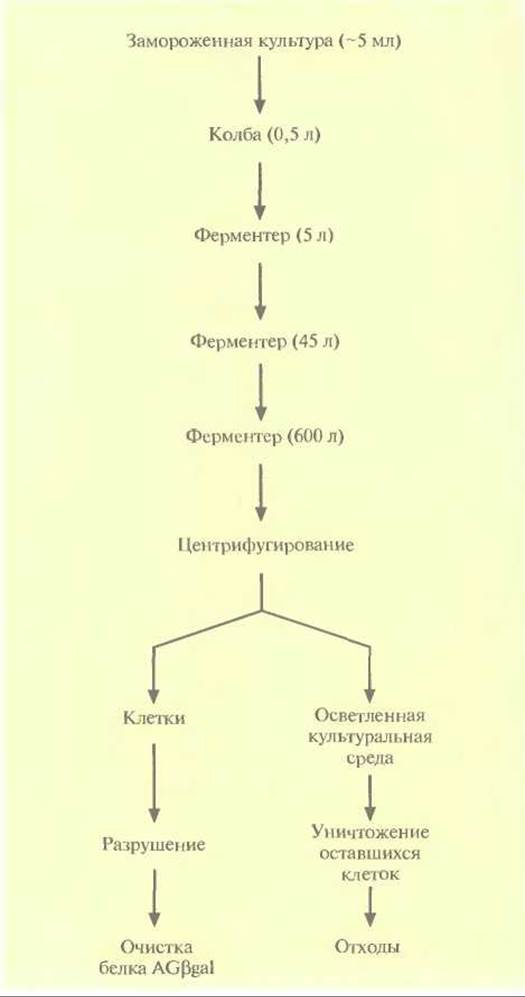
Рис. 16.6. Схематическое представление промышленного синтеза белка AGßgal. В скобках указан объем культуральной среды на каждом этапе. На ее долю приходится от 60 до 75% объема соответствующих биореакторов (ферментеров).
Удельная активность белка AGßgal в течение 2 ч после начала индукции повышалась, а затем снижалась. Возможно, это было связано с синтезом протеаз клетками, перешедшими в фазу замедленного роста или в стационарную фазу. Кроме того, примерно 50% клеток, росших в течение 4 ч при 40 °С, утратили плазмиду. Но даже при этом после 4-часового культивирования при 40 °С на долю AGßgal-белка приходилось примерно 20% всей массы сухого вещества. Учитывая все это, можно не интегрировать гены белка AGßgal и репрессора сІ в хромосомную ДНК хозяйской клетки Е. coli с целью увеличения выхода продуктов.
Периодическая ферментация и периодическая ферментация с добавлением субстрата
В некоторых случаях для достижения высокой плотности культуры и получения больших количеств продукта достаточно проводить ферментацию в обычном периодическом режиме. В одном из экспериментов плазмиду, несущую ген гибридного белка, одним из компонентов которого был пептид инсулина В, помещали под контроль trp-промотора Е. coli и вводили в trp- - штамм Е. colі, трансформированные клетки культивировали в среде с разным содержанием триптофана. При высоких концентрациях последнего гибридный белок не синтезировался; последующее поглощение триптофана из среды растущими клетками приводило к индукции синтеза необходимого белка. Добавление триптофана в среду приводило к увеличению количества как биомассы, так и синтезируемого белка, а использование периодических ферментеров с добавлением постоянного количества субстрата еще более усиливало этот эффект (табл. 16.1).