Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Введение в биологию клетки
Макромолекулы: структура, форма и информационные функции
Функции белков
Химические свойства белковых молекул практически полностью зависят от экспонированных на их поверхности аминокислотных остатков, способных образовывать разнообразные слабые связи с другими молекулами (см. разд. 3.1.1). Чтобы взаимодействие белка с другой молекулой (именуемой в дальнейшем лигандом) было эффективным, между ними должно одновременно образовываться много слабых связей. Поэтому к белку могут прочно присоединиться лишь те лиганды, которые в точности подходят к его поверхности.
Центр связывания, т. е. участок белка, который взаимодействует с лигандом, обычно имеет вид углубления, сформированного на поверхности белковой молекулы определенным расположением аминокислот. Эти аминокислоты часто принадлежат удаленным друг от друга участкам полипептидной цепи (рис. 3-49) и составляют лишь небольшую долю всех аминокислот белка. Остальные аминокислоты необходимы для поддержания правильной формы белковой молекулы и для создания дополнительных центров связывания, играющих регуляторную роль. Значение внутренней части белка обычно ограничивается лишь тем, что она обеспечивает нужную форму поверхности и необходимую жесткость структуры.
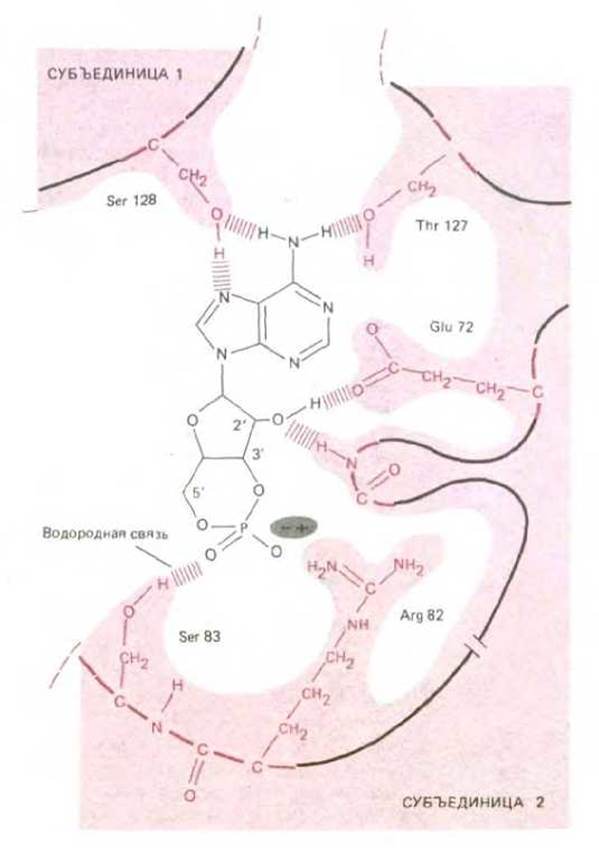
Рис. 3-49. Водородное связывание между САР-белком и его лигандом, сАМР, выявленное с помощью рентгеноструктурного анализа комплекса. Показано, что две идентичные субъединицы димера объединяются с образованием центра связывания (см. также рис. 3-40). (С любезного разрешения Tom Steitz.)
3.4.1. Конформация белка определяет его химические свойства [19, 33]
Соседние аминокислотные остатки поверхности белковой молекулы часто взаимодействуют таким образом, что меняется реакционноспособность боковых групп определенных аминокислот. Такие взаимодействия можно подразделить на несколько типов.
Во-первых, соседние части полипептидной цепи могут взаимодействовать таким образом, что доступ молекул воды к другим участкам поверхности белка будет ограничен. Поскольку молекулы воды стремятся к формированию водородных связей, они должны конкурировать с лигандами за предназначенные для последних боковые группы аминокислот на поверхности белка. Поэтому прочность водородных связей (и ионных взаимодействий) между белком и лигандом значительно больше в том случае, если удалось исключить молекулы воды. На первый взгляд трудно представить себе механизм, способный ограничить доступ к белковой поверхности столь маленькой молекулы, как молекула воды, и не повлиять при этом на связывание самого лиганда. Но молекулы воды благодаря сильной тенденции к образованию водородных связей формируют большие молекулярные сети (схема 2-1) и индивидуальной молекуле часто бывает энергетически невыгодно отрываться от такой сети, чтобы проникнуть в углубление белковой поверхности.
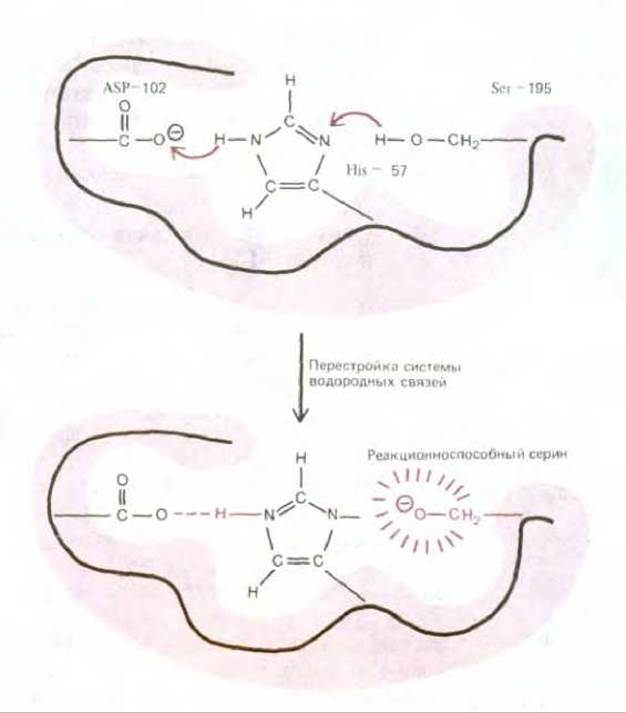
Рис. 3-50. Необычайно реакционно-способная аминокислота в активном центре фермента. Здесь для примера показана «система переноса заряда», обнаруженная у химотрипсина, эластазы и других сериновых протеиназ (см. рис. 3-35). Участок цепи, содержащий аспарагиновую кислоту, индуцирует гистидин к захвату протона у серина 195; это активирует серин к образованию ковалентной связи с субстратом фермента и гидролизу пептидной связи, как показано на рис. 3-53.
Во-вторых, образование кластера из соседних полярных аминокислот изменяет реакционноспособность их боковых групп. Например, полипептидная цепь может свернуться так, что сблизит ряд отрицательно заряженных аминокислот, несмотря на их взаимное отталкивание. Когда это происходит, резко возрастает сродство каждой из боковых групп к положительно заряженному иону. Боковые группы некоторых аминокислот могут также образовывать водородные связи и таким путем активировать обычно неактивные боковые группы (например, —СН2ОН-группу серина, рис. 3-50). Активированные боковые группы могут вступать в реакции, приводящие к образованию или разрыву определенных ковалентных связей.
Таким образом, поверхность каждой белковой молекулы имеет уникальные химические свойства, зависящие не только от природы аминокислот, расположенных на поверхности, но и от точной взаимной ориентации этих аминокислот. Поэтому даже незначительные изменения конформации белковой молекулы могут привести к резкому изменению ее химических свойств.
В тех случаях, когда химические свойства боковых групп аминокислот не могут обеспечить решение конкретной каталитической задачи, белки прибегают к помощи специальных небелковых молекул. Такие лиганды часто служат в ферментативных реакциях коферментами и могут быть столь прочно связаны с белком, что фактически являются его частью. В качестве примера можно назвать: содержащие железо гемы в молекуле гемоглобина и цитохромов; тиаминпирофосфат в ферментах, участвующих в переносе альдегидной группы; биотин в ферментах, участвующих в переносе карбоксильной группы (см. разд. 2.4.3). В процессе эволюции каждый фермент был отобран по определенной химической активности, которую он проявляет в комплексе с белком. Коферментами часто служат очень сложные органические молекулы, химические свойства которых в комплексе с белком не всегда понятны в деталях. Кроме реакционноспособного центра в состав коферментов нередко входят остатки, связывающие их с соответствующими белками (рис. 3-51). На рис. 3-52, А показаны объемные модели двух ферментов, связанных со своими коферментами.
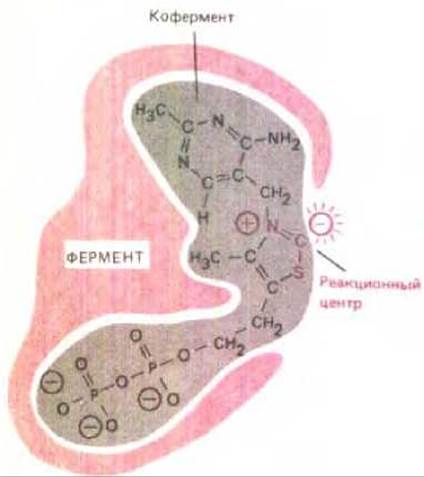
Рис. 3-51. Коферменты, такие, как выделенный здесь серым цветом тиаминпирофосфат, представляют собой небольшие молекулы, которые связываются с поверхностью фермента, обусловливая тем самым способность катализировать определенные реакции. Активность тиаминпирофосфата зависит от «кислого» атома углерода, который с легкостью обменивает связанный с ним атом водорода на атом углерода молекулы субстрата. Другие части молекулы тиаминпирофосфата, видимо, служат «ручками», за которые фермент удерживает кофермент в правильном положении.
3.4.2. Связывание субстрата - первая стадия ферментативного катализа [34]
Одна из важнейших функций белков состоит в специфическом катализе химических реакций. Лигандом в этом случае служит молекула субстрата, связывание которой ферментом - необходимая предпосылка химической реакции (рис. 3-52, Б). Ферменты способны очень сильно ускорять химические реакции - значительно сильнее, чем любые искусственные катализаторы. Столь высокую эффективность можно приписать нескольким факторам. Во-первых, ферменты увеличивают локальную концентрацию молекул субстрата в каталитическом центре и удерживают соответствующие атомы в ориентации, необходимой для последующей реакции. Но наиболее важное значение имеет тот факт, что часть энергии связывания непосредственно используется для катализа. Дело в том, что молекулы субстрата, перед тем как превратиться в продукты реакции, проходят через ряд промежуточных форм с измененной геометрией и измененным электронным распределением. Свободная энергия всех этих промежуточных форм и особенно наименее стабильных переходных состояний существенно снижена, если молекула связана с поверхностью фермента. Обычно ферменты имеют значительно большее сродство к нестабильным переходным состояниям субстратов, чем к их стабильным формам. Используя энергию связывания, ферменты помогают субстратам принять определенное переходное состояние и таким образом значительно ускоряют одну определенную реакцию.
Некоторые ферменты ковалентно взаимодействуют с одним из своих субстратов. При этом субстрат связывается с аминокислотой или с молекулой кофермента. Такие ферментативные реакции часто происходят в несколько стадий так, что один субстрат захватывается центром связывания и ковалентно связывается, а затем реагирует на поверхности фермента со вторым субстратом (рис. 3-53). К концу каждого реакционного цикла свободный фермент восстанавливается.
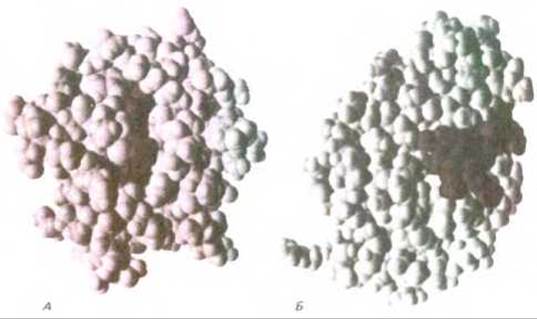
Рис. 3-52. Компьютерные модели. А. Цитохром с с его простетической группой - гемом. Б. Лизоцим яичного белка со связанным олигосахаридом. В обоих случаях связанный лиганд показан в цвете. (С любезного разрешения Richard J. Feldmann.)
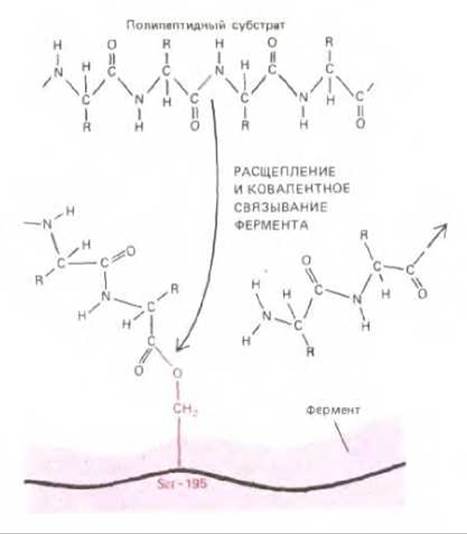
Рис. 3-53. Некоторые ферменты образуют временную ковалентную связь со своими субстратами. В приведенном здесь примере карбоксильная группа разорвавшейся полипептидной цепи образует ковалентную связь с активированным сериновым остатком протеиназы. После диссоциации несвязанной части полипептида происходит вторая (не показанная здесь) стадия реакции: молекула воды гидролизует вновь образованную ковалентную связь и освобождает оставшуюся часть полипептидной цепи, давая возможность серину в положении 195 вступать в следующую стадию реакции (см. также рис. 3-50).
Способ действия ферментов накладывает ограничение на количество молекул субстрата, которое может быть «обработано» одной молекулой фермента в единицу времени. При увеличении концентрации субстрата скорость образования продукта сначала тоже увеличивается до максимальной величины (рис. 3-54). В этой точке достигается насыщение молекул фермента субстратом, и теперь скорость реакции (обозначаемая Vmax) зависит только от того, сколь быстро фермент может обработать одну молекулу субстрата. Отношение этой скорости к концентрации фермента, называют числом оборотов, которое для многих ферментов составляет около 1000 молекул субстрата в секунду, но в исключительных случаях может достигать значения 106 и более.
Другой часто используемой для характеристики ферментов кинетический параметр - это их константа Михаэлиса Км, определяемая как концентрация субстрата, при которой скорость реакции составляет половину максимальной (рис. 3-54). Низкое значение Кч свидетельствует о том, что фермент достигает максимальной скорости катализа при низкой концентрации субстрата и обычно соответствует очень прочному связыванию субстрата ферментом.
3.4.3. Ферменты ускоряют реакции, но не смещают химического равновесия
Сколь бы хитро не был устроен фермент, он не может сделать катализируемую им реакцию более энергетически выгодной. Он не может изменить разницы свободной энергии между начальным субстратом и конечным продуктом реакции. Как и уже обсуждавшееся простое связывание, каждая химическая реакция имеет положение равновесия, при котором скорости прямой и обратной реакций равны и, следовательно, не происходит дальнейшего изменения концентраций (см. рис. 3-7). Если фермент ускоряет прямую реакцию А + Б → АБ в 108 раз, то и обратную реакцию АБ → А + Б он должен ускорить в 108 раз. Отношение скоростей прямой и обратной реакций зависит только от концентраций А, Б и АБ. Положение равновесия остается в точности тем же вне зависимости от того, катализирует фермент реакцию или нет.
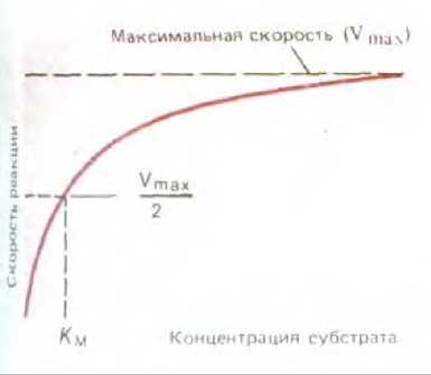
Рис. 3-54. При увеличении концентрации субстрата скорость ферментативной реакции V увеличивается до тех пор, пока не достигнет максимального значения Vmax. Происходит это при такой концентрации субстрата, при которой уже не остается незанятых молекул фермента, и скорость реакции лимитируется скоростью каталитического процесса на поверхности фермента. Для большинства ферментов концентрация субстрата, при которой скорость реакции составляет половину максимальной Км, отражает прочность связывания субстрата с ферментом. Большие значения Км соответствуют слабому связыванию, и наоборот.
3.4.4. Многие ферменты заставляют реакции протекать преимущественно в одном направлении, сопрягая их с гидролизом АТР [35].
Живая клетка представляет собой далекую от равновесия химическую систему: продукт каждого фермента обычно быстро расходуется, так как используется в качестве субстрата другим ферментом данного метаболического пути. Еще более важно, что многие из уже описанных в гл. 2 ферментативных реакций сопряжены с расщеплением АТР на ADP и неорганический фосфат (см. разд. 2.4.2). Чтобы это оказалось, возможным, пул АТР в свою очередь должен поддерживаться на уровне, далеком от равновесия, так чтобы отношение концентрации АТР к концентрации продуктов его гидролиза было высоким. Таким образом, пул АТР служит «аккумулятором», поддерживающим постоянный перенос в клетке энергии и атомов по метаболическим путям, определяемым наличными ферментами. Приближение живой системы к химическому равновесию равнозначно ее распаду и смерти.
3.4.5. Мультиферментные комплексы повышают скорость клеточного метаболизма [36]
Способность ферментов ускорять химические реакции является решающей для поддержания жизни. В самом деле, клетка должна сопротивляться неизбежному процессу распада, что приводит ее в состояние, далекое от химического равновесия. Если бы скорость ключевых реакций не была выше скорости их обратных реакций, клетка быстро бы погибла. Представление о скорости метаболизма можно получить на основании того факта, что пул АТР типичной клетки млекопитающего за 1-2 мин полностью обновляется (т.е. все молекулы расщепляются и заменяются вновь синтезированными). Значит, за одну секунду каждая клетка использует 107 молекул АТР, а весь человеческий организм, таким образом, перерабатывает около грамма АТР в минуту.
Такая высокая скорость клеточных реакций обеспечивается эффективностью ферментных катализаторов. Эффективность многих ключевых ферментов столь высока, что ее дальнейшее увеличение бессмысленно, поскольку катализируемые этими ферментами реакции лимитирует скорость столкновений фермента с субстратами: другими словами, скорость реакций лимитируется диффузией.
Если реакция лимитируется диффузией, то ее скорость будет зависеть от концентрации фермента и субстрата. Поэтому для очень большой скорости ряда последовательных реакций необходимо, чтобы каждый промежуточный продукт и все ферменты присутствовали в высоких концентрациях. Но огромное количество одновременно протекающих в клетке различных реакций накладывает ограничение на достижимые концентрации реагентов. На деле большинство метаболитов присутствует в микромолярных концентрациях (10-6 М), а клеточная концентрация большинства ферментов значительно меньше. Как же в таком случае возможно поддерживать очень высокие скорости метаболизма?
Ответ кроется в пространственной организации клеточных компонентов. Скорость реакций можно повысить, не увеличивая концентрации субстратов, если собрать различные участвующие в последовательных реакциях ферменты в большой мультиферментный комплекс. При таком способе организации продукт фермента А переходит непосредственно к ферменту Б и т. д. до конечного продукта, причем лимитирующая стадия диффузии отсутствует даже при очень низких внутриклеточных концентрациях промежуточных соединений. Подобные ферментные комплексы встречаются очень часто. Структура одного из них - пируват-дегидрогеназы - была показана на рис. 2-40. Эти комплексы вовлечены почти во все аспекты метаболизма, включая центральные генетические процессы синтеза ДНК, РНК и белка. На самом деле возможно, что какое-то незначительное число ферментов эукариотических клеток свободно диффундируют в растворе, однако большинство из них, по-видимому, смогло развить центры связывания, которые концентрируют их с другими ферментами сходных функций в определенных участках клетки, повышая таким образом скорость и эффективность катализируемых ими реакций.
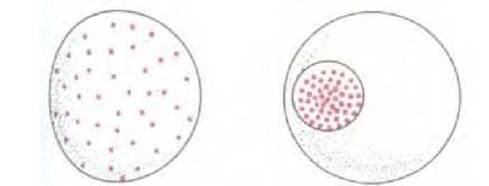
Рис. 3-55. Большое увеличение концентрации взаимодействующих молекул может быть достигнуто заключением их в ограниченный мембраной компартмент в эукариотической клетке.
Клетки имеют и другой способ увеличения скорости метаболических реакций, связанный с внутриклеточными мембранами.
3.4.6. Внутриклеточные мембраны ускоряют реакции, лимитируемые диффузией [37]
Обширная сеть внутриклеточных мембран эукариотических клеток по крайней мере двумя способами ускоряет реакции, скорость которых в отсутствие мембран зависела бы от скорости диффузии. Во-первых, мембраны способны изолировать ряд субстратов и действующие на них ферменты в одном компартменте, например, в эндоплазматическом ретикулуме или ядре. Если принять, что каждый такой компартмент занимает около 10% объема клетки, то концентрация реагентов в компартменте может быть в 10 раз выше, чем в такой же клетке без компартментализации (рис. 3-55).
Второй способ, которым мембраны могут увеличить скорость реакции, состоит в том, чтобы ограничить диффузию реагентов только двумя измерениями поверхности самой мембраны. Ферменты и их субстраты, ограниченные двумя измерениями, будут соударяться друг с другом значительно чаще, чем при трехмерной диффузии, даже несмотря на то что скорость диффузии молекул на мембране примерно в 100 раз ниже, чем в водном растворе (рис. 3-56). Такой процесс, видимо, используется в случае ферментов и субстратов, участвующих в синтезе липидных молекул; в этом случае субстраты растворены непосредственно в липидном бислое. Возможно, он также используется для ускорения многих других реакций, в которых участвуют связанные с мембранами ферменты.
Было обнаружено, что подобный механизм «плененной диффузии» увеличивает скорость нахождения некоторыми регуляторными белками геноспецифических последовательностей ДНК, с которыми они связываются, непосредственно на хромосоме. Такие белки имеют слабое сродство ко всем участкам ДНК. Они постоянно наталкиваются на хромосому, «скользят» по ней и таким способом сканируют всю длину ДНК до обнаружения своих специфических центров связывания.

Рис. 3-56. Скорости реакции возрастают, когда из-за наличия мембран трехмерная диффузия заменяется двумерной. Здесь показан результат серии теоретических расчетов. А. При диффузии в отсутствие мембран средней молекуле понадобится около 30 мин, чтобы найти любую единичную «мишень» внутри сферической частицы диаметром 10 мкм. Б. Если мишень фиксирована на мембране, то время диффузии значительно уменьшается. Средней молекуле требуется около 1 с, чтобы попасть на большую внутреннюю мембрану и около 2 мин, чтобы найти на мембране мишень. В. Если уменьшить площадь внутренней мембраны в 10 раз, то молекуле потребуется 10 с, чтобы попасть на мембрану, но поиск мишени теперь займет приблизительно в 10 раз меньше времени, чем в случае Б. Таким образом, эффективность соударений в случае В почти в 100 раз выше, чем в А.
3.4.7. Молекулы белка способны обратимо изменять свою форму [38]
В общем случае естественный отбор способствовал эволюции полипептидов, которые приобретали специфические стабильные конформации. Однако некоторые белковые молекулы, возможно даже большинство из них, имеют две или более слегка различающиеся конформации и, переходя обратимо от одной к другой, могут менять свою функцию. В таком аллостерическом белке могут, например, образоваться несколько различных наборов водородных связей с примерно одинаковой энергией, причем каждый такой набор связей требует разных пространственных взаимоотношений между двумя участками полипептидной цепи. Альтернативные стабилизированные конформации, как правило, разделяются нестабильными промежуточными состояниями, так что молекула «мечется» между стабильными конформациями.
Каждая дискретная конформация аллостерического белка имеет несколько отличную от других поверхность и, следовательно, разную способность взаимодействовать с другими молекулами. Часто лишь одна из двух конформаций имеет высокое сродство к конкретному лиганду; в этом случае наличие или отсутствие лиганда определяет принимаемую белком конформацию (рис. 3-57). В тех случаях, когда с различными участками поверхности одного белка могут связываться два различных лиганда, изменение концентрации одного из них меняет сродство белка к другому. Подобные аллостерические изменения играют ведущую роль в регуляции многих биологических процессов.
3.4.8. Аллостерические белки участвуют в регуляции метаболизма [39]
Аллостерические белки участвуют в регуляции по принципу обратной связи, которая контролирует поток веществ через метаболические пути (см. разд. 2.5). Например, ферменты, действующие на ранних стадиях какого-либо метаболического пути, почти всегда являются аллостерическими белками, способными существовать в двух альтернативных конформациях. Одна из них - это активная конформация. Белок в активной конформаций связывает в активном центре субстрат и превращает его в следующий метаболит данного пути. Другая конформация - неактивная. Белок в этой конформаций прочно связывает конечный продукт того же самого пути в специальном участке поверхности (регуляторном центре). По мере накопления конечного продукта, фермент связывается и переходит в неактивную конформацию (отрицательная обратная связь), которая становится стабильной, в силу того что продукт может связать фермент только в этой форме. В других случаях фермент, участвующий в метаболическом пути, активируется аллостерическим переходом, который происходит при недостатке в клетке продукта этого пути, когда фермент связывает накапливающийся лиганд. В этом случае лиганд связывается с активной формой фермента (положительная обратная связь) и такое связывание требует перехода из неактивной в активную конформацию (см. рис. 3-57). Результатом регуляции посредством положительной и отрицательной обратной связи является то, что данный продукт синтезируется в клетке лишь тогда, когда он необходим, и таким путем поддерживаются относительно постоянные концентрации всех метаболитов.

Рис. 3-57. Каждая конформация аллостерического белка может быть стабилизирована предпочтительным связыванием лиганда. Прочное связывание лиганда лишь с одной из возможных конформаций аллостерического белка переводит белок в эту конформацию. Таким образом, высокая концентрация лиганда X будет активировать представленный белок, а высокая концентрация лиганда Y инактивировать его.

Рис. 3-58. Схема, показывающая как конформация одной субъединицы влияет на конформацию соседних субъединиц в симметричном белке, состоящем из идентичных аллостерических субъединиц. Связывание одной регуляторной молекулы лиганда с одной субъединицей изменяет конформацию этой субъединицы, как показано на рис. 3-57. Поскольку такое изменение способствует возникновению тесносвязанной конформации, то связывание первой молекулы лиганда увеличивает сродство других субъединиц к связыванию того же лиганда. Таким образом, фермент может активироваться относительно малым увеличением концентрации регуляторного лиганда (см. рис. 3-59).
3.4.9. Аллостерические белки совершенно необходимы для клеточной сигнализации [40]
Мы уже отметили, что аллостерические белки (например, те, которые участвуют в регуляции по принципу обратной связи) имеют по меньшей мере два центра связывания - один для субстрата и один или более для регуляторных лигандов. Эти центры занимают различные участки поверхности белка и узнаваемые лиганды могут быть совершенно различными. Поскольку связывание одного лиганда с соответствующим центром может повлиять на другой центр изменением конформации белка, то любой метаболический процесс в клетке может регулироваться продуктом любой другой реакции независимо от его химической природы. Например, синтез и распад гликогена в мышечных клетках регулируются концентрацией связанного Са2+ с помощью аллостерических ферментов, активность которых меняется при изменении концентрации Са2+ в цитозоле (см. разд. 12.4.4).
Аллостерические белки особенно тонко реагируют на сигналы, если, как это часто случается, они работают совместно как идентичные субъединицы в симметричном ансамбле. В таких белках изменение конформации одной субъединицы, вызванное связыванием лиганда, может помочь соседним субъединицам связать тот же самый лиганд (рис. 3-58). В результате относительно малое изменение концентрации лиганда в окружающей среде переключает переход всего ансамбля из неактивной конформации в активную или наоборот. Если лиганд связывается преимущественно с активной конформацией каждой субъединицы фермента, то это приведет к резкому увеличению ферментативной активности, поскольку концентрация лиганда падает (рис. 3-59). Структура одного хорошо изученного аллостерического фермента аспартат-транскарбамоилазы показана на рис. 3-60.
3.4.10. Белки можно заставить изменять конформацию [40, 41]
Белки обеспечивают направленное течение всех происходящих в клетке процессов. Как же можно заставить молекулы самих белков двигаться упорядоченным образом? Прежде чем ответить на этот вопрос, мы должны рассмотреть, каким образом клетка контролирует изменения конформации аллостерических белков. Рассмотрим аллостерический белок, способный принимать две альтернативные конформации - неактивную низкоэнергетическую К и активную высокоэнергетическую К*, энергия которых различается на 4,3 ккал/моль (что приблизительно соответствует энергии образования на поверхности белка четырех водородных связей). При такой разнице энергий вероятность концентрации К будет в 1000 раз превышать вероятность конформации К* (табл. 3-3), и белок почти всегда будет находится в неактивной конформации. Есть, однако, два способа заставить белок принять активную конформацию.

Рис. 3-59. При увеличении концентрации лиганда активность изображенного на рис. 3-58 аллостерического фермента, состоящего из нескольких субъединиц, будет выражаться «сигмоидной» кривой (цветная кривая) благодаря кооперативному связыванию молекул лиганда. Напротив, активация аллостерического фермента, состоящего из одной субъединицы, описывается кривой простого насыщения (черная кривая). Пунктирная прямая показывает максимальный уровень активности, достигаемый при очень высоких концентрациях лиганда, который будет одинаковым в обоих случаях.
Связывание низкомолекулярного лиганда, образно выражаясь, «перетаскивает» молекулу в активную конформацию К*. Если лиганд связывается только с К*, то энергия этой конформации избирательно уменьшается, а энергия К остается неизменной. Поскольку лиганд связывается с белком достаточно слабо (большая часть энергии связывания уходит на удержание подходящей для лиганда формы белка), он с легкостью диссоциирует, и поэтому такое изменение конформации белка полностью обратимо.
Другой способ состоит в использовании дополнительной химической энергии для того, чтобы «толкнуть» белок на изменение конформации К на активную конформацию К*. В этом случае смена конформации почти необратима. Обычно происходит ковалентный перенос фосфата с молекулы АТР на остатки серина, треонина или тирозина белка с образованием ковалентной связи. Предположим, что эта реакция фосфорилирования, направляемая благоприятным гидролизом АТР в ADP создает невыгодное для конформации К отталкивание зарядов. Если это отталкивание уменьшено в активной форме К*, то переход из К в К* будет сильно облегчаться фосфорилированием (рис. 3-61). Регулируемое фосфорилирование, активирующее или подавляющее функционирование специфических белков, - обычное явление в эукариотических клетках (см. разд. 3.2.3); в самом деле, приблизительно одна десятая различных белков клеток млекопитающих содержит ковалентно связанный фосфат.
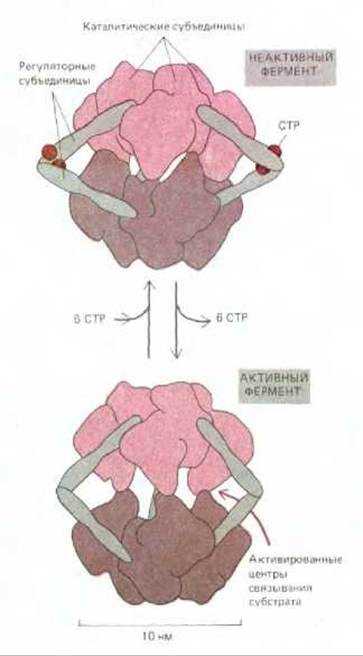
Рис. 3-60. Фермент аспартат-транскарбамоилаза выключается в ответ на связывание цитозинтрифосфата (СТР). Ферментный комплекс состоит из шести каталитических субъединиц и шести регуляторных субъединиц. Структура его неактивной и активной форм определена методом рентгеноструктурного анализа. Каждая регуляторная субъединица может связывать одну молекулу СТР, являющегося одним из конечных продуктов реакции. Эта реакция начинается, когда фермент катализирует образование карбамоиласпартата из карбамоилфосфата и аспарагиновой кислоты. Посредством такой регуляции по типу отрицательной обратной связи фермент защищен от производства большего количества СТР, чем это необходимо клетке. (По данным К. L. Krause, К. W. Volz and W.N. Lipscomb Proc. Natl. Acad. Sci. USA 82: 1643 1647, 1985.)
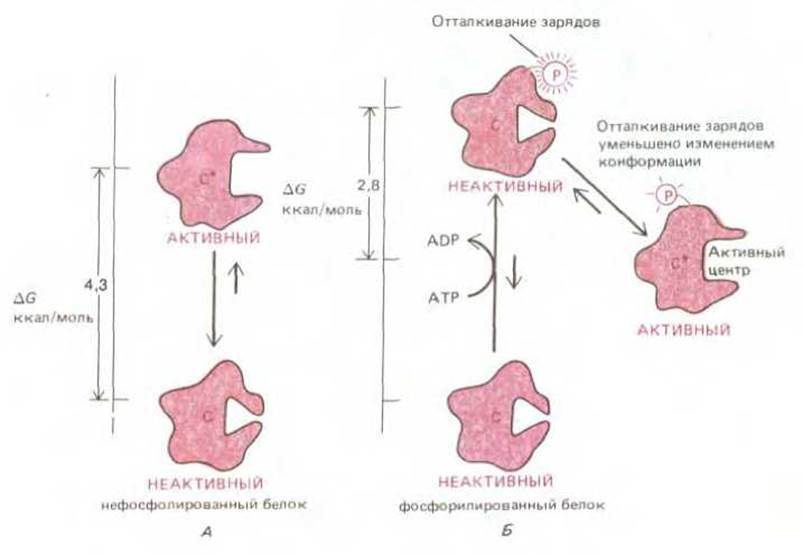
Рис. 3-61. Фосфорилирование с помощью АТР может активировать аллостерический белок. На этом примере неактивная конформация нефосфорилированного белка А в 1000 раз энергетически выгодней из-за разницы свободной энергии 4,3 ккал/моль (см. табл. 3-3). Когда же он фосфорилирован, активная конформация белка Б выгоднее в 100 раз (2,8 ккал/моль), поскольку фосфорилирование создает энергетически невыгодное отталкивание зарядов; этот эффект частично снимается переходом в активную информацию К*. Следовательно, фосфорилирование «толкает» фермент в активную конформацию. В другом случае фосфорилирование может приводить к притяжению зарядов, которое сближает две удаленные части аллостерического белка.
Иногда при добавлении ADP к таким фосфорилированным белкам in vitro наблюдается синтез АТР. Эти данные непосредственно показывают, что существенная часть энергии гидролиза АТР была запасена в напряженной конформации, принимаемой белком при его фосфорилировании. Как же, однако, происходящие с потреблением энергии изменения конформации белка вызывают движения и производят в клетке полезную работу?
3.4.11. Изменения конформации белка, происходящие с затратой энергии, могут быть использованы для выполнения полезной работы [42]
Предположим, что белку необходимо «пройти» вдоль тонкой нити, например, вдоль актиновой нити или молекулы ДНК. На рис. 3-62 показано, как аллостерический белок может выполнить эту задачу, принимая различные конформации. Если ничто не направляет и не упорядочивает конформационные изменения, то изменения формы белка будут полностью обратимы, т. е. белок будет случайно и бесцельно блуждать вдоль нити или волокна.
Поскольку при направленном движении белка совершается работа, то по законам термодинамики на движение должна быть затрачена какая-либо энергия (в противном случае это движение можно было бы использовать для создания вечного двигателя). Поэтому, как бы мы ни модифицировали показанную на рис. 3-62 модель, например, путем введения стабилизирующих ту или иную конформацию лигандов, молекула белка не будет способна к направленному движению, если не снабдить ее источником энергии.
Необходимо каким-либо образом сделать последовательность изменений конформации белка направленной. Например, весь цикл может стать направленным, если какую-либо из стадий сделать необратимой. Один из способов достижения необратимости состоит в использовании уже описанного цикла фосфорилирования - дефосфорилирования. Но аллостерические изменения белков можно направлять и без этого, используя энергию гидролиза АТР. К примеру, в показанной на рис. 3-63 модифицированной схеме циклического перемещения связывание АТР заставляет белок изменить конформацию 1 на конформацию 2. Затем происходит гидролиз АТР, продуктами которого являются связанные ADP и неорганический фосфат (Рі). Этот гидролиз сопровождается переходом конформации 2 в конформацию 3. Наконец, освобождение ADP и Ріпозволяет белку вернуться в конформацию 1.
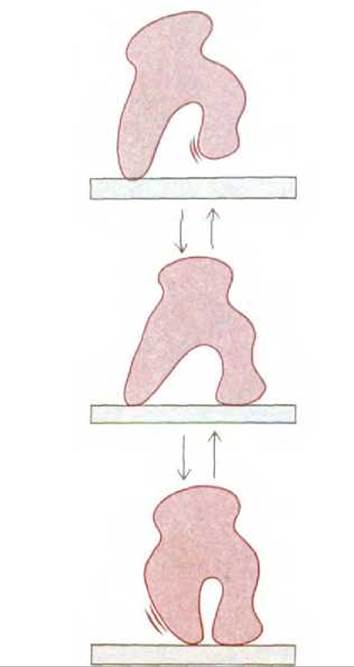
Рис. 3-62. Схематическое изображение «шагающего» аллостерического белка. Хотя три различные конформации белка позволяют ему перемещаться и назад, и вперед по волокну, с которым он связан, постоянное движение в одном направлении невозможно.
Поскольку на последовательность конформационных переходов 1 → 2 → 3 → 1 затрачивается энергия гидролиза АТР, то весь цикл при физиологических условиях становится практически необратимым (т.е. вероятность образования АТР из ADP и Ріпо пути 1 → 3 → 2 → 1 очень низка). Так как необратимость обеспечивает направленность цикла, то молекула белка в нашем схематическом примере будет непрерывно перемещаться вправо. Примерами белков, осуществляющих направленное движение с помощью описанного механизма, могут служить мышечный белок миозин и белок ДНК-геликаза, играющая важную роль в репликации ДНК.
Многие белковые устройства используют аналогичные механизмы для выполнения упорядоченных движений. Все эти белки способны претерпевать циклические изменения формы, сопровождающиеся гидролизом АТР. Некоторые из них по ходу цикла временно фосфорилируются, другие - нет.
3.4.12. Мембранные аллостерические белки, используя энергию АТР, могут служить молекулярными насосами [43]
Аллостерические белки могут использовать энергию гидролиза АТР не только для создания механического напряжения, но и для осуществления других форм работы, таких, как перекачивание специфических ионов внутрь или наружу клетки. Например, присутствующий в плазматической мембране всех клеток животных аллостерический белок под названием (Na+, К+) - зависимая АТРаза в каждом цикле конформационных изменений, сопровождающихся АТР-зависимым фосфорилированием белка, выкачивает из клетки 3 иона Na+ и накачивает в клетку 2 иона К+ (см. разд. 6.4.5). Этот насос, работающий за счет энергии АТР, потребляет более 30% энергетических потребностей большинства клеток. Постоянное выкачивание Na+ и накачивание К+ приводят к тому, что во внутриклеточной среде содержание Na+ оказывается ниже, а содержание К+ выше, чем во внеклеточной среде. Таким путем создаются противоположно направленные трансмембранные градиенты концентраций ионов К+ и Na+. Заключенная в этих и других ионных градиентах энергия в свою очередь направляет конформационные изменения множества других мембранных аллостерических белков, заставляя их выполнять полезную для клетки работу.
3.4.13. Белки могут мобилизовать энергию ионных градиентов для выполнения полезной работы [43, 44]
АТР и другие нуклеозидтрифосфаты - крайне важные, но не единственные источники энергии для белков, которые могут использовать ее для совершения полезной работы. Ионный градиент по обе стороны различных клеточных мембран способен запасать и расходовать энергию подобно перепаду воды по разные стороны плотины. Например, созданный (Na+, К+) - зависимой АТРазой большой перепад концептрации Na+ с двух сторон плазматической мембраны приводит в движение другие белковые насосы, транспортирующие в клетку глюкозу или специфические аминокислоты.

Рис. 3-63. «Шагающий» аллостерический белок, у которого переход между тремя конформациями направляется гидролизом связанной молекулы АТР. Цикл становится практически необратимым, поскольку один из таких переходов сопряжен с гидролизом АТР. С помощью повторяющихся циклов белок постоянно движется по волокну вправо.
Мембранные аллостерические насосы, питаемые энергией гидролиза АТР, способны работать в обратном направлении и использовать энергию ионного градиента для синтеза АТР. В самом деле, как мы увидим в гл. 7, именно такой механизм мобилизует у животных энергию градиента протонов [Н+] (направленного поперек внутренней мембраны митохондрий) для синтеза большинства молекул АТР.
3.4.14. Белковые машины играют основную роль во многих биологических процессах [45]
Сложные клеточные процессы, такие, как репликация ДНК или синтез белка осуществляются мультиферментными комплексами, которые работают как сложные «белковые машины». Например, многочисленные белки аппарата репликации ДНК согласованно перемещаются друг относительно друга, что дает возможность всему комплексу, подобно застежке-молнии, быстро двигаться вдоль ДНК (см. разд. 5.3.7).
В таких белковых машинах гидролиз связанных молекул нуклеозидгрифосфата приводит к направленным конформационным изменениям индивидуальных белков, что заставляет группу этих белков координирование перемещаться. Таким же способом соответствующие ферменты движутся прямо в то место, где они необходимы для осуществления определенной реакции, а не ожидают случайных столкновений между отдельными компонентами реакции. Простая механическая аналогия, которая отражает существо таких «высокотехнологичных» решений клеточных потребностей, проиллюстрирована на рис. 3-64. Видимо, большинство основных процессов, происходящих в клетках, осуществляется именно такими крайне сложными многокомпонентными белковыми машинами.
Заключение
Биологические функции белка определяются деталями химических свойств его поверхности. Углубления на поверхности белка, образованные точно расположенными аминокислотными остатками, формируют центры специфического связывания. Ферменты катализируют химические изменения связанных с ними молекул субстратов; при этом для расширения своих возможностей они часто используют маленькие, прочно связанные молекулы коферментов. Скорость ферментативных реакций нередко лимитируется диффузией, однако она может быть выше, если фермент и субстрат оказываются вместе в одном и том же небольшом клеточном компартменте.
Связывание лигандов с поверхностью аллостерических белков обратимо меняет форму последних. Изменения, вызванные присоединением одного лиганда, могут повлиять на связывание второго лиганда, что обеспечивает механизм регуляции различных клеточных процессов. Использование дополнительной химической энергии может внести направленность в изменения формы, белка. Например, за счет сопряжения аллостерических изменений с гидролизом АТР белки могут выполнять полезную работу, скажем создавать механическое усилие или перекачивать ионы, через мембрану. Могут формироваться и высокоэффективные «белковые машины.» - объединение согласованно работающих белков в многоферментные комплексы. Возможно, что белковые ансамбли такого типа осуществляют множество основных биологических реакций.
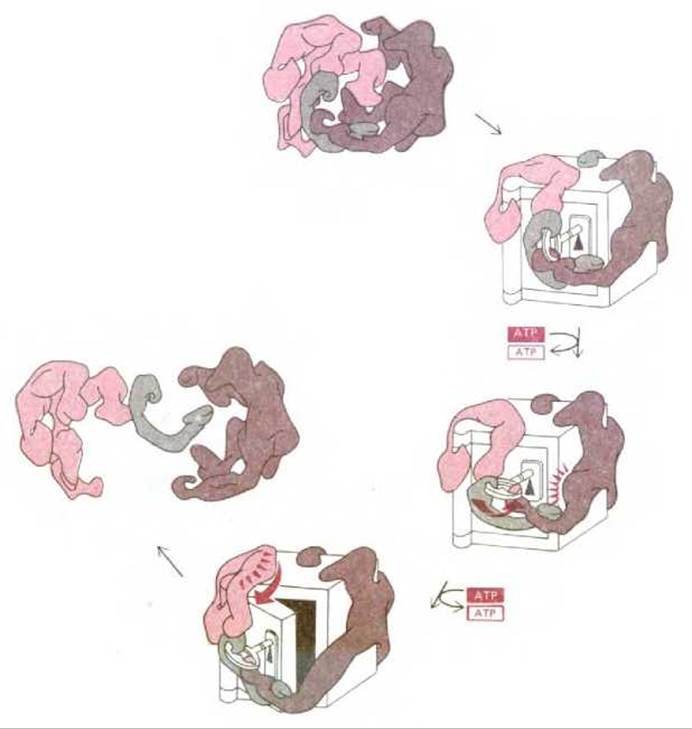
Рис. 3-64. «Белковая машина». Белковые комплексы часто состоят из одной или более субъединиц, способных к движению, которое направляется энергетически выгодным изменением при связывании молекулы субстрата (см. рис. 3-63). Такого рода движения белка особенно полезны для клетки, если они происходят в большом белковом комплексе, в котором, как представлено на рисунке, активности разных субъединиц скоординированы.
Литература
Цитируемая
1. Burley S.K., Petsko G. A. Weakly polar interactions in proteins. Adv. Prot. Chem, 39, 125-189, 1988.
Cantor C. R., Schimmel P. R. Biophysical Chemistry, Part I and Part III. New York, W.H. Freeman, 1980.
Eisenberg D., Crothers D. Physical Chemistry with Applications to the Life Sciences. Menlo Park, CA, Benjamin-Cummings, 1979. Pauling L. The Nature of the Chemical Bond, 3rd ed. Ithaca, NY, Cornell University Press, 1960.
2. Fersht A. R. The hydrogen bond in molecular recognition. Trends Biochem. Sci., 12, 301-304, 1987.
3. Cohen C., Parry D.A.D. a helical coiled coils. Trends Biochem. Sci., 11, 245-248, 1986.
DickersonR.E. The DNA helix and how it is read. Sci. Am., 249(6), 94-111, 1983.
4. Berg H. C. Random Walks in Biology. Princeton, NJ, Princeton University Press, 1983.
Einstein A. Investigations on the Theory of Brownian Movement. New York. Dover, 1956.
5. LavendaB.H. Brownian motion. Sci. Am., 252(2), 70-85, 1985.
6. Karplus M., McCammon J.A. The dynamics of proteins. Sci. Am., 254(4), 42-51, 1986.
McCammon J. A., Harvey S. C. Dynamics of Proteins and Nucleic Acids. Cambridge UK, Cambridge University Press, 1987.
7. Kirkwood T. W., Rosenberger R. F., Galas D. J., eds. Accuracy in Molecular Processes: Its Control and Relevance to Living Systems. London,
Chapman and Hall, 1986.
Kurland C. G., Ehrenberg M. Growth-optimized accuracy of gene expression. Annu. Rev. Biophys. Biophys. Chem., 16, 291-317, 1987.
8. RosenfieldI., Ziff E., Van Loon B. DNA for Beginners, London: Writers and Readers Publishing Cooperative. New York, Distributed in the USA by W. W: Norton, 1983.
Saenger W. Principles of Nucleic Acid Structure. Berlin, Springer, 1984.
9. Olby R. The Path to the Double Helix. Seattle, University of Washington Press, 1974.
Stent G. S. Molecular Genetics: An Introductory Narrative. San Francisco, Freeman, 1971.
10. Watson J.D., Crick F.H.C. Molecular structure of nucleic acids. A structure for deoxyribose nucleic acid. Nature, 171, 737-738, 1953.
11. Felsenfeld G. DNA. Sci. Am., 253(4), 58-66, 1985.
Meselson M., Stahl F. W. The replication of DNA in E. coli. Proc. Natl. Acad. Sci. USA, 44, 671-682, 1958.
Watson J. D., Crick F. H. C. Genetic implications of the structure of deoxyribonucleic acid. Nature, 171, 964-967, 1953.
12. Drake J. W. The Molecular Basis of Mutation. San Francisco, Holden Day, 1970.
Drake J. W., Glickman B. W., Ripley L. S. Updating the theory of mutation. Am. Scientist, 71, 621-630, 1983.
Wilson A. C. Molecular basis of evolution. Sci, Am., 253(4), 164-173, 1985.
13. Sanger F. Sequences, sequences, and sequences. Annu. Rev. Biochem., 57, 1-28, 1988.
Thompson E.O.P. The insulin molecule. Sci. Am., 192(5), 36-41, 1955.
Yanofsky C. Gene structure and protein structure. Sci. Am., 216(5), 80-94, 1967.
14. Brenner S., Jacob F., Meselson M. An unstable intermediate carrying information from genes to ribosomes for protein synthesis. Nature, 190, 576-581, 1961.
Darnell J.E., Jr. RNA. Sci. Am., 253(4), 68-78, 1985.
15. Chambon P. Split genes. Sci. Am., 244(5), 60-71, 1981.
Steitz J.A. Snurps. Sci. Am., 258(6), 58-63, 1988.
Wikowski J. A. The discovery of "split" genes: a scientific revolution. Trends Biochem. Sci., 13, 110-113, 1988.
16. Crick F.H.C. The genetic code: III. Sci. Am., 215(4), 55-62, 1966. The Genetic Code. Cold Spring Harbor Symp. Quant. Biol., 31, 1965.
17. Rich A., Kim S.H. The three-dimensional structure of transfer RNA. Sci. Am., 238(1), 52-62, 1978.
18. Lake J.A. The ribosome. Sci. Am., 245(2), 84-97, 1981.
Watson J.D. Involvement of RNA in the synthesis of proteins. Science, 140, 17-26, 1963.
Zamecnik P. The machinery of protein synthesis. Trends Biochem. Sci., 9, 464-466, 1984.
19. Alman S., Baer M., Guerrier-Takada C., Viogue A. Enzymatic cleavage of RNA by RNA. Trends Biochem. Sci., 11, 515-518, 1986.
Cech T. RNA as an enzyme. Sci. Am., 255(5), 64-75, 1986.
20. Cantor C. R., Schimmel P. R. Biophysical Chemistry. Part I: The Conformation of Biological Macromolecules, Chapter 2 and 5. New York, W.H. Freeman, 1980.
Creighton Т.Е. Proteins: Structure and Molecular Properties. New York, W.H. Freeman, 1984.
Dickerson R.E., Geisl. The Structure and Action of Proteins. New York, Harper and Row, 1969.
Schulz G. E., Schirmer R. H. Principles of Protein Structure. Chapters 1 through 5. New York, Springer, 1979.
21. Anfinsen C.B. Principles that govern the folding of protein chains. Science, 181, 223-230, 1973.
Baldwin R.I. Seeding protein folding. Trends Biochem. Sci., 11, 6-9, 1986.
Creighton Т.Е. Disulphide bonds and protein stability. Bioessays, 8, 57-63, 1988.
Rupley J. A., Gratton E., Careri G. Water and globular proteins. Trends Biochem. Sci., 8, 18-22, 1983.
Tanford C. The Hydrophobic Effect: Formation of Micelles and Biological Membranes, 2nd ed. New York, Wiley, 1980.
22. Doolittle R.F. Proteins. Sci. Am., 253(4), 88-99, 1985.
Milner-White E.J., Poet R. Loops, bulges, turns and hairpins in proteins. Trends Biochem. Sci., 12, 189-192, 1987.
Pauling L., Corey R. B. Configurations of polypeptide chains with favored orientations around single bonds: two new pleated sheets. Proc. Natl. Acad. Sci. USA, 37, 729-740, 1951.
Pauling L., Corey R. В., Branson H. R. The structure of proteins: two hydrogen-bonded helical configurations of the polypeptide chain. Proc. Natl. Acad. Sci. USA, 27, 205-211, 1951.
Richardson J. S. The anatomy and taxonomy of protein structure. Adv. Protein Chem., 34, 167-339, 1981.
23. Scott J. E. Molecules for strength and shape. Trends Biochem. Sci., 12, 318-321, 1987.
24. Hardie D.G., Coggins J.R. Multidomain Proteins - Structure and Evolution. Amsterdam, Elsevier, 1986.
25. Doolittle R. F. The genealogy of some recently evolved vertebrate proteins. Trends Biochem. Sci., 10, 233-237, 1985.
Doolittle R. F. Protein evolution. In: The Proteins, 3rd ed. (H. Neurath, R. L. Hill eds.), Vol. 4, pp. 1-118. New York, Academic Press, 1979. Neurath H. Proteolytic enzymec, past and present. Fed. Proc., 44, 2907-2913, 1985.
26. Biesecker G. et al. Sequence and structure of D-glyceraldehyde 3-phosphate dehydrogenase from Bacillus stearother-mophilus. Nature, 266, 328-333, 1977.
Blake C. Exons and the evolution of proteins. Trends Biochem. Sci., 8, 11-13, 1983.
Gilbert W. Genes-in-pieces revisited. Science, 228, 823-824, 1985.
McCarthy A. D., Hardie D. G. Fatty acid synthase: an example of protein evolution by gene fusion. Trends Biochem. Sci., 9, 60-63, 1984. RossmannM.G., ArgosP. Protein folding. Annu. Rev. Biocem., 50, 497-532, 1981.
27. Gehring W.J. On the homeobox and its significance. Bioessays, 5, 3-4, 1986.
Hunter T. The proteins of oncogenes. Sci. Am., 251(27), 70-79, 1984.
Siidhof T. C. et al. Cassette of eight exons shared by genes for LDL receptor and EOF precursor. Science, 228, 893-895, 1985.
Weber I. Т., Takio K., Titani K., Steiz T. A. The cAMP-binding domains of the regulatory subunit of cAMP-dependent protein kinase and the catabolite gene activator protein are homologous. Proc. Natl. Acad. Sci. USA, 79, 7679-7683, 1982.
28. Bajaj M., Blundell T. Evolution and the tertiary structure of proteins. Annu. Rev. Biophys. Bioeng., 13, 453-492, 1984.
Klug A. From macromolecules to biological assemblies. Biosci. Rep., 3, 395-430, 1983.
Metzler D.E. Biochemistry. New York, Academic Press, 1977. (Chapter 4 describes how macromolecules pack together into large assemblies.)
29. Caspar D.L.D., Klug A. Physical principles in the construction of regular viruses. Cold Spring Harbor Symp. Quant. Biol., 27, 1-24, 1962. Harrison S. C. Virus structure: high resolution perspectives. Adv. Virus Res., 28, 175-240, 1983.
30. Fraenkel-Conrat H., Williams R. C. Reconstruction of active tobacco mosaic virus from its inactive protein and nucleic acid components. Pro. Natl. Acad. Sci. USA,
41. 690-698, 1955. Harrison S. C. Multiple modes of subunit association in the structures of simple spherical viruses. Trends Biochem. Sci., 9, 345351, 1984.
Hendrix R. W. Tail lenght determination in double-stranded DNA bacteriophage. Curr. Top. Microbiol. Immunol., 136, 21-29, 1988.
Hogle J. M., Chow M., Filman D. J. The structure of polio virus. Sci. Am., 25(3), 42-49. 1987.
Namba K., Caspar D.L.D., Stubbs G.J. Computer graphics representation of levels of organization in tobacco mosaic virus structure. Science, 227, 773-776, 1985.
Nomura M. Assembly of bacterial ribisimes. Science, 179, 864-873, 1973.
31. Mathews C.K., Kutter E.M., Mosig G., Berget P.B. Bacteriophage T4, Chapters 1 and 4. Washington, DC, American Society of Microbiologists, 1983.
Steiner D. F., Kemmler W, Tager H. S., Peterson J. D. Proteolytic processing in the biosynthesis of insulin and other proteins. Fed. Proc., 33, 2105-2115, 1974.
32. Fersht A. Enzyme Structure and Mechanism, 2nd ed. New York, W. H. Freeman, 1985.
33. Chothia C. Principles that determine the structure of proteins. Annu. Rev. Biochem., 53, 537-572, 1984.
34. Fersht A. R., Leatherbarrow R. J., Wells T. N. C. Binding energy and catalysis. Trends Biochem. Sci., 11, 321-325, 1986.
Lerner R.A., Tramontano A. Catalytic antibodies. Sci. Am., 258(3), 58-70, 1988.
Wolfenden R. Analog approaches to the structure of the transition state in enzyme reactions. Accounts Chem. Res., 5, 10-18, 1972.
35. Wood W. В., Wilson J. H., Benbow R.M., Hood L.E. Biochemistry, A Problems Approach, 2nd ed. Menlo Park, CA, Benjymin-Cummings, 1981. (Chapters 9 and 15 and associated problems.)
36. Barnes S. J., Weitzman P. D. J. Organization of citric acid cycle enzymes into a multienzyme cluster. FEBS Lett., 201, 267-270, 1986.
Reed L. J., Cox D. J. Multienzyme complexes. In: The Enzymes, 3rd ed. (P.D. Boyer ed.), Vol. 1, pp. 213-240. New York, Academic Press, 1970.
37. Adam G., Delbruck M. Reduction of dimensionality in biological diffusion processes. InB Structural Chemistry and Molecular Biology (A.
Rich, N. Davidson eds.), pp. 198-215. San Francisco, Freeman, 1968.
Berg O. G., van Hippel P. H. Diffusion-controlled macromolecular interactions. Anna Rev. Biophys. Biophys. Biochem., 14, 131-160, 1985.
38. Cantor C.R., Schimmel P.R. Biophysical Chemistry. Part III: The Behavior of Biological Macromolecules. Chapters 15 and 17. New York, W. H. Freeman, 1980.
Dickerson R. E., Geis I. Hemoglobin: Structure, Function, Evolution and Pathology. Menlo Park, CA. Benjamin-Cummings, 1983.
Edelstein S. J. Introductory Biochemistry. San Francisco, Holden-Day, 1973. (Chapter 10 on protein aggregates and allosteric interactions.) Monod J., Changeux J.-P., Jacob F. Allosteric proteins and cellular control systems. J. Mol. Biol., 6, 306-329, 1963.
39. Koshland D.E., Jr. Control of enzyme activity and metabolic pathways. Trends Biochem. Sci., 9, 155-159, 1984. Newsholme E. A., Start C. Regulation in Metabolism. New York, Wiley, 1973.
40. KochK.-W., StryerL. Highly cooperative feedback control of retinal rod guanylate cyclase by calcium ions. Nature, 334, 64-65, 1988.
Nishizuka Y. Protein kinases in signal transduction. Trends Biochem. Sci., 9, 163-166, 1984.
41. Kantrowitz E.R., Lipscomb W.N. Escherichia coli aspartate transcarbamoylase: the relation between structure and fanction Science, 241, 669-674, 1988.
Schachman H.K. Can a simple model account for the allosteric transition of aspartate transcarbamoylase? J. Biol. Chem., 263, 18583-18586, 1988.
Sprang S., Goldsmith E., Fretterick R. Structure of the nucleotide activation switch in glycogen phosphorylase a. Science, 237, 1012-1019, 1987.
42. Hill T.L. Biochemical cycles and free energy transduction. Trends Biochem. Sci., 2, 204-207, 1977.
Hill T.L. A. proposed common allosteric mechanism for active transport, muscle contraction, and ribosomal translocation. Proc. Natl. Acad. Sci. USA, 64, 267-274, 1969.
Johnson K.A. Pathway of the microtubule-dynein ATPase and the structure of dynein: a comparison with actomyosin. Annu. Rev. Biophys. Biophys. Chem., 14, 161-188, 1985.
43. Hokin L.E. The molecular machine for driving the coupled transports of Na+ and K+ is an (Na+ + Reactivated ATPase. Trends Biochem. Sci., 1, 233-237, 1976.
Kyte J. Molecular considerations relevant to the mechanism of active transport. Nature, 292, 201-204, 1981.
Tanford C. Mechanism of free energy coupling in active transport. Annu. Rev. Biochem., 53, 379-409, 1983.
44. NichollsD. G. Bioenergetics: An Introduction to the Chemiosmotic Theory. New York, Academic Press, 1982.
45. Alberts В. М. Protein machines mediate the basic genetic processes. Trends Genet., 1, 26-30, 1985.