Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Введение в биологию клетки
Как изучают клетки?
Изучение клеточных макромолекул с помощью антител и радиоактивных изотопов
Для изучения клеточных макромолекул можно использовать практически все свойства молекул - физические, химические и биологические. При биологическом исследовании молекулы внутри клеток выявляют обычно по оптическим свойствам (в чистом виде или в комплексе с красителями), а также по биохимической активности. Здесь мы рассмотрим два метода определения молекул внутри клеток: один из них включает использование радиоактивных изотопов, а другой - использование антител. Оба метода весьма эффективны для выявления определенных молекул в сложных смесях. Потенциально эти методы очень чувствительны и при оптимальных условиях дают возможность обнаруживать в образце молекулы, общее количество которых меньше 1000.
4.5.1. Методы выявления радиоактивных атомов отличаются высокой чувствительностью [31]
Большинство известных природных элементов представляют собой смесь изотопов, различающихся массой атомного ядра, но имеющих, тем не менее, одинаковый набор электронов, а, следовательно, одинаковые химические свойства. Ядра радиоактивных изотопов, или радиоизотопов, нестабильны и подвергаются спонтанному распаду, образуя различные атомы. При распаде ядра испускаются заряженные частицы (например, электроны) или излучение (например, гамма-лучи).
Вследствие своей нестабильности в природе радиоизотопы встречаются редко, но в ядерных реакторах, где стабильные атомы подвергаются бомбардировке частицами высокой энергии, их образуется чрезвычайно много (табл. 4-11). В настоящее время многие биологические молекулы стали доступны в форме, содержащей радиоактивные атомы. Для регистрации излучения, испускаемого радиоактивными изотопами, используют различные подходы. Электроны (ß-частицы) можно определять по ионизации газа, которую они вызывают в счетчике Гейгера, или в сцинтилляционном счетчике по маленьким вспышкам света в сцинтилляционной жидкости. С помощью этих методов в биологическом образце можно выявить содержание определенного радиоактивного изотопа. Наличие радиоактивных изотопов в образце регистрируют и методом радиоавтографии (по их действию на зерна серебра в фотоэмульсии). Данный метод характеризуется очень высокой чувствительностью, и в благоприятных условиях с его помощью можно зарегистрировать практически каждый распад, т. е. может быть учтен практически каждый радиоактивный атом.
4.5.2. Радиоактивные изотопы используют для изучения перемещения молекул в клетках и в целом организме [32]
Один из первых примеров использования феномена радиоактивности в биологических исследованиях - изучение превращения углерода в процессе фотосинтеза. Одноклеточные зеленые водоросли поместили в атмосферу, содержащую радиоактивно меченный СО2 (14СО2), и облучали в разные промежутки времени солнечным светом. Затем радиоактивное содержимое водорослей фракционировали с помощью хроматографии на бумаге. Небольшие молекулы, содержащие атомы 14С, происходящие из молекул СО2, выявляли на хроматограмме, помещая поверх высушенной бумажной хроматограммы лист фотопленки. Таким образом было идентифицировано большинство основных компонентов, образующихся в процессе фотосинтеза Сахаров из СО2.
Радиоактивные молекулы можно использовать для исследования практически всех внутриклеточных процессов. Для этого обычно в ходе эксперимента в культуральную среду добавляют предшественник в радиоактивной форме: при этом радиоактивные молекулы смешиваются с присутствующими в клетках нерадиоактивными. Клетка использует оба типа молекул, поскольку они отличаются только массой атомного ядра. Изменение локализации радиоактивных молекул в клетке или их химические превращения можно проследить во времени. Чувствительность таких экспериментов во многих случаях повышают, используя метод вытеснения метки (pulse-chase). При использовании этого метода радиоактивные вещества добавляют на очень короткое время (импульсная метка), затем их удаляют и замещают нерадиоактивными молекулами. Образцы отбирают через различные промежутки времени и в каждой такой точке определяют химическую природу и локализацию химических веществ (рис. 4-54).
Значение метода радиоактивного мечения трудно переоценить. Именно этот метод дает возможность дискриминировать химически идентичные молекулы, история которых различна - например, те молекулы, которые отличаются временем синтеза. С помощью радиоактивных методов удалось определить, что почти все молекулы живой клетки постоянно разрушаются и замещаются другими молекулами. Такие медленные обменные процессы могли бы остаться незамеченными, если бы не радиоактивные изотопы.
В настоящее время промышленность производит в радиоактивной форме практически все распространенные низкомолекулярные вещества. Независимо от степени сложности биологических молекул почти каждую из них можно пометить радиоактивной меткой. Часто получают радиоактивные молекулы, в структуру которых радиоактивные атомы введены в определенных положениях. Это делают для того, чтобы получить возможность следить за независимыми превращениями, претерпеваемыми различными частями одной молекулы в ходе биологических реакций (рис. 4-55).
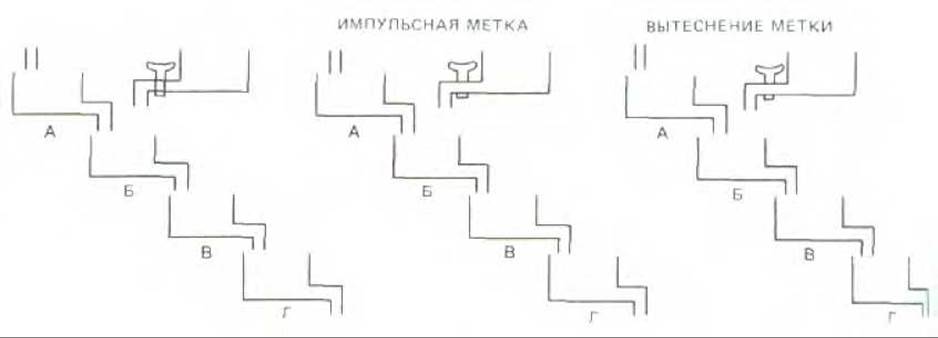
Рис. 4-54. Схема, иллюстрирующая суть типичного эксперимента с вытеснением импульсной метки. Буквами А, Б, и В помечены резервуары, которые соответствуют различным компартментам клетки (выявляемым с помощью радиоавтографии или в опытах, включающих фракционирование клетки) или различным химическим соединениям (выявляемым хроматографически или с помощью каких-либо иных химических методов).
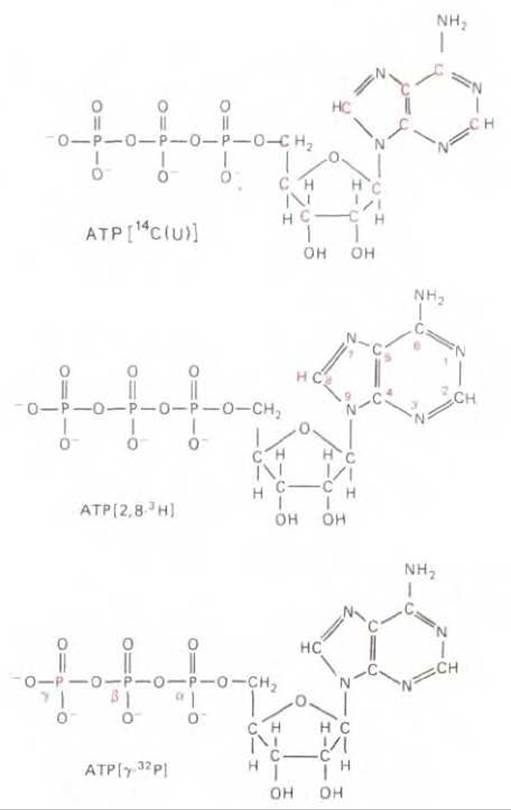
Рис. 4-55. Три радиоактивные формы АТР, имеющиеся в продаже. Радиоактивные атомы выделены цветом. Приведены обозначения, с помощью которых указывается расположение и тип радиоактивных атомов.
Одна из наиболее важных областей применения радиоактивных изотопов в биологии клетки - это определение локализации радиоактивных соединений в срезах клеток или живых тканей методом радиоавтографии. При использовании этого метода живые клетки подвергают кратковременному (импульсному) мечению с последующей инкубацией в течение различных промежутков времени в нерадиоактивной среде. Затем клетки фиксируют и обрабатывают для проведения световой или электронной микроскопии. Каждый приготовленный препарат покрывают тонким слоем фотоэмульсии и оставляют на несколько дней в темноте - время, в течение которого происходит распад радиоактивного изотопа. Затем фотоэмульсию проявляют. Местоположение радиоактивных молекул в каждой клетке можно определить по расположению темных зерен серебра. Если инкубировать клетки с радиоактивным предшественником ДНК (3Н-тимидином), то можно увидеть, что ДНК синтезируется в ядре и там же остается. И наоборот, мечение клеток радиоактивным предшественником РНК (3Н-уридином) показывает, что РНК исходно синтезируется в ядре и затем быстро накапливается в цитоплазме клеток.
4.5.3. Для выявления и выделения специфических молекул можно использовать антитела [33]
Антителами называют белки, продуцируемые позвоночными животными для защиты от инфекции (см. гл. 18). Количество различных форм антител достигает миллиона; этим антитела и отличаются от прочих белков. Каждая форма антител обладает определенными участками связывания, которые предназначены для специфического узнавания молекул, стимулировавших синтез антител. Эти молекулы называют антигенами. Высокая специфичность антител в отношении антигена превращает их в мощный инструмент для исследования биологии клетки. После окрашивания антител флуоресцирующими красителями их можно использовать для определения внутриклеточной локализации специфических макромолекул с помощью флуоресцентной микроскопии (рис. 4-56). Мечение электроноплотными микрочастицами, например, микросферами коллоидного золота, позволяет использовать антитела для локализации клеточных антигенов при помощи электронной микроскопии (рис. 4-57). Антитела могут выступать в роли биохимических звеньев для выявления и определения количества молекул в клеточных экстрактах и идентификации специфических белков после их разделения с помощью электрофореза в полиакриламидном геле. При связывании антител с инертным матриксом получают аффинные колонки, пригодные для выделения и очистки специфических молекул из грубых клеточных экстрактов. Чувствительность антител, используемых в качестве зонда для выявления специфических макромолекул в клетках и тканях, часто увеличивают с помощью метода усиления сигнала. Например, такую маркерную молекулу как флуоресцирующий краситель можно прямо связывать с антителами и использовать для непосредственного определения антигена (первые антитела). Еще большего усиления сигнала можно добиться, применяя немеченые первые антитела и затем выявляя их с помощью меченых вторых антител, связывающихся с первыми антителами (рис. 4-58, А).
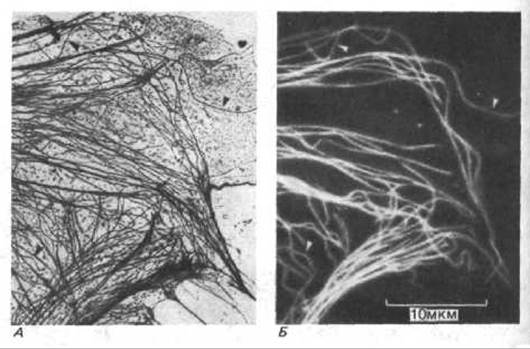
Рис. 4-56. А. На электронной микрофотографии периферического участка эпителиальной клетки в культуре можно различить расположение микротрубочек и других филаментов. Б. С помощью метода непрямой иммуноцитохимии тот же участок окрашен флуоресцирующими антителами к тубулину, который является мономером микротрубочек (см. рис. 4-58). Стрелками указаны отдельные микротрубочки, хорошо различимые на обеих микрофотографиях (Osborn M., Webster R., Weber К., J. Cell Biol., 77, R27-R34, 1978, воспроизводится с разрешения Rockefeller University Press.)
Еще одна система усиления сигнала основана на исключительно высоком сродстве биотина (низкомолекулярного растворимого витамина) к стрептавидину (бактериальному белку). При ковалентном связывании первых антител с биотипом можно прямо пометить стрептавидин маркером и использовать его вместо вторых антител. Стрептавидин также можно применять для связывания отдельных молекул антител, меченных биотином, с разветвленной сетью молекул, меченных биотином (рис. 4-58, Б). Такие сети получают вследствие модификации метода (рис. 4-58, А) за счет применения третьего слоя антител.
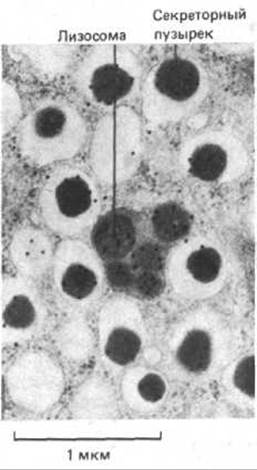
Рис. 4-57. Иммуноцитохимическая локализация специфических белковых молекул на электронных микрофотографиях с помощью мечения антителами, связанными с частицами коллоидного золота. Показан тонкий срез клетки, секретирующей инсулин, где молекулы инсулина помечены антиинсулиновыми антителами, связанными с мельчайшими микросферами золота (каждая в виде черной точки). Большая часть инсулина накапливается в плотном содержимом секреторных гранул; кроме того, содержимое некоторых секреторных гранул деградирует в лизосомах. (L. Orri, Diabetology, 28, 528-546, 1985.)
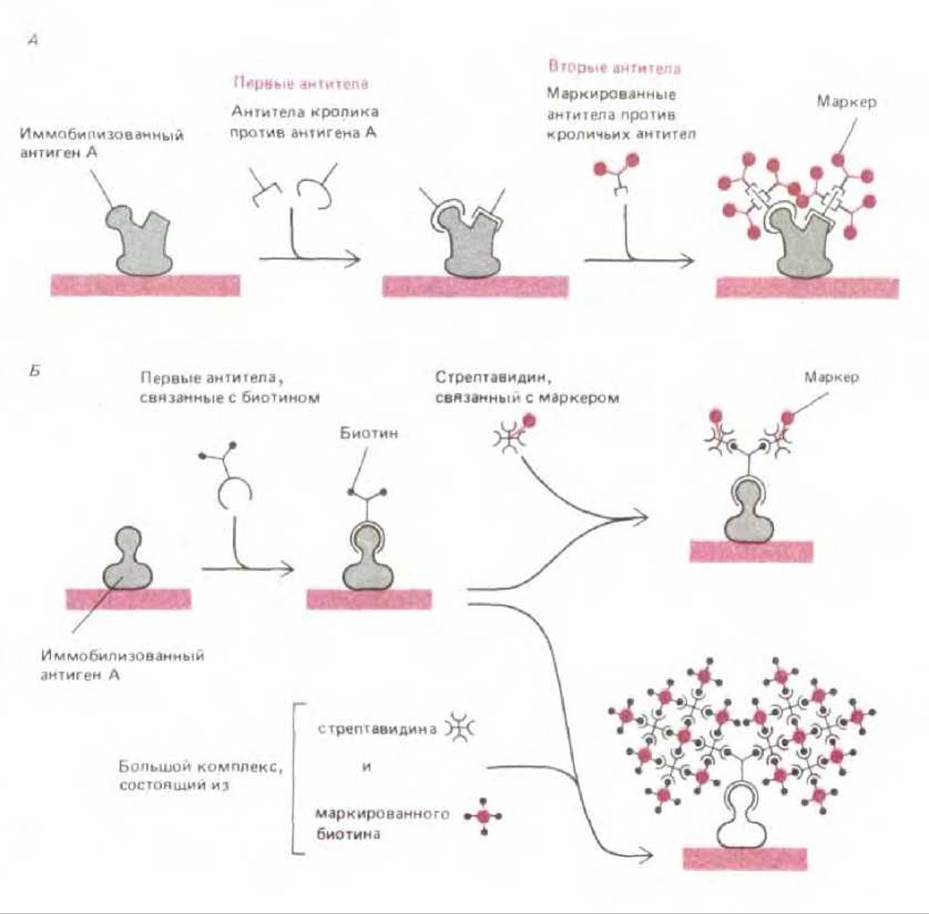
Рис. 4-58. Применение антител для выявления определенных молекул с высокой чувствительностью. А. Иллюстрация метода непрямой иммуноцитохимии, высокая чувствительность которого определяется тем, что первое антитело (так называют молекулу антитела непосредственно связывающуюся с узнаваемой молекулой антигена) опознается многими молекулами антител второго типа. Эти вторые антитела предварительно связаны с маркерными молекулами, что и позволяет их регистрировать. В качестве маркерных молекул используют красители флуоресцеин и родамин (для флуоресцентной микроскопии), фермент щелочную пероксидазу (для электронной и светлопольной микроскопии), белок ферритин, содержащий железо, или микросферы коллоидного золота (для электронной микроскопии) и фермент щелочную фосфатазу (для биохимической детекции). Б. Модификация метода, представленного на А: вместо вторых антител используют взаимодействие биотина и стрептавидина, характеризуемое высоким сродством. Поскольку каждая из молекул стрептавидина может связать четыре молекулы биотина, она соединяет множество биотинилированных маркерных молекул поперечными сшивками с образованием громадной трехмерной сети. Внизу представлен особенно чувствительный метод «сандвича», где такие сети используются для интенсивного мечения каждой из молекул первых антител.
В наиболее чувствительных методах усиления сигнала в качестве маркерной молекулы используется фермент. Например, щелочная фосфатаза участвует в реакции образования неорганического фосфата, и поэтому связывание фермента со вторым антителом позволяет использовать чувствительный химический тест на фосфат для выявления комплекса антитело - антиген. Поскольку такая ферментная молекула вследствие своих каталитических свойств образует многие тысячи молекул продукта реакции, метод иммунодетекции с применением связанной формы фермента (Enzyme-Linked Immunoassay - ELISA) дает возможность обнаружить минимальное количество антигена. Данный метод хорошо зарекомендовал себя в клинической медицине для диагностики различных типов инфекций.
Обычно антитела извлекают из сыворотки, обогащенной антителами, которую получают путем многократного введения антигена животным (например, кролику или козе). Эта антисыворотка содержит гетерогенную смесь антител, каждый тип которых был образован определенными клетками, синтезирующими антитела (В-лимфоцитами). Различные антитела опознают различные части молекулы антигена, а также примеси в препарате антигена. Иногда специфичность антисыворотки к различным антигенам можно повысить, удалив молекулы нежелательных антител, которые связываются другими молекулами. Например, антисыворотку, полученную к белку X, можно пропустить через аффинную колонку с антигенами Y и Z и удалить таким образом все загрязняющие анти-Y и анти-Z антитела. Однако даже в этом случае сыворотка гетерогенна, что ограничивает ее применение.
4.5.4. Клеточные линии гибридом служат источником моноклональных антител [34]
Проблему гетерогенности антисыворотки удалось преодолеть в 1976 г. после разработки нового метода, который произвел революцию в исследовании внутриклеточных процессов с помощью антител. Этот метод включает клонирование В-лимфоцитов, секретирующих только один определенный тип антител, что обеспечивает получение однородных антител в большом количестве. Время жизни В-лимфоцитов в культуре обычно весьма ограничено. Поэтому от иммунизированных мышей получают В-лимфоциты, секретирующие отдельные виды антител, и осуществляют их слияние с «бессмертными» клетками из опухоли В-лимфоцитарного происхождения. В результате образуется гетерогенная смесь гибридных клеток, из которых отбирают гибриды, способные размножаться в культуре и синтезировать антитела определенного вида. Эти так называемые гибридомы клонируют по отдельности и получают клоны, каждый из которых является постоянным источником моноклональных антител одного типа (рис. 4-59).
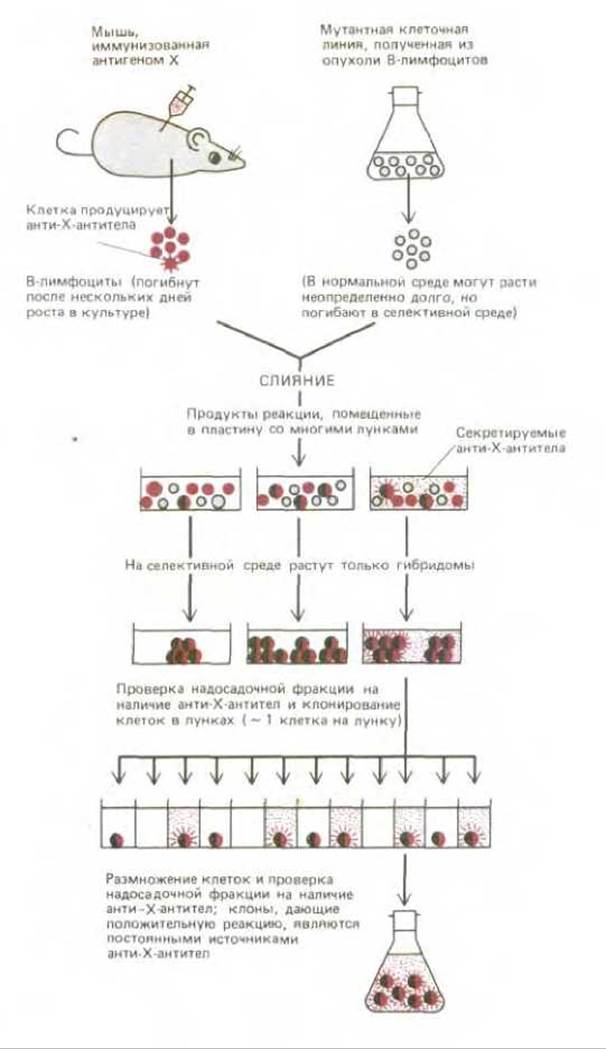
Рис. 4-59. Схема получения гибридных клеток, или «гибридом», синтезирующих гомогенные моноклональные антитела против определенного антигена (X). Использованная для роста клеток селективная среда содержит ингибитор (аминоптерин), блокирующий нормальные пути биосинтеза нуклеотидов. Поэтому для синтеза нуклеиновых кислот клеткам приходится использовать обходной путь (шунт) биосинтеза. Но именно этот шунт нарушен у мутантных клеток, использованных для слияния с нормальными В-лимфоцитами. Поскольку ни одна из взятых для опыта клеточных линий в этой среде размножаться не может, в ней выживают только гибридные клетки.
Моноклональные антитела продуцируются В-лимфоцитами одного клона, т.е. клетками, ведущими свое начало от одной-единственной клетки. Поэтому все молекулы антител данного вида обладают одинаковой специфичностью связывания антигенов. Один такой участок может опознавать, например, определенную конформацию отдельной группы из 5-6 аминокислот боковой цепи белковой молекулы и такое же количество остатков Сахаров в полисахариде. Благодаря своей строгой специфичности моноклональные антитела имеют значительное преимущество по сравнению с обычной антисывороткой, которая, как правило, содержит антитела, опознающие множество различных участков-антигенов даже в сравнительно небольшой макромолекуле.
Основное преимущество метода гибридом определяется возможностью получения моноклональных антител против неочищенных молекул, содержащихся в сложной смеси в качестве минорного компонента. Это преимущество обеспечивается реальностью выбора индивидуальных гибридом, образующих антитела определенного вида, из сложной смеси различных гибридных клеток, продуцирующих множество разных антител. Таким образом в принципе можно получить моноклональные антитела против любого белка, содержащегося в клетке. Каждый тип антител можно затем использовать в качестве специфического зонда как для локализации белков с помощью цитологических методов, так и для очистки белков. Получив белки в чистом виде, мы можем исследовать их структуру и функцию. К настоящему времени выделено не более 5% из 1000 или более различных белков, которые, судя по имеющимся данным, содержатся в типичной клетке млекопитающих. Использование моноклональных антител и технологии клонирования генов (см. ниже) снимает многие сложности в идентификации и определении новых белков и генов. Проблемой для исследователей остается определение их функций.
4.5.5. Антитела и другие макромолекулы можно инъецировать в живые клетки [35]
Молекулы антител можно использовать для определения функции тех молекул, с которыми они связываются. Например, у новорожденных крыс, получивших антитела к белковому фактору, который стимулирует рост нейронов, не развиваются нервные клетки определенного типа, нуждающиеся для выживания в данном факторе роста. Подобным образом антитела, реагирующие с молекулами на поверхности некоторых типов клеток, можно использовать для уничтожения этих клеток; специфически удаляя клетки определенного типа из смешанной клеточной популяции, можно определить важность клеток этого типа для осуществления различных биологических функций.
Поскольку плазматическая мембрана клеток непроницаема для крупных молекул, белки, расположенные внутри живых клеток, не могут взаимодействовать с антителами, добавляемыми извне. Если такие белки необходимо связать, в цитоплазму клеток эукариот можно ввести антитела и другие молекулы, инъецируя их тонкой стеклянной пипеткой через плазматическую мембрану. Прокалываемая плазматическая мембрана имеет способность «самозапаиваться» спустя некоторое время после инъекции. С помощью этого метода было установлено, что при введении в оплодотворенное яйцо морского ежа антител к миозину, его деление останавливается, хотя деление ядер происходит нормально. Отсюда следует, что миозин выполняет ключевую роль в процессах сокращения, обеспечивающих деление цитоплазмы при митозе, но не принимает участия в работе митотического веретена. Моноклональные антитела обладают высокой специфичностью, их нетрудно получить в концентрированной форме, и поэтому они особенно удобны для проведения таких исследований.
Заключение
В клетке можно пометить любые молекулы: для этого в них вводят один или несколько радиоактивных атомов. Нестабильные радиоактивные атомы распадаются, испуская излучение, что позволяет прослеживать судьбу исследуемых молекул. Применение радиоизотопов в клеточной биологии ограничено двумя видами экспериментов: анализ метаболических путей по методу вытеснения метки и локализацией меченых молекул в клетке с помощью радиоавтографии. Антитела представляют собой очень удобный и чувствительный инструмент для локализации специфических биологических макромолекул. В организме позвоночных животных продуцируются миллионы различных антител, в каждом из которых имеются участки связывания, опознающие специфические группы молекул. Метод гибридом позволяет получать моноклональные антитела с одинаковой специфичностью практически в неограниченных количествах. В принципе можно получать моноклональные антитела против любых макромолекул в клетке и затем использовать эти антитела для локализации или очистки определенных макромолекул, а в некоторых случаях и для анализа внутриклеточных свойств этих молекул.