Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Преобразование энергии: митохондрии и хлоропласты
Дыхательная цепь и АТР-синтетаза
Ознакомившись в общих чертах с функцией митохондрий, перейдем теперь к более детальному рассмотрению цепи дыхания - электронтранспортной цепи, имеющей столь важное значение для окислительного метаболизма в целом. Большинство элементов этой цепи составляет неотъемлемую часть внутренней митохондриальной мембраны и может служить одним из самых ярких примеров сложного взаимодействия между отдельными белками биологической мембраны.
7.2.1. Из митохондрий можно выделить функционально активные частицы, «вывернутые наизнанку» [13]
В интактных митохондриях дыхательная цепь относительно недоступна для экспериментального анализа. Однако путем обработки митохондрий ультразвуком можно получить функционально активные субмитохондриальные частицы - обрывки крист, замкнувшиеся в маленькие пузырьки около 100 нм в диаметре (рис. 7-23). При использовании метода негативного контрастирования на электронных микрофотографиях субмитохондриальных частиц видно, что их наружная поверхность усеяна крошечными шариками, прикрепленными к мембране с помощью «ножки» (рис. 7-24). В интактных митохондриях эти грибовидные структуры локализованы на внутренней (обращенной к матриксу) стороне внутренней мембраны. Таким образом, субмитохондриальные частицы представляют собой как бы вывернутые наизнанку фрагменты внутренней мембраны: поверхности их, ранее обращенные к матриксу, обращены теперь к окружающей среде. В результате на них легко воздействовать теми не проходящими через мембрану веществами, которые в обычных условиях находились в матриксе. При добавлении NADH, ADP и неорганического фосфата эти частицы осуществляют перенос электронов с NADH на О2, сопрягая это окисление с синтезом АТР. Такая бесклеточная система дает возможность выделять в функционально активной форме многочисленные белки, ответственные за окислительное фосфорилирование.
7.2.2. АТР-синтетазу можно выделить и снова встроить в мембрану в активной форме [14]
В 1960 г. было впервые показано, что различные мембранные белки, участвующие в окислительном фосфорилировании, могут быть выделены без потери активности. От поверхности субмитохондриальных частиц удалось отделить и перевести в растворимую форму усеивающие их крошечные белковые структуры. Хотя субмитохондриальные частицы без этих сферических структур продолжали окислять NADH в присутствии кислорода, синтеза АТР при этом не происходило. С другой стороны, выделенные структуры действовали как АТРазы, гидролизуя АТР до ADP и Рі. Когда сферические структуры (названные Fi - АТРазами) добавляли к лишенным их субмитохондриальным частицам, реконструированные частицы вновь синтезировали АТР из АDР и Рі

Рис. 7-23. Методика получения субмитохондриальных частиц из митохондрий. Частицы представляют собой обрывки разрушенных крист, образовавшие замкнутые пузырьки.
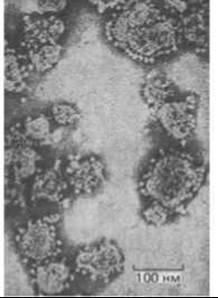
Рис. 7-24. Электронная микрофотография субмитохондриальных частиц. (С любезного разрешения Efraim Racker.)
Впоследствии было показано, что F1-АТРаза - это часть большого, пронизывающего всю толщу мембраны комплекса (массой около 500000 дальтон), который состоит но меньшей мере из девяти различных полипептидных цепей. Этот комплекс получил название АТР-синтетазы (или F0F1-АТРазы); он составляет около 15% всего белка внутренней митохондриальной мембраны. Весьма сходные АТР-синтетазы имеются в мембранах хлоропластов и бактерий. Такой белковый комплекс содержит трансмембранные каналы для протонов, и синтез АТР происходит только тогда, когда через эти каналы проходят протоны вниз по своему электрохимическому градиенту.
В экспериментах, проведенных в 1974 г., было очень наглядно показано, как работает АТР-синтетаза. К тому времени уже были разработаны методы введения интегральных мембранных белков, предварительно солюбилизированных с помощью детергента, в липидные пузырьки (липосомы), приготовленные из очищенных фосфолипидов (см. разд. 6.1.2). Это позволило создать «гибридную» мембрану, которая одновременно содержала очищенную митохондриальную АТР-синтетазу и бактериородопсин, выполняющий у бактерий функцию светозависимого протонного насоса (см. разд. 6.2.7). При освещении таких пузырьков протоны, накачиваемые внутрь бактериородопсином, выходили наружу через АТР-синтетазу, и в результате в окружающем растворе накапливался АТР (рис. 7-25). Так как прямое взаимодействие между бактериальным протонным насосом и АТР-синтетазой млекопитающих вряд ли возможно, этот эксперимент указывает на то, что и в митохондриях активный перенос протонов и синтез АТР - это, по всей вероятности, два раздельных процесса в общем механизме окислительного фосфорилирования.
7.2.3. АТР-синтетаза может действовать в обратном направлении - расщеплять АТР и перекачивать протоны [16]
Действие АТР-синтетазы обратимо: она способна использовать как энергию гидролиза АТР для перекачивания протонов через внутреннюю митохондриальную мембрану, так и энергию потока протонов по электрохимическому градиенту для синтеза АТР (рис. 7-26). Таким образом, АТР-синтетаза - это обратимая сопрягающая система, которая осуществляет взаимопревращение энергии электрохимического протонного градиента и химических связей. Направление ее работы зависит от соотношения между крутизной протонного градиента и локальной величиной ∆G для гидролиза АТР.
АТР-синтетаза получила свое название в связи с тем, что в обычных условиях протонного градиента, поддерживаемого дыхательной цепью (см. рис. 7-20), синтезирует большую часть всего АТР клетки. Число протонов, необходимое для синтеза одной молекулы АТР, в точности не известно. Для упрощения приводимых ниже расчетов мы будем предполагать, что при прохождении через АТР-синтетазу каждых трех протонов синтезируется одна молекула АТР.
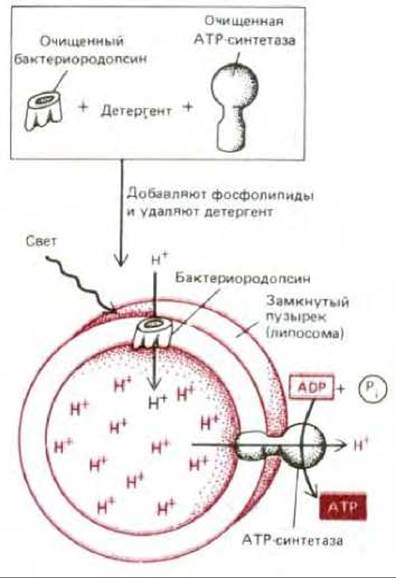
Рис. 7-25. Схема важного эксперимента, который показал, что АТР-синтетазу можно привести в действие простым током протонов. Путем сочетания светозависимого бактериального протонного насоса (бактериородопсина), АТР-синтетазы, выделенной из митохондрий бычьего сердца, и фосфолипидов были получены липосомы, синтезирующие при воздействии света АТР.
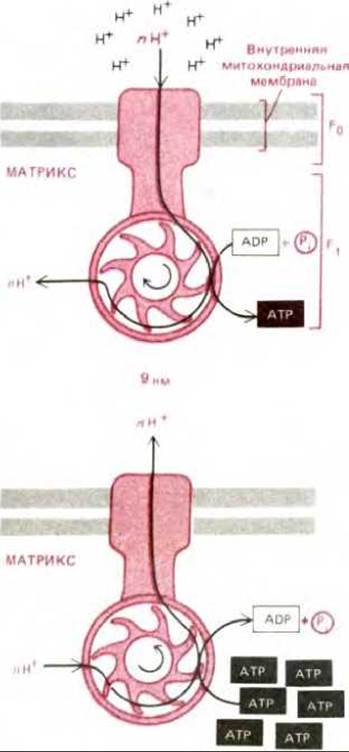
Рис. 7-26. АТР-синтетаза представляет собой обратимое сопрягающее устройство для взаимопревращения энергии электрохимического протонного градиента и энергии химических связей. Она известна также как F0F1-АТРаза и состоит по меньшей мере из девяти различных полипептидных цепей. Пять из этих цепей образуют сферическую головку комплекса, называемую F1-АТРазой. АТР-синтетаза способна либо синтезировть АТР за счет энергии протонодвижущей силы (вверху), либо перекачивать протоны против электрохимического градиента за счет гидролиза АТР (внизу).
Как объяснено в тексте, направление действия фермента в любой данный момент зависит от суммарного изменения свободной энергии для сопряженных процессов - для перемещения протонов через мембрану и для синтеза АТР из ADP и Pi.
Ранее мы уже показали, что свободная энергия гидролиза АТР зависит от концентрации трех реагирующих веществ - АТР, ADP и Рі (см. рис. 7-22). ∆G для синтеза АТР - это та же величина, взятая с минусом. Свободная энергия перемещения протонов через мембрану равна сумме (1) ∆G для перемещения одного моля любых ионов между областями с разностью потенциалов ∆V и (2) ∙ ∆G для перемещения моля любых молекул между областями с различной их концентрацией. Уравнение для протонодвижущей силы, приведенное в разд. 7.1.7, объединяет те же самые составляющие, но только разность концентраций заменена эквивалентным ей приращением мембранного потенциала, так что получается выражение для «электрохимического потенциала» протона. Таким образом, ∆G для перемещения протонов и протонодвижущая сила учитывают один и тот же потенциал, только в первом случае он измеряется в килокалориях, а во втором - в милливольтах. Коэффициентом для перевода из одних единиц в другие служит число Фарадея. Таким образом, ∆GH+ = -0,023 (протонодвижущая сила), где ∆GH+ выражается в килокалориях на 1 моль (ккал/моль), а протонодвижущая сила - в милливольтах (мВ). Если электрохимический протонный градиент равен 220 мВ, то ∆GH+ = 5,06 ккал/моль.
Как будет работать в данный момент АТР-синтетаза - в направлении синтеза или гидролиза АТР, - зависит от точного баланса между изменениями свободной энергии для прохождения трех протонов через мембрану в матрикс (∆G3H+ меньше нуля) и для синтеза АТР в матриксе (∆GСИНТ. атр больше нуля). Как уже говорилось, величина ∆GСИНТ.атр определяется концентрациями трех веществ в матриксе митохондрии - АТР, ADP и Рі (см. рис. 7-22). С другой стороны, величина ∆G3H+ будет пропорциональна протонодвижущей силе на внутренней мембране. Приводимый ниже пример поможет понять, каким образом соотношение между этими двумя изменениями свободной энергии влияет на работу АТР-синтетазы.
Как объяснено в подписи к рис. 7-26, переход одного протона в матрикс по электрохимическому градиенту, равному 220 мВ, высвобождает 5,06 ккал/моль, а переход трех протонов - в три раза больше энергии (∆G3H+ = -15,2 ккал/моль). Таким образом, при постоянной протонодвижущей силе (220 мВ) АТР-синтетаза будет синтезировать АТР до тех пор, пока отношение АТР к ADP и Рі не достигнет такого значения, при котором величина ∆GСИНТ. АТР станет в точности равна + 15,2 ккал/моль (при этом ∆GСИНТ.АРТ. + ∆G3H+ = 0). При таких условиях синтез АТР будет точно уравновешиваться его гидролизом.
Предположим, что в связи с реакциями, требующими затраты энергии, в цитозоле внезапно гидролизовалось большое количество АТР, и это привело к падению отношения АТР: ADP в матриксе митохондрии. В этом случае ∆GСИНТ. АТР понизится (см. рис. 7-22) и АТР-синтетаза вновь переключится на синтез АТР, пока не восстановится исходное отношение АТР: ADP. Если же протонодвижущая сила внезапно снизится и будет поддерживаться на постоянном уровне 200 мВ, то ∆G3H+ уменьшится до —13,8 ккал/моль. В результате АТР-синтетаза начнет расщеплять АТР, и эта реакция будет продолжаться до тех пор, пока соотношение между концентрациями АТР и ADP не достигнет какого-то нового значения (при котором ∆GСИНТ.АТР — +13,8 ккал/моль), и так далее.
Как мы увидим позже, у многих бактерий АТР-синтетаза обращает свое действие при каждом переходе от аэробного метаболизма к анаэробному и обратно. Подобная обратимость свойственна и другим мембранным ферментам, сопрягающим перенос ионов с синтезом или гидролизом АТР. Например, натрий-калиевый й кальциевый насосы (второй из них описан в гл. 6) гидролизуют АТР и используют высвобождаемую энергию для перекачки через мембрану определенных ионов (см. разд. 6.4.5). Если любой из этих насосов заставить работать в условиях необычно крутого градиента транспортируемых ионов, то он будет действовать в обратном направлении - синтезировать АТР из ADP и PІ, вместо того чтобы осуществлять гидролиз АТР. Таким образом, подобно АТР-синтетазе, эти насосы способны преобразовывать энергию, запасаемую в трансмембранном ионном градиенте, непосредственно в энергию фосфатных связей АТР.
7.2.4. Дыхательная цепь переносит ионы Н+ через внутреннюю митохондриальную мембрану [16]
Если АТР-синтетаза в норме не транспортирует Н+ из матрикса, то дыхательная цепь, находящаяся во внутренней митохондриальной мембране, при нормальных условиях переносит через эту мембрану протоны, создавая таким образом электрохимический протонный градиент, доставляющий энергию для синтеза АТР. При определенных условиях можно экспериментально продемонстрировать способность дыхательной цепи откачивать протоны из матрикса. Можно, например, обеспечить взвесь изолированных митохондрий подходящим субстратом для окисления, а поток протонов через АТР-синтетазу блокировать. В анаэробных условиях небольшая добавка кислорода к такому препарату вызовет вспышку дыхательной активности, которая будет длиться одну-две секунды - пока весь кислород не израсходуется. Во время такой вспышки дыхания с помощью чувствительного рН-электрода можно зарегистрировать внезапное подкисление среды в результате выталкивания ионов Н+ из матрикса митохондрий.
Сходный эксперимент можно провести и на взвеси субмитохондриальных частиц. В этом случае при продувании кислорода среда будет подщелачиваться, так как мембрана здесь «вывернута наизнанку» и потому протоны будут накачиваться внутрь частиц.
7.2.5. Многие переносчики электронов могут быть идентифицированы с помощью методов спектроскопии [17].
Большинство переносчиков электронов, входящих в состав дыхательной цепи, поглощают свет, и их окисление или восстановление сопровождается изменением цвета. Обычно спектр поглощения и реакционноспособность каждого переносчика достаточно характерны, что позволяет даже в неочищенном экстракте прослеживать изменения его состояний с помощью спектроскопии. Это дало возможность выделить такие переносчики задолго до того, как стала понятна их истинная функция. Например, цитохромы были открыты в 1925 г. как соединения, которые быстро окисляются и восстанавливаются у таких различных организмов, как дрожжи, бактерии и насекомые. Наблюдая клетки и ткани с помощью спектроскопа, удалось идентифицировать три типа цитохромов, которые различались по спектрам поглощения и были названы цитохромами a, b и с. Эта номенклатура сохранилась до сих пор, хотя сейчас известно, что клетки содержат несколько видов цитохромов каждого типа, и классификация по типам не отражает их функцию.
Цитохромы образуют семейство окрашенных белков, объединяемых наличием в их молекуле связанной группы гема; принимая один электрон, атом железа, входящий в состав гема, восстанавливается - переходит из состояния Fe III в состояние Fe II. Гем содержит порфириновое кольцо и атом железа, прочно связанный с помощью четырех азотных атомов, расположенных в углах квадрата (рис. 7-27). Близкие по строению порфириновые кольца определяют красный цвет крови и зеленый цвет листьев, связывая железо в гемоглобине (разд. 10.5.3) и магний в хлорофилле (разд. 7.3.6). Из множества белков дыхательной цепи лучше всего изучен цитохром с; его трехмерная структура была определена методом рентгеноструктурного анализа (рис. 7-28).
Железо-серные белки образуют вторую важную группу переносчиков электронов. В молекулах этих белков два или четыре атома железа связаны с тем же числом атомов серы и с боковыми цепями цистеина, образуя железо-серный центр белка (рис. 7-29). Железо-серных центров в дыхательной цепи больше, чем цитохромов, но для их выявления нужны методы электронного спинового резонанса (ЭСР), поэтому железо-серные центры менее изучены.
Самый простой переносчик электронов представляет собой небольшую гидрофобную молекулу, растворенную в липидном бислое и называемую убихиноном или коферментом Q. Он способен принять или отдать как один, так и два электрона и временно захватывает из среды протон при переносе каждого электрона (рис. 7-30).

Рис. 7-27. Строение гема, ковалентно связанного с цитохромом с. Четыре из шести координационных положений железа заняты порфириновым кольцом. Пятое и шестое координационные положения ориентированы перпендикулярно к плоскости кольца. Почти во всех цитохромах эти два положения заняты боковыми цепями аминокислот, что не позволяет связывать здесь другие лиганды. Исключением служит цитохром аь; так же как в гемоглобине и миоглобине, шестое координационное положение железа в этом компоненте цитохромоксидазы свободно и потому может связывать кислород.
В дыхательной цепи имеется пять различных цитохромов. Поскольку гемы, входящие в состав разных цитохромов, несколько различаются по своему строению и не одинаковым образом связаны с соответствующими белками, не одинаково и их сродство к электронам.
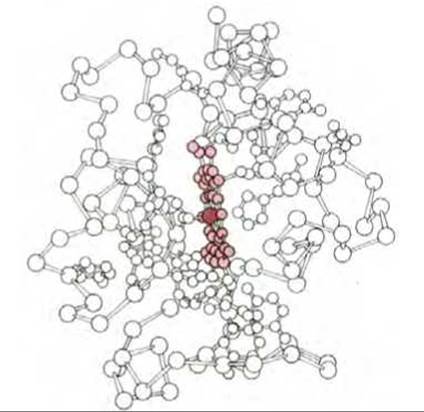
Рис. 7-28. Трехмерная модель цитохрома с - одного из переносчиков электронов в дыхательной цепи. Этот небольшой белок, содержащий немногим больше 100 аминокислотных остатков, может перемещаться в мембране, так как связан лишь ионными взаимодействиями (см. рис. 7-35). Атом железа (выделен более темным цветом) в составе связанного гема (окрашенного слабее) способен переносить один электрон (см. также рис. 352, А).
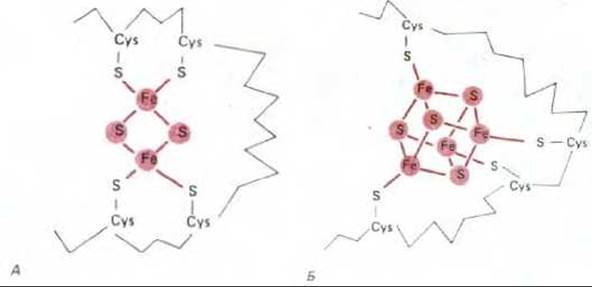
Рис. 7-29. Строение железо-серных центров двух типов. А. Центр типа 2Fe2S. Б. Центр типа 4Fe4S. Хотя в состав центра входят несколько атомов железа, каждый из центров способен переносить за один раз только один электрон. В дыхательной цепи имеется более шести различных железосерных центров.
Помимо шести различных гемов в молекулах цитохромов, более чем шести железо-серных центров и убихинона, имеются еще два атома меди и флавин, служащие переносчиками электронов и прочно связанные с белками дыхательной цепи на всем пути от NADH до кислорода. Путь переноса электронов включает всего около 40 различных белков. Порядок расположения различных переносчиков в дыхательной цепи был определен с помощью сложных спектроскопических измерений (рис. 7-31), и вначале многие белки были выделены и описаны как отдельные полипептиды. Однако истинное понимание функции дыхательной цепи пришло позднее, когда выяснилось, что белки организованы в три больших ферментных комплекса.
7.2.6. Дыхательная цепь содержит три больших ферментных комплекса, встроенных во внутреннюю мембрану [18]
Мембранные белки трудно выделить в виде интактных комплексов, так как они нерастворимы в большинстве водных растворов, а такие вещества, как детергенты и мочевина, необходимые для их солюбилизации, могут нарушать нормальное белок-белковое взаимодействие (разд. 6.2.2). Однако в начале 1960-х гг. было обнаружено, что с помощью относительно мягких ионных детергентов, таких как дезоксихолат (рис. 7-32), можно солюбилизировать некоторые компоненты митохондриальной внутренней мембраны в нативной форме. Это позволило идентифицировать и выделить три главных связанных с мембраной комплекса дыхательных ферментов на пути от NADH до кислорода (рис. 7-33).
1. NADH-дегидрогеназный комплекс самый большой из дыхательных ферментных комплексов - имеет мол. массу свыше 800000 и содержит более 22 полипептидных цепей. Он принимает электроны от NADH и передает их через флавин и по меньшей мере пять железо-серных центров на убихинон - небольшую жирорастворимую молекулу (см. рис. 7-30), передающую электроны на второй комплекс дыхательных ферментов - комплекс b-с1.
2. Комплекс b-с1 состоит по меньшей мере из 8 разных полипептидных цепей и, вероятно, существует в виде димера с мол. массой 500 000. Каждый мономер содержит три гема, связанных с цитохромами, и железо-серный белок. Комплекс принимает электроны от убихинона и передает цитохрому с, небольшому периферическому мембранному белку (см. рис. 7-28), который затем переносит их на цитохромоксидазный комплекс.
3. Цитохромоксидазный комплекс (цитохром аа3) - наиболее изученный из трех комплексов. Он состоит не менее чем из восьми различных полипептидных цепей и выделен как димер с мол. массой 300000; каждый мономер содержит два цитохрома и два атома меди. Этот комплекс принимает электроны от цитохрома с и передает их на кислород.
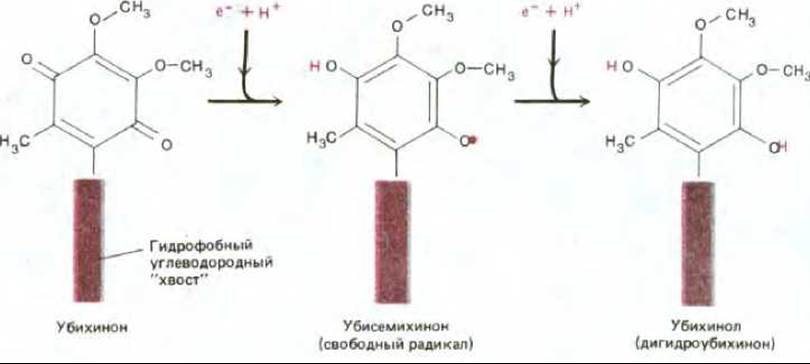
Рис. 7-30. Хиноны - важные переносчики электронов в дыхательной цепи. На каждый принятый электрон хинон захватывает из окружающей водной среды по одному протону; при этом он способен переносить как один, так и два электрона. Когда хинон отдает свои электроны следующему переносчику, протоны высвобождаются. В митохондриях млекопитающих хинон представлен убихиноном (коферментом Q), показанным на рисунке; длинный гидрофобный хвост, удерживающий убихинон в мембране, обычно состоит из 10 пятиуглеродных изопреновых единиц. У растений соответствующим переносчиком служит пластохинон, который почти не отличается от убихинона. Для простоты убихинон и пластохинон обычно называют просто хинонами и обозначают Q.
Цитохромы, железо-серные центры и атомы меди способны переносить одновременно только один электрон. Между тем каждая молекула NADH отдает два электрона и каждая молекула О2 должна принять четыре электрона при образовании молекул воды. В электронтранспортной цепи имеется несколько электронсобирающих и электронраспределяющих участков, где согласовывается разница в числе электронов. Так, например, цитохромоксидазный комплекс принимает от молекул цитохрома с по отдельности четыре электрона и в конечном итоге передает их на одну связанную молекулу О2, что ведет к образованию двух молекул воды. На промежуточных ступенях этого процесса два электрона, прежде чем перейти к участку, связывающему кислород, поступают в гем цитохрома а и связанный с белком атом меди, Сuа. В свою очередь участок связывания кислорода содержит еще один атом меди и гем цитохрома а3. Однако механизм образования двух молекул воды в результате взаимодействия связанной молекулы О2 с четырьмя протонами в точности не известен.
В большинстве клеток с цитохромоксидазой взаимодействует около 90% всего поглощаемого кислорода. Токсичность таких ядов, как цианид и азид, связана с их способностью прочно присоединяться к цитохромоксидазному комплексу и блокировать тем самым весь транспорт электронов.
7.2.7. Перенос электронов осуществляется путем случайных столкновений между донорами и акцепторами электронов, диффундирующими во внутренней митохондриальной мембране [19]
Два компонента, переносящие электроны между тремя главными ферментными комплексами дыхательной цепи, - убихинон и цитохром с - быстро перемещаются путем диффузии в плоскости мембраны.

Рис. 7-31. Общая схема метода, с помощью которого определяют путь перемещения электронов по дыхательной цепи. Степень окисленности переносчиков электронов а, b, с и d непрерывно прослеживают по изменениям их спектров в окисленном и восстановленном состоянии. А. В обычных условиях все переносчики находятся в частично окисленном состоянии. Если добавить специфический ингибитор электронного транспорта, то все переносчики, находящиеся «ниже» места действия ингибитора, становятся более окисленными, а те, что находятся «выше», - более восстановленными. Б. В отсутствие кислорода все переносчики находятся в своих полностью восстановленных состояниях. При внезапном поступлении кислорода переносчики переходят в частично окисленную форму; этот процесс окисления идет с запаздыванием, которое тем больше, чем «выше» расположен в цепи переносчик.

Рис. 7-32. Строение молекул относительно мягких анионных детергентов холата и дезоксихолата. Хотя оба детергента достаточно сильны, чтобы солюбилизировать мембранные белки, их часто можно применять без ущерба для активности ферментов.

Рис. 7-33. Относительные размеры и форма трех дыхательных ферментных комплексов. Эти грубые трехмерные модели были построены на основе изображений, полученных от двумерных кристаллов (кристаллических слоев) при исследовании их под разными углами с помощью электронного микроскопа.
Столкновения между этими подвижными переносчиками и ферментными комплексами вполне позволяют объяснить наблюдаемую скорость переноса электронов (каждый комплекс отдает и принимает один электрон каждые 5-20 миллисекунд). Поэтому нет необходимости предполагать структурную упорядоченность цепи белков-переносчиков в липидном бислое; в самом деле, ферментные комплексы, видимо, существуют в мембране как независимые компоненты и упорядоченный перенос электронов обеспечивается только специфичностью функциональных взаимодействий между компонентами цепи.
В пользу этого говорит и тот факт, что различные компоненты Дыхательной цепи присутствуют в совершенно разных количествах. Например, в митохондриях сердца на каждую молекулу NADH-детидрогеназного комплекса приходятся 3 молекулы комплекса b-с1, 7 молекул цитохромоксидазного комплекса, 9 молекул цитохрома с и 50 молекул убихинона; весьма различные соотношения этих белков обнаружены и в некоторых других клетках.
7.2.8. Значительный перепад окислительно-восстановительного потенциала на каждом из трех комплексов дыхательной цепи доставляет энергию, необходимую для перекачивания протонов [12, 20]
Такую пару, как Н2О и 1/2О2 (или NADH и NAD+), называют сопряженной окислительно-восстановительной парой, так как один из ее членов превращается в другой, если добавить один или несколько электронов и один или несколько протонов (последних всегда достаточно в любом водном растворе). Так, например,
1/2О2 + 2е- + 2Н+→ Н2О.
Хорошо известно, что смесь соединений, образующих сопряженную кислотно-щелочную пару, в соотношении 50:50 действует как буфер, поддерживающий определенное «давление протонов» (рН), величина которого определяется константой диссоциации кислоты. Точно таким же образом смесь компонентов сопряженной окислительно-восстановительной пары в соотношении 50:50 поддерживает определенное «давление электронов», или окислительно-восстановительный потенциал (редокс-потенциал) Е, служащий мерой сродства молекулы-переносчика к электронам.
Помещая электроды в раствор с соответствующими окислительно-восстановительными парами, можно измерить редокс-потенциал каждого переносчика электронов, участвующего в биологических окислительно-восстановительных реакциях. Пары соединений с наиболее отрицательными значениями редокс-потенциала обладают наименьшим средством к электронам, т. е. содержат переносчики с наименьшей тенденцией принимать электроны и наибольшей тенденцией их отдавать. Например, смесь NADH и NAD+ (50:50) имеет редокс-потенциал — 320 мВ, что указывает на сильно выраженную способность NADH отдавать электроны, тогда как редокс-потенциал смеси равных количеств Н2О и 1/2O2 составляет +820 мВ, что означает сильную тенденцию О2 к принятию электронов.
Окислительно-восстановительные потенциалы можно измерять для всех переносчиков электронтранспортной цепи, различимых по их спектрам. Можно, например, шунтировать цепь, добавляя небольшие молекулы, способные легко отдавать и принимать электроны. При этом производят спектральные измерения, чтобы определить отношение концентраций окисленной и восстановленной форм для каждого переносчика; для этого ступенчатым образом изменяют редокс-потенциал шунтирующего раствора. Как и следовало ожидать, оказалось, что потенциалы возрастают вдоль по ходу цепи переносчиков. У большинства цитохромов они выше, чем у железо-серных центров; и соответственно цитохромы обычно располагаются вблизи О2-конца дыхательной цепи, а железо-серные белки - вблизи NADH-конца.

Рис. 7-34. Возрастание редокс-потенциала (обозначаемого Е'0 или Eh) по мере прохождения электронов по дыхательной цепи к кислороду. На оси ординат справа - величины стандартной свободной энергии переноса каждого из двух электронов, отдаваемых одной молекулой NADH [∆G = - n (0,023)∆Е0', где n - число переносимых электронов при перепаде редокс-потенциала ∆E0' мВ]. В каждом дыхательном ферментном комплексе электроны последовательно проходят через четыре или большее число переносчиков. Как уже говорилось, часть высвобождаемой энергии используется каждым ферментным комплексом для перекачивания протонов через внутреннюю митохондриальную мембрану. Число протонов, перекачиваемых на каждый переносимый электрон (n), точно не известно. Два электрона от FADH2, образованного при окислении жирных кислот (см. рис. 7-11) и в цикле лимонной кислоты (см. рис. 7-14), дают меньше полезной энергии, чем два электрона от NADH. Поскольку редокс-потенциал FADH2 близок к 0 мВ, при переносе электронов с FADH2 на убихинон не происходит запасания энергии (на схеме это не показано). Поэтому транспорт электронов от FADH2 до кислорода приводит к перемещению протонов только на двух, а не на трех участках дыхательной цепи.
На рис. 7-34 показаны уровни окислительно-восстановительного потенциала на различных участках дыхательной цепи. Резкий перепад имеет место в пределах каждого из трех главных дыхательных комплексов. Разность потенциалов между любыми двумя переносчиками электронов прямо пропорциональна энергии, высвобождаемой при переходе электрона от одного переносчика к другому (рис. 7-34). Каждый комплекс действует как энергопреобразующее устройство, направляя эту свободную энергию на перемещение протонов через мембрану, что приводит к созданию электрохимического протонного градиента по мере прохождения электронов по цепи. Такое преобразование энергии можно прямо продемонстрировать, включив по отдельности любой изолированный комплекс дыхательной цепи в липосомы (см. рис. 7-25). В присутствии подходящего донора и акцептора электронов такой комплекс будет переносить электроны, что приведет к перекачиванию протонов через мембрану липосомы.
Для работы энергопреобразующего механизма, лежащего в основе окислительного фосфорилирования, нужно, чтобы каждый ферментный комплекс дыхательной цепи был ориентирован во внутренней митохондриальной мембране определенным образом - так, чтобы все протоны перемещались в одном направлении, т. е. из матрикса наружу (рис. 7-35). Такая векторная организация мембранных белков была продемонстрирована с помощью специальных зондов, не проходящих сквозь мембрану, которыми метили комплекс только с какой-нибудь одной стороны мембраны (разд. 6.2.3). Специфическая ориентация в бислое свойственна всем мембранным белкам и очень важна для их функции.
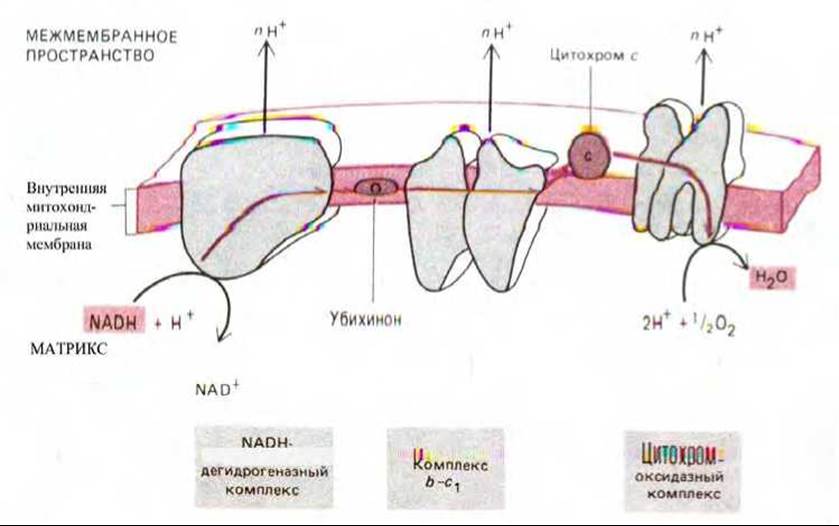
Рис. 7-35. Схема переноса двух электронов через три главных дыхательных комплекса от NADH к кислороду. В качестве переносчиков между комплексами выступают убихинон и цитохром с.
7.2.9. Механизмы перекачивания протонов компонентами дыхательной цепи еще не вполне ясны
В процессе окислительного фосфорилирования при окислении одной молекулы NADH (т. е. при прохождении двух электронов через все три ферментных комплекса) образуется не более трех молекул АТР. Если предположить, что обратное прохождение трех протонов через АТР-синтетазу обеспечивает синтез одной молекулы АТР (разд. 7.2.3), можно будет заключить, что в среднем перенос одного электрона каждым комплексом сопровождается перемещением полутора протонов (иными словами, при транспорте одного электрона некоторые комплексы перекачивают один протон, а другие - два протона).
Вероятно, у разных компонентов дыхательной цепи существуют разные механизмы сопряжения транспорта электронов с перемещением протонов. Аллостерические изменения конформации белковой молекулы, связанные с транспортом электронов, могут в принципе сопровождаться «перекачиванием» протонов, подобно тому как перемещаются протоны при обращении действия АТР-синтетазы (разд. 7.2.3). Кроме того, как уже упоминалось, при переносе каждого электрона хинон захватывает из водной среды протон, который затем отдает при высвобождении электрона (см. рис. 7-30). Поскольку убихинон свободно передвигается в липидном бислое, он может принимать электроны вблизи внутренней поверхности мембраны и передавать их на комплекс b-c1 около ее наружной поверхности, перемещая при этом через бислой по одному Н+ на каждый перенесенный электрон. С помощью более сложных моделей можно объяснить и перемещение комплексом b-c1 двух протонов на каждый электрон, предположив, что убихинон повторно проходит через комплекс b-c1 в определенном направлении.
В отличие от этого молекулы, передающие электроны цитохромоксидазному комплексу, по-видимому, не переносят протонов, и в этом случае транспорт электронов, вероятно, связан с определенным аллостерическим изменением конформации белковых молекул, в результате которого какая-то часть белкового комплекса сама переносит протоны.
7.2.10. Н+-ионофоры рассеивают протонный градиент и тем самым разобщают транспорт электронов и синтез АТР [22]
С 40-х годов известен ряд липофильных слабых кислот, способных действовать как разобщающие агенты, т. е. нарушать сопряжение транспорта электронов с синтезом АТР. При добавлении к клеткам этих низкомолекулярных органических соединений митохондрии прекращают синтез АТР, продолжая при этом поглощать кислород. В присутствии разобщающего агента скорость транспорта электронов остается высокой, но протонный градиент не создается. Существует простое и изящное объяснение этого эффекта: разобщающие агенты действуют как переносчики Н+ (Н+-ионофоры) и открывают дополнительный путь - уже не через АТР-синтетазу - для потока Н+ через внутреннюю митохондриальную мембрану. Этот механизм показан на рис. 7-36 на примере широко используемого разобщителя 2,4-динитрофенола.
7.2.11. В нормальных условиях поток электронов по дыхательной цепи сдерживается дыхательным контролем [23]
Когда к клеткам добавляют разобщающий агент, например динитрофенол, поглощение кислорода митохондриями значительно возрастает, так как скорость переноса электронов увеличивается. Такое ускорение связано с существованием дыхательного контроля. Полагают, что этот контроль основан на прямом ингибирующем влиянии электрохимического протонного градиента на транспорт электронов. Когда в присутствии разобщителя электрохимический градиент исчезает, не контролируемый более транспорт электронов достигает максимальной скорости. Возрастание градиента притормаживает дыхательную цепь, и транспорт электронов замедляется. Более того, если в эксперименте искусственно создать на внутренней мембране необычно высокий электрохимический градиент, то нормальный транспорт электронов прекратится совсем, а на некоторых участках дыхательной цепи можно будет обнаружить обратный поток электронов. Это позволяет предполагать, что дыхательный контроль отражает простой баланс между изменением свободной энергии при перемещении протонов, сопряженного с транспортом электронов, и изменением свободной энергии при самом транспорте электронов; другими словами, величина электрохимического градиента влияет как на скорость, так и на направление переноса электронов, так же как и на направление действия АТР-синтетазы (разд. 7.2.3).
Дыхательный контроль - это лишь часть сложной системы взаимосвязанных регуляторных механизмов с обратными связями, координирующей скорости гликолиза, расщепления жирных кислот, реакций цикла лимонной кислоты и транспорта электронов. Скорости всех этих процессов зависят от отношения АТР: ADP - они возрастают, когда это отношение уменьшается в результате усиленного использования АТР. Например, АТР-синтетаза внутренней митохондриальной мембраны работает быстрее, когда концентрации ее субстратов, т. е. ADP и Рі, увеличиваются. Чем выше скорость этой реакции, тем больше протонов перетекает в матрикс, быстрее рассеивая тем самым электрохимический градиент; а уменьшение градиента в свою очередь приводит к ускорению транспорта электронов.
Сходные регуляторные механизмы, в том числе ингибирование ряда ключевых ферментов аденозинтрифосфатом (АТР) по принципу обратной связи (см., например, рис. 7-13), координируют скорость образования NADH с его утилизацией дыхательной цепью. Благодаря этим многочисленным приспособлениям организм при большой физической нагрузке окисляет жиры и сахара в 5-10 раз быстрее, чем во время отдыха.
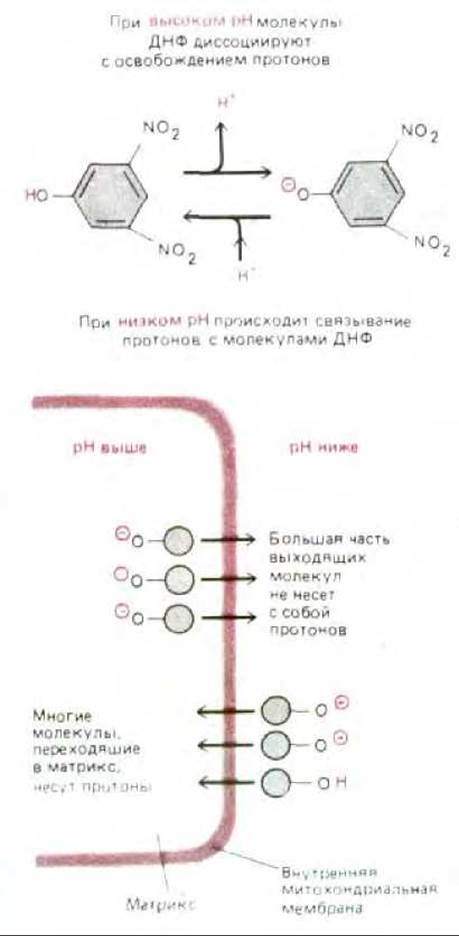
Рис. 7-36. Перенос протонов через внутреннюю митохондриальную мембрану при участии разобщающего агента 2,4-динитрофенола (ДНФ). Заряженная (протонированная) форма ДНФ может свободно проходить через липидный бислой. Полагают, что перенос заряженной формы ДНФ через мембрану осуществляется с помощью анион-транспортного белка (на схеме не представленного). Как показано на рисунке, благодаря электрохимическому протонному градиенту молекулы динитрофенола будут переносить больше протонов в матрикс, чем из него, до тех пор, пока протонодвижущая сила не исчезнет полностью.
7.2.12. Природные разобщители превращают митохондрии бурой жировой ткани в генераторы тепла [24]
В некоторых специализированных клетках - клетках бурой жировой ткани - митохондриальное дыхание может естественным путем отделяться от синтеза АТР, и тогда большая часть энергии окисления рассеивается в виде тепла, а не превращается в энергию АТР. Внутренняя мембрана крупных митохондрий этих клеток содержит особый транспортный белок, позволяющий протонам перемещаться по их электрохимическому градиенту без активации АТР-синтетазы. В результате клетки окисляют запасы жира с большой скоростью и образуют много тепла, но мало АТР. Таким образом, бурая жировая ткань служит своего рода печкой, которая в нужный момент пробуждает животное, погруженное в зимнюю спячку, а у новорожденного ребенка защищает наиболее чувствительные части тела от переохлаждения.
7.2.13. Все бактерии используют хемиосмотические механизмы
Бактерии извлекают энергию из самых разнообразных источников. Некоторые бактерии, подобно животным клеткам, синтезируют АТР, окисляя сахара до СО, и Н2О в процессе гликолиза и затем в цикле лимонной кислоты; в плазматической мембране таких бактерий имеется дыхательная цепь, сходная с аналогичной цепью внутренней митохондриальной мембраны. Бактерии других типов - строгие анаэробы получают энергию только за счет реакций гликолиза (брожения) или же за счет окислительных процессов, но конечным акцептором электронов у них служит не кислород, а какая-либо иная молекула. Такими альтернативными акцепторами могут быть соединения азота (нитрат или нитрит), серы (сульфат или сульфит) или углерода (фумарат или карбонат). Электроны передаются на эти акцепторы с помощью ряда переносчиков, находящихся в плазматической мембране и сходных с компонентами дыхательной цепи митохондрий.
Несмотря на все эти различия, в плазматической мембране большинства бактерий имеется АТР-синтетаза, очень сходная с АТР-синтетазой митохондрий (и хлоропластов). У анаэробов, не имеющих цепи переноса электронов, АТР-синтетаза работает в обратном направлении - использует образованный в результате гликолиза АТР для создания на плазматической мембране протонодвижущей силы. У аэробных бактерий протонодвижущую силу, заставляющую АТР-синтетазу синтезировать АТР, создает цепь переноса электронов.
Почти все бактерии, включая строгих анаэробов, поддерживают на своей мембране протонодвижущую силу. Энергия электрохимического протонного градиента используется у них для вращения бактериального жгутика, что позволяет клетке передвигаться (разд. 12.5.4), и для откачивания из клетки ионов Н+ с помощью механизма антипорта, заменяющего здесь Na+ К+-AТРазу эукариотических клеток. В животных клетках активное поглощение веществ через плазматическую мембрану осуществляется в основном за счет энергии натриевого градиента, создаваемого Na+ К+-ЛТРазой (разд. 6.4.9). В отличие от этого у бактерий активный перенос питательных веществ в клетку происходит путем Н+-симпорта, при котором необходимые метаболиты поступают в клетку вместе с одним или несколькими протонами при участии специального белка-переносчика. Таким способом в клетку транспортируются многие сахара и большинство аминокислот (рис. 7-37).
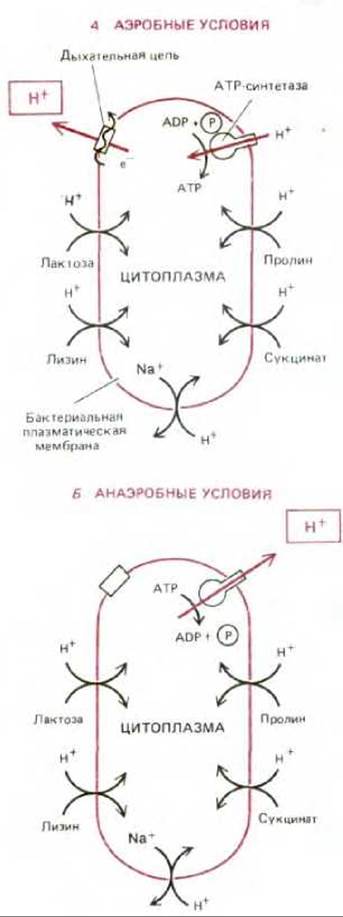
Рис. 7-37. Протонодвижущая сила, генерируемая на плазматической мембране бактериальной клетки, обеспечивает перенос внутрь питательных веществ и выведение наружу натрия. В присутствии кислорода (А) дыхательная цепь аэробных бактерий создает электрохимический протонный градиент, который используется АТР-синтетазой для синтеза АТР, а также для переноса в клетку некоторых питательных веществ. В анаэробных условиях (Б) те же бактерии получают АТР в результате гликолиза. За счет гидролиза части этого АТР под действием АТР-синтетазы создается трансмембранная протонодвижущая сила, доставляющая энергию для транспортных процессов. (Как описано в тексте, существуют бактерии, у которых цепь переноса электронов откачивает протоны при анаэробных условиях; конечным акцептором электронов в этом случае служит не кислород, а какая-то другая молекула.)
Среди многообразных типов бактерий есть формы, которые приспособились к крайне неблагоприятным условиям среды. Например, некоторые бактерии живут в сильнощелочной среде и для защиты своих неустойчивых к щелочи молекул, таких, как РНК, должны поддерживать внутри клетки более низкие значения рН, чем снаружи. В таких случаях созданию электрохимического протонного градиента препятствовал бы значительный градиент концентрации протонов, направленный в обратную сторону (уровень Н+ выше внутри, чем снаружи). Вероятно, по этой причине толерантные к щелочи морские бактерии Vibrio alginolyticus используют во всех хемиосмотических механизмах Na+, а не Н+. Дыхательная цепь этих бактерий откачивает из клетки Na+, поглощение метаболитов сопряжено с переходом внутрь Na+, жгутик движется за счет входящего тока Na+, и, по-видимому, большая часть АТР синтезируется АТР-синтетазой, приводимой в действие ионами Na+. Существование таких бактерий показывает, что принцип хемиосмоса более фундаментален, чем его обычный частный случай - использование электрохимического протонного градиента.
Заключение
Дыхательная цепь внутренней митохондриальной мембраны содержит три главных ферментных комплекса, участвующих в переносе электронов с NADH на О2. Если любой из этих комплексов выделить и встроить в мембрану липосомы, то можно продемонстрировать способность его переносить через эту мембрану протоны одновременно с транспортом электронов. В естественной мембране цепь переноса электронов дополняют мобильные переносчики - убихинон и цитохром с, передвигающиеся, подобно челнокам, от одного ферментного комплекса к другому и обратно. Путь электронов в этой цепи можно представить следующей схемой: NADH → NADH-дегидрогеназный комплекс → убихинон → комплекс b-с1→ цитохром с → цитохромоксидазный комплекс - молекулярный кислород (О2).
Дыхательные ферментные комплексы сопрягают транспорт электронов, сопровождающийся выделением энергии, с откачиванием протонов из матрикса. Создаваемый при этом электрохимический протонный градиент доставляет энергию для синтеза АТР еще одним трансмембранным белковым комплексом-АТР-синтетазой, через которую протоны возвращаются в матрикс. АТР-синтетаза - это обратимый сопрягающий комплекс; в норме он преобразует энергию потока протонов, направленного в матрикс, в энергию фосфатных связей АТР, но при уменьшении электрохимического протонного градиента он способен также использовать энергию гидролиза АТР для перемещения протонов из матрикса наружу. Хемиосмотические механизмы свойственны как митохондриям и хлоропластам, так и бактериям, что указывает на исключительную важность их для всех клеток.