Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Преобразование энергии: митохондрии и хлоропласты
Митохондрии
Митохондрии занимают значительную часть цитоплазмы почти во всех эукариотических клетках. Хотя митохондрии настолько велики, что их можно увидеть в обычный световой микроскоп, и впервые были обнаружены еще в прошлом веке, все же реальная возможность разобраться в их функции появилась только после 1948 г., когда были разработаны методы выделения интактных митохондрий. По техническим причинам большинство биохимических исследований проводилось на митохондриях, выделенных из печени.
Митохондрии обычно изображают в виде жестких вытянутых, похожих на бактерии цилиндров диаметром от 0,5 до 1 мкм. Однако цейтраферная микрокиносъемка живых клеток позволяет увидеть, что митохондрии - необыкновенно подвижные и пластичные органеллы, которые постоянно изменяют свою форму (рис. 7-2) и даже сливаются друг с другом и затем вновь разделяются. Пути перемещения митохондрий в цитоплазме часто связаны с микротрубочками (рис. 7-3), что может определять характерную ориентацию митохондрий и распределение их в различных клетках. В некоторых клетках митохондрии образуют длинные подвижные филаменты или цепочки, а в других они фиксированы вблизи мест высокого потребления АТР-например, в сердечной мышце они располагаются между миофибриллами, а в сперматозоидах плотно обвивают жгутик (рис. 7-4).
7.1.1. Митохондрии имеют наружную и внутреннюю мембраны, образующие два внутренних компартмента [2]
Каждая митохондрия окружена двумя высокоспециализированными мембранами, играющими ключевую роль в ее активности. Мембраны образуют два изолированных митохондриальных компартмента: внутренний матрикс и значительно более узкое межмембранное пространство.
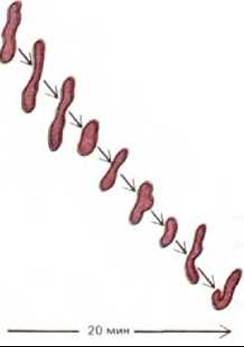
Рис. 7-2. Быстрое изменение формы митохондрий, наблюдаемое в живых клетках.
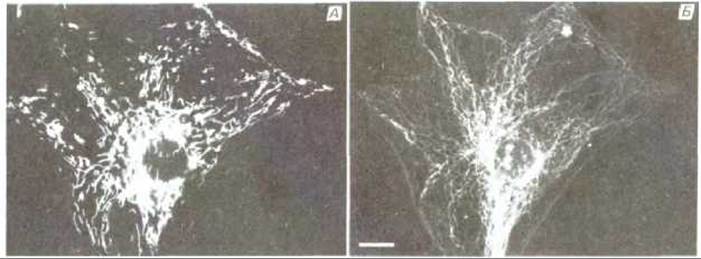
Рис. 7-3. А. Световая микрофотография цепочек вытянутых митохондрий в живой клетке в культуре ткани млекопитающего. Клетка обработана витальным флуоресцентным красителем (родамином 123), специфически окрашивающим митохондрии. Б. Иммунофлуоресцентная микрофотография той же самой клетки, обработанной (после фиксации) флуоресцентными антителами к микротрубочкам. Обратите внимание, что митохондрии располагаются в основном вдоль микротрубочек. Масштабный отрезок 10 мкм. (С любезного разрешения Lan Во Chen.)
Если очищенные митохондрии осторожно разрушить и затем разделить на фракции (рис. 7-5), можно определить биохимический состав каждой из двух мембран и заключенных между ними пространств. Как показано на рис. 7-6, каждая фракция содержит уникальный набор белков.
В состав наружной мембраны входит много копий белка, называемого порином, который образует широкие гидрофильные каналы в липидном бислое. Таким образом, эта мембрана напоминает сито, проницаемое для всех молекул массой 10000 дальтон и меньше, включая небольшие белки. Эти молекулы могут проникать в межмембранное пространство, но большая их часть не способна проходить через непроницаемую внутреннюю мембрану. Это означает, что если химический состав межмембранного пространства эквивалентен составу цитозоля хотя бы в отношении молекул малого размера, то матрикс содержит гораздо более ограниченный набор небольших молекул.
Как будет подробнее описано позже, основная рабочая часть митохондрии - это матрикс и окружающая его внутренняя мембрана. Внутренняя мембрана высокоспецифична, она содержит большое количество «двойного» фосфодипида кардиолипина (разд. 7.5.15), что как полагают, и делает мембрану особенно непроницаемой для ионов. В состав внутренней мембраны входят также разнообразные транспортные белки, обусловливающие ее избирательную проницаемость для тех малых молекул, которые либо метаболизируются многочисленными ферментами, сконцентрированными в матриксе, либо необходимы для их активности. В частности, матрикс содержит ферменты, превращающие пируват и жирные кислоты в ацетил-СоА и затем окисляющие последний в цикле лимонной кислоты. Главные конечные продукты этого окисления - СО2, выходящий из клетки, и NADH, который служит главным источником электронов, переносимых дыхательной цепью - так называется электронтранспортная цепь митохондрий. Ферменты дыхательной цепи встроены во внутреннюю митохондриальную мембрану и необходимы для процесса окислительного фосфорилирования, дающего большую часть АТР в животных клетках.
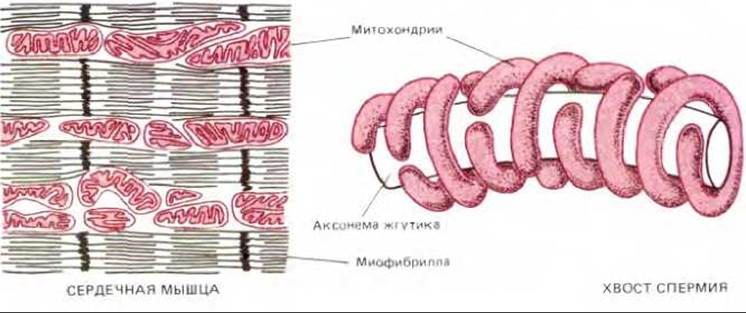
Рис. 7-4. Локализация митохондрий вблизи мест высокого потребления АТР в сердечной мышце и в хвосте спермия. В ходе развития жгутика спермия микротрубочки обвивают аксонему и обеспечивают тем самым надлежащее расположение митохондрий.
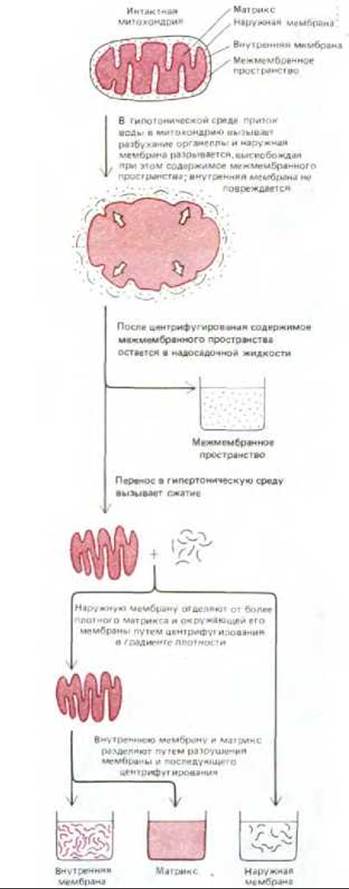
Рис. 7-5. Методы разделения митохондрий на отдельные компоненты дают возможность изучать различные белки в каждом компартменте митохондрии. Представленный здесь метод, позволяющий одновременно обрабатывать большое количество митохондрий, основан на том, что в среде с низкой ионной силой вода проникает в митохондрию и вызывает сильное набухание матрикса. При этом кристы внутренней мембраны расправляются, а наружная мембрана, не имеющая складок, разрывается, высвобождая структуру, состоящую только из внутренней мембраны и матрикса.

Рис. 7-6. Общее строение митохондрии. В митохондриях печени 67% всего белка находится в матриксе, 21% - в наружной мембране, 6% - во внутренней мембране и 6% - в межмембранном пространстве. Каждый из этих четырех компартментов в соответствии со своей функцией содержит определенный набор ферментов (см. схему внизу). (Микрофотография любезно предоставлена Daniel S. Friend.)
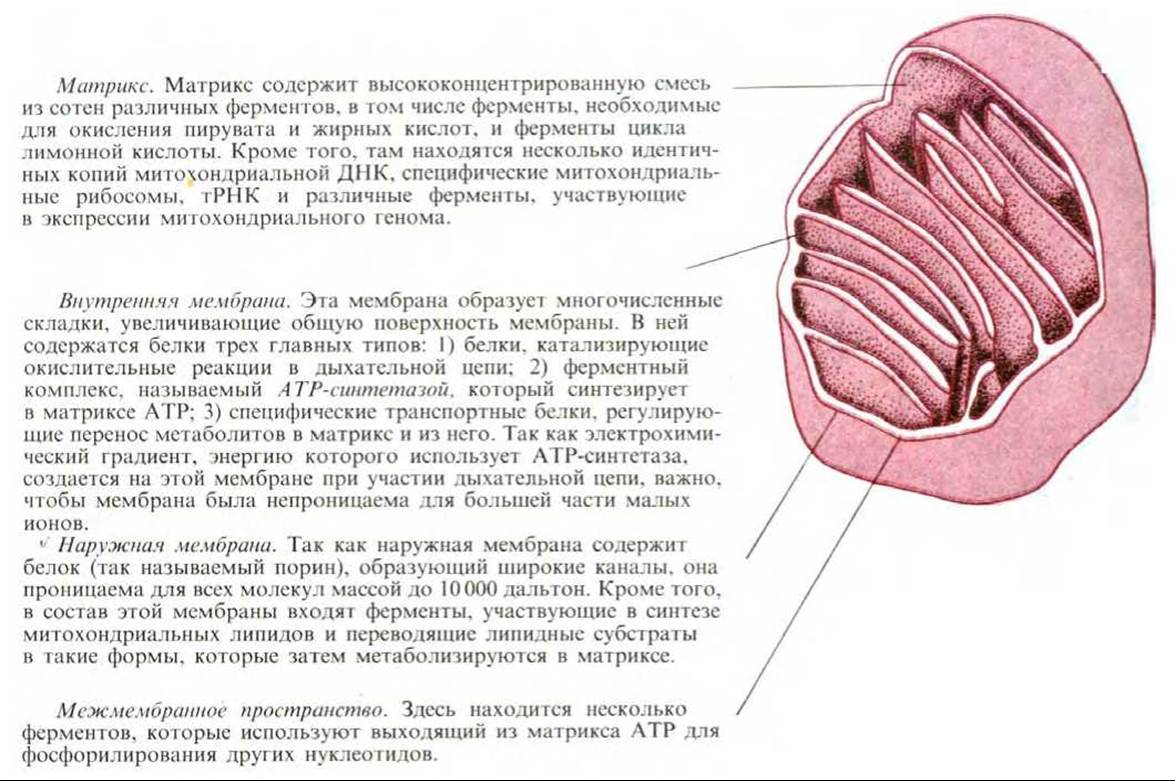
7.1.2. Внутренняя мембрана образует складки - кристы [3]
Внутренняя мембрана обычно образует в матриксе сложную систему складок, называемых кристами. Эти складки значительно увеличивают площадь внутренней мембраны; например, в митохондриях печени внутренняя мембрана составляет третью часть всех мембран клетки (см. табл. 8-2). В митохондриях сердечной мышцы число крист в три раза больше, чем в митохондриях печени, что, по-видимому, связано с высокой потребностью клеток сердца в АТР. Кроме того, кристам митохондрий в различных клетках свойственны поразительные морфологические особенности, значение которых неизвестно (рис. 7-7).
Помимо морфологических особенностей разные типы клеток существенно различаются по составу митохондриальных ферментов. Однако в этой главе мы отвлечемся от различий и рассмотрим лишь ферменты и свойства, общие для всех митохондрий.
7.1.3. Окислительные процессы в митохондриях начинаются после образования в матриксе достаточного количества ацетил-СоА из пирувата и жирных кислот [4]
«Топливом» для окислительного метаболизма в митохондриях служат главным образом жирные кислоты и пируват, образуемый в результате гликолиза в цитозоле. Эти вещества избирательно транспортируются из цитозоля в митохондриальный матрикс, где распадаются до двухуглеродных групп, присоединенных к ацетилкоферменту А (ацетил-СоА, рис. 7-8). В составе молекулы ацетил-СоА каждая ацетильная группа поступает затем в цикл лимонной кислоты для дальнейшего расщепления. Процесс заканчивается переносом по дыхательной цепи богатых энергией электронов, извлеченных из ацетильной группы.
Для того чтобы обеспечить непрерывное снабжение окислительного метаболизма «топливом», животные клетки запасают его в виде жиров, служащих источником жирных кислот, и гликогена - источника глюкозы. которая потом расщепляется до пирувата. В количественном отношении жиры гораздо более важны хотя бы потому, что при их окислении освобождается в шесть с лишним раз больше энергии, чем при окислении равного количества гликогена в его гидратированной форме. Запасов гликогена в организме среднего взрослого человека достаточно на один день нормальной активности, тогда как запаса жиров хватит на месяц. Если бы главным резервом топлива в нашем организме служил гликоген, а не жиры, вес тела увеличился бы в среднем на 25 кг.
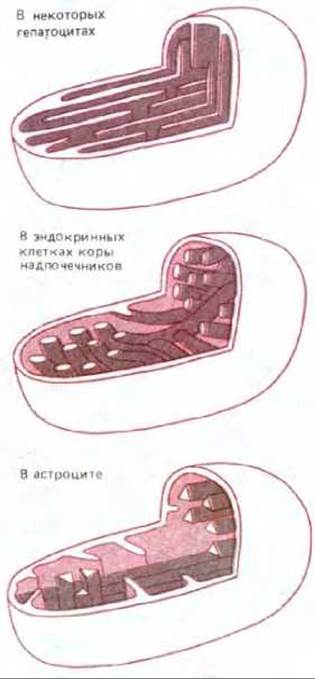
Рис. 7-7. Некоторые морфологические различия в строении крист митохондрий, выделенных из разных тканей крысы. Значение этих различий для функционирования митохондрий не известно.
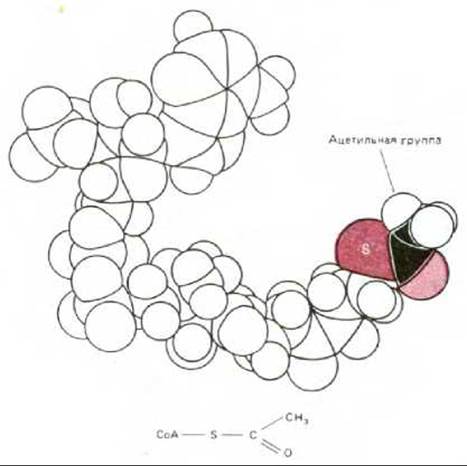
Рис. 7-8. Ацетил-СоА - главный промежуточный продукт, образующийся при расщеплении питательных веществ в митохондриях. На рисунке изображена пространственная модель этой молекулы (см. также рис. 2-19). S - атом серы, образующий с ацетатом тиоэфирную связь. Так как эта связь высокоэнергетическая, ацетатная группа может быть легко перенесена на другую молекулу, такую как оксалоацетат (см. рис. 7-14).
Основная часть жировых запасов находится у нас в жировой ткани, откуда по мере надобности жиры транспортируются с током крови к остальным клеткам. Потребность в жирах возрастает после некоторого периода голодания; даже после ночного сна происходит мобилизация жира, так что в утренние часы большая часть ацетил-СоА, поступающего в цикл лимонной кислоты, извлекается из жирных кислот, а не из глюкозы. Однако после еды главным источником ацетил-СоА для цикла лимонной кислоты становится глюкоза, полученная с пищей. Избыток этой глюкозы идет на восполнение истощенных запасов гликогена или на синтез жиров. (Следует отметить, что хотя сахара в животных клетках легко переводятся в жиры, последние не могут превращаться в сахара.)
Молекула жира состоит из трех остатков жирных кислот, присоединенных эфирными связями к молекуле глицерола. Такие триацилглицеролы (триглицериды) неполярны и практически нерастворимы в воде - в цитозоле они образуют жировые капельки (рис. 7-9). В адипоцитах - клетках жировой ткани - одна большая капля жира занимает почти весь клеточный объем; крупные жировые клетки специализированы для хранения жира. Мелкие жировые капельки обычны для таких клеток, как волокна сердечной мышцы, использующие энергию расщепления жирных кислот; жировые капли в этих клетках часто бывают тесно связаны с митохондриями (рис. 7-10). Во всех клетках ферменты наружной и внутренней мембран митохондрий участвуют в переносе жирных кислот, извлеченных из молекул жира, в митохондриальный матрикс. В матриксе каждая молекула жирной кислоты (в виде ацил-СоА) полностью расщепляется в цикле реакций, за каждый оборот которого она укорачивается с карбоксильного конца на два атома углерода и образуется одна молекула ацетил-СоА (рис. 7-11). Дальнейшее окисление ацетил-СоА происходит в цикле лимонной кислоты.
Гликоген представляет собой большой разветвленный полимер глюкозы, содержащийся в виде гранул в цитоплазме (рис. 7-12); синтез и распад гликогена с высокой степенью точности регулируется нуждами организма (см. разд. 12.4.1). При повышении потребности в глюкозе гликоген расщепляется с образованием глюкозо-1-фосфата. В процессе гликолиза шестиуглеродная молекула глюкозы (или родственного ей сахара) превращается в две трехуглеродные молекулы пирувата (см. разд. 2.3.2), еще сохраняющие большую часть энергии, которая может быть извлечена при полном окислении сахара. Эта энергия высвобождается только после переноса пирувата из цитозоля в митохондриальный матрикс, где пируват подвергается воздействию мультиферментного комплекса, который крупнее рибосомы, - пируватдегидрогеназного комплекса. Этот комплекс, содержащий множественные копии трех ферментов, пяти коферментов и двух регуляторных белков, быстро превращает пируват в ацетил-СоА (при этом в качестве побочного продукта выделяется СО2) (рис. 7-13). Этот ацетил-СоА, так же как и ацетил-СоА, образующийся при окислении жирных кислот, поступает в цикл лимонной кислоты.
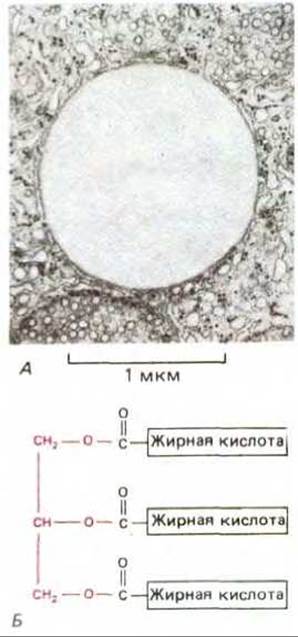
Рис. 7-9. А. Электронная микрофотография жировой капельки, содержащей триацилглицеролы основную форму резервных жиров в цитоплазме. Б. Строение триацилглицерола; цветом выделен остаток глицерола. (Фото А любезно предоставлено Daniel S. Friend.)
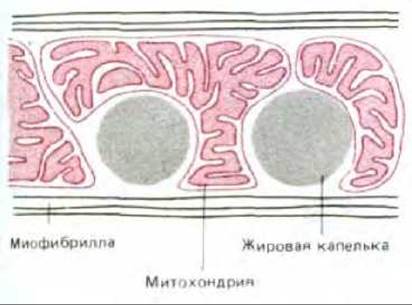
Рис. 7-10. В клетках сердечной мышцы жировые капельки окружены митохондриями, в которых происходит окисление жирных кислот, извлекаемых из триацилглицеролов.
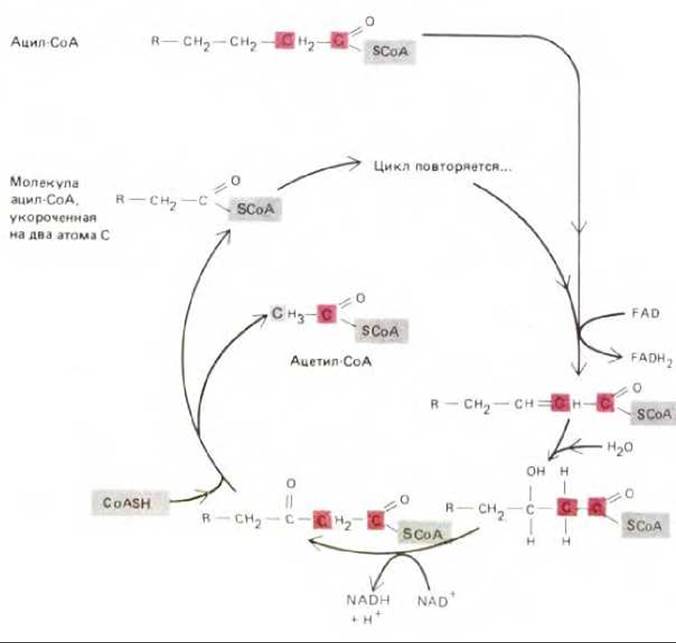
Рис. 7-11. Цикл окисления жирных кислот, этапы которого последовательно катализируются в митохондриальном матриксе четырьмя ферментами. За каждый оборот цикла молекула жирной кислоты укорачивается на два углеродных атома (выделены цветом) и образуется одна молекула ацетил-СоА и по одной молекуле NADH и FADH2. NADH свободно растворяется в матриксе, в то время как FADH2 остается тесно связанным с ферментом ацил-СоА-дегидрогеназой; два электрона FADH2 быстро переносятся на убихинон, находящийся во внутренней мембране митохондрии (разд. 7.2.5), и при этом регенерируется NAD. Представленный здесь четырехступенчатый путь окисления жирных кислот идентичен по своей химической сущности расщеплению многих других углерод-углеродных связей (см., например, рис. 7-14).

Рис. 7-12. Электронная микрофотография и схематическое изображение гранул гликогена - главной резервной формы углеводов в клетках позвоночных. Гликоген - это полимер глюкозы, и каждая гранула представляет собой единственную сильно разветвленную молекулу. Синтез и расщепление гликогена катализируют ферменты, связанные с поверхностью гранул, в том числе гликогенсинтаза и расщепляющий фермент гликогенфосфорилаза. (С любезного разрешения Robert Fletterick и Daniel S. Friend.)
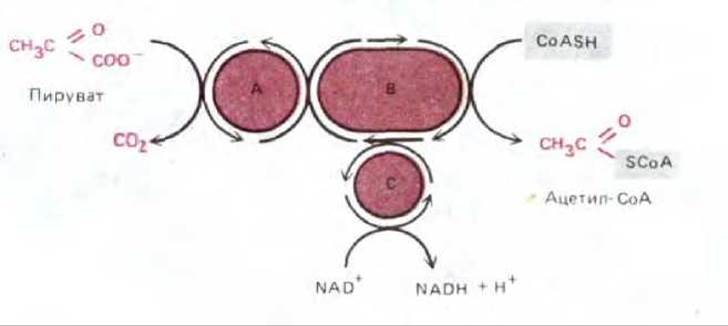
Рис. 7-13. Реакции, осуществляемые пируватдегидрогеназным комплексом, превращающим пируват в ацетил-СоА в митохондриальном матриксе; в ходе этих реакций также образуется NADH. А, В, С - это три фермента: пируватдегидрогеназа, дигидролипоил-трансацетилиза и дигидролипоил-дегидрогеназа, функции которых сопряжены, как показано на рисунке. Строение комплекса изображено на рис. 2-40; комплекс содержит также протеинкиназу и протеинфосфатазу, которые регулируют активность пируватдегидрогеназы, «отключая» ее при высоких концентрациях АТР.
7.1.4. Окисление ацетильной группы до ацетил-СоА в цикле лимонной кислоты ведет к образованию молекул NADH и FADH2 для дыхательной цепи [5]
Еще в прошлом веке биологи заметили, что в отсутствие воздуха (в анаэробных условиях) клетки образуют молочную кислоту (или этанол), тогда как в аэробных условиях они используют кислород, образуя СО2 и Н2О. Усилия по выяснению путей аэробного метаболизма в конце концов сосредоточились на окислении пирувата и привели в 1937 г. к открытию цикла лимонной кислоты, называемого также циклом трикарбоновых кислот или циклом Кребса. В большинстве клеток в цикле лимонной кислоты происходит около двух третей всех реакций окисления углеродных соединений. Главные конечные продукты этого цикла - СО2 и NADH. CO2 выделяется как побочный продукт, а молекулы NADH передают свои богатые энергией электроны в дыхательную цепь, в конце которой эти электроны используются для восстановления О2 до Н2О.
Цикл лимонной кислоты начинается с взаимодействия между ацетил-СоА, образованным из жирных кислот или пирувата, и четырехуглеродным соединением оксалоацетатом, в результате чего образуется шестиуглеродная лимонная кислота, которая и дала название всему циклу. Далее в ходе семи последовательных ферментативных реакций два атома углерода удаляются в виде СО2 и в конце концов регенерируется оксалоацетат. Каждый оборот цикла дает две молекулы СО2, образующиеся из двух углеродных атомов, поступивших в предыдущие обороты цикла (рис. 7-14). Превращение ацетильной группы в составе ацетил-СоА можно представить следующей суммарной реакцией:
СН3СООН (в виде ацетил-СоА) + 2Н2О + 3NAD+ + FAD, связанный с белком → 2СО2 + 3Н+ + 3NADH + FADH2, связанный с белком.
Кроме того, в результате этой реакции синтезируется одна молекула АТР (через GTP) путем субстратного фосфорилирования, подобно тому как это происходит при гликолизе (см. разд. 2.3.2).
Наиболее важный вклад цикла лимонной кислоты в метаболизм - это извлечение высокоэнергетических электронов, происходящее при окислении двух углеродных атомов в молекуле ацетил-СоА. Эти электроны связываются NADH и FADH2 и затем быстро передаются в дыхательную цепь во внутренней митохондриальной мембране. FADH2 - компонент сукцинатдегидрогеназного комплекса внутренней мембраны - передает свои электроны непосредственно в дыхательную цепь. В отличие от этого NADH образует растворимый пул восстанавливающих эквивалентов в матриксе и отдает свои электроны в результате случайных взаимодействий с мембраносвязанной дегидрогеназой. Рассмотрим теперь, каким образом энергия этих электронов используется для синтеза АТР.
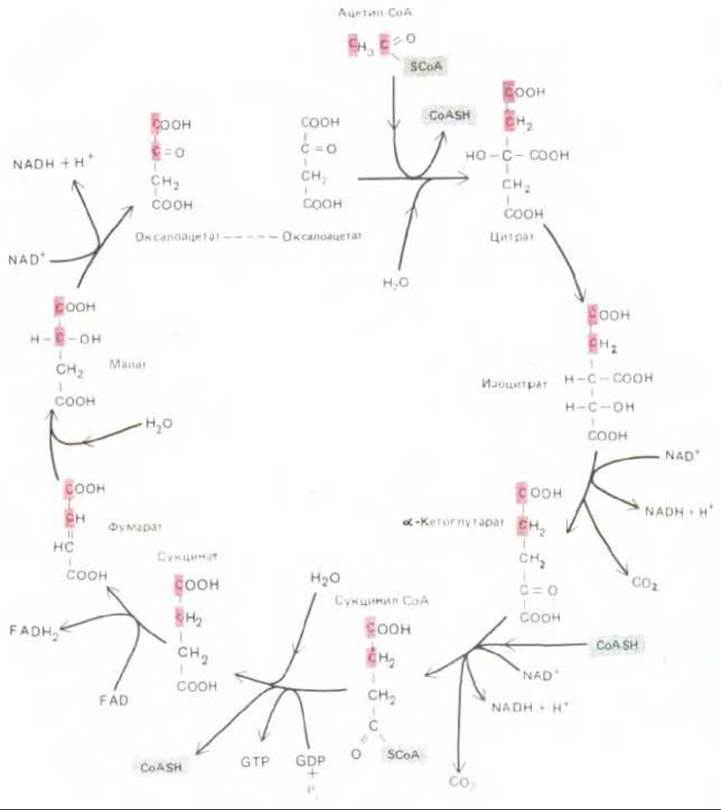
Рис.7-14. Цикл лимонной кислоты. Промежуточные продукты представлены в виде свободных жирных кислот, хотя в действительности карбоксильные группы ионизированы. Каждая из показанных реакций катализируется особым ферментом; все эти ферменты находятся в матриксе митохондрии. Два углеродных атома, приносимые с ацетил-CoA, превращаются в СО2 в последующих оборотах цикла. Цветом выделены два углеродных атома, превращающиеся в СО2 уже в данном цикле. Кроме того, образуются три молекулы NADH. Образующаяся молекула GTP может быть превращена в АТР путем обменной реакции GTP + ADP → GDP + АТР. Молекула FADH2 остается в составе сукцинатдегидрогеназного комплекса, находящегося во внутренней мембране митохондрии; этот комплекс передает электроны с FADH2 непосредственно на убихинон.
7.1.5. На митохондриальной мембране энергия окислительных реакций преобразуется в результате хемиосмотического процесса в энергию АТР [6]
Хотя цикл лимонной кислоты составляет часть аэробного метаболизма, ни в одной из реакций этого цикла, приводящих к образованию NADH и FADH2, молекулярный кислород не принимает прямого участия; это происходит только в завершающей серии катаболических реакций, протекающих на внутренней мембране. Почти вся энергия, получаемая на ранних этапах окисления от сжигания углеводов, жиров и других питательных веществ, вначале запасается в форме высокоэнергетических электронов, переносимых NADH и FADH. Затем эти электроны взаимодействуют с молекулярным кислородом в дыхательной цепи. Так как большое количество высвобождаемой энергии используется ферментами внутренней мембраны для синтеза АТР из ADP и Pi, эти последние реакции называют окислительным фосфорилированием (рис. 715).
Как уже упоминалось, синтез АТР в реакциях окислительного фосфорилирования, протекающих в дыхательной цепи, зависит от хемиосмотического процесса. Механизм этого процесса, впервые предложенный в 1961 г., позволил разрешить проблему, давно стоявшую перед биологией клетки. Однако идея была настолько нова, что лишь через несколько лет она получила всеобщее признание в результате накопления экспериментальных данных. Раньше думали, что энергию для синтеза АТР в дыхательной цепи обеспечивает такой же механизм, как и при субстратном фосфорилировании: предполагалось, что энергия окисления используется для образования высокоэнергетической связи между фосфатной группой и каким-то промежуточным соединением и что превращение ADP в АТР осуществляется за счет энергии, выделяемой при разрыве этой связи. Однако, несмотря на интенсивные поиски, предполагаемый интермедиат не был обнаружен.
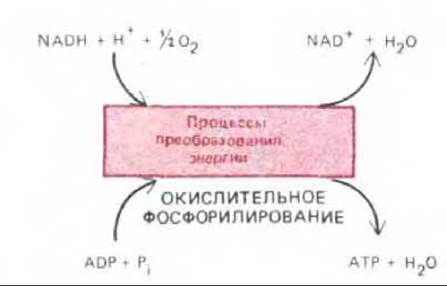
Рис. 7-15. Основной итог превращения энергии, происходящего в митохондрии. В этом процессе, называемом окислительным фосфорилированием, внутренняя митохондриальная мембрана играет роль энергопреобразующего устройства, которое превращает часть энергии окисления NADH (и FADH2) в энергию фосфатных связей АТР.
Таблица 7-1. Хемиосмотическое сопряжение
|
Хемиосмотическая гипотеза, предложенная в начале 60-х годов, включала четыре независимых постулата, касавшиеся функции митохондрий: |
|
|
і. |
Митохондриальная дыхательная цепь, находящаяся во внутренней мембране, способна перемещать протоны; при прохождении электронов по дыхательной цепи происходит «откачивание» Н+ из матрикса. |
|
2. |
Митохондриальный АТР-синтетазный комплекс тоже перемещает протоны через внутреннюю мембрану. Поскольку этот процесс обратим, фермент может не только использовать энергию гидролиза АТР для переноса Н+ через мембрану, но при достаточно большом протонном градиенте протоны начинают «течь» через АТР-синтетазу в обратном направлении, что сопровождается синтезом АТР. |
|
3. |
Внутренняя мембрана митохондрий непроницаема для Н+, ОН" и вообще всех анионов и катионов. |
|
4. |
Внутренняя митохондриальная мембрана содержит ряд белков-переносчиков, осуществляющих транспорт необходимых метаболитов и неорганических ионов. |
Согласно хемиосмотической гипотезе, вместо богатых энергией промежуточных продуктов существует прямая связь между процессами химическими («хеми...») и транспортными (осмотическими, от греческого osmos - толчок, давление) - хемиосмотическое сопряжение (табл. 7-1). При прохождении высокоэнергетических электронов, доставляемых NADH и FADH2, по дыхательной цепи внутренней митохондриальной мембраны от одного переносчика к следующему высвобождается энергия, которая используется для перекачивания протонов (Н+) через внутреннюю мембрану из матрикса в межмембранное пространство. В результате на внутренней мембране создается электрохимический протонный градиент; энергию обратного тока протонов «вниз» по этому градиенту использует связанный с мембраной фермент АТР-синтетаза, катализирующий образование АТР из ADP и Рі, т. е. завершающий этап окислительного фосфорилирования (рис. 7-16).

Рис. 7-16. Потоки важнейших метаболитов, поступающих в митохондрию и выходящих из нее. Пируват и жирные кислоты входят в митохондрию и метаболизируются в цикле лимонной кислоты, в котором образуется NADH. Затем в ходе окислительного фосфорилирования богатые энергией электроны NADH передаются на кислород с помощью дыхательной цепи, находящейся во внутренней мембране; при этом благодаря хемиосмотическому механизму образуется АТР. NADH, образовавшийся в цитозоле при гликолизе, тоже передает свои электроны в дыхательную цепь (не показано). Так как NADH не способен проходить через внутреннюю мембрану, перенос его электронов осуществляется непрямым путем - при помощи одной из нескольких челночных систем, транспортирующих в митохондрию другое восстановленное соединение; после окисления это соединение возвращается в цитозоль, где вновь восстанавливается с помощью NADH.
В оставшейся части этого раздела мы кратко рассмотрим тот тип реакций, который делает возможным окислительное фосфорилирование; детали будут обсуждаться позже (разд. 7.2).
7.1.6. Электроны переносятся с NADH на кислород с помощью трех больших ферментных комплексов дыхательной цепи [7]
Хотя механизмы извлечения энергии в дыхательной цепи и в других катаболических реакциях различны, в их основе лежат общие принципы. Реакция Н2 + 1/2 О2→ Н2О разбита на много небольших «шагов», так что высвобождаемая энергия может переходить в связанные формы, а не рассеивается в виде тепла. Как и в случае образования АТР и NADH при гликолизе или в цикле лимонной кислоты, это связано с использованием непрямого пути. Но уникальность дыхательной цепи заключается в том, что здесь прежде всего атомы водорода расщепляются на электроны и протоны. Электроны передаются через серию переносчиков, встроенных во внутреннюю митохондриальную мембрану. Когда электроны достигают конца этой электронтранспортной цепи, протоны оказываются там же для нейтрализации отрицательного заряда, возникающего при переходе электронов на молекулу кислорода (рис. 7-17).
Проследим процесс окисления, начиная с образования NADH - главного акцептора реактивных электронов, извлекаемых при окислении молекул питательных веществ. Каждый атом водорода

Рис. 7-17. Эти схемы показывают, каким образом большая часть энергии «сжигания» водорода не рассеивается в виде тепла (слева), а улавливается и запасается в полезной для клетки форме с помощью электронтранспортной цепи, находящейся во внутренней митохондриальной мембране (справа). Остаток энергии высвобождается митохондрией в форме тепла. В действительности изображенные здесь электроны и протоны отнимаются от атомов водорода, ковалентно связанных с молекулами NADH или FADH2 (см. рис. 7-18).
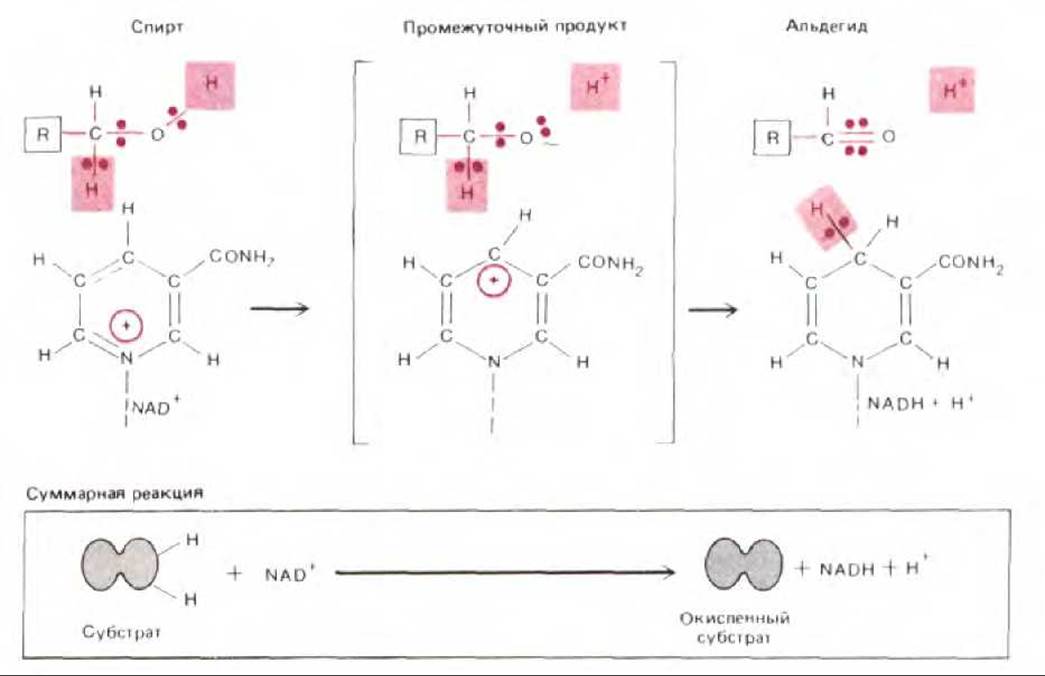
Рис. 7-18. Предполагаемый механизм биологического окисления спирта в альдегид. От молекулы спирта отщепляются компоненты двух полных атомов водорода, при этом гидрид-ион переносится на NAD+, а протон переходит в водную среду. Здесь представлены только никотинамидные кольца, входящие в состав NAD+ и NADH (см. рис. 2-22). Показанные стадии процесса протекают на поверхности фермента алкогольдегидрогеназы (не показан) при участии его специфических групп. (С разрешения P. F. Cook, N.J. Oppenheimer, W. W. Cleland, Biochemistry, 20: 1817 1825, 1981. Copyright 1981, American Chem. Soc.)
(будем обозначать его Н) состоит из одного электрона (е-) и одного протона (Н+). Механизм присоединения электронов к NADH обсуждался раньше (разд. 2.3.4) и более детально представлен на рис. 7-18. Как ясно из этой схемы, каждая молекула NADH несет гидрид-ион (водородный атом плюс добавочный электрон, Н:-), а не просто атом водорода. Однако из-за присутствия в окружающем водном растворе свободных протонов перенос гидрид-иона в составе NADH эквивалентен переносу двух атомов водорода или молекулы водорода (Н:- + Н+→ Н2).
Перенос электронов по дыхательной цепи начинается с отнятия гидрид-иона (Н:-) от NADH; при этом регенерируется NAD+, a гидрид-ион превращается в протон и два электрона (Н:-→ Н+ + 2е). Эти электроны переходят на первый из более чем 15 различных переносчиков электронов в дыхательной цепи. В этот момент электроны обладают очень большой энергией, запас которой постепенно уменьшается по мере прохождения их по цепи. Чаще всего электроны переходят от одного атома металла к другому, причем каждый из этих атомов прочно связан с белковой молекулой, которая влияет на его сродство к электрону. Разнообразные типы переносчиков электронов в дыхательной цепи будут подробно рассмотрены позднее (разд. 7.2.5). Важно отметить, что все белки - переносчики электронов - группируются в три больших комплекса дыхательных ферментов, каждый из которых содержит трансмембранные белки, прочно закрепляющие комплекс во внутренней мембране митохондрии (см. разд. 7.2.6). Каждый последующий комплекс обладает большим сродством к электронам, чем предыдущий. Электроны последовательно переходят с одного комплекса на другой, пока наконец не перейдут на кислород, имеющий наибольшее сродство к электрону.
7.1.7. Энергия, высвобождаемая в процессе переноса электронов по дыхательной цепи, запасается в форме электрохимического протонного градиента на внутренней мембране митохондрий [8]
Окислительное фосфорилирование возможно благодаря тесной ассоциации переносчиков электронов с белковыми молекулами. Белки направляют электроны по дыхательной цепи так, что они последовательно переходят от одного ферментного комплекса к другому, не «перескакивая» через промежуточные звенья. Особенно важно то, что перенос электронов сопряжен с аллостерическими изменениями определенных белковых молекул, в результате чего энергетически выгодный поток электронов вызывает перекачивание протонов (Н+) через внутреннюю мембрану из матрикса в межмембранное пространство и далее за пределы митохондрии. Передвижение протонов приводит к двум важным следствиям: 1) между двумя сторонами внутренней мембраны создается градиент рН - в матриксе рН выше, чем в цитозоле, где значение рН обычно близко к 7,0 (так как малые молекулы свободно проходят через наружную мембрану митохондрии, рН в межмембранном пространстве будет таким же, как в цитозоле); 2) на внутренней мембране создается градиент напряжения (мембранный потенциал), причем внутренняя сторона мембраны заряжается отрицательно, а наружная - положительно.

Рис. 7-19. Две составляющие электрохимического протонного градиента. Общая протонодвижущая сила, создающаяся на внутренней митохондриальной мембране, складывается из большой силы, обусловленной мембранным потенциалом (традиционно обозначается как ∆ψ, но в нашем тексте - как ∆V), и меньшей, которую создает градиент концентрации протонов (∆рН). Обе силы стремятся перемещать протоны внутрь матрикса.
Градиент рН (∆рН) заставляет ионы Н+ переходить обратно в матрикс, а ионы ОН- из матрикса, что усиливает эффект мембранного потенциала (∆V), под действием которого любой положительный заряд притягивается в матрикс, а любой отрицательный выталкивается из него. Совместное действие этих двух сил приводит к возникновению электрохимического протонного градиента (рис. 7-19).
Электрохимический протонный градиент создает протонодвижущую силу, измеряемую в милливольтах (мВ). Так как градиент рН (∆рН) в 1 единицу рН эквивалентен мембранному потенциалу около 60 мВ, протонодвижущая сила будет равна ∆V — 60 (∆рН). В типичной клетке эта сила на внутренней мембране дышащей митохондрии составляет около 220 мВ и складывается из мембранного потенциала примерно в 160 мВ и градиента рН, близкого к — 1 единице рН.
7.1.8. Энергия электрохимического протонного градиента используется для синтеза АТР и транспорта метаболитов и неорганических ионов в матрикс [9]
Внутренняя мембрана митохондрий отличается необычно высоким содержанием белка - в ней по весу примерно 70% белка и 30% фосфолипидов. Многие из этих белков входят в состав электронтранспортной цепи, поддерживающей протонный градиент на мембране. Другой важный компонент - фермент АТР-синтетаза, катализирующий синтез АТР. Это большой белковый комплекс, через который протоны перетекают обратно в матрикс по электрохимическому градиенту. Подобно турбине, АТР-синтетаза преобразует одну форму энергии в другую, синтезируя АТР из ADP и Рі в митохондриальном матриксе в ходе реакции, сопряженной с током протонов в матрикс (рис. 7-20).
Но синтез АТР - это не единственный процесс, идущий за счет энергии электрохимического градиента. В матриксе, где находятся ферменты, участвующие в цикле лимонной кислоты и других метаболических реакциях, необходимо поддерживать высокие концентрации различных субстратов; в частности, для АТР-синтетазы требуются ADP и фосфат. Поэтому через внутреннюю мембрану должны транспортироваться разнообразные несущие заряд субстраты. Это достигается с помощью различных белков-переносчиков, встроенных в мембрану (см. разд. 6.4.4), многие из которых активно перекачивают определенные молекулы против их электрохимических градиентов, т. е. осуществляют процесс, требующий затраты энергии. Для большей части метаболитов источником этой энергии служит сопряжение с перемещением каких-то других молекул «вниз» по их электрохимическому градиенту (см. разд. 6.4.9). Например, в транспорте ADP участвует система антипорта ADP-ATP: при переходе каждой молекулы ADP в матрикс из него выходит по своему электрохимическому градиенту одна молекула АТР. В то же время система симпорта сопрягает переход фосфата внутрь митохондрии с направленным туда же потоком Н+: протоны входят в матрикс по своему градиенту и при этом «тащат» за собой фосфат. Подобным образом переносится в матрикс и пируват (рис. 7-21). Энергия электрохимического протонного градиента используется также для переноса в матрикс ионов Са2+, которые, по-видимому, играют важную роль в регуляции активности некоторых митохондриальных ферментов; большое значение может иметь и поглощение митохондриями этих ионов для удаления их из цитозоля, когда концентрация Са2+ в последнем становится опасно высокой (см. разд. 12.3.7).
Чем больше энергии электрохимического градиента затрачивается на перенос молекул и ионов в митохондрию, тем меньше остается для синтеза АТР. Например, если изолированные митохондрии поместить в среду с высоким содержанием Са2+, то они полностью прекратят синтез АТР; вся энергия градиента будет расходоваться на транспорт Са2+ в матрикс. В некоторых специализированных клетках электрохимический протонный градиент «шунтируется» таким образом, что митохондрии вместо синтеза АТР образуют тепло (см. разд. 7.2.12). Очевидно, клетки способны регулировать использование энергии электрохимического протонного градиента и направлять ее на те процессы, которые наиболее важны в данный момент.
7.1.9. Быстрое превращение ADP в АТР в митохондриях позволяет поддерживать высокое отношение концентраций ATP/ADP в клетках [10]
С помощью особого белка, встроенного во внутреннюю мембрану, ADP транспортируется в матрикс в обмен на АТР по принципу антипорта (рис. 7-21). В результате молекулы ADP, высвобождаемые при гидролизе АТР в цитозоле, быстро поступают в митохондрию для «перезарядки», в то время как молекулы АТР, образующиеся в матриксе в процессе окислительного фосфорилирования, тоже быстро выходят в цитозоль, где они нужны. В организме человека молекулы АТР за сутки оборачиваются несколько тысяч раз, что позволяет поддерживать в клетке концентрацию АТР, более чем в 10 раз превышающую концентрацию ADP.

Рис. 7-20. Общий механизм окислительного фосфорилирования. По мере прохождения высокоэнергетических электронов по электронтранспортной цепи некоторая часть высвобождаемой энергии используется для приведения в действие трех дыхательных ферментных комплексов, откачивающих протоны из матрикса. В результате этого на внутренней мембране создается электрохимический протонный градиент, под действием которого протоны возвращаются обратно в матрикс через АТР-синтетазу - трансмембранный белковый комплекс, использующий энергию протонного тока для синтеза в матриксе АТР из ADP и Рі.
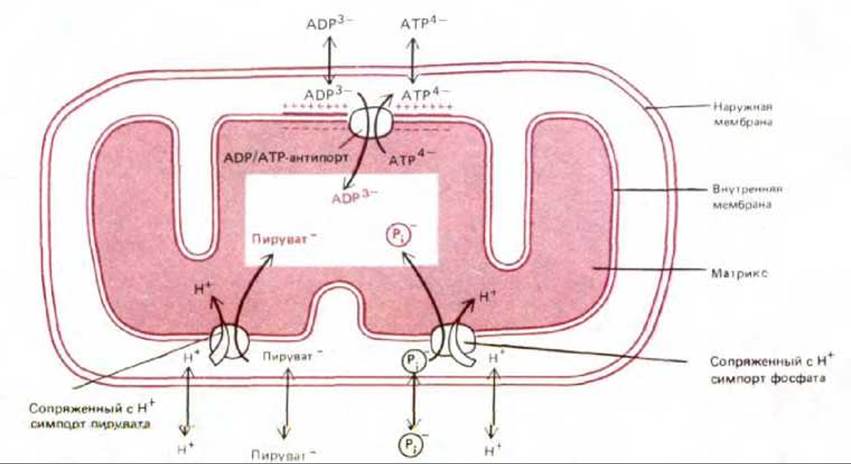
Рис. 7-21. Некоторые из процессов активного транспорта, идущих за счет энергии электрохимического протонного градиента, который поддерживается на внутренней мембране. Указан заряд каждой из транспортируемых молекул. Наружная мембрана свободно проницаема для всех этих соединений. Транспортные механизмы типа симпорта и антипорта подробно рассмотрены в гл. 6.
Как уже говорилось в гл. 2, биосинтетические ферменты клетки направляют превращения своих субстратов по определенным метаболическим путям, часто осуществляя энергетически невыгодные реакции путем сопряжения их с энергетически выгодным гидролизом АТР (см. рис. 2-27). Таким образом, высококонцентрированный пул АТР обеспечивает внутриклеточные процессы энергией подобно аккумулятору, приводящему в действие электромотор: если митохондрии прекратят свою активность, то клеточная «аккумуляторная батарея» начнет разряжаться и наступит момент, когда энергетически невыгодные реакции уже не смогут осуществляться за счет гидролиза АТР.
На первый взгляд может показаться, что такого состояния не будет до тех пор, пока концентрация АТР не упадет до нуля. Фактически же это состояние наступает значительно раньше - при определенном уровне АТР, зависящем от концентраций ADP и Рi. Для того чтобы объяснить, почему так происходит, нужно обратиться к некоторым элементарным принципам термодинамики.
7.1.10. Разница между ∆G° и ∆G. Для того чтобы клетка могла использовать гидролиз АТР, необходима большая отрицательная величина ∆G [11]
Согласно второму закону термодинамики, химические реакции протекают спонтанно только в направлении, повышающем «неупорядоченность» во Вселенной. В гл. 2 говорилось о том, что реакции, при которых высвобождаемая энергия рассеивается в виде тепла в окружающую среду (такие, как гидролиз АТР), способствуют увеличению этой неупорядоченности, так как усиливают хаотическое движение молекул. Кроме того, химические реакции могут влиять на степень неупорядоченности, изменяя концентрации реагирующих веществ и продуктов реакции. Суммарное изменение неупорядоченности Вселенной в результате какой-либо реакции определяется изменением свободной энергии, ∆G, сопровождающим эту реакцию: чем больше уменьшается свободная энергия (т. е. больше отрицательное значение ∆G), тем в большей степени возрастает неупорядоченность Вселенной и тем легче протекает реакция (см. схему 2-7).

Рис. 7-22. Принципиальная связь между изменениями свободной энергии и равновесием реакции иллюстрируется здесь на примере гидролиза АТР. Приводимая константа равновесия К выражена в литрах на моль. (Вопрос о свободной энергии иллюстрируется на схеме 2-7, с. 96-97; определение константы равновесия дано на рис. 3-7).
Величина изменения свободной энергии для гидролиза АТР с образованием ADP и неорганического фосфата при условиях, обычно существующих в клетке, варьирует в пределах от — 11 до — 13 ккал/моль. Однако столь благоприятные условия для протекания этой реакции связаны с тем, что концентрация АТР в клетке поддерживается на очень высоком уровне по сравнению с концентрациями ADP и Рi. При так называемых «стандартных условиях», когда концентрации АТР, ADP и Рi одинаковы и равны 1 моль/л, величину ∆G для гидролиза АТР называют изменением стандартной свободной энергии для данной реакции, ∆G°; она составляет — 7,3 ккал/моль. При какой-то еще более низкой концентрации АТР по сравнению с ADP и Pi величина ∆G упадет до нуля. В этом случае скорость образования АТР из ADP и Рі будет равна скорости гидролиза АТР; иными словами, при ∆G = 0 реакция находится в состоянии равновесия (рис. 7-22).
При постоянной температуре величина ∆G° постоянна и зависит только от природы реагирующих веществ, тогда как ∆G изменяется при изменении концентраций реагирующих веществ и указывает, насколько данная реакция далека от равновесия. Поэтому именно ∆G, а не ∆G° определяет, может ли данная реакция служить источником энергии для других реакций. Высокая концентрация АТР в клетке (относительно ADP и Pi) при активном синтезе этого вещества в митохондриях обусловливает большую отрицательную величину ∆G для реакции гидролиза АТР и удерживает эту реакцию в состоянии, далеком от равновесия. В противном случае гидролиз АТР не мог бы использоваться клеткой для осуществления других процессов и многие биосинтетические реакции пошли бы в обратном направлении.
7.1.11. Клеточное дыхание необычайно эффективно
В процессе окислительного фосфорилирования каждая пара электронов NADH обеспечивает энергией образование примерно трех молекул АТР. Пара электронов FADH2, обладающая меньшей энергией, дает энергию для синтеза только двух молекул АТР. В среднем каждая молекула ацетил-СоА, поступающая в цикл лимонной кислоты, дает около 12 молекул АТР. Это означает, что при окислении одной молекулы глюкозы образуются 24 молекулы АТР, а при окислении одной молекулы пальмитата - жирной кислоты с 16 углеродными атомами - 96 молекул АТР. Если учесть также экзотермические реакции, предшествующие образованию ацетил-СоА, окажется, что полное окисление одной молекулы глюкозы дает около 36 молекул АТР, тогда как при полном окислении пальмитата образуется примерно 129 молекул АТР. Это максимальные величины, так как фактически количество синтезируемого в митохондриях АТР зависит от того, какая доля энергии протонного градиента идет на синтез АТР, а не на другие процессы.
Если сравнить изменение свободной энергии при сгорании жиром и углеводов прямо до СО2 и Н2О с общим количеством энергии запасаемой в фосфатных связях АТР в процессах биологического окисления, окажется, что эффективность преобразования энергии окисления в энергию АТР часто превышает 50%. Это значительно выше эффективности большинства энергопреобразующих устройств, созданных человеком. Если бы клетка работала с эффективностью (к.п.д) электромотора или автомобильного двигателя (10-20%), то организму для поддержания жизни требовалось бы намного больше пищи. Кроме того, поскольку вся неиспользованная энергия высвобождается в виде тепла, крупные организмы нуждались бы в более эффективных способах отвода тепла в окружающую среду.
Изучая клеточное дыхание, студенты иногда удивляются, почему химические взаимопревращения в клетке идут таким сложным путем. Казалось бы, вполне можно обойтись без цикла лимонной кислоты и многих звеньев дыхательной цепи и окислять сахара до СО2 и Н2О более прямым способом. Но, хотя в этом случае ход процессов дыхания было бы легче запомнить, для клетки подобный путь оказался бы катастрофическим. Огромное количество свободной энергии, высвобождаемое при окислении, может эффективно использоваться только мелкими порциями. В сложном процессе окисления участвует много промежуточных продуктов, каждый из которых лишь незначительно отличается от предыдущего. Благодаря этому высвобождаемая энергия дробится на меньшие количества, которые можно эффективно преобразовывать с помощью сопряженных реакций в высокоэнергетические связи молекул АТР и NADH (см. рис. 2-17).
Заключение
Митохондрии осуществляют большую часть клеточных процессов окисления и производят почти весь АТР животной клетки. Митохондриальный матрикс содержит множество разнообразных ферментов, в том числе ферменты, окисляющие пируват и жирные кислоты до ацетил-СоА, и ферменты, окисляющие этот ацетил-СоА до СО2 в цикле. лимонной кислоты. В ходе этих реакций окисления образуются большие количества NADH (и FADH2). Энергия, получаемая при соединении кислорода с переносимыми NADH и FADH2 реакционноспособными электронами, используется электронтранспортной цепью, находящейся во внутренней мембране митохондрии и называемой дыхательной цепью. Дыхательная цепь «откачивает» протоны из матрикса, что приводит к созданию трансмембранного электрохимического протонного градиента, слагающегося из мембранного потенциала и разности рН. Энергия трансмембранного градиента в свою очередь используется для синтеза АТР и для активного транспорта необходимых метаболитов через внутреннюю митохондриальную мембрану. Сочетание этих реакций обеспечивает эффективный обмен ATP-ADP между митохондрией и цитозолем, что позволяет поддерживать в клетке высокий уровень АТР.