Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Преобразование энергии: митохондрии и хлоропласты
Эволюция электронтранспортных цепей
Структуру, функцию и эволюцию клеток и организмов в значительной мере можно связать с их потребностью в энергии. Мы уже видели, что механизмы использования таких разных источников энергии, как свет и окисление глюкозы, в основе своей одинаковы. По-видимому, эффективный способ синтеза АТР появился еще на ранних этапах эволюции и с тех пор подвергся лишь незначительным изменениям. Как же впервые возникли ключевые компоненты электронтранспортной цепи - АТР-синтетаза, протонные насосы, использующие энергию окислительновосстановительных процессов, и фотосистемы? Гипотезы о событиях, происходивших в ходе эволюции, проверить трудно. Однако ключи к разгадке можно найти как в различных примитивных электронтранспортных цепях, сохранившихся у некоторых современных бактерий, так и в геологических данных относительно условий, существовавших на Земле миллиарды лет назад.
7.4.1. Древнейшие клетки, вероятно, синтезировали АТР с помощью процессов брожения [41]
Как уже говорилось в гл. 1, полагают, что первые живые клетки возникли примерно 3,5∙109 лет назад, когда возраст Земли составлял свыше 109 лет. Поскольку в окружающей среде отсутствовал кислород, а органические молекулы, образовавшиеся в ходе геохимических процессов, имелись в избытке, самые первые метаболические пути синтеза АТР были, по-видимому, сходны с существующими ныне формами брожения.
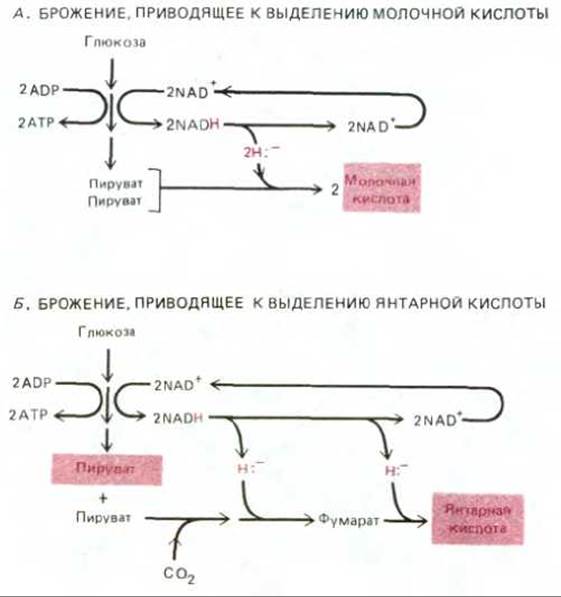
Рис. 7-56. Схемы двух типов брожения (конечные продукты выделены цветом). А. Две молекулы NAD+, использованные на каждую молекулу глюкозы, подвергшейся гликолизу, регенерируются путем переноса гидрид-иона с NADH на пируват с образованием двух молекул молочной кислоты. Молочная кислота выводится из клетки. Б. Две молекулы NAD+, израсходованные на каждую молекулу глюкозы при гликолизе, регенерируются путем последовательного переноса гидрид-ионов от двух молекул NADH на соединения, получаемые из пирувата, в результате чего образуется янтарная кислота. На каждую молекулу янтарной кислоты, выводимую из клетки, одна молекула пирувата (выделена цветом) остается в клетке для последующих процессов биосинтеза. В обоих случаях (А и Б) для регенерации NAD+ и продолжения гликолиза в анаэробных
условиях требуется выведение какой-то органической кислоты.
При брожении АТР образуется путем субстратного фосфорилирования (разд. 2.2.2), при котором используется энергия, высвобождаемая в реакциях частичного окисления органических молекул, богатых водородом, таких как глюкоза. В отсутствие кислорода, который мог бы служить акцептором водорода, выделяемый при окислении молекул водород должен переноситься (через NADH или NADPH) на какую-то другую органическую молекулу (или на другую часть той же молекулы), которая при этом восстанавливается. Из органических конечных продуктов брожения один (или несколько) выводится из клетки в окружающую среду как отход метаболизма, а другие, такие как пируват, используются клеткой для биосинтезов.
Разные организмы выделяют разные конечные продукты, но чаще всего это органические кислоты (углеродные соединения с группой СООН). Из наиболее важных продуктов бактериального брожения следует отметить молочную кислоту (которая накапливается и при анаэробном гликолизе в клетках млекопитающих; см. разд. 2.3.2), а также муравьиную, уксусную, пропионовую, масляную и янтарную кислоты. На рис. 7-56 представлены два типа брожения, встречающиеся у современных бактерий.
7-28
7.4.2. Появление электронтранспортной цепи, запасающей энергию, позволило анаэробным бактериям использовать в качестве источника энергии несбраживаемые органические соединения [42]
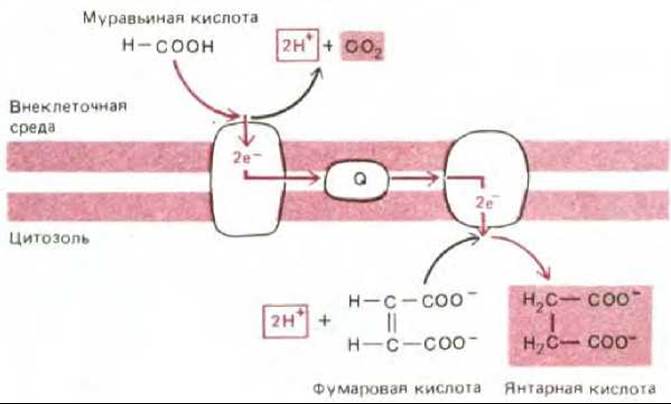
Рис. 7-57. У некоторых современных бактерий, растущих в анаэробных условиях, в том числе у Е. соli, окисление муравьиной кислоты фумаратом осуществляется при участии электронтранспортной цепи, находящейся в плазматической мембране. Как показано, в результате этого процесса образуются сукцинат и СО2. Обратите внимание, что протоны используются внутри клетки, а образуются снаружи, что равнозначно перекачиванию протонов из клетки. Таким образом, эта связанная с мембраной электронтранспортная система может генерировать на плазматической мембране электрохимический протонный градиент. Окислительно-восстановительный потенциал пары Ранние процессы брожения должны были обеспечить образование не только АТР, но и восстанавливающих агентов (NADH и NADPH), необходимых для процессов биосинтеза, и, вероятно, многие из главных метаболических путей сложились в условиях, когда брожение было единственным способом получения энергии. Однако со временем метаболическая активность прокариот должна была изменить окружающую муравьиная кислота - СО2 равен - 420 мВ, а для пары фумарат - сукцинат он составляет + 30 мВ.
среду, и это привело к возникновению новых биохимических путей. Накопление побочных продуктов брожения могло привести к следующим изменениям:
Стадия 1. Из-за непрерывного выделения кислот рН окружающей среды понизился; в результате понадобились трансмембранные насосы, откачивающие ионы Н+ из клетки, чтобы она не погибла от чрезмерного закисления. Вполне возможно, что один из таких насосов использовал энергию гидролиза АТР и, таким образом, мог быть предшественником современной АТР-синтетазы.
Стадия 2. Одновременно с накоплением несбраживаемых органических кислот, которое привело к появлению протонного насоса, использующего энергию АТР, истощались запасы сбраживаемых веществ, за счет окисления которых можно было осуществлять транспорт метаболитов и другие важные жизненные процессы. В этих условиях отбор благоприятствовал тем бактериям, которые были способны выводить ионы Н+ без сопряжения с гидролизом АТР, так что последний сохранялся для других надобностей. Давление отбора, возможно, привело к появлению первых белков, связанных с мембраной, которые могли использовать перенос электронов между молекулами с различным окислительно-восстановительным потенциалом в качестве источника энергии для откачивания протонов через плазматическую мембрану. Для некоторых из этих белков могли найтись подходящие доноры и акцепторы электронов среди накопившихся несбраживаемых органических кислот. Немало таких электронтранспортных белков встречается и у ныне живущих бактерий; например, некоторые бактерии, растущие на средах с муравьиной кислотой, перекачивают протоны за счет относительно небольшой окислительно-восстановительной энергии, извлекаемой при переносе электронов с муравьиной кислоты на фумаровую (рис. 7-57). У других бактерий возникли сходные электронтранспортные механизмы, «занятые» исключительно окислением и восстановлением неорганических субстратов (см., например, рис. 7-59).
Стадия 3. В конце концов у некоторых бактерий выработалась настолько эффективная цепь переноса электронов, что энергии запасалось больше, чем было нужно для поддержания внутриклеточного рН. Откачивание протонов создавало большой электрохимический градиент, который позволял протонам переходить обратно в клетку через АТР-зависимые протонные насосы, что приводило к обращению их действия, т.е. заставляло их функционировать как АТР-синтетазы. Поскольку таким бактериям нужно было гораздо меньше сбраживаемых питательных веществ, запасы которых всё уменьшались, эти бактерии стали быстро вытеснять своих соседей.
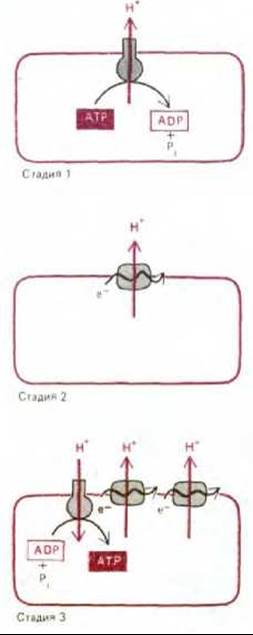
Рис. 7-58. Возможная эволюция механизмов окислительного фосфорилирования.
Эти три гипотетические стадии в эволюции механизмов окислительного фосфорилирования схематически представлены на рис. 7-58.
7.4.3. Фотосинтезирующие бактерии, найдя неисчерпаемый источник восстановительной силы, смогли преодолеть серьезный кризис в эволюции клетки
Хотя только что описанные эволюционные шаги разрешили проблему поддержания как нейтральной внутриклеточной среды, так и достаточных энергетических запасов, осталось непреодоленным другое, не менее серьезное затруднение. Истощение запасов сбраживаемых органических веществ означало, что нужно найти иной источник углерода для синтеза Сахаров - предшественников столь многих других молекул, необходимых клетке. Потенциальным источником углерода могла быть углекислота, которой было достаточно в атмосфере; однако для превращения СО2 в органические молекулы, например углеводы, нужно восстановить связанную углекислоту сильным донором водорода (таким, как NADH или NADPH), способным отдавать богатые энергией электроны, необходимые для образования одной СН2О-единицы из СО2 (см. рис. 743). На ранних стадиях эволюции клетки большие количества таких восстанавливающих агентов образовывались при брожении. Однако по мере сокращения запасов сбраживаемых субстратов и возрастания роли мембранной АТР-синтетазы в образовании АТР запасы NADH и других восстановителей должны были тоже иссякнуть. Таким образом, клетки столкнулись с острой необходимостью найти новый источник сильных восстановителей.
Главными донорами электронов в среде, где уже не было сбраживаемых молекул, стали органические кислоты, получаемые при анаэробном метаболизме углеводов, неорганические молекулы, такие как сероводород (H2S), образующийся в ходе геохимических процессов, и вода. Но восстанавливающая способность всех этих соединений слишком мала, чтобы ее можно было использовать для фиксации углекислоты. Впервые появление сильных доноров электронов было связано, вероятно, с использованием электрохимического протонного градиента между двумя сторонами плазматической мембраны для поддержания обратного тока электронов, что и послужило причиной возникновения мембраносвязанных ферментных комплексов, напоминающих NADH-дегидрогеназу (рис. 7-59). Однако главный эволюционный «прорыв» в энергетическом метаболизме произошел, когда возникли фотохимические реакционные центры, способные прямо синтезировать такие молекулы, как NADH. Полагают, что такие центры впервые появились больше 3 млрд. лет назад у предшественников зеленых серных бактерий. Современные зеленые серные бактерии используют лучистую энергию для переноса атома водорода (в виде электрона и протона) от молекулы сероводорода на NADP+, создавая тем самым восстановительную силу, необходимую для фиксации углерода (рис. 7-60). Так как электроны, отнятые от H2S, обладают гораздо более отрицательным редокс-потенциалом, чем электроны в молекуле воды (-230 и +820 мВ соответственно), одного кванта света, поглощенного единственной имеющейся у этих бактерий фотосистемой, достаточно, чтобы достигнуть редокс-потенциала, необходимого для образования NADPH при участии сравнительно простой электронтранспортной цепи.
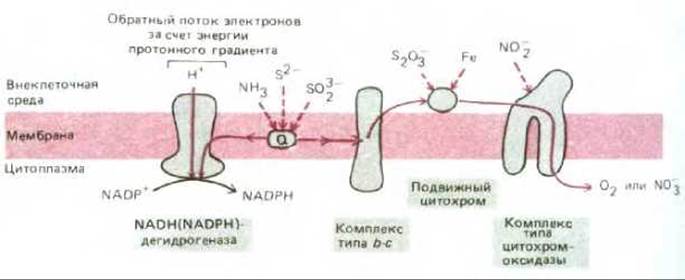
Рис. 7-59. Некоторые пути переноса электронов у современных бактерий, у которых необходимые для роста АТР и восстановительная сила образуются всецело за счет энергии окисления неорганических молекул - таких, как соединения железа, азота, серы и аммиака. Некоторые виды способны расти в анаэробных условиях благодаря замене кислорода как конечного акцептора электронов нитратом. Другие виды используют цикл фиксации углерода и синтезируют органические молекулы исключительно из СО2. «Прямой» поток электронов позволяет откачивать из клетки протоны, и энергия возникающего при этом протонного градиента используется АТР-синтетазой для синтеза АТР (на схеме не показано). NADPH, необходимый для фиксации углерода, образуется при участии «обратного» тока электронов (см. также рис. 7-51, Б).
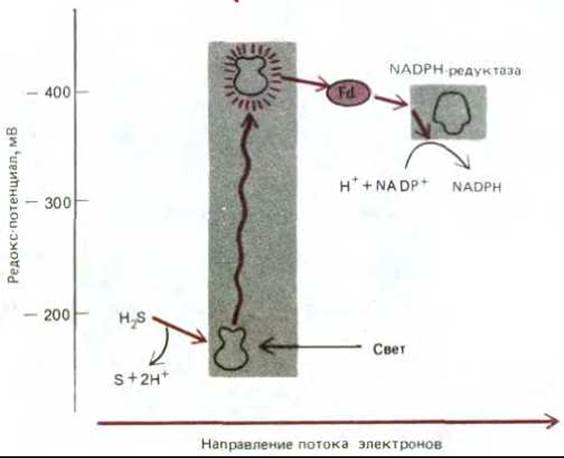
Рис. 7-60. Поток электронов в относительно примитивной схеме нециклического фотосинтеза у современных зеленых серных бактерий. Фотосистема зеленых бактерий сходна с фотосистемой I растений и цианобактерий тем, что в ней тоже используется ряд железо-серных центров, которые служат первичными акцепторами электронов и затем отдают свои высокоэнергетические электроны ферредоксину (Ф).
7.4.4. Первый атмосферный кислород был, вероятно, продуктом более сложных фотосинтетических электронтранспортных цепей цианобактерий [44]
На следующем этапе, который, как полагают, начался примерно 3 млрд. лет назад с появления цианобактерий, возникли организмы, способные использовать воду как источник водорода для восстановления СО2. Это привело к развитию второй фотосистемы, включенной последовательно с первой, что позволило преодолеть большой разрыв в редокс-потенциалах Н2О и NADPH. Структурные гомологии между современными фотосистемами дают основание предполагать, что здесь объединились две фотосистемы, одна из которых ведет свое происхождение от зеленых бактерий (фотосистема I), а другая - от пурпурных бактерий (фотосистема II). Этот эволюционный шаг имел далеко идущие биологические последствия. Впервые появились организмы, обладавшие минимальными потребностями в химических веществах окружающей среды, и эти организмы могли распространяться и эволюционировать по путям, недоступным для более примитивных фотосинтезирующих бактерий, которые нуждались в H2S и органических кислотах как донорах электронов. В результате накопилось большое количество восстановленного органического материала, синтезированного живыми клетками. Кроме того, впервые в атмосферу стал поступать молекулярный кислород.
Кислород весьма токсичен, так как он может инактивировать ферменты, окисляя их. Например, многие из ныне существующих анаэробных бактерий быстро погибают при контакте с воздухом. Поэтому организмы древней Земли должны были выработать средства защиты от возрастающих концентраций О2 в окружающей среде. Существа, появившиеся на поздних этапах эволюции, обладают многочисленными механизмами, предохраняющими их ферменты от вредного воздействия кислорода.
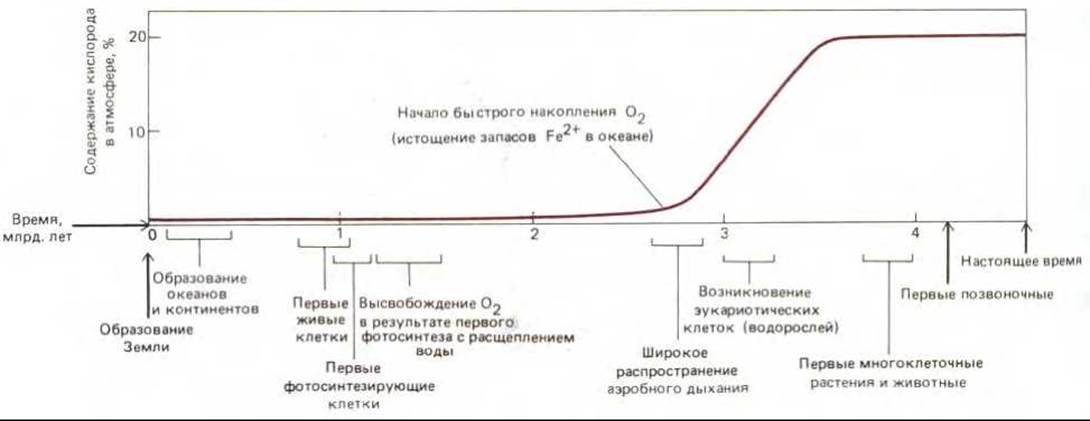
Рис. 7-61. Связь между содержанием кислорода в атмосфере и некоторыми из важнейших гипотетических этапов эволюции жизни на Земле. Судя по геологическим данным, между возникновением цианобактерий (которые, видимо, были первыми организмами, выделявшими кислород) и началом быстрого повышения концентрации кислорода в воздухе прошло больше миллиарда лет. Такая «задержка» объясняется главным образом наличием большого запаса растворенных в океане ионов закисного (двухвалентного) железа, которые вступали в реакцию с выделявшимся кислородом, что привело к образованию огромных отложений железа в окисной форме.
Вначале уровень кислорода в атмосфере повышался очень медленно. Первобытные моря содержали большие количества ионов двухвалентного железа (Fe II), и почти весь кислород, выделяемый ранними фотосинтезирующими бактериями, использовался на превращение Fe II в Fe III. что привело к осаждению огромного количества окислов железа. Обширные «полосчатые железные формации», образование которых началось примерно 2,7 млрд. лет назад, помогают определить время интенсивного развития цианобактерий. Около 2 млрд. лет назад запасы двухвалентного железа истощились и отложение железосодержащих осадков прекратилось, после чего, судя по геологическим данным, содержание кислорода в атмосфере стало повышаться и достигло современного уровня где-то в период от 0,5 до 1,5 млрд. лет назад (рис. 7-61).
Наличие кислорода сделало возможным возникновение бактерий, способных синтезировать АТР за счет аэробного метаболизма; эти бактерии могли использовать большое количество энергии, высвобождаемое при полном расщеплении углеводов и других восстановленных органических молекул до СО2 и Н2О. В результате модификации некоторых компонентов существовавших ранее электронтранспортных комплексов образовалась цитохромоксидаза, благодаря чему электроны, извлекаемые из органических и неорганических субстратов, могли передаваться на О2 как конечный акцептор электронов. Многие из современных пурпурных фотосинтезирующих бактерий способны переключать метаболизм с фотосинтеза на дыхание и обратно в зависимости от того, какой источник энергии более доступен - свет или кислород; такое переключение связано у них с поразительно малыми изменениями в электронтранспортной цепи.
По мере накопления органического материала в результате фотосинтеза некоторые фотосинтезирующие бактерии (в том числе предшественники Е. coli) утратили способность существовать только за счет лучистой энергии и полностью перешли на дыхательный метаболизм. Полагают, что митохондрии впервые появились 1,5 млрд. лет назад, когда такие «дышащие» бактерии стали эндосимбионтами в примитивных эукариотических клетках (см. разд. 7.5.16). Позднее потомки ранних аэробных эукариотических клеток поглотили путем эндоцитоза какую-то фотосинтезирующую бактерию, которая и стала предшественником хлоропластов. Однако уникальность хлоропластов у различных водорослей указывает на независимую эволюцию хлоропластов у разных групп организмов. На рис. 7-62 показаны некоторые из предполагаемых эволюционных путей, рассмотренных выше.
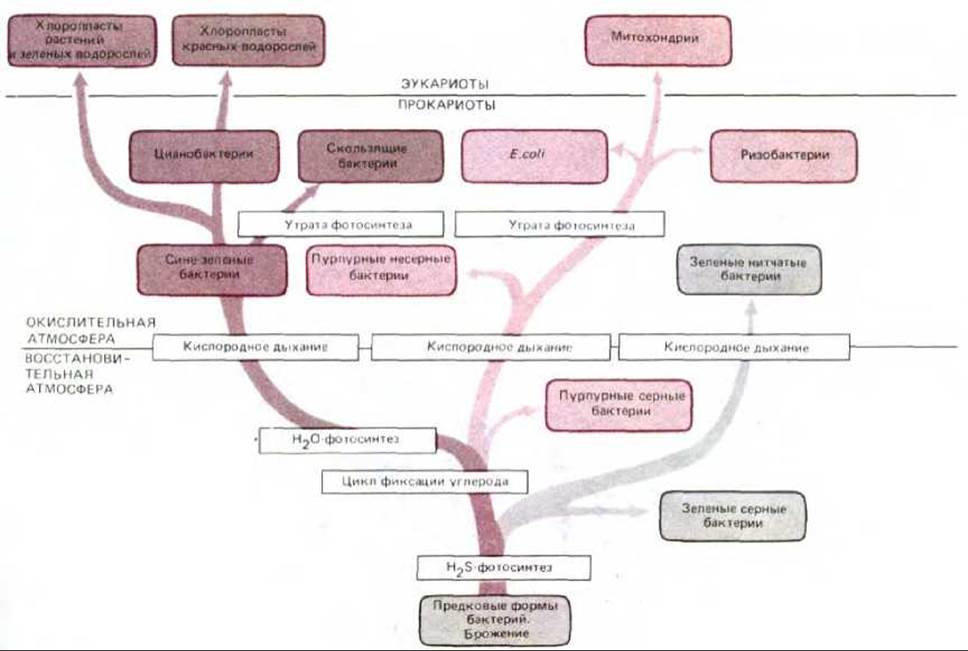
Рис. 7-62. Филогенетическое древо возможной эволюции митохондрий, хлоропластов и их бактериальных предков. Полагают, что кислородное дыхание стало развиваться примерно 2 млрд. лет назад. Как видно из рисунка, такое дыхание, вероятно, независимо возникло в трех линиях фотосинтезирующих прокариот - у зеленых, пурпурных и синезеленых бактерий. По-видимому, какая-то форма аэробных пурпурных бактерий, утратившая способность к фотосинтезу, дала начало митохондриям, тогда как несколько различных синезеленых бактерий были предками хлоропластов. Детальный анализ нуклеотидных последовательностей показывает, что митохондрии скорее всего произошли от бактерий, напоминающих современные ризобактерии, агробактерии и риккетсии - три родственные группы, представители которых вступают в тесные ассоциации с современными эукариотическими клетками (см. разд. 20.3.2 и 20.3.3).
Эволюция всегда консервативна - все новое создается на основе какой-то части уже существующего. Например, некоторые участки электронтранспортной цепи, служившей анаэробным бактериям три миллиарда лет назад, вероятно, вошли в измененном виде в соответствующие цепи митохондрий и хлоропластов высших эукариот. Примером может служить поразительная гомология между структурой и функцией ферментных комплексов в среднем участке митохондриальной дыхательной цепи (комплекс b-c1) и определенными участками электронтранспортной цепи бактерий и хлоропластов (рис. 7-63).
Заключение
Как полагают, древнейшие клетки представляли собой организмы, сходные с бактериями, и жили в среде, богатой восстановленными органическими молекулами, образовавшимися в ходе геохимических процессов на протяжении сотен миллионов лет. Эти организмы, вероятно, получали почти весь свой АТР путем превращения восстановленных соединений в различные органические кислоты, которые выводились, как отходы, в окружающую среду. Процессы брожения привели к закислению среды, в связи с чем, возможно, и возник первый протонный насос, связанный с мембраной, при помощи которого внутри клетки поддерживалась нейтральная реакция. Особенности современных бактерий указывают на то, что протонный насос, использующий энергию переноса электронов, и протонный насос, функционирующий за счет энергии гидролиза АТР, возникли в этих анаэробных условиях. Обратимость функционирования позволила АТР-зависимому протонному насосу действовать в роли АТР-синтетазы. Поэтому по мере создания более эффективных электронтранспортных цепей энергия, высвобождаемая при окислительновосстановительных реакциях между неорганическими молекулами, могла использоваться для синтеза АТР.
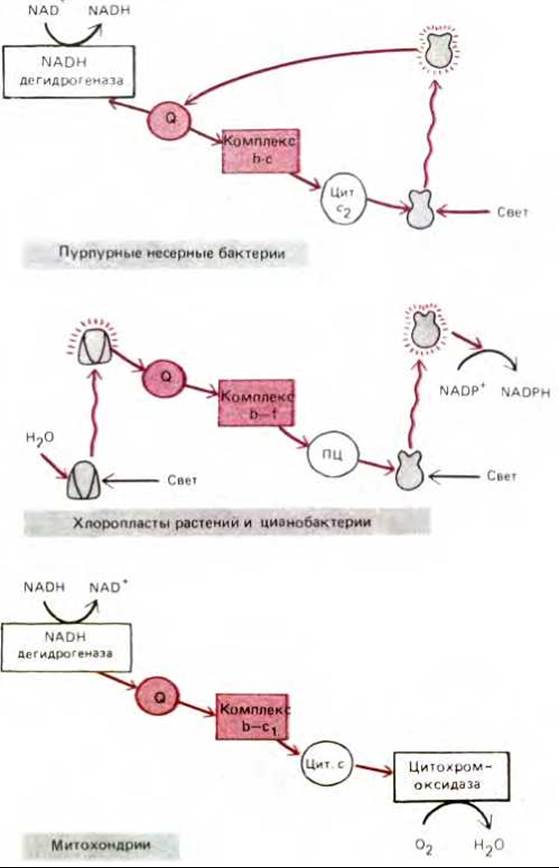
Рис. 7-63. Сравнительные схемы трех электронтранспортных цепей, подробно рассмотренных в этой главе. Бактерии и хлоропласты содержат связанный с мембраной ферментный комплекс, очень сходный с аналогичным комплексом b-c1 митохондрий. Все эти комплексы принимают электроны от хинона (Q) и перекачивают протоны через соответствующие мембраны. Более того, в системах, реконструированных in vitro, различные комплексы могут заменять друг друга, а анализ аминокислотных последовательностей их белковых компонентов показывает, что эти белки эволюционно родственны.
Размножение бактерий, использовавших в качестве источника углерода и восстановителей предобразованные органические молекулы, не могло продолжаться долго, так как этот источник пополнялся в результате геохимических процессов очень медленно. Истощение запасов сбраживаемых органических веществ, вероятно, привело к возникновению бактерий, способных создавать углеводы из СО2. Используя уже имевшиеся у них части электронтранспортной цепи, фотосинтезирующие бактерии улавливали с помощью своей единственной фотосистемы лучистую энергию и направляли ее на синтез NADPH, необходимый для фиксации углерода. Последующее появление более сложной фотосинтезирующей цепи переноса электронов у цианобактерий дало возможность использовать в качестве донора электронов при образовании NADPH воду,
а не другие более редкие доноры электронов, необходимые остальным фотосинтезирующим бактериям. При этом в результате распространения жизни на обширных пространствах снова аккумулировались восстановленные органические вещества. Кислород, высвобождаемый благодаря фотосинтезу цианобактерий, стал накапливаться в атмосфере примерно 2 млрд. лет назад. При обилии кислорода и органических молекул электронтранспортные цепи адаптировались для переноса электронов с NADH на кислород и у многих бактерий выработался эффективный аэробный метаболизм. Точно такой же аэробный метаболизм характерен для митохондрий эукариотических клеток, и уже есть убедительные данные в пользу того, что митохондрии и хлоропласты - это потомки аэробных бактерий, поглощенных примитивными эукариотическими клетками путем эндоцитоза.