Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Преобразование энергии: митохондрии и хлоропласты
Геномы митохондрий и хлоропластов
По мере роста и деления клеток в их цитоплазме должны образовываться новые органеллы. В неделящихся клетках тоже происходит непрерывное обновление органелл - вместо распадающихся образуются новые. Для этого требуется регулируемый синтез необходимых белков и липидов с последующей доставкой каждого компонента в надлежащий участок органеллы. В гл. 8 уже рассматривался перенос определенных белков и липидов, синтезированных вне органелл, в митохондрии и хлоропласты, а здесь речь пойдет о вкладе этих органелл в их собственный биосинтез.
В биосинтезе белков митохондрий и хлоропластов участвуют две различные генетические системы. Хотя большая часть этих белков кодируется ядерной ДНК и переходит в органеллу после того, как они были синтезированы на рибосомах цитозоля, некоторые белки кодируются собственной ДНК органеллы и синтезируются на рибосомах внутри самой органеллы. Видимо, перенос белков осуществляется только в одном направлении - из цитозоля в органеллы; во всяком случае такие белки, которые переходили бы в цитозоль из митохондрий или хлоропластов, не известны.

Рис. 7-64. Обобщенная схема синтеза белков, содержащихся в митохондриях и хлоропластах. Толстыми стрелками указаны места воздействия ингибиторов, специфически подавляющих белковый синтез либо в митохондриях, либо в цитозоле.
Участие двух генетических систем в образовании митохондрий и хлоропластов довольно точно согласовано (разд. 7.5.12). Однако эта согласованность не абсолютна, и изолированные органеллы продолжают некоторое время синтезировать в пробирке ДНК, РНК и белки, что позволяет установить, какие белки кодируются ДНК самой органеллы, а какие ядерной ДНК. Другой подход состоит в изучении действия специфических ингибиторов на интактную клетку. Например, циклогексимид ингибирует белковый синтез в цитозоле, но не влияет на синтез белка в митохондриях и хлоропластах. Некоторые другие антибиотики, такие как хлорамфеникол, тетрациклин и эритромицин, наоборот, подавляют синтез белка в энергетических органеллах, но не оказывают заметного влияния на его синтез в цитозоле (рис. 7-64). Подобные ингибиторы широко используются для изучения функций митохондрий и хлоропластов.
7-33
7.5.1. Число митохондрий и хлоропластов в клетке поддерживается путем их деления [46]
Митохондрии и хлоропласты никогда не возникают de novo, они всегда образуются путем деления уже существующих органелл. Как показывают наблюдения над живыми клетками, митохондрии не только делятся, но могут и сливаться друг с другом. Однако в среднем каждая органелла должна удвоить свою массу и затем разделиться пополам один раз за одну клеточную генерацию. Электронные микрофотографии дают основание полагать, что деление митохондрий начинается с образования кольцевой бороздки на внутренней мембране, подобно тому как это происходит при делении многих бактериальных клеток (рис. 7-65 и 7-66); таким образом, деление митохондрий - это, по-видимому, контролируемый процесс, а не случайное расщепление надвое.
В большинстве клеток энергопреобразующие органеллы делятся на протяжении всей интерфазы; таким образом, каждая из них делится независимо от остальных и от всей клетки. Точно так же репликация ДНК в органеллах происходит не только в период синтеза ядерной ДНК (S- фаза), но и в другие фазы клеточного цикла. Хотя, по-видимому, индивидуальные молекулы ДНК реплицируются случайным образом (так что в данном клеточном цикле одни могут удвоиться несколько раз, а другие ни разу), общее число их за каждый клеточный цикл удваивается, поддерживая постоянство количества этой ДНК в клетке.
Число энергетических органелл может регулироваться в зависимости от потребности клетки в энергии; например, значительное увеличение (в 5-10 раз) количества митохондрий наблюдается при многократном сокращении скелетной мышцы в течение длительного периода. Более того, в ряде случаев деление органелл регулируется клеткой: так, хлоропласты некоторых водорослей, содержащих только одну или несколько таких органелл, делятся непосредственно перед цитокинезом, причем в той же плоскости, в которой будет происходить очередное деление клетки (рис. 7-67). Но действующие при этом регуляторные механизмы на молекулярном уровне не изучены.
7.5.2. В большинстве случаев геномы хлоропластов и митохондрий представлены кольцевыми молекулами ДНК [47]
Молекулы ДНК органелл относительно просты, невелики и (за исключением митохондриальных геномов некоторых водорослей и простейших) замкнуты в кольцо. Размеры генома хлоропластов у всех исследованных организмов сходны, тогда как митохондриальные геномы у растений намного больше, чем у животных (табл. 7-2). У многих органелл молекулы ДНК по размерам близки к вирусным ДНК. Например, в митохондриях млекопитающих геном представлен кольцевой ДНК, содержащей около 16500 пар оснований (более чем в 10000 раз меньше ядерного генома). У столь различных животных, как дрозофила и морской еж, размеры митохондриальной ДНК почти одинаковы (рис. 7-68). У растений, однако, кольцевой геном митохондрий в 100-150 раз больше в зависимости от вида растения. Размеры самой большой из этих молекул ДНК примерно вдвое меньше, чем у бактериальной ДНК, которая тоже замкнута в кольцо.

Рис. 7-65. Схема деления митохондрии. Представленный здесь ход событий предполагают, основываясь на статичных изображениях, таких как микрофотография, приведенная на рис. 7-66.
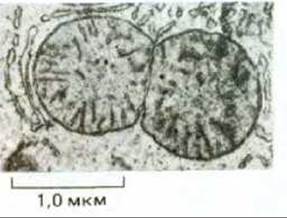
Рис. 7-66. Электронная микрофотография делящейся митохондрии из клетки печени. (С любезного разрешения Daniel S. Friend.)
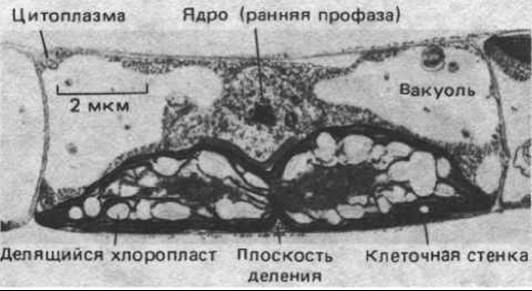
Рис. 7-67. У примитивной нитчатой водоросли Klebsormidium деление хлоропласта происходит в определенное время на ранней стадии митоза. В клетке имеется только один хлоропласт, и плоскость его деления совпадает с плоскостью последующего разделения клетки. (Из J. D. Pickett-Heaps, Cytobios, 1972, 6, 167-183.)
Все митохондрии и хлоропласты содержат по нескольку копий своей геномной ДНК (табл. 7-3). Эти молекулы ДНК обычно распределены в виде отдельных групп в матриксе митохондрий и в строме хлоропластов, где, как полагают, они прикреплены к внутренней мембране. Хотя способ упаковки ДНК неизвестен, геном по своей структуре, вероятно, сходен не с хроматином эукариот, а с бактериальным геномом. Например, как и у бактерий, здесь нет гистонов.
В клетках млекопитающих митохондриальная ДНК составляет меньше 1% всей клеточной ДНК. Однако в других клетках (например, в листьях высших растений или в очень крупных яйцах амфибий) доля ДНК энергетических органелл может быть намного больше (табл. 7-3); в них осуществляется также и большая доля всего клеточного синтеза РНК и белков.
Таблица 7-2. Размеры геномов органелл1)
|
Тип ДНК |
Размеры в тысячах пар нуклеотидов |
|
|
ДНК хлоропластов |
||
|
Высшие растения |
120-200 |
|
|
Chlamydomonas (зеленая водоросль) |
180 |
|
|
Митохондриальная ДНК |
||
|
Животные (включая плоских червей, насекомых и млекопитающих) |
16-19 |
|
|
Высшие растения |
150-2500 |
|
|
Грибы |
||
|
Schizosaccharomyces pombe (дрожжи) |
17 |
|
|
Aspergillus nidulans |
32 |
|
|
Neurospora crassa |
60 |
|
|
Saccharomyces cerevisiae (дрожжи) |
78 |
|
|
Chlamydomonas (зеленая водоросль) |
16 (линейная: молекула) |
|
|
Простейшие |
||
|
Trypanosoma brucei |
22 |
|
|
Paramecium |
40 (линейная: молекула) |
1) Эти геномы представлены кольцевыми молекулами ДНК, если не указано иное.
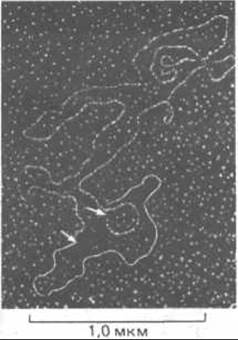
Рис. 7-68. Электронная микрофотография кольцевой ДНК из митохондрии млекопитающего во время репликации. Пока реплицировался только участок между двумя точками, указанными стрелками (цепи, выделенные белым цветом). (С любезного разрешения David Clayton.)
Таблица 7-3. Относительное количество ДНК органелл в некоторых клетках и тканях
|
Организмы |
Ткань или тип клеток |
Число молекул ДНК на 1 органеллу |
Число органелл в клетке |
Доля ДНК органелл во всей ДНК клетки, % |
|
Митохондриальная ДНК |
||||
|
Крыса |
Печень |
5-10 |
1000 |
1 |
|
Мышь |
Клетки линии L |
5-10 |
100 |
<1 |
|
Дрожжи * |
Вегетативные |
2-50 |
1-50 |
15 |
|
Лягушка |
клетки Яйцеклетка |
5-10 |
107 |
99 |
|
ДНК хлоропластов |
||||
|
Chlamydomonas |
Вегетативные клетки |
80 |
1 |
7 |
|
Кукуруза |
Листья |
20-40 |
20-40 |
15 |
7.5.3. Митохондрии и хлоропласты обладают полноценной генетической системой [48]
Несмотря на небольшое число белков, кодируемых генами митохондрий и хлоропластов, эти органеллы осуществляют репликацию и транскрипцию своей ДНК и белковый синтез. Эти процессы протекают в матриксе митохондрий и строме хлоропластов. Хотя белки, участвующие во всех этих процессах, специфичны для органелл, большая часть их кодируется ядерным геномом (разд. 7.5.17). Это тем более удивительно в связи с тем, что весь аппарат белкового синтеза в органеллах сходен с бактериальным, а не с эукариотическим. У хлоропластов это сходство особенно велико:
1. Рибосомы хлоропластов очень напоминают рибосомы Е. coli как по своей чувствительности к различным антибиотикам (хлорамфениколу, стрептомицину, эритромицину, тетрациклину и др.), так и по структуре. При этом не только поразительно сходны нуклеотидные последовательности рибосомных РНК хлоропластов и Е. coli, но рибосомы хлоропластов способны использовать тРНК бактерий при синтезе белка. Во всех этих отношениях рибосомы хлоропластов отличаются от рибосом, находящихся в цитозоле растительных клеток.
2. Синтез белка в хлоропластах начинается с N-формилметионина, как и у бактерий, а не с метионина, как в цитозоле эукариотических
клеток.
3. ДНК хлоропластов в отличие от ядерной ДНК может транскрибироваться с помощью РНК-полимеразы из Е. coli с образованием хлоропластных мРНК, которые эффективно транслируются белок-синтезирующей системой Е. coli.
Хотя у митохондрий генетические системы гораздо менее сходны с аналогичными системами современных бактерий, чем у хлоропластов, митохондриальные рибосомы тоже чувствительны к противобактериальным антибиотикам, а белковый синтез в митохондриях начинается с N-формилметионина.
7.5.4. Геном хлоропластов высших растений содержит около 120 генов [49]
Гены хлоропластов наиболее изучены у растений и зеленых водорослей, у которых эти органеллы очень сходны. Геном хлоропласта представляет собой кольцевую молекулу ДНК; в настоящее время определена его полная нуклеотидная последовательность у табака и одного печеночника. Полученные данные говорят о том, что гены хлоропластов этих очень отдаленно родственных высших растений практически идентичны. Помимо четырех рибосомных РНК эти геномы кодируют около 20 рибосомных белков, некоторые субъединицы хлоропластной РНК- полимеразы, несколько белков, входящих в состав фотосистем I и II, субъединицы АТР-синтетазы, части ферментных комплексов электронтранспортной цепи, одну из двух субъединиц рибулозобисфосфат-карбоксилазы и 30 тРНК (рис. 7-69). Кроме того, последовательность ДНК, по- видимому, кодирует еще по меньшей мере 40 белков с невыясненной функцией. Удивительно, что все известные белки, кодируемые в хлоропластах, входят в состав больших ферментных комплексов, которые содержат также одну или несколько субъединиц, кодируемых ядерным геномом. Возможные причины этого будут рассмотрены позже (разд. 7.5.17).
Поражает сходство хлоропластного и бактериального геномов. Основные регуляторные последовательности, такие как промоторы и терминаторы транскрипции, в обоих геномах фактически идентичны. Белки, кодируемые в хлоропластах, очень похожи на бактериальные, а некоторые группы генов с близкими функциями (например, кодирующие белки рибосом) организованы одинаково в геномах хлоропластов, Е. coli и цианобактерий.
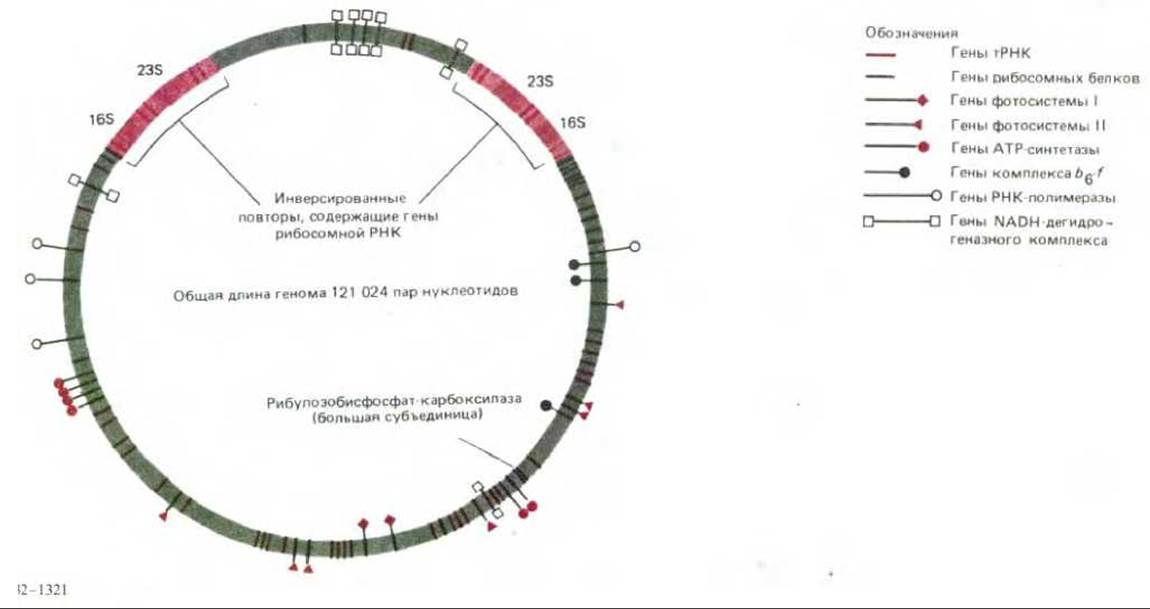
Рис. 7-69. Организация генома хлоропласта у печеночника. Для этого генома определена полная нуклеотидная последовательность. У всех высших растений организация хлоропластных геномов очень сходна, размеры кольцевой молекулы ДНК варьируют от вида к виду в зависимости от того, какая часть ДНК вокруг генов, кодирующих рибосомные РНК 16S и 23S, представлена двумя копиями.
Для того чтобы проследить цепь эволюции от бактерий до хлоропластов, потребуются детальные сравнения гомологичных нуклеотидных последовательностей, но некоторые выводы можно сделать уже сейчас:
1) хлоропласты высших растений произошли от фотосинтезирующих бактерий;
2) геном хлоропластов остается почти неизменным уже по меньшей мере несколько сот миллионов лет (именно столько лет назад, по-видимому, разошлись пути эволюции печеночников и табака);
3) многие из генов исходной бактерии можно сейчас идентифицировать в ядерном геноме, в который они были перенесены и сохранились до настоящего времени. Например, хотя у высших растений белки рибосом в хлоропластах родственны бактериальным белкам и сами эти рибосомы сходны с рибосомами бактерий, две трети из примерно 60 белков хлоропластных рибосом кодируются в ядре клетки.
7-34
7.5.5. Геном митохондрий имеет ряд поразительных особенностей [50]
Геном хлоропластов не был первым полностью расшифрованным геномом органелл. Первым оказался митохондриальный геном человека: относительно малые размеры сделали его особенно привлекательным объектом для молекулярных генетиков, вооруженных новейшей методикой секвенирования ДНК (см. разд. 4.6.6), и в 1981 г. была опубликована полная последовательность этого генома, состоящая из 16569 пар нуклеотидов. Сопоставляя ее с известными нуклеотидными последовательностями тРНК и частичными аминокислотными последовательностями белков, кодируемых генами митохондрий, удалось определить на кольцевой молекуле ДНК локализацию всех этих генов (рис. 7-70). По сравнению с геномами ядра, хлоропластов и бактерий митохондриальный геном человека имеет несколько поразительных особенностей:
1) здесь в отличие от других геномов практически каждый нуклеотид входит в состав кодирующей последовательности либо для белка, либо для одной из рРНК или тРНК. Поскольку эти кодирующие последовательности переходят непосредственно одна в другую, для регуляторных последовательностей ДНК остается очень мало места;
2) если в цитозоле имеется по меньшей мере 31 тРНК для различных аминокислот, а в хлоропластах - 30 тРНК, то в митохондриях для осуществления белкового синтеза используются всего 22 тРНК. В митохондриях обычные правила спаривания кодонов с антикодонами соблюдаются менее строго, и многие молекулы тРНК способны узнавать любой из четырех нуклеотидов в третьей (неоднозначной) позиции (разд. 5.1.6). Такое считывание «двух из трех» дает возможность одной тРНК связываться с любым из четырех различных кодонов и позволяет обходиться меньшим числом тРНК при синтезе белка;
3) сопоставление нуклеотидных последовательностей митохондриальных генов с аминокислотными последовательностями белков выявило, возможно, самую поразительную особенность: генетический код в митохондриях видоизменен, и значения четырех из 64 кодонов отличны от значений этих кодонов в других геномах (табл. 7-4).
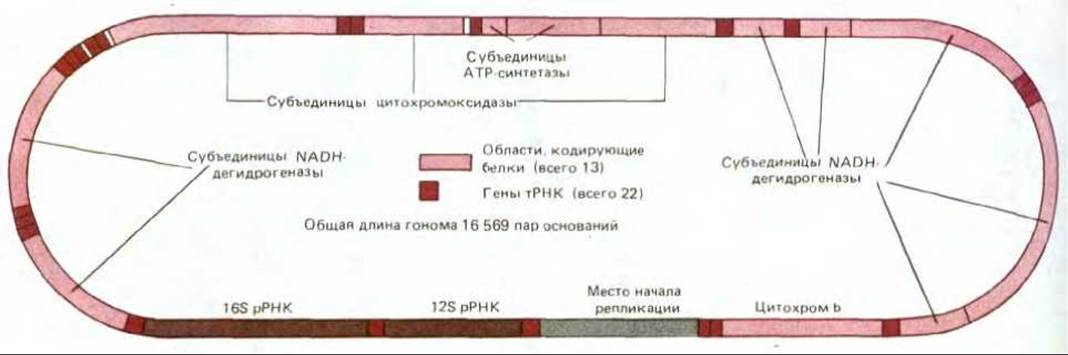
Рис. 7-70. Организация митохондриального генома человека, установленная в результате определения полной нуклеотидной последовательности ДНК. Геном содержит два гена рРНК, 22 гена тРНК и 13 участков, кодирующих белки. Определены также полные последовательности молекул ДНК митохондриальных геномов коровы и мыши, которые содержат те же гены и организованы сходным образом.
Таблица 7-4. Различия между «универсальным» кодом и митохондриальными генетическими кодами*
|
Кодон |
«Универсальный» код |
Митохондриальные коды |
|||
|
Млекопитающие |
Дрозофила |
Дрожжи |
Растения |
||
|
UGA |
STOP |
Тrр |
Тrр |
Тrр |
STOP |
|
AUA |
Ilе |
Met |
Met |
Met |
Ile |
|
CUA AGA |
Leu |
Leu |
Leu |
Thr |
Leu |
|
AGG |
Arg |
STOP |
Ser |
Arg |
Arg |
* Курсивом и цветом выделены значения кодонов, отличающиеся от «универсального» кода.
Почти полная идентичность генетического кода у всех организмов служит убедительным доводом в пользу того, что все клетки произошли от общего предшественника. Как же в этом случае объяснить некоторые отличия генетического кода митохондрий? Приблизиться к пониманию этого помогли недавно полученные данные о различии генетического кода в митохондриях разных организмов. Например, триплет UGA, служащий в универсальном коде стоп-кодоном, в митохондриях млекопитающих, грибов и простейших кодирует триптофан, но в митохондриях растений используется как стоп-кодон. Аналогичным образом триплет AGG, обычно кодирующий аргинин, в митохондриях млекопитающих обозначает сигнал "stop", а у дрозофилы кодирует серин (табл. 7-4). Подобные отклонения указывают на то, что в генетическом коде митохондрий могут происходить случайные перемены. Вероятно, возможность появления и закрепления в потомстве случайных изменений в значении кодона связана с необычайно малым числом белков, кодируемых митохондриальным геномом; в большом геноме подобные изменения привели бы к нарушению функции многих белков и, как следствие, к гибели клетки.
7.5.6. Митохондрии животных имеют самую простую из известных генетических систем [52]
Сравнение последовательностей ДНК у разных организмов показывает, что в митохондриальном геноме скорость замены нуклеотидов в процессе эволюции в 10 раз выше, чем в ядре, что, вероятно, объясняется снижением точности либо репликации, либо репарации митохондриальной ДНК, либо того и другого вместе. Поскольку в митохондриях животной клетки все РНК и белки образуются в результате репликации и экспрессии последовательности ДНК, состоящей всего лишь из 16500 нуклеотидов, вероятность ошибки на каждый считываемый нуклеотид в ходе репликации и репарации ДНК, транскрипции с помощью РНК-полимеразы и трансляции при синтезе белка на митохондриальной рибосоме может быть относительно высокой без вреда для органеллы. По-видимому, этим и объясняется, почему механизмы таких процессов относительно просты по сравнению с теми, которые используются клеткой для тех же целей вне органелл. Например, можно предположить (хотя это еще достоверно не установлено), что наличие всего только 22 тРНК и необычно малые размеры рРНК (менее 2/3 от их величины у Е. coli) снижают точность белкового синтеза в митохондриях.
Благодаря относительно быстрой эволюции митохондриальных генов сравнение последовательностей в их ДНК может быть особенно полезным для датирования таких недавних событий, как этапы эволюции приматов (см. разд. 1.2.2).
7-35
7.5.7. Почему у растений такой большой митохондриальный геном? [52]
У растений геном митохондрий значительно больше, чем в животных клетках, и содержание митохондриальной ДНК варьирует в широких пределах - примерно от 150000 до 2,5 млн. пар нуклеотидов. И тем не менее митохондриальный геном у растений, видимо, кодирует немногим больше белков, чем у животных. К этому можно еще добавить, что, например, внутри одного из семейств растений (тыквенных) размеры митохондриального генома различаются в семь раз; а линейный митохондриальный геном зеленой водоросли Chlamydomonas имеет такие же размеры, как и в животных клетках, и составляет 16000 пар нуклеотидов.
О последовательностях нуклеотидов в митохондриальной ДНК высших растений сведений очень мало, но секвенирован почти полностью большой (78 000 п. н.) митохондриальный геном дрожжей Saccharomyces cerevisiae, и оказалось, что только около трети его кодирует белки. Эти данные говорят о том, что, возможно, большая часть «избыточной» ДНК в митохондриях дрожжей (а может быть, и высших растений) не имеет существенного значения для организма.
7.5.8. Некоторые гены органелл содержат интроны [53]
В обеих детально изученных митохондриальных системах - человеческой и дрожжевой - важную роль играет процессинг РНК-предшественников. В клетках человека обе цепи митохондриальной ДНК транскрибируются с одинаковой скоростью от единственного промотора на каждой цепи, и при этом образуются две различные гигантские молекулы РНК, каждая из которых представляет собой полную копию одной цепи ДНК. Таким образом, транскрипция совершенно симметрична. Молекула РНК, транскрибированная с одной из цепей ДНК, которую называют тяжелой цепью (Н-цепью) из-за ее высокой плотности, выявляемой в градиенте CsCl, расщепляется нуклеазами, и в результате получаются две молекулы рРНК, большая часть митохондриальных тРНК и около десятка РНК, содержащих концевой поли(А). В отличие от этого процессинг РНК, транскрибированной с легкой цепи (L-цепи), приводит к образованию только восьми тРНК и одной малой РНК, содержащей поли(А). Остальные 90% нуклеотидов этого транскрипта, видимо, не несут полезной информации (будучи комплементарными кодирующей последовательности, синтезированной на другой цепи) и расщепляются. Как полагают, РНК, содержащие концевой поли(А), представляют собой митохондриальные мРНК; у них отсутствует «кэп» на 5'-конце, а 3'-концевой участок поли(А) содержит около 55 нуклеотидов. Этот полинуклеотидный хвост добавляется после транскрипции при участии митохондриальной поли-А-полимеразы.
В отличие от человека у некоторых растений и грибов (включая дрожжи) митохондриальные гены содержат интроны, которые должны быть удалены из транскрипта с последующим сплайсингом (разд. 3.2.7). У растений интроны обнаружены также примерно в 20 генах хлоропластов. Многие интроны в генах органелл содержат родственные нуклеотидные последовательности, которые могут исключаться из РНК-транскриптов в результате реакции, катализируемой самой РНК (разд. 9.4.14), хотя в этом «самосплайсинге» обычно участвуют и белки. Открытие интронов в генах органелл было неожиданным с точки зрения эндосимбиотической теории происхождения энергопреобразующих органелл, так как в генах бактерий, от предков которых могли произойти митохондрии и хлоропласты, интронов не обнаружено.
У дрожжей интроны могут иметься в митохондриальном гене одного штамма, но отсутствовать в том же гене другого штамма. По-видимому, такие «факультативные» интроны способны включаться в гены и выходить из них подобно транспозонам. С другой стороны, в некоторых митохондриальных генах дрожжей интроны занимают те же позиции, что и в митохондриях Aspergillus и Neurospora; значит, они были унаследованы от общего предка этих трех грибов. Вероятно, интроны имеют древнее происхождение, и хотя они были утрачены многими бактериями, они сохранились в геномах тех органелл, где регуляция сплайсинга РНК помогает контролировать экспрессию гена (разд. 10.5.5).
7-36
7.5.9. Неменделевское (цитоплазматическое) наследование митохондриальных генов позволяет отличать их от генов клеточного ядра [54]
По ряду причин большинство экспериментов по изучению механизмов биогенеза митохондрий проводится на культурах Saccharomyces carlsbergensis (пивные дрожжи) и S. cerevisiae (пекарские дрожжи). Во-первых, при росте на глюкозе эти дрожжи обнаруживают уникальную способность существовать только за счет гликолиза и поэтому могут обходиться без функционально активных митохондрий, т.е. без окислительного фосфорилирования. Это дает возможность работать с клетками, митохондриальная и ядерная ДНК которых несут мутации, препятствующие нормальному развитию митохондрий. Такие мутации летальны почти у всех организмов. Во-вторых, дрожжи - простые одноклеточные эукариоты - легко выращивать и подвергать биохимическим исследованиям. И наконец, у дрожжей, обычно размножающихся бесполым способом путем почкования (асимметричного митоза), встречается и половой процесс. При половом размножении две гаплоидные клетки сливаются, образуя диплоидную зиготу, которая затем либо делится путем митоза, либо претерпевает мейоз и снова дает гаплоидные клетки. Возможность контролировать в лабораторных условиях чередование бесполого и полового размножения (разд. 13.2) намного облегчает проведение генетического анализа. Такой анализ позволяет выявить гены, ответственные за функцию митохондрий, и установить, которые из них находятся в ядерной ДНК и которые - в митохондриальной, поскольку мутации митохондриальных генов не наследуются по законам Менделя, которым подчиняется наследование ядерных генов.
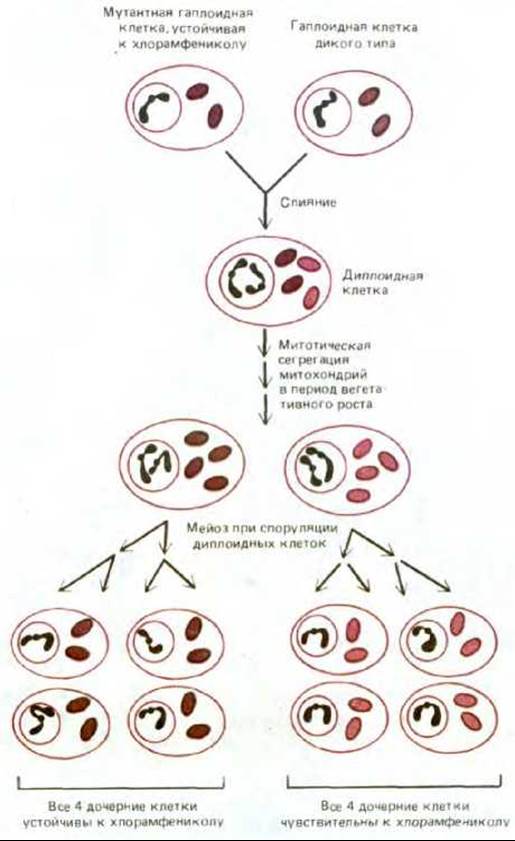
Рис. 7-71. Различие в схеме наследования митохондриальных и ядерных генов у дрожжей. Две дрожжевые клетки из четырех, образовавшихся в результате мейоза, получают тот или иной ядерный ген от одной гаплоидной родительской клетки, а две другие - от другой (менделевское наследование). В отличие от этого в результате постепенной митотической сегрегации митохондрий в период вегетативного роста (см. текст) вполне может случиться, что все четыре клетки, образовавшиеся при мейозе, получат митохондриальные гены только от одной из двух гаплоидных родительских клеток (неменделевское, или цитоплазматическое, наследование). В этом примере мутация митохондриального гена придает митохондриям устойчивость к хлорамфениколу - ингибитору белкового синтеза в энергопреобразующих органеллах и бактериях (разд. 5.1.15).
На рис. 7-71 приведен пример неменделевского (цитоплазматического) наследования митохондриальных генов в потомстве гаплоидных дрожжевых клеток. Мутантный ген придает белок-синтезирующей системе митохондрий устойчивость к хлорамфениколу; дрожжевые клетки, несущие такой ген, можно легко обнаружить, выращивая культуры в присутствии хлорамфеникола на таком субстрате, как глицерол, который нельзя использовать для гликолиза. В условиях блокады гликолиза АТР будет доставляться только функционально активными митохондриями, и поэтому на такой среде способны расти лишь клетки, обладающие устойчивыми к хлорамфениколу митохондриями. При слиянии гаплоидной клетки, устойчивой к хлорамфениколу, с гаплоидной клеткой дикого типа, чувствительной к этому антибиотику, образуется диплоидная зигота, содержащая смесь митохондрий как мутантного, так и дикого типа. Но если в результате митоза от зиготы отпочкуется диплоидная дочерняя клетка, то в нее перейдет лишь небольшая часть митохондрий. После нескольких митотических циклов в какой-то из новых клеток все митохондрии могут оказаться одинаковыми - либо мутантного, либо дикого типа. Поэтому все потомство такой клетки будет иметь генетически идентичные митохондрии. Такой случайный процесс, в результате которого образуется диплоидное потомство с митохондриальной ДНК только одного типа, называют митотической сегрегацией. Когда диплоидная клетка с одним типом митохондрий претерпевает мейоз, все четыре дочерние гаплоидные клетки получают одинаковые митохондриальные гены. Этот тип наследования называют неменделевским, или цитоплазматтеским, в отличие от менделевского наследования ядерных генов (рис. 7-71); он указывает на то, что изучаемый ген находится вне ядерных хромосом, т.е., вероятно, в органеллах цитоплазмы.
7.5.10. У многих организмов гены органелл наследуются по материнской линии [55]
Для некоторых организмов, в том числе и для человека, последствия цитоплазматической передачи генов более существенны, чем для дрожжей. У дрожжей сливающиеся две гаплоидные клетки имеют одинаковые размеры и вносят в зиготу одинаковое количество митохондриальной ДНК (рис. 7-71). Таким образом, у дрожжей митохондриальный геном наследуется от обоих родителей, вносящих равный вклад в генофонд потомства (хотя, как мы видели, спустя несколько генераций отдельные потомки нередко будут содержать митохондрии только одного из родительских типов). В отличие от этого у высших животных яйцеклетка вносит в зиготу намного больше цитоплазмы, чем спермий, а у некоторых животных спермин могут вообще не вносить цитоплазмы. Поэтому можно думать, что у высших животных митохондриальный геном будет передаваться только от одного родителя, а именно по материнской линии. Это было подтверждено в экспериментах с лабораторными животными двух линий, различающихся по типу митохондриальной ДНК. При скрещивании животных, несущих митохондриальную ДНК типа А, с животными типа В получается потомство, содержащее митохондриальную ДНК только материнского типа. Точно так же, если проследить распределение различных последовательностей митохондриальной ДНК в больших семьях, можно показать, что ДНК митохондрий и у человека наследуется по материнской линии.
Примерно у двух третей высших растений хлоропласты мужского родителя (они содержатся в пыльцевых зернах) не попадают в зиготу; таким образом, ДНК хлоропластов, так же как и митохондрий, наследуется по материнской линии. У других растений дефектные хлоропласты служат причиной пестролистности: в результате митотической сегрегации в процессе роста и развития растения смесь нормальных и дефектных хлоропластов разделяется, что приводит к образованию листьев с чередующимися зелеными и белыми участками; в зеленых участках содержатся нормальные хлоропласты, а в белых - дефектные.
7.5.11. Как показывает изучение мутантов "petite» у дрожжей, важнейшую роль в биогенезе митохондрий играет клеточное ядро
Ключевую роль в анализе биогенеза митохондрий сыграли генетические исследования на дрожжах. Ярким примером служит изучение мутантов с обширными делециями в митохондриальной ДНК, которая приводит к полному прекращению белкового синтеза в митохондриях. Не удивительно поэтому, что у таких мутантов отсутствуют «дышащие» митохондрии. Редко встречающаяся, но важная группа таких мутантов вообще не имеет митохондриальной ДНК. Так как при росте на среде с низким содержанием глюкозы такие мутанты образуют необычно мелкие колонии, всех мутантов с дефектными митохондриями называют цитоплазматическими мутантами petite.

Рис. 7-72. Электронные микрофотографии тонких срезов дрожжевых клеток; можно видеть строение нормальных митохондрий (А) и строение митохондрий у мутанта petite, у которого отсутствуют все белки, кодируемые митохондриальным геномом (Б). В последнем случае органелла состоит только из белков, кодируемых ядерным геномом. (С любезного разрешения Barbara Stevens.)
Хотя у мутантов petite нет митохондриального синтеза белка и поэтому они не образуют митохондрий, способных синтезировать АТР, тем не менее у них есть митохондрии с нормальной наружной мембраной, но с плохо развитыми кристами внутренней мембраны (рис. 7-72). В таких митохондриях имеются практически все митохондриальные белки, кодируемые ядерным геномом и переносимые в органеллу из цитозоля, в том числе ДНК- и РНК-полимеразы, все ферменты цикла лимонной кислоты и большинство белков внутренней мембраны. Это наглядно демонстрирует преобладающую роль ядерного генома в биогенезе митохондрий. Кроме того, ясно, что органеллы, способные делиться надвое, могут неопределенно долго воспроизводиться в цитоплазме пролиферирующих эукариотических клеток даже при полном отсутствии собственного генома. Многие биологи полагают, что таким же путем обычно воспроизводятся пероксисомы (разд. 8.5.2).
Что касается хлоропластов, то здесь ближайшими аналогами дрожжевых митохондриальных мутантов petite могут служить мутанты таких одноклеточных водорослей, как Euglena. Клетки, в которых отсутствует хлоропластный синтез белка, все же содержат хлоропласты и вполне жизнеспособны при наличии окисляемых субстратов. Однако если у высших растений развитие зрелых хлоропластов блокировано из-за отсутствия света (разд. 20.4.1), из-за дефектов их ДНК или ее полного отсутствия, то такие растения погибают, как только запасы питательных веществ истощаются.
7-37
7.5.12. Образование митохондрий и хлоропластов регулируется белками, кодируемыми ядерным геномом [57]
Генетические системы ядра и органелл должны координировать свое участие в построении митохондрий и хлоропластов. Общий контроль, несомненно, осуществляется ядром, поскольку у мутантов с блокированным синтезом белка в органеллах митохондрии и хлоропласты образуются в нормальных количествах, хотя и с нарушенной функцией. В некоторых из таких функционально дефектных органелл продолжается синтез ДНК и частично РНК, из чего следует, что все необходимые для этих процессов белки кодируются ядерными генами.
Ядро должно регулировать число митохондрий и хлоропластов в соответствии с потребностью клетки; ядро должно также контролировать количество белков, синтезируемых на рибосомах внутри органелл, чтобы поддерживать надлежащий баланс между участием ядра и органелл в биогенезе митохондрий и хлоропластов. Хотя эти регуляторные аспекты имеют ключевое значение для понимания гомеостаза эукариотических клеток, наши знания об этом недостаточны.
Ядерную регуляцию белкового синтеза в митохондриях интенсивно изучали на дрожжевых мутантах. У Saccharomyces cerevisiae было выделено множество мутантов с изменениями в ядерном (а также и в митохондриальном - см. разд. 7.5.9) геноме, не способных к образованию дышащих митохондрий. Каждый из этих ядерных мутантов petite имеет один дефектный белок, кодируемый ядерной ДНК и необходимый для функционирования митохондрий. Выращивая дрожжевые культуры на среде с мечеными аминокислотами и циклогексимидом, подавляющим синтез белков, кодируемых ядерными генами, можно установить, какое влияние оказывает каждая из таких ядерных мутаций на экспрессию митохондриальных генов. Оказалось, что мутации ядерных генов, кодирующих митохондриальные белки, непосредственно связанные с дыхательной функцией митохондрий (такие, как одна из субсединиц АТР-синтетазы или один из ферментов цикла лимонной кислоты), как и следовало ожидать, не влияют на белковый синтез в митохондриях. Мутации же тех генов ядра, в которых закодированы белки митохондриальных рибосом или субъединицы митохондриальной РНК-полимеразы, блокируют в митохондриях синтез всех белков.
К регуляторным процессам наибольшее отношение имеет третья группа ядерных мутантов petite, у которых отсутствуют или изменены один или несколько генных продуктов, кодируемых митохондриальной ДНК. В ядре дрожжевой клетки обнаружено более 50 таких генов, и некоторые из них, необходимые для экспрессии того или иного митохондриального гена, уже подвергнуты клонированию и охарактеризованы. Часть этих генов кодирует белки, которые, видимо, воздействуют прямо на определенную молекулу мРНК, повышая либо ее стабильность, либо эффективность ее использования в митохондриальном белковом синтезе. Продукты других генов участвуют в сплайсинге митохондриальной РНК и, следовательно, необходимы для экспрессии тех генов митохондрий, которые содержат интроны. Как полагают, оба типа ядерных генов участвуют в регуляции функций белков, кодируемых митохондрией, в соответствии с метаболическими потребностями клетки, однако механизмы этой регуляции не известны.
Хотя главная роль и принадлежит ядру, есть данные о том, что взаимодействие генетических систем ядра и митохондрий происходит в обоих направлениях. Например, если в интактной клетке блокировать митохондриальный синтез белка, то будет наблюдаться повышенное образование переносимых в органеллу ферментов, участвующих в синтезе митохондриальных ДНК, РНК и белков, как будто клетка пытается преодолеть эту блокаду. Природу сигнала, посылаемого от митохондрий к ядру, еще предстоит выяснить.
7.5.13. Энергопреобразующие органеллы содержат тканеспецифические белки [58]
Клетка регулирует функции митохондрий и более обычными способами. У млекопитающих главным метаболическим путем переработки азотсодержащих продуктов обмена служит цикл мочевины. Образующаяся при этом мочевина выводится с мочой. Ферменты, кодируемые ядерным геномом, катализируют несколько этапов этого цикла в митохондриальном матриксе. Мочевина образуется лишь в некоторых органах, таких как печень, и ферменты цикла мочевины синтезируются и переходят в митохондрии только в этих органах. Кроме того, дыхательные ферментные комплексы, входящие в состав внутренней митохондриальной мембраны, у млекопитающих содержат несколько тканеспецифических субъединиц, которые кодируются ядром и, вероятно, действуют как регуляторы переноса электронов. Например, у некоторых людей с наследственным заболеванием мышц одна из субъединиц цитохромоксидазы дефектна; поскольку эта субъединица специфична для скелетных мышц, волокна сердечной мышцы у этих людей функционируют нормально, что позволяет таким больным выживать. Как и следовало ожидать, тканеспецифические различия свойственны и хлоропластным белкам, кодируемым ядерными генами.
Рассмотрим теперь, каким образом специфические цитоплазматические белки переносятся в митохондрии и хлоропласты; более детально этот вопрос обсуждается в гл. 8.
7.5.14. Перенос белков в митохондрии и хлоропласты требует затраты энергии [59]
Большая часть белков, содержащихся в митохондриях и хлоропластах, импортируется этими органеллами из цитозоля (разд. 8.4). В связи с этим возникают два вопроса: как клетка направляет белки к надлежащей органелле и каким образом эти белки проникают в нее?
Частичный ответ был получен при изучении транспорта малой субъединицы (S) рибулозобисфосфат-карбоксилазы в строму хлоропласта. Если мРНК, выделенную из цитоплазмы одноклеточной водоросли Chlamydomonas или из листьев гороха, ввести в качестве матрицы в белок-синтезирующую систему in vitro, то одним из многих образующихся белков будет предшественник S-белка, называемый про-S, который больше S на 50 аминокислотных остатков. При инкубации белка про-S с интактными хлоропластами он проникает в органеллы и превращается там под действием эндопептидазы в S-белок. Затем этот S-белок связывается с большой субъединицей рибулозобисфосфат-карбоксилазы, синтезируемой на рибосомах хлоропласта, и образует с нею в строме активный фермент. Перенос белка про-S в хлоропласт, как и следовало ожидать для процессов этого типа, требует затраты энергии, которую доставляет гидролиз АТР (разд. 8.4.7).
Сходным образом осуществляется и транспорт белков внутрь митохондрий. Если очищенные митохондрии дрожжей инкубировать с клеточным экстрактом, содержащим только что синтезированные радиоактивные дрожжевые белки, то можно наблюдать, что митохондриальные белки, кодируемые ядерным геномом, избирательно включаются в митохондрии - точно так же, как это происходит в интактной клетке. При этом белки наружной и внутренней мембран, матрикса и межмебранного пространства находят свой путь к соответствующему компартменту митохондрии (см. рис. 8-30).
По-видимому, транспорт белков через мембраны митохондрий и хлоропластов происходит в специальных контактных зонах, где внутренняя и наружная мембраны соединяются (рис. 7-73). Белки приходят сюда в форме предшественников, содержащих особый сигнальный пептид. Для того чтобы транспортируемый белок мог быть перенесен в органеллу в такой зоне, его пептидная цепь должна развернуться (см. разд. 8.4.4).
7.5.15. Хлоропласты сами синтезируют большую часть своих липидов, а митохондрии в основном получают их из цитозоля [60]
Помимо нуклеиновых кислот и белков для построения новых митохондрий и хлоропластов нужны липиды. Все необходимые хлоропластам липиды обычно образуются в самих органеллах. В листьях шпината, например, синтез всех жирных кислот клетки происходит в хлоропластах, и только образование ненасыщенных связей в их молекулах - в других местах. Даже важнейшие гликолипиды хлоропластов образуются в них самих.
В отличие от этого митохондрии получают большую часть своих липидов извне. В животных клетках фосфолипиды фосфатидилхолин и фосфатидилсерин синтезируются в эндоплазматическом ретикулуме и затем переходят в наружную мембрану митохондрий. Полагают (хотя это еще не доказано), что в процессе переноса участвуют специальные белки (разд. 8.6.15), а затем липиды включаются во внутреннюю мембрану - по-видимому, в местах контакта двух мембран. Помимо декарбоксилирования получаемого извне фосфатидилсерина до фосфатидилэтаноламина, митохондрии сами катализируют превращение приносимых в органеллу липидов в кардиолипин. Кардиолипин представляет собой «двойной» фосфолипид, содержащий четыре остатка жирной кислоты; этот липид содержится главным образом во внутренней мембране митохондрии, где составляет около 20% всех липидов.
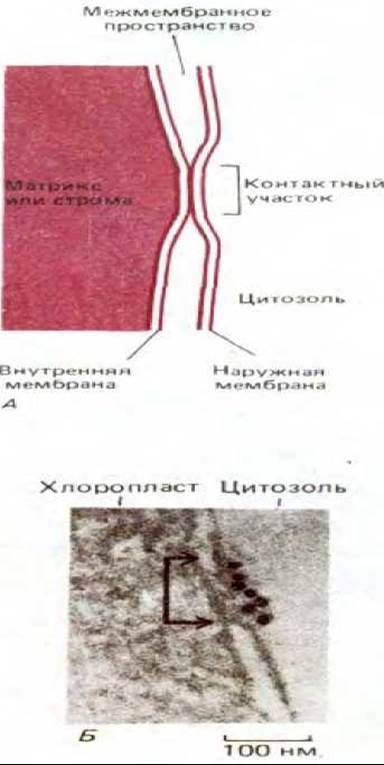
Рис. 7-73. Контактные участки. А. Схематическое изображение небольшой части митохондрии или хлоропласта, содержащей контактную область мембраны. Видимо, такие области участвуют в избирательном переносе белков в органеллу. Недавно контактные участки (называемые также контактными зонами) были выделены, и их специфические белковые компоненты в настоящее время изучаются. Через эти зоны переносятся белки, кодируемые клеточным ядром и синтезируемые в цитозоле. Б. Электронная микрофотография небольшого участка хлоропласта гороха, в котором контактная область (показана стрелками) помечена коньюгатами антител с золотом, которые, как полагают, связываются интегральным мембранным белком, участвующим в транспорте белков. (Из D. Pain, J. S. Kanwar, G. Blobel, Nature, 331, 232-237, 6, 1988.)
7-38
7.5.16. Митохондрии и хлоропласты, вероятно, произошли от эндосимбиотических бактерий [61]
Как уже говорилось в гл. 1, «прокариотический» характер генетической системы органелл, особенно ярко выраженный у хлоропластов, позволяет предполагать, что митохондрии и хлоропласты произошли от бактерий, некогда поглощенных путем эндоцитоза. Согласно этой эндосимбиотической гипотезе, клетки эукариот в начале своего эволюционного пути были анаэробными организмами без митохондрий и хлоропластов, а затем вступили в прочный симбиоз с бактериями и приспособили их систему окислительного фосфорилирования для своих нужд (рис. 7-74). Полагают, что событие, приведшее к появлению митохондрий, произошло 1,5 млрд. лет назад, когда в атмосферу поступило значительное количество кислорода, еще до разделения линий животных и растений (см. рис. 7-61). Вероятно, хлоропласты растений и водорослей появились позднее в результате другого эндосимбиоза, когда клеткой были захвачены фотосинтезирующие бактерии, выделяющие молекулярный кислород. Обычно предполагают, что произошло по меньшей мере три независимых события этого рода, так как тогда можно было бы объяснить различие пигментов и других особенностей у современных высших растений и у зеленых, бурых и красных водорослей (см. рис. 7-62).
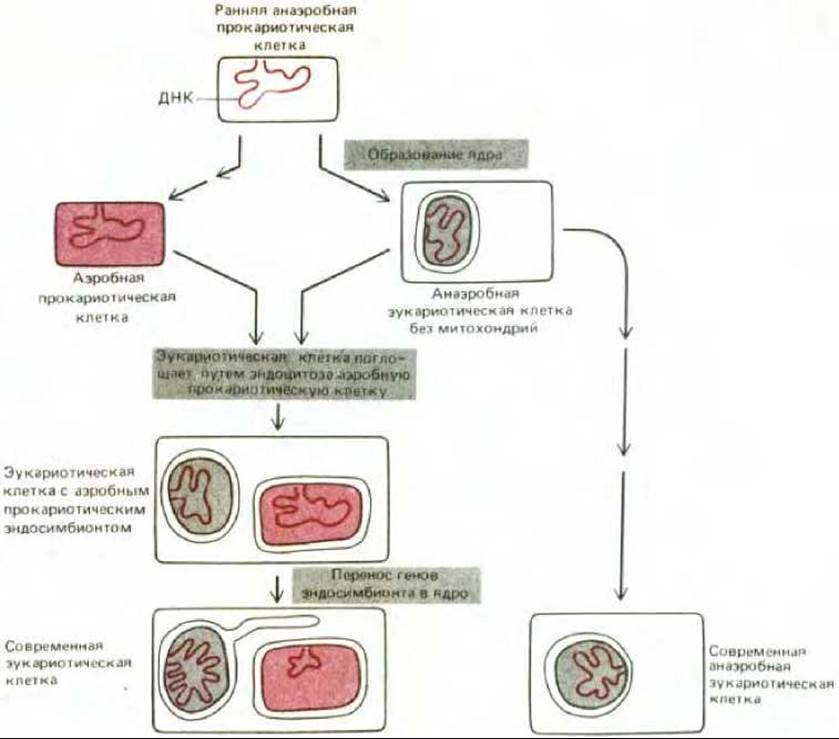
Рис. 7-74. Предполагаемый путь эволюционного происхождения митохондрий (выделены цветом). Иногда считают, что все митохондрии произошли от одного и того же предка, однако митохондрии таких эволюционно далеких друг от друга форм, как трипаносомы и эвгленовые (см. рис. 1-16), могли возникнуть в результате независимых эндосимбиозов. Микроспоридии (Microsporidia, Protozoa) - современные анаэробные одноклеточные эукариоты, обитающие в кишечнике многих животных, не имеют митохондрий. Поскольку анализ нуклеотидной последовательности рРНК этих микроорганизмов показал, что в эволюционном отношении они очень далеки от всех других известных эукариот, предполагают, что предки микроспоридий тоже были анаэробами и были сходны с тем эукариотическим организмом, который впервые поглотил предка митохондрий (разд. 1.2.6).
Так как большинство генов, кодирующих белки современных митохондрий и хлоропластов, находится в ядерном геноме, можно думать, что в ходе эволюции эукариот значительная часть генов органелл была перенесена в ядерную ДНК. Это позволило бы объяснить, почему некоторые из ядерных генов, кодирующих митохондриальные белки, сходны с генами бактерий. Так, например, у курицы N-концевая аминокислотная последовательность митохондриального фермента супероксиддисмутазы гораздо больше похожа на соответствующий сегмент супероксиддисмутазы бактерий, чем на N-концевой участок того же фермента, выделенного из цитозоля тех же эукариотических клеток. Еще одним указанием на то, что подобные переносы участков происходили в ходе эволюции, служат обнаруженные в ядерном геноме некодирующие последовательности ДНК, имеющие, вероятно, недавнее митохондриальное происхождение; очевидно, что эти последовательности были интегрированы в ядерный геном как «балластная» ДНК.
Какой же тип бактерий дал начало митохондриям? Расшифровка полной аминокислотной последовательности и трехмерный рентгеноструктурный анализ цитохромов типа с из различных бактерий выявили близкое сходство этих белков между собой и с цитохромом с дыхательной цепи митохондрий растительных и животных клеток. На основе этих и других биохимических данных было предложено эволюционное древо, изображенное на рис. 7-62. По-видимому, митохондрии произошли от особого рода пурпурных фотосинтезирующих бактерий, которые утратили способность к фотосинтезу и сохранили только дыхательную цепь. Однако до сих пор не ясно, все ли митохондрии (так же как и хлоропласты) возникли в результате одного единственного случая эндосимбиоза. Хотя митохондрии простейших имеют отчетливо выраженные прокариотические свойства, некоторые из них достаточно отличаются от митохондрий растительных и животных клеток, чтобы можно было предположить их независимое происхождение.
7.5.17. Для чего митохондриям и хлоропластам собственная генетическая система? [62]
Почему митохондриям и хлоропластам необходима собственная генетическая система, тогда как другие органеллы, например пероксисомы и лизосомы, ее не имеют? Этот вопрос совсем не тривиален, так как поддержание отдельной генетической системы дорого обходится клетке: специально для этих целей в ядерном геноме должно быть закодировано более 90 белков, в том числе много рибосомных белков, аминоациал-тРНК-синтетазы, ДНК- и РНК-полимеразы, ферменты процессинга и модификации РНК (рис. 7-75). Большинство изученных белков из митохондрий и хлоропластов отличаются по аминокислотной последовательности от своих аналогов из других частей клетки, и есть основание полагать, что в этих органеллах сравнительно мало таких белков, которые могли бы встретиться еще где-нибудь. Это означает, что только для поддержания генетической системы каждого вида энергетических органелл в ядерном геноме должно быть не менее 90 дополнительных генов. Причины такого «расточительства» неясны, и надежда на то, что разгадка будет найдена в нуклеотидных последовательностях митохондриальной ДНК, не оправдалась. Трудно представить себе, почему образующиеся в митохондриях белки должны непременно синтезироваться там, а не в цитозоле.
Одно время предполагалось, что некоторые из синтезируемых внутри органеллы белков слишком гидрофобны, чтобы пройти сквозь ее мембрану из цитозоля. Однако полученные позже данные показали, что такое объяснение неправдоподобно. Во многих случаях даже высоко-гидрофобные субъединицы синтезируются в цитозоле. Более того, хотя отдельные белковые субъединицы различных митохондриальных ферментных комплексов весьма консервативны в ходе эволюции, места их синтеза изменяются. Различную локализацию генов, кодирующих субъединицы функционально эквивалентных белков у разных организмов, трудно объяснить с помощью какой бы то ни было гипотезы, постулирующей какие-то эволюционные преимущества современных генетических систем митохондрий и хлоропластов.

Рис. 7-75. Белки, синтезируемые в цитозоле и переносимые затем в митохондрию, не только составляют основную часть всех белков органеллы, но и играют важную роль в митохондриальной системе белкового синтеза. Из компонентов этой системы сама митохондрия синтезирует только мРНК, рРНК и тРНК.
Возможно, генетические системы этих органелл представляют собой эволюционный тупик. В рамках эндосимбиотической гипотезы это означает, что процесс переноса генов эндосимбионта в ядерный геном хозяина прекратился раньше, чем был завершен; может быть, в случае митохондрий эта остановка была результатом сравнительно недавних изменений в генетическом коде митохондрий. Такие изменения, вероятно, сделали бы оставшиеся митохондриальные гены функционально неактивными в случае их переноса в ядро.
Заключение
Рост и деление митохондрий и хлоропластов контролируются двумя отдельными генетическими системами: геномом самой органеллы и ядерным геномом. Большая часть белков этих органелл закодирована в ядерной ДНК, синтезируется в цитозоле и затем переходит в органеллу. Однако некоторые белки митохондрий и хлоропластов и все их РНК кодируются в ДНК самих органелл и в них же синтезируются. Геном митохондрий человека содержит около 16500 пар нуклеотидов и кодирует 2 рибосомные РНК, 22 транспортные РНК и 13 различных полипептидных цепей. Геном хлоропластов примерно в 10 раз больше генома митохондрий человека и содержит около 120 генов. Однако преобладающая роль в биогенезе органелл обоих типов принадлежит ядру: это подтверждается тем, что даже у таких мутантов, у которых отсутствует функционирующий геном органелл, частично функционирующие органеллы образуются в нормальном количестве.
Рибосомы хлоропластов очень сходны с бактериальными рибосомами, тогда как рибосомы митохондрий несколько больше отличаются от последних; поэтому проследить происхождение митохондрий сложнее. Однако сходство между белками дает основание предполагать, что те. и другие органеллы произошли от бактерий, вступивших в устойчивый симбиоз (в качестве эндосимбионтов) с какими-то примитивными эукариотическими клетками; как полагают, митохондриям дали начало пурпурные бактерии, а хлоропластам (позднее) - цианобактерии или близкие к ним организмы. Хотя многие гены этих древних бактерий все еще используются для синтеза белков органеллы, большая их часть по неясным причинам включилась в ядерный геном, где они кодируют ферменты, которые сходны с бактериальными и синтезируются на рибосомах в цитозоле, а затем переходят в органеллу.
Литература
Общая
Becker W.M. The World of the Cell, pp. 117-284. Menlo Park CA, Benjamin-Cummings, 1986.
Ernster L. ed. Bioenergetics. New York, Elsevier, 1984.
Harold F. M. The Vital Force: A Study of Bioenergetics. New York, W. H. Freeman, 1986.
Lehninger A.L. Principles of Biochemistry, Chapters 16, 17, 23. New York, Worth, 1982.
Nicholls D. G. Bioenergetics: An Introduction to the Chemiosmotic Theory. New York, Academic Press, 1982.
Stryer L. Biochemistry, 3rd ed., Chapters 16, 17 and 22. New York, W. H. Freeman, 1988.
Цитируемая
1. Ernster L., Schatz G. Mitochondria: a historical review. J. Cell Biol., 91, 227s-255s, 1981.
Fawcett D. W. The Cell, 2nd ed., pp. 410-485. Philadelphia, Saunders, 1981.
Harold F. M. The Vital Force: A Study of Bioenergetics, Chapter 7. New York, W.H. Freeman, 1986.
Tzagoloff A. Mitochondria. New York, Plenum, 1982.
2. DePierre J. W., Ernster L. Enzyme topology of intracellular membranes. Annu. Rev. Biochem., 46, 201-261, 1977.
Srere P. A. The structure of the mitochondrial inner membrane-matrix compartment. Trends Biochem. Sci., 7, 375-378, 1982.
3. Krstic R. V. Ultrastructure of the Mammalian Cell, pp. 28-57. New York, Springer-Verlag, 1979.
Pollak J. K., Sutton R. The differentiation of animal mitochondria during development. Trends Biochem. Sci., 5, 23-27, 1980.
4. Geddes R. Glycogen: a metabolic viewpoint. Biosci. Rep., 6, 415-428, 1986.
McGilvery R. W. Biochemistry: A Functional Approach, 3rd ed. Philadelphia, Saunders, 1983.
Newsholme E.A., Start C. Regulation in Metabolism. New York, Wiley, 1973.
5. Baldwin J.E., Krebs H. The evolution of metabolic cycles. Nature, 291, 381-382, 1981.
Krebs H. A. The history of the tricarboxylic acid cycle. Perspect Biol. Med., 14, 154-170, 1970.
Reed I. J., Damuni Z., Merryfleld M. L. Regulation of mammalian pyruvate and branched-chain a-keto acid dehydrogenase complexes by phosphorylation-dephosphorylation. Curr. Top. Cell Regul., 27, 41-49, 1985. Williamson J. R., H. Cooper R. H. Regulation of the citric acid cycle in mammalian systems. FEBS Lett., Suppl. 117, K73-K85, 1980.
6. Mitchell P. Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. Nature, 191, 144-148, 1961.
Racker E. From Pasteur to Mitchell: a hundred years of bioenergetics. Fed. Proc., 39, 210-215, 1980.
7. Hatefi Y. The mitochondrial electron transport and oxidative phosphorylation system. Annu. Rev. Biochem., 54, 1015-1070. 1985.
8. Nicholls D. G. Bioenergetics: An Introduction to the Chemiosmotic Theory, Chapter 3. New York, Academic Press, 1982.
Wood W. В., Wilson J. H., Benbow R. M., Hood L. E. Biochemistry: A Problems Approach, 2nd ed. Menlo Park CA, Benjamin-Cummings 1981. (See problems, Chapter 9, 12 and 14).
9. Al-Awgati A. Proton-translocating ATPase. Annu. Rev. Cell Biol, 2, 179-199, 1986.
Hinkle P. C, McCarty R.E. How cells make ATP. Sci. Am., 283(3), 104-123, 1978.
10. Durand R., Briand Y., Touraille S., Alziari S. Molecular approaches to phosphate transport in mitochondria. Trends Biochem. Sci., 6, 211-214, 1981.
Klingenberg M. The ADP, ATP shuttle of the mitochondrion. Trends Biochem. Sci., 4, 249-252, 1979.
LaNoue K. F., Schoolwerth A. C. Metabolite transport in mitochondria. Annu. Rev. Biochem., 48, 871-922, 1979.
11. Eisenberg D., Crothers D, Physical Chemistry with applications to the Life Sciences, Chapters 4 and 5. Menlo Park CA, Bemjamin-Cummings, 1979.
12. Hatefi Y. The mitochondrial electron transport and oxidative phosphorylation system. Annu. Rev. Biochem., 54, 1015-1069, 1985.
Wikstrom M., Saraste M. The mitochondrial respiratory chain. In: Bioenergetics (L. Ernster ed.), pp. 49-94. New York, Elsevier, 1984.
13. Racher E. A New Look at Mechanisms in Bioenergetics. New York, Academic Press, 1976. (A personal account of the concepts and history).
14. Awzel L. M., McKinney M., Narayanan P., Pedersen P. L. Structure of the mitochondrial F1 ATPase at 9-А resolution. Proc. Natl. Acad. Sci. USA, 79, 5852-5856, 1982.
Futai M., Kanazawa H. Structure and function of protontranslocating adenosine triphosphatase (F0F1): biochemical approaches. Microbiol. Rev., 47, 285-312, 1983.
Racker E., Stoeckenius W. Reconstruction of purple membrane vesicles catalyzing light-driven proton uptake and adenosine triphosphate formation. J. Biol. Chem., 249, 662-663, 1974.
Schneider E., Altendorf K. The proton-translocating portion (F0) of the E. coli. ATP synthase. Trends.Biochem. Sci., 9, 51-53, 1984.
15. Hammes G. G. Mechanism of ATP synthesis and coupled proton transport: studies with purified chloroplast coupling factor. Trends Biochem. Sci., 8, 131-134, 1983.
Ogawa S., Lee Т. М. The relation between the internal phosphorylation potential and the proton motive force in mitochondria during ATP synthesis and hydrolysis. J. Biol. Chem., 259, 10004-10011, 1984.
Pederson P. L., Carafoli E. Ion motive ATPases. II. Energy coupling and work output. Trends Biochem. Sci., 12, 186-189, 1987.
Senior A. E. ATP synthesis by oxidative phosphorylation. Physiol. Rev., 68, 177-231, 1988.
16. Fillingame R. H. The proton-translocating pumps of oxidative phosphorylation. Annu. Rev. Biochem., 49, 1079-1113, 1980.
17. Chance В., Williams G.R. A method for the localization of sites for oxidative phosphorylation. Nature, 176, 250-254, 1955.
Dickerson R. E. The structure and history of an ancient protein. Sci. Am., 226(4), 58-72, 1972. (The conformation and evolution of cytochrome c).
Keilin D. The History of Cell Respiration and Cytochromes. Cambridge U. K., Cambridge University Press, 1966.
Spiro T.G. ed. Iron-Sulfur Proteins. New York, Wiley-Interscience, 1982.
18. Capaldi R.A., Darley-Usmar V., Fuller S., Millet F. Structural and functional features of the interaction of cytochrome с with complex III and cytochrome с oxidase. FEBS Lett., 138, 1-7, 1982.
Casey R. P. Membrane reconstruction of the energy-conserving enzymes of oxidative phosphorylation. Biochim. Biophys. Acta, 768, 319-347, 1984.
Leonard K., Haiker H., Weiss H. Three-dimensional structure of NADH: ubiquinone reductase (complex I) from Neurospora mitochondria determined by electron microscopy of membrane crystals. J. Mol. Biol., 194, 277-286, 1987.
Weiss H., Linke P., Haiker H., Leonard K. Structure and function of the mitochondrial ubiquinol: cytochrome с reductase and NADH: ubiquinone reductase. Biochem. Sci. Trans., 15, 100-102, 1987.
19. Hackenbrock C.R. Lateral diffusion and electron transfer in the mitochondrial inner membrane. Trends Biochem. Soc. Trans., 15, 151-154, 1981.
20. Dutton P. L., Wilson D. F. Redox potentiometry in mitochondrial and photosynthetic bioenergetics. Biochim. Biophys. Acta, 346, 165-212, 1974.
Hamamoto Т., Carrasco N., Matsushita K., Kabak H. R., Montal M. Direct measurement of the electrogenic activity of D-type cytochrome oxidase from E. coli reconstituted into planar lipid bilayers. Proc. Natl. Acad. Sci. USA, 82, 2570-2573, 1985.
Lehninger A. L. Bioenergetics: The Molecular Basis of Biological Energy Transformations, 2nd ed. Menlo Park CA, Benjamin-Cummings, 1971.
21. Prince R.C. The proton pump of cytochrome oxidase. Trends Biochem. Sci., 13, 159-160, 1988.
Slater Е. С. The Q Cycle, an ubiquitous mechanism of electron transfer. Trends Biochem. Sci., 8, 239-242, 1983.
22. Hanstein W. G. Uncoupling of oxidative phosphorylation. Trends Biochem. Sci., 1, 65-67, 1976.
23. Brand M. D., Murphy M. P. Control of electron flux through the respiratory chain in mitochondria and cells. Biol. Rev. Cambridge Philosophic. Soc., 62, 141-193, 1987.
Erecinska A., Wilson D. F. Regulation of cellular energy metabolism. J. Membr. Biol., 70, 1-14, 1982.
Racker E. A New Look at Mechanisms in Bioenergetics. New York. Academic Press, 1976.
24. Klinyerberg M. Principles of carrier catalysis elucidated by comparing two similar membrane translocators from mitochondria, the ADP/ATP carrier and the uncoupling protein. Ann. N. Y. Acad. Sci., 456, 279-288, 1985.
Nicholls D.G., RialE. Brown fat mitochondria. Trends Biochem. Sci., 9, 489-491, 1984.
25. Gottskalk G. Bacterial Metabolism, 2nd ed. New York, Springer-Verlag, 1986.
MacNab R.M. The bacterial flagellar motor. Trends Biochem. Sci., 9, 185-189, 1984.
Neidhardt F. C. et al, eds. Escherichia coli and Salmonella typhimurium: Cellular and Molecular Biology. Washington DC, American Society for Microbiology, 1987.
Skulachev V.P. Sodium bioenergetics. Trends Biochem. Sci., 9, 483-485, 1984.
Thauer R., Jungermann K., Decker K. Energy conservation in chemotrophic anaerobic bacteria. Bacteriol. Rev., 41, 100-180, 1987.
26. Bogorad L. Chloroplasts. J. Cell. Biol., 91, 256s-270s, 1981. (A historical review).
Clayton R. K. Photosynthesis: Physical Mechanisms and Chemical Patterns. Cambridge U.K., Cambridge University Press 1980 (Excellent general treatment).
Haliwell B. Chloroplast Metabolism - The Structure and Function of Chloroplasts in Green Leaf Cells. Oxford U.K., Clarendon, 1981.
Hoober J.K. Chloroplasts. New York, Plenum, 1984.
27. Cramer W.A., Widger W.R., Herrmann R.G., Trebst A. Topography and function of thylakoid membrane proteins. Trends Biochem. Sci., 10, 125-129, 1985.
Miller K.R. The photosynthetic membrane. Sci. Am., 241(4), 102-113, 1979.
28. Akazawa Т., Takabe Т., Kobayashi H. Molecular evolution of ribulose-l,5-bisphos-phate carboxylase/oxygenase (RuBisCO). Trends Biochem. Sci., 9, 380-383, 1984.
Barber J. Structure of key enzyme refined. Nature, 325, 663-664, 1987.
Lorimer G.H. The carboxylation and oxygenation of ribulose-1,5-biphosphate: the primary events in photosynthesis and photorespiration. Annu. Rev. Plant Physiol., 32, 349-383, 1981.
29. Bassham J.A. The path of carbon in photosynthesis. Sci. Am., 206(6), 88-100, 1962.
Preiss J. Starch, sucrose biosynthesis and the partition of carbon in plants are regulated by orthophosphate and triose-phosphates. Trends Biochem. Sci., 9, 24-27, 1984.
30. Bjorkman J., Berry J. High-efficiency photosynthesis. Sci. Am. 229(4), 80-93, 1973. (C4 plants).
Cholelet R. The biochemistry of photorespiration. Trends Biochem. Sci., 2,155-159, 1977.
Edwards G., Walker D. С3, С4 Mechanisms, and Cellular and Environmental Regulation of Photosynthesis. Berkeley, University of California Press, 1983.
Heber U., Krause G.H. What is the physiological role of photorespiration? Trends Biochem. Sci., 5, 32-34, 1980.
31. Clayton R. К. Photosynthesis: Physical Mechanisms and Chemical Patterns. Cambridge U.K., Cambridge University Press 1980.
Parson W. W. Photosynthesis and other reactions involving light. In: Biochemistry (G. Zubay ed.), 2nd ed., pp. 564-597. New York, Macmillan, 1988.
32. Barber J. Photosynthetic reaction centres: a common link. Trends Biochem. Sci., 12, 321-326, 1987.
Govindjee, Govindjee R. The absorption of light in photosynthesis. Sci. Am 231(6)68-82, 1974.
Li J. Light-harvesting chlorophyll a/b-proteins three-dimensional structure of a reconstituted membrane lattice in negative stain. Proc. Natl. Acad. Sci. USA, 82, 386-390, 1985.
Zuber J. Structure of light-harvesting antenna complexes of photosynthetic bacteria, cyanobacteria, and red algae. Trends Biochem. Sci., 11, 414-419, 1986.
33. Deisenhofer J., Epp J., Miki K., Huber R., Michel H. Structure of the protein subunits in the photosynthetic reaction centre of Rhodopseudomonas viridis at ЗА resolution. Nature, 318, 618-624, 1985.
Deiaenhofer J., Michel H., Huber R. The structural basis of photosynthetic light reactions in bacteria. Trends Biochem. Sci., 10, 243-248, 1985. Knaff D. B. Reaction centers of photosynthetic bacteria. Trends Biochem. Sci., 13, 157-158, 1988.
Michel H., Epp D., Deisenhofer J, Pigment-protein interactions in the photosynthetic reaction center from Rhodopseudomonas viridis. EMBO J., 5, 2445-2451, 1986. (Three-dimensional structure by x-ray diffraction).
34. Govindjee ed. Photosynthesis: Energy Conversion by Plants and Bacteria. New York, Academic Press, 1982. (Two volumes of review articles at an advanced level.)
Nugent J. H. A. Photosynthetic electron transport in plants and bacteria. Trends Biochem. Sci., 9, 354-357, 1984.
Scolnik P. A., Mans B. L. Genetic research with photosynthetic bacteria. Annu. Rev. Microbiol., 41, 703-726, 1987.
35. Blankenship R.E., Prince R.C. Excited-state redox potentials and the Z scheme of photosynthesis. Trends Biochem. Sci., 10, 382-383, 1985. Prince R. C. Manganese at the active site of the chloroplast oxygen-evolving complex. Trends Biochem. Sci., 11, 491-492, 1986.
36. Anderson J. M. Photoregulation of the composition, function and structure of thylakoid membranes. Annu. Rev. Plant Physiol., 37, 93-136, 1986.
Carrillo N., Vallejos R. H. The light-dependent modulation of photosynthetic electron transport. Trends Biochem. Sci., 8, 52-56, 1983.
Miller K. R., Lyon M. K. Do we really know why chloroplast membranes stack? Trends Biochem. Sci., 10, 219-222, 1985.
37. Hinkle P. C., McCarty R.E. How cells make ATP. Sci. Am., 238(3), 104-123, 1978.
Jagendorf A. T. Acid-base transitions and phosphorylation by chloroplasts. Fed. Proc., 26, 1361-1369, 1967.
38. Flugge U. I., Heldt H. W. The phosphate-triose phosphate-phosphoglycerate translocator of the chloroplast. Trends Biochem. Sci., 9, 530-533, 1984.
Heber U., Heldt H. W. The chloroplast envelope: structure, function and role in leaf metabolism. Annu. Rev. Plant Physiol., 32, 139-168, 1981.
39. Raven J. A. Division of labor between chloroplast and cytoplasm. In: The Intact Chloroplast (J. Barber ed.), pp. 403-443, Amsterdam, Elsevier, 1976.
40. Wilson T. H., Lin E. C. C. Evolution of membrane bioenergetics. J. Supramol. Struct., 13, 421-446, 1980.
Woese C.R. Bacterial Evolution. Microbiol. Rev., 51, 221-271, 1987.
41. Gest H. The evolution of biological energy-transducting systems. FEBS Microbiol. Lett, 7, 73-77, 1980.
Gottschalk G. Bacterial Metabolism, 2nd ed. New York, Springer-Verlag, 1986. (Chapter 8 covers fermentations).
Miller S. M., Orgel L. E. The Origins of Life on the Earth. Englewood Cliffs, NJ. Prentice-Hall, 1974.
42. Danson M. J. Archaebacteria: the comparative enzymology of their metabolic pathways. Adv. Microb. Physiol., 29, 165-231, 1988.
Knowles C.J., ed. Diversity of Bacterial Respiratory Systems Vol. 1. Boca Raton FL. CRC Press, 1980.
43. Clayton R. K., Sistrom W. R. eds. The Photosynthetic Bacteria. New York, Plenum, 1978.
Deamer D. W. ed. Light Transducting Membranes: Structure, Function and Evolution. New York, Academic Press, 1978.
Gromet-Elhanan Z. Electrochemical gradients and energy coupling in photosynthetic bacteria. Trends Biochem. Sci., 2, 274-277, 1977.
Olson J. M., Pierson B. K. Evolution of reaction centers in photosynthetic prokaryotes. Int. Rev. Cytol., 108, 209-248, 1987.
44. Dicherson R. E. Cytochrome с and the evolution of energy metabolism. Sci. Am., 242(3), 136-153, 1980.
Gabellini N. Organization and structure of the genes for the cytochrome b/c complex in purple photosynthetic bacteria. A phylogenetic study describing the homology of the b/ci subunits between prokaryotes, mitochondria, and chloroplasts. J. Bioenerg. Biomembr., 20, 59-83, 1988. Schopf J. W., Hayes J. M., Walter M. R. Evolution of earth's earliest ecosystems: recent progress and unsolved problems. In: Earth's Earliest Biosphere: Its Origin and Evolution (J. W. Schopf ed.), pp. 361-384. Princeton, NJ. Princeton University Press, 1983.
45. Attardi G., Schatz G. Biogenesis of mitochondria. Annu. Rev. Cell. Biol., 4, 289-333, 1988.
Ellis R. J. ed. Chloroplast biogenesis. Cambridge U. K., Cambridge University Press, 1984.
46. Clayton D.A. Replication of animal mitochondrial DNA. Cell 28, 693-705, 1982.
Posakony J.W., England J. M., Attardi G. Mitochondrial growth and division during the cell cycle in HeLa cells. J. Cell Biol., 74, 468-491, 1977.
47. Attardi G.; Borst P., Slonimski P. P. Mitochondrial Genes. Cold Spring Harbor, NY. Cold Spring Harbor Laboratory, 1982.
Borst P., Grivell L. A., Groot G. S. P. Orga elle DNA. Trends Biochem. Sci., 9, 128-130, 1984.
Palmer J. D. Comparative organization of chloroplast genomes. Annu. Rev. Genet., 19, 325-354, 1985.
48. Grivell L. A. Mitochondrial DNA. Sci. Am., 248(3), 60-73, 1983.
Hoober J.K. Chloroplasts. New York, Plenum, 1984.
49. Ohyama K. et ah Chloroplast gene organization deduced from complete sequence of liverwort Marchantia polymorpha chloroplast DNA. Nature, 322, 572-574, 1986.
Rochaix J. D. Molecular genetics of chloroplasts and mitochondria in the unicellular green alga Chlamydomonas. FEMS Microbiol. Rev., 46, 13-34, 1987.
Shinozaki K. et al. The complete nucleotide sequence of the tobacco chloroplast genome: its gene organization and expression. EMBO J., 5, 2034-2049, 1986.
Umesono K., Ozeki J. Chloroplast gene organization in plants. Trends Genet., 3, 281-287, 1987.
50. Anderson S. et al. Sequence and organization of the human mitochondrial genome. Nature, 290, 457-465, 1981.
Bibb M. J., Van Etten R. A., Wright С. Т., Walberg M. W., Clayton D. A. Sequence and gene organization of mouse mitochondrial DNA. Cell, 26, 167-180, 1981.
Breitenberger C.A., RajBhandary U.L. Some highlights of mitochondrial research based on analysis of Neurospora crassa mitochondrial DNA. Trends Biochem. Sci., 10, 478-482, 1985.
Fox T.D. Natural variation in the genetic code. Annu. Rev. Genet, 21, 67-91, 1987.
51. Attardi G. Animal mitochondrial DNA: an extreme example of genetic economy. Int. Rev. Cytol., 93, 93-145, 1985.
Wilson A. The molecular basis of evolution. Sci. Am., 253(4) 164-173, 1985.
52. Levings C.S. The plant mitochondrial genome and its mutants. Cell, 32, 659-661, 1983.
Mulligan R. M., Walbot V. Gene expression and recombination in plant mitochondrial genomes. Trends Genet, 2, 263-266, 1986.
Newton K. J. Plant mitochondrial genomes: organization, expression and variation. Annu. Rev. Plant Physiol. Plant Mol. Biol., 39, 503-532, 1988.
53. Clayton D. A. Transcription of the mammalian mitochondrial genome. Annu. Rev. Biochem., 53, 573-594, 1984.
Gruissem W., Barken A., Deng S., Stern D. Transcriptional and post-transcriptional control of plastid mRNA in higher plants. Trendes Genet., 4, 258-262, 1988.
Mullet J. E. Chloroplast development and gene expression. Annu. Rev. Plant Physiol. Plant Mol. Biol., 39, 475-502, 1988.
TabakH. F., Grivell L. A. RNA catalysis in the excision of yeast mitochondrial introns. Trends Genet, 2, 51-55, 1986.
54. Birky C. W, Jr. Transmission genetics of mitochondria and chloroplasts. Annu. Rev. Genet, 12, 471-512, 1978.
55. Giles R. E., Blanc H., Cann H. M., Wallace D. C. Material inheritance of human mitochondrial DNA. Proc. Natl. Acad. Sci. USA, 77, 67156719, 1980.
56. Bernardi G. The petite mulation in yeast. Trends Biochem. Sci., 4, 197-201, 1979.
Locker J., Lewin A., Rabinowitz M. The structure and organization of mitochondrial DNA from petite yeast. Plasmid, 2, 155-181, 1979. Montisano D. P., James T. W. Mitochondrial morphology in yeast with and without mitochondrial DNA. J. Ultrastruct. Res., 67, 288-296, 1979.
57. Attardi G., Schatz G. Biogenesis of mitochondria. Annu. Rev. Cell Biol., 4, 289-333, 1988.
Fox T. D. Nuclear gene products required for translation of specific mitochondrially coded mRNAs in yeast. Trends Genet, 2, 97-99, 1986. Tzagoloff A., Myers A. M. Genetics of mitochondrial biogenesis. Annu. Rev, Biochem., 55, 249-285, 1986.
58. Capaldi R. A. Mitochondrial myopathies and respiratory chain proteins. Trends Biochem. Sci., 13, 144-148, 1988.
DiMauro S. et al. Mitochondrial myopathies. J. Inherited Meta. Dis., 10(Suppl 1), 113-128, 1987.
59. Chua N.-H., Schmidt G. W. Post-translational transport into intact chloroplasts of a precursor to the small subunit of ribulose-l,5-bisphosphate carboxylase. Proc. Natl. Acad. Sci. USA, 75, 6110-6114, 1978.
Douglas M. G., McCammon M. Т., Vassarotti A. Targeting proteins into mitochondria. Microbiol. Rev., 50, 166-178, 1986.
Keegstra K., Bauerle C. Targeting of proteins into chloroplasts. Bioassays, 9, 15-19, 1988.
Schmidt G. W., Mishkind M. L. The transport of proteins into chloroplasts. Annu. Rev. Biochem., 55, 879-912, 1986.
60. Bishop W. R., Bell R. M. Assembly of phospholipids into cellular membranes: biosynthesis, transmembrane movement and intracellular translocation. Annu. Rev. Cell Biol, 4, 579-611, 1988.
61. Cavalier-Smith T. The origin of eukaryotic and archaebacterial cells. Ann. N.Y. Acad. Sci., 503, 17-54, 1987.
Butow B. A., Doeherty R., Parikh V. S. A path from mitochondria to the yeast nucleus. Philos. Trans. R. Soc. Lond. (Biol.), 319, 127-133, 1988. Gellissen G., Michaelis G. Gene transfer: Mitochondria to nucleus. Ann. N. Y. Acad. Sci., 503, 391-401, 1987.
Margulis 1. Symbiosis in Cell Evolution. New York, W. H. Freeman, 1981.
Schwartz R. M., Dayhoff M. O. Origins of prikaryotes, eukaryotes, mitochondria, and chloroplasts. Science, 199, 395-403, 1978.
Whatley f. M., John P., Whatley F. R. From extracellular to intracellular: the establishment of mitochondria and chloroplasts. Proc. R. Soc. Lond. (Biol.), 204, 165-187, 1979.
62. von Heijne G. Why mitochondria need a genome. FEBS Lett., 198, 1-4, 1986.