Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Внутриклеточная сортировка макромолекул и сохранение клеточных компартментов
Транспорт из аппарата Гольджи к секреторным пузырькам и к клеточной поверхности
В норме от аппарата Гольджи непрерывным потоком отделяются транспортные пузырьки, предназначенные для немедленного слияния с плазматической мембраной. Трансмсмбранные белки и липиды пузырьков обеспечивают клеточную мембрану новыми белками и липидами, а растворимые белки пузырьков секретируются во внеклеточное пространство. Таким способом клетка производит, например, протеогликаны и белки внеклеточного матрикса (см. разд. 14.2).
Такая конститутивная секреция существует во всех типах клеток, но в специализированных секреторных клетках имеется еще один способ секреции, при котором растворимые белки и другие вещества сначала накапливаются в секреторных гранулах, а затем по сигналу высвобождаются позднее (так называемая переключаемая, или регулируемая секреция (рис. 8-76).
В данном разделе мы проанализируем роль аппарата Гольджи в этих двух типах секреции и сравним участвующие в их реализации механизмы. Мы рассмотрим также, каким образом вирусы используют сортировочный аппарат клетки-хозяина и чем вообще вирусные частицы могут быть полезны при выяснении различных путей транспорта веществ внутри клетки.
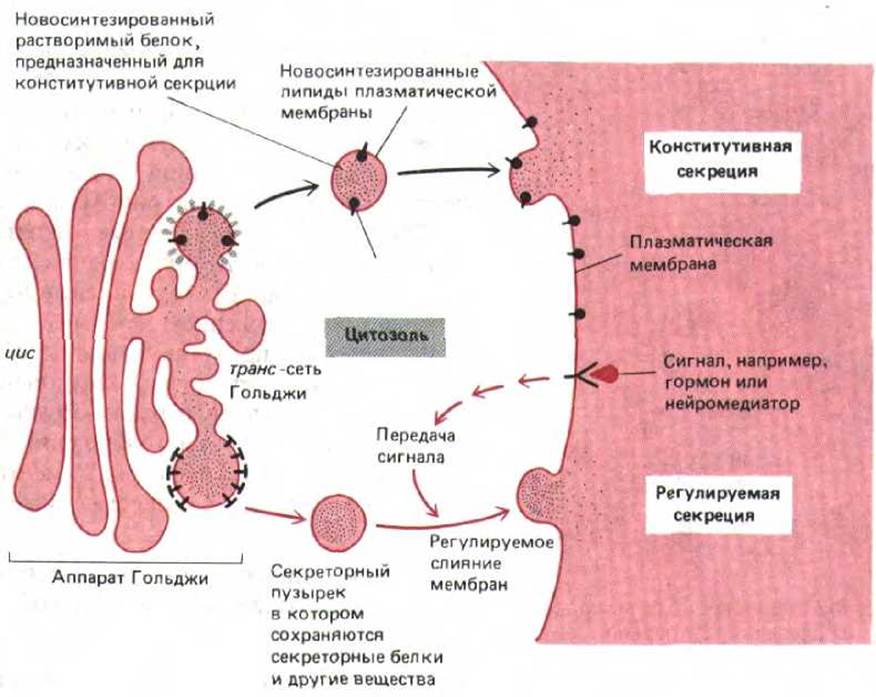
Рис. 8-76. Пути регулируемой и конститутивной секреции расходятся в транс-сети Гольджи. Многие растворимые белки непрерывно выводятся из клетки по конститутивному секреторному пути, который существует во всех клетках. Этот же механизм снабжает плазматическую мембрану вновь синтезированными липидами и трансмембранными белками. Специализированные секреторные клетки имеют еще и регулируемый секреторный механизм, с помощью которого определенные белки в транс-сети Гольджи направляются в секреторные пузырьки. В них белок концентрируется и хранится до тех пор, пока не будет получен внеклеточный сигнал, вызывающий их секрецию.
8-41
8.9.1. Секреторные пузырьки отпочковываются от транс-сети Гольджи [61]
В клетках, в которых секреция происходит в ответ на внеклеточный сигнал, секретируемые белки концентрируются и хранятся в секреторных пузырьках (их часто называют секреторными гранулами из-за темной сердцевины). При получении соответствующего сигнала они высвобождаются путем экзоцитоза. Секреторные пузырьки отпочковываются от транс-сети Гольджи. Полагают, что для их образования нужен клатрин и связанные с ним белки, создающие «кайму», потому что часть поверхности формирующихся пузырьков обычно покрыта клатрином. Эта кайма удаляется вскоре после того, как пузырек полностью сформируется (рис. 8-77).
Подобно лизосомным гидролазам, описанным в предыдущем разделе, белки, предназначенные для секреторных пузырьков (их часто называют секреторными белками) должны быть отобраны и упакованы в соответствующие пузырьки в транс-сети Гольджи. По-видимому, в этом случае происходит избирательная агрегация секреторных белков. Образовавшиеся агрегаты в электронном микроскопе выглядят как электроноплотный материал в транс-сети Гольджи. «Сигнал сортировки», направляющий белок к таким агрегатам, неизвестен, но, видимо, это сигнальный участок, общий для многих секреторных белков. Гакой вывод подтверждается следующими данными: если ген, кодирующий секреторный белок, перенести в секреторную клетку другого типа, в норме не синтезирующую данный белок, то чужой белок будет также упаковываться в секреторные пузырьки.
Неизвестно, каким образом при образовании секреторных пузырьков отбираются агрегаты, содержащие секреторные белки. Секреторные пузырьки имеют уникальные мембранные белки, часть из которых может служить рецепторами (в транс-сети Гольджи) для связывания агрегированного материала, подлежащего упаковке. Заметим, что секреторные пузырьки больше транспортных пузырьков, переносящих лизосомные тидролазы, и агрегаты, которые в них содержатся, слишком велики для того, чтобы каждая молекула секретируемого белка могла связаться с рецептором в мембране пузырька, как это происходит при транспорте лизосомных ферментов (см. рис. 8-73). Захват этих агрегатов секреторными гранулами скорее напоминает поглощение частиц при фагоцитозе на клеточной поверхности, которое также происходит с участием покрытых клатрином мембран.

Рис. 8-77. Электронная микрофотография секреторных пузырьков, образующихся из транс-сети Гольджи в клетках поджелудочной железы, секретирующих инсулин. Для локализации молекул клатрина были использованы антитела, конъюгированные с частицами коллоидного золота (черные точки). Незрелые секреторные пузырьки (черные стрелки), содержащие молекулы проинсулина, покрыты клатрином. Как только пузырек сформируется, клатриновая кайма быстро сбрасывается, и в зрелых секреторных пузырьках (светлые стрелки) она отсутствует. (Микрофотография любезно предоставлена Lelio Orel.)
После того, как незрелые секреторные пузырьки отпочкуются от транс-сети Гольджи, они утрачивают кайму, и их содержимое сильно концентрируется. Такая конденсация происходит резко и, возможно, вызывается закислением среды в полости пузырька за счет работы АТР-зависимой протонной помпы в его мембране. Агрегация секретируемых белков (или других компонентов) и последующая их конденсация в секреторных пузырьках обусловливает увеличение концентрации этих белков в 200 раз по сравнению с аппаратом Гольджи. Благодаря этому секреторные пузырьки имеют возможность высвобождать по «команде» большие количества материала.
8.9.2. Компоненты мембраны секреторных пузырьков используются вторично [62]
Многие секреторные клетки, такие, как ацинарные клетки поджелудочной железы, поляризованы, и экзоцитоз протекает только на их апикальной поверхности. Апикальная часть клеток обращена обычно в просвет системы протоков, собирающей секрет. Когда секреторный пузырек сливается с плазматической мембраной, его содержимое выбрасывается из клетки путем экзоцитоза, а мембрана становится частью плазматической мембраны (см. разд. 6.5.1). Это должно было бы сильно увеличивать поверхность плазматической мембраны. В действительности такое увеличение возникает очень ненадолго, потому что участки мембраны удаляются с поверхности путем эндоцитоза (или рециркулируют) почти с той же скоростью, с которой они добавляются при, экзоцитозе (рис. 8-78). Очевидно, что при таком удалении мембранные белки секреторных пузырьков возвращаются в аппарат Гольджи, где они могут быть использованы вторично. Рециркуляция обеспечивает постоянное распределение компонентов мембран между различными клеточными компартментами.
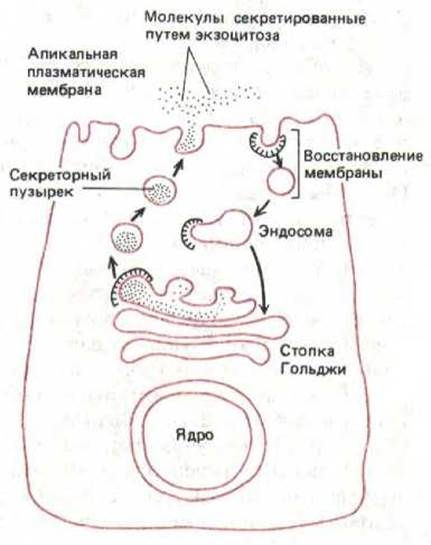
Рис. 8-78. После того, как секреторный пузырек сольется с плазматической мембраной в апикальной части клетки, его мембрана возвращается в круговорот. Количество мембран, добавляемых к плазматической мембране в процессе регулируемой секреции, может быть огромным. Но из нее все время образуются и возвращаются в транс-сеть Гольджи (возможно, через эндосомы) клатриновые окаймленные пузырьки; за счет этого поддерживается постоянная площадь апикальной поверхности клетки.
8.9.3. В неполиризованных клетках белки и липиды, по-видимому, автоматически переносятся от ЭР и аппарата Гольджи к клеточной поверхности [63]
В клетках, способных к регулируемой секреции, белки, перед тем, как покинуть транс-сеть Гольджи, должны быть рассортированы по крайней мере на три группы. Первая из них включает белки, предназначенные для эндолизосом; вторая - белки, предназначенные для секреторных пузырьков, и наконец, в третью группу входят белки, которые прямо добавляются к клеточной поверхности. Белки, направляющиеся в эндолизосомы, отбираются для упаковки в пузырьки по сигналу (для лизосомных гидролаз им служит МбФ); каждый белок, поступающий в секреторные пузырьки, также должен иметь специальный сигнал. Возможно, белки третьей группы транспортируются к поверхности клетки «неизбирательным» образом (рис. 8-79). Существует гипотеза, согласно которой в неполяризованных клетках (к ним относятся лейкоциты и большинство культивируемых клеток) любой белок из ЭР, если он не будет оставлен в качестве постоянного компонента этой органеллы, аппарата Гольджи или отобран для специфичного транспорта, будет автоматически переноситься к клеточной поверхности. Привлекательность этой гипотезы состоит в ее простоте и в том, что она объясняет, каким образом поврежденные или неправильно адресованные белки выводятся из клетки.
Была предпринята попытка экспериментально проверить возможность такого неизбирательного «поточного» транспорта к плазматической мембране. Для этого клетки в культуре инкубировали с простым трипептидом (Asn-Tyr-Thr), содержащим сигнал гликозилирования Asn-X-Thr. Этот маленький пептид может проникать в клетки и через внутриклеточные мембраны; в полости ЭР он гликозилируется по аспарагиновому остатку. Добавление N-связанного олигосахарида предотвращает обратную диффузию данного трипептида в цитозоль. Вместо этого он транспортируется в одном направлении из ЭР в аппарат Гольджи и затем к клеточной мембране. Это происходит примерно за 10 минут, что совпадает со скоростью транспорта наиболее «быстрых» белков плазматической мембраны. Полученный результат согласуется с гипотезой о том, что существует неизбирательный поток жидкости, заполняющей полость органелл. который автоматически доставляет любую растворимую молекулу из ЭР к клеточной поверхности (если только она не остается в органелле или не направляется по сигналу куда-либо еще).

Рис. 8-79. Наиболее хорошо изученные пути сортировки белков в транс-сети Гольджи. Белки с маннозо-6-фосфатным маркером направляются в лизосомы (через эндолизосомы) в составе клатриновых окаймленных пузырьков (см. рис. 8-72). Белки, предназначенные для секреции, концентрируются в больших, покрытых клатрином окаймленных пузырьках, которые, утратив кайму, превращаются в секреторные пузырьки - путь, существующий только в специализированных секреторных клетках. Полагают, что в неполяризованных клетках белки, не имеющие специальных сигналов, направляются к поверхности клетки «по умолчанию» в процессе конститутивной секреции. В поляризованных клетках секретируемые белки и белки плазматической мемраны направляются избирательно к апикальной или базолатеральной части плазматической мембраны, и поэтому хотя бы один из этих потоков должен регулироваться специфическими сигналами.
В принципе тот же неизбирательный поток может доставлять к клеточной поверхности трансмембранные белки и липиды, которые утратили сигналы сортировки. Он может также переносить белки, предназначенные для секреторных пузырьков, от ЭР к концу аппарата Гольджи. ведь специфические сигналы, отличающие эти белки от белков, направляющихся к плазматической мембране, требуются только в транс-сети Гольджи. Возможно, для того, чтобы белок остался в ЭР или аппарате Гольджи. необходим специальный механизм сортировки (см. разд. 8.1.5). Полученные недавно данные о том. что некоторые постоянные белки ЭР (включая ВІР и протеиндисульфидизомеразу) содержат сигнальный пептид, ответственный за их пребывание в ЭР (см. разд. 8.1.7). подтверждают этот общий взгляд на транспорт белков внутри клетки.
Некоторые конститутивно секретируемые белки затрачивают много времени, чтобы покинуть ЭР и секретироваться. Чтобы увязать эти данные с гипотезой неизбирательного потока, предположили, что таким белкам необходимо время, чтобы правильно свернуться, и поэтому они долго удерживаются в ЭР либо за счет того, что пронизывают мембрану ЭР, либо за счет связи со специальными белками типа ВІР. Как только они свернутся правильным образом, эти белки тоже попадают в неизбирательный поток.
8-42
8.9.4. Поляризованные клетки могут направлять белки из аппарата Гольджи к определенному участку плазматической мембраны [64]
Большинство клеток в тканях поляризованы, а их плазматическая мембрана состоит из двух (а иногда и большего числа) различных доменов или частей. Например, типичная эпителиальная клетка имеет две физически непрерывных, но различных по составу части клеточной мембраны (см. рис. 6-36): апикальная часть обращена в полость органа и часто несет специальные приспособления, такие, как реснички или щеточная каемка микроворсинок; базолатеральная часть покрывает всю остальную клетку. Эти две части соединены по границе кольцом плотных контактов (см. разд. 14.1.1). которые не позволяют белкам (и липидам внешней половины липидного бислоя) диффундировать из одной части мембраны в другую. Вот почему, хотя обе части мембраны и видны в электронный микроскоп как единое целое, они надежно изолированы друг от друга плотными контактами и содержат разные наборы белков. Липидный состав двух бислоев тоже различен, в частности, гликолипиды встречаются только в апикальной части мембраны. Существуют убедительные данные, показывающие, что и набор белков, секретируемых с апикальной и базолатеральной поверхности эпителиальной клетки, тоже различен. Следовательно, в поляризованных клетках должны существовать механизмы, специфически направляющие как мембранные, так и секретируемые белки к определенному домену плазматической мембраны. В опытах по культивированию поляризованных клеток удалось установить, что белки, предназначенные для разных доменов, вместе проходят путь от ЭР до транс-сеть Гольджи, где они сортируются и направляются в составе секреторных или транспортных пузырьков к соответствующим участкам клеточной мембраны. Возможно, что и апикальные, и базолатеральные участки несут сигналы сортировки, направляющие их к соответствующему домену; с другой стороны, может быть, только один из этих путей требует специального сигнала, а другой реализуется при отсутствии сигнала.
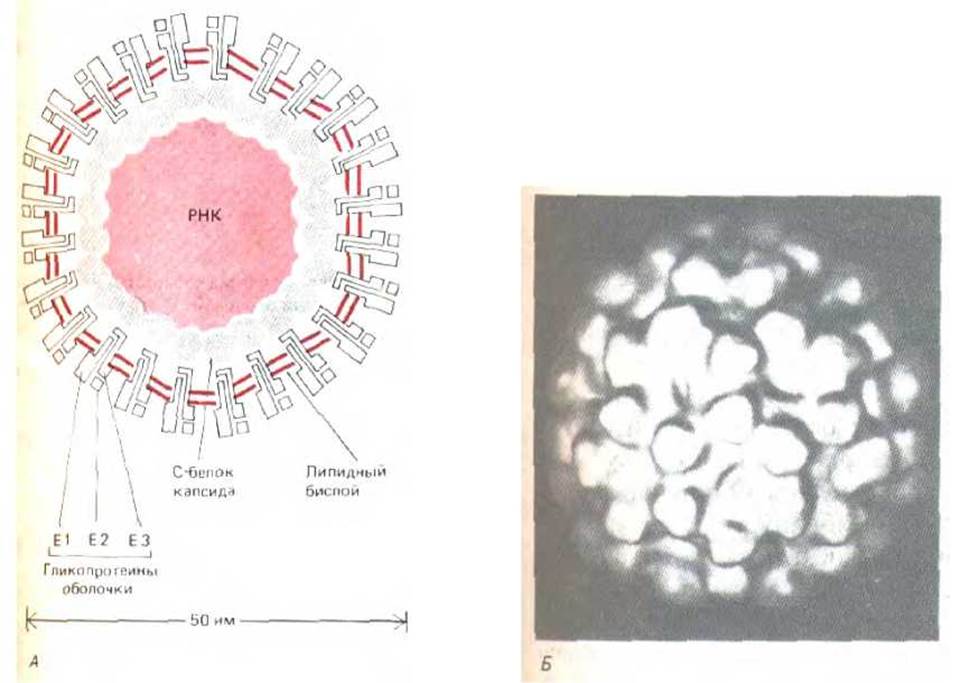
Рис. 8-80. Строение вируса леса Семлики. Схематическое изображение поперечного среза вируса (А) и трехмерная реконструкция его поверхности, полученная на основе криоэлектронных микрофотографий неокрашенных препаратов (Б). На каждую вирусную частицу приходится 180 копий белка С-капсида (собранных в 60 тримеров) и 240 копий каждого из трех белков оболочки (собранных в 80' тримеров). Внешняя оболочка вируса состоит из белков оболочки, заключенных н двухслойную липидную мембрану. Вирус имеет общую массу 46 миллионов дальтон. (Б-но S. Fuller, Cell, 48: 923-934, 1987).
8.9.5. Вирусы используют аппарат сортировки клетки-хозяина [65]
Геном многих вирусов животных представлен небольшим количеством нуклеиновой кислоты и включает не более четырех или пяти генов. Большинство этих генов кодирует структурные белки зрелой вирусной частицы (вириона), поэтому вирусы должны в ходе репликации пользоваться соответствующим аппаратом клетки-хозяина. Поскольку при инфекции вирусные продукты обычно вырабатываются в больших количествах, а вирусные частицы на протяжении своего жизненного цикла проходят последовательный путь через компартменты клетки-хозяина, инфицированные вирусом клетки представляют собой чрезвычайно удобную модель для выявления путей внутриклеточного транспорта.
Имеющие оболочку вирусы животных, геном которых заключен в мембрану из липидного бислоя (см. разд. 5.5.2), необычайно эффективно используют компартментацию клетки. Проследить жизненный цикл такого вируса - значит совершить путешествие по клетке. Хорошо изученным примером является вирус леса Семлики, геном которого представлен РНК, окруженной капсидом, состоящим из правильно построенной икосаэдрической (20-гранной) белковой оболочки. Белок оболочки называется С-белком. Нуклеокапсид (геном + капсид) окружен тесно прилегающим липидным бислоем, содержащим всего три белка (обозначаемых как E1, Е2 и Е3). Эти белки (белки оболочки) представляют собой гликопротеины, пронизывающие липидный бислой и связывающие вместе мембрану и нуклеокапсид (рис. 8-80, А). Гликозшифрованные части белков оболочки всегда находятся вне липидного бислоя, и комплексы этих белков образуют на поверхности вирусной частицы «шипы», можно увидеть в электронном микроскопе (рис. 8-80, Б).
Инфекция начинается с того, что вирус связывается с белком-рецептором на плазматической мембране клетки-хозяина. Для попадания в клетку вирус использует нормальный механизм опосредованного рецептором эндоцитоза, и, таким образом, попадает в эндосомы (см. разд. 6.5.8). Но вместо того, чтобы потом быть доставленным в лизосомы, вирус покидает эндосомы благодаря специальным свойствам одного из белков оболочки. При кислом рН, какой существует в эндо-соме, этот белок вызывает слияние оболочки вируса с мембраной эндосомы, при этом нуклеокапсид высвобождается в цитозоль (рис. 8-81). В цитозоле нуклеокапсид «раздевается», освобождая вирусную РНК, которая затем транслируется на рибосомах клетки-хозяина с образованием кодируемой вирусом РНК-полимеразы. Этот фермент в свою очередь создает множество копий РНК. Некоторые из этих копий служат затем в качестве мРНК, направляя синтез четырех структурных вирусных белков-С-белка капсида и трех белков оболочки-E1, Е2 и ЕЗ.
Белки оболочки и капсида проходят в клетке разные пути. Белки оболочки, подобно нормальным клеточным гликопротеинам, синтезируются на рибосомах, связанных с ЭР; белок капсида, как обычный белок цитозоля, синтезируется на свободных рибосомах. Вновь синтезированный белок капсида связывается с только что реплицированной вирусной РНК, образуя новый нуклеокапсид. Напротив, белки оболочки встраиваются в мембрану ЭР, где они гликолизируются, транспортируются к аппарату Гольджи (там модифицируются их олигосахариды), и затем доставляются к клеточной мембране.

Рис. 8-81. Жизненный цикл вируса леса Семлики. На большинстве этапов биосинтеза этот вирус паразитирует на клетке-хозяине.
В конце концов вирусные нуклеокапсиды и белки оболочки «встречаются» на плазматической мембране (см. рис. 8-81). В результате специфического взаимодействия с кластером белков оболочки нуклеокапсид «заворачивается» в плазматическую мембрану, образуя «почку», мембрана которой сильно обогащена вирусными белками оболочки, но содержит липиды клетки-хозяина. Наконец, эта почка отшнуровывается, и свободная вирусная частица отделяется от клетки. Кластеризацию белков оболочки в липидном бислое можно рассматривать как модель сегрегации специфических мембранных белков при образовании окаймленных пузырьков.
8.9.6. Белки вирусной оболочки несут сигналы, направляющие их к определенным внутриклеточным мембранам [66]
Имеющие оболочку вирусные частицы отпочковываются от различных участков мембраны клетки-хозяина. Следовательно, их белки оболочки (это трансмембранные белки, синтезируемые в ЭР) должны нести сигналы, направляющие их из ЭР к определенной клеточной мембране. При культивировании эпителиальных клеток на подложке из покрытого коллаганом пористого фильтра образуются поляризованные клеточные слои. Если такие поляризованные клетки инфицировать вирусом (при этом различие между апикальной и базолатеральной частями мембраны сохраняется), то одни вирусы (например, вирус гриппа) отпочковываются исключительно от апикальной части плазматической мембраны, а другие (как вирус леса Семлики и вирус везикулярного стоматита) - только от базолатеральной (рис. 8-82). Такая полярность отражает присутствие на вирусных белках оболочки различных апикальных или базолатеральных сигналов сортировки, направляющих эти белки только к одному домену клеточной поверхности; в свою очередь белки оболочки вызывают сборку вируса именно на этом домене.
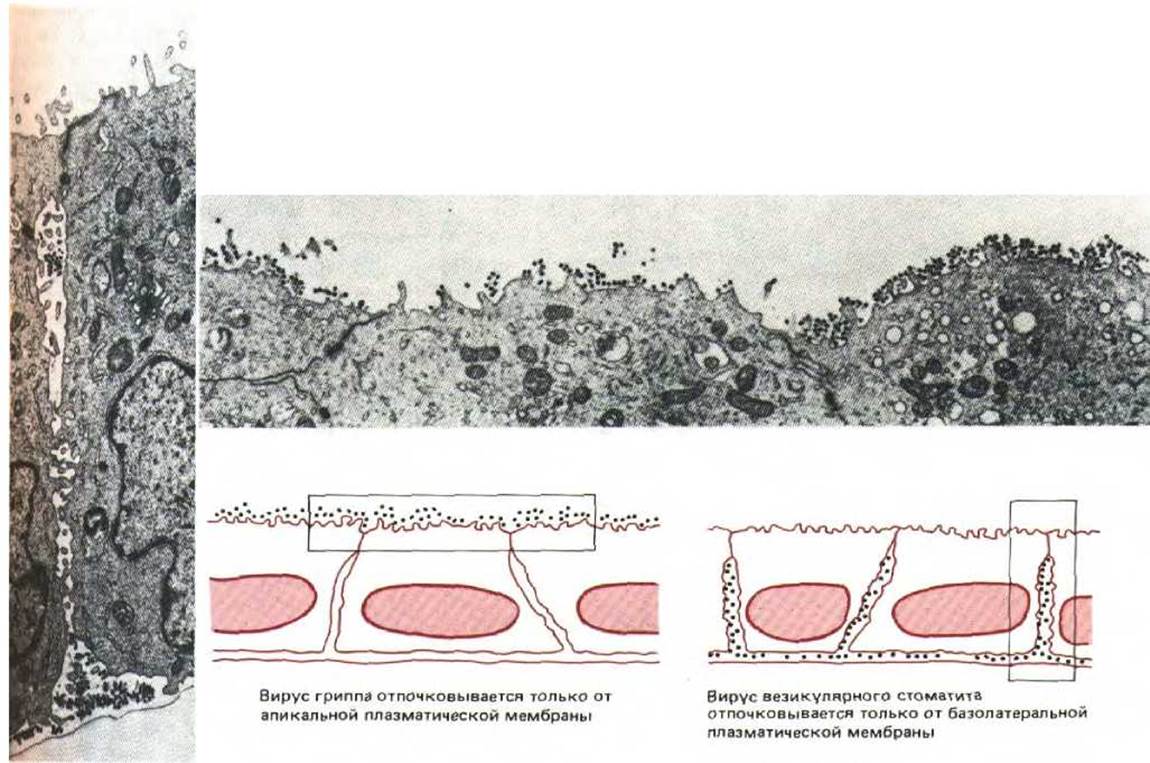
Рис. 8-82. Электронные микрофотографии, показывающие, что один тип покрытых оболочкой вирусов отпочковывается от апикальной, а другой - от базолатеральной поверхности плазматической мембраны одних и тех же эпителиальных клеток, растущих в культуре. Эти клетки растут, прикрепляясь базальной поверхностью к культуральной чашке. (С любезного разрешения Е. Rodriguez-Boulan и D. Sabatini.)
У других вирусов белки оболочки несут иные сигналы сортировки. Например, вирус герпеса представляет собой ДНК-содержащий вирус, который реплицируется в клеточном ядре, там же происходит сборка его нуклеокапсида. Затем этот вирус приобретает оболочку, отпочковываясь от внутренней ядерной мембраны в полость ЭР. Таким образом, белки его оболочки должны быть доставлены из мембраны ЭР во внутреннюю ядерную мембрану. Напротив, флавивирус отпочковывается прямо в полость ЭР, а буньявирус - внутрь аппарата Гольджи; это значит, что белки их оболочки несут сигналы, удерживающие их в мембране ЭР и аппарата Гольджи соответственно. Частицы вируса герпеса, флавиви- руса и буньявируса «растворяются» в полости ЭР и аппарата Гольджи, и движутся по направлению к клеточной поверхности в точности так, как если бы они были секретируемыми белками; в транс-сети Гольджи они включаются в транспортные пузырьки и выводятся из клетки по пути конститутивной секреции.
Заключение
Белки могут выводиться из клетки в процессе экзоцитоза, либо по конститутивной, либо по регулируемой схеме. При регулируемом механизме молекулы сохраняются в секреторных пузырьках, которые не сливаются с плазматической мембраной и не высвобождают свое содержимое, пока не будет получен внеклеточный сигнал. Упаковка белков в эти пузырьки в транс-сети Гольджи сопровождается их избирательной конденсацией. Регулируемая секреция происходит только в специализированных секреторных клетках, тогда как конститутивный секреторный механизм существует во всех клетках. Основной путь конститутивной секреции - везикулярный транспорт от транс-сети Гольджи к плазматической мембране. Для неполяризованных клеток доказано, что те белки, которые не предназначены специально для транспорта в какую-либо органеллу и не имеют сигналов сортировки, удерживающих их в данной органелле, автоматически доставляются при помощи конститутивного механизма к транс-сети Гольджи и оттуда к плазматической мембране. В поляризованных клетках транспортные пути от транс-сети Гольджи к плазматической мембране должны работать избирательно, чтобы обеспечить доставку к апикальному и базолатеральпому доменам мембраны различных наборов мембранных белков, секрстируемых белков и липидов.