Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Внутриклеточная сортировка макромолекул и сохранение клеточных компартментов
Транспорт белков из аппарата Гольджи в лизосомы
В настоящее время полагают, что все белки, проходящие через аппарат Гольджи, кроме тех, которые остаются там в качестве постоянных компонентов, сортируются в соответствии с местом конечного назначения в транс-сеть Гольджи. Особенно хорошо механизм этой сортировки изучен для белков, направляющихся в полость лизосом. В данном разделе мы рассмотрим этот процесс избирательного транспорта. Начнем с краткого описания структуры и функции лизосом.
8.8.1. Внутриклеточное гидролитическое расщепление макромолекул происходит главным образом в лизосомах [53]
В 1949 г. при изучении ферментов углеводного обмена в гомогенатах клеток печени было замечено несколько «необычное» поведение кислой фосфатазы. Активность этого фермента в экстрактах, приготовленных на дистиллированной воде, оказалась выше, чем в экстрактах, приготовленных на изотоническом растворе сахарозы. В старых препаратах она была выше, чем в свежих, и, кроме того, в старых препаратах активность не была связана с осаждаемыми частицами. Вскоре появились такие же сообщения относительно некоторых других гидролитических ферментов. Все эти наблюдения привели к открытию новой органеллы, названной лизосомой. Она представляет собой мембранный мешок, наполненный гидролитическими ферменгами, которые служат для контролируемого внутриклеточного расщепления макромолекул. Повреждение мембраны лизосом в клеточных экстрактах, вызванное осмотическим лизисом или старением препарата, приводит к высвобождению этих ферментов из лизосом в неосаждаемой форме.

Рис. 8-69. Лизосомы определяют как окруженные мембранами пузырьки, участвующие во внеклеточном расщеплении веществ. Они содержат большое количество гидролитических ферментов, которые активны при кислом рН. В просвете лизосом кислый рН (около 5) поддерживается при помощи протонной помпы в мембране, которая использует энергию гидролиза АТР для накачки ионов Н+ внутрь пузырька.
Сейчас известно около 40 гидролитических ферментов, содержащихся в лизосомах. Это различные протеазы, нуклеазы, гликозидазы, липазы, фосфолипазы, фосфатазы и сульфатазы. Кроме того, все они - кислые гидролазы, обладающие наибольшей активностью при рН 5. Именно такое значение рН поддерживается в лизосомах. В норме мембрана лизосом не проницаема для этих ферментов, но даже в случае их утечки необходимость кислого рН для функционирования гидролаз защищает цитоплазму от разрушения.
Как и все клеточные органеллы, лизосомы не только содержат уникальный набор ферментов, но и окружены необычной, непохожей на остальные, мембраной. Эта мембрана, например, содержит транспортные белки, позволяющие продуктам расщепления макромолекул покидать лизосому, после чего они могут либо выделяться из клетки, либо использоваться внутри нее вторично. Кроме того полагают, что в мембране лизосомы находится специальный белок, использующий энергию АТР для накачки ионов Н+ в лизосому. Именно это поддерживает в полости данной органеллы рН около 5 (рис. 8-69). Большинство белков лизосомной мембраны необычно сильно гликозилированы, что, возможно, защищает их от действия протеаз в полости органеллы.
8.8.2. Лизосомы - это гетерогенные органеллы [54]
Лизосомы удалось четко визуализировать методом электронной микроскопии примерно через десять лет после того, как впервые были описаны их биохимические свойства. Лизосомы чрезвычайно разнообразны по форме и размеру, но могут быть идентифицированы как одно семейство органелл методами гистохимии. Для этого часто приходится анализировать нерастворимые продукты реакции какой-либо гидролазы с субстратом. В ходе такого исследования можно определить, какие именно органеллы содержат данный фермент (рис. 8-70). С помощью такого подхода лизосомы были обнаружены во всех эукариотических клетках. Морфологическая гетерогенность лизосом контрастирует с относительно однообразной структурой других органелл клетки. Эта гетерогенность отражает широкий спектр реакций расщепления, протекающих с участием кислых гидролаз, включая расщепление внутри- и внеклеточных отходов, переваривание фагоцитированных микроорганизмов и даже питание клетки (поскольку лизосомы - это основное место накопления холестерола из поступающих в клетку путем эндоцитоза сывороточных липопротеинов). На этом основании лизосомы иногда рассматривают как группу разнородных органелл, общим свойством которых является высокое содержание гидролитических ферментов.

Рис. 8-70. Электронная микрофотография двух срезов клетки, окрашенной для выявления кислой фосфатазы-маркерного фермента лизосом. Мембранные органеллы большего размера, содержащие электроноплотные преципитаты фосфата свинца, представляют собой лизосомы, а их разнообразная морфология отражает изменения количества и природы расщепляемых веществ. На верхнем фото показаны стрелками два маленьких пузырька, которые, вероятно, переносят гидролазы из аппарата Гольджи. Преципитаты образуются, когда ткань, зафиксированную глутаровым альдегидом (чтобы сохранить локализацию фермента) инкубируют с субстратом фосфатазы в присутствии ионов свинца. (С любезного разрешения Daniel S. Friend.)
8.8.3. Существуют три пути поступления веществ в лизосомы [55]
Транспорт молекул в лизосомы происходит по-разному и зависит от источника этих молекул. Наиболее хорошо изучен путь, по которому идет расщепление материала, поглощенного путем эндоцитоза. Он включает окаймленные ямки, эндосомы, и, наконец, лизосомы. Как обсуждалось в гл. 6, поглощенные путем эндоцитоза молекулы проходят последовательно от периферических к перинуклеарным эндосомам. Те компоненты, которые не были извлечены из этих эндосом, чтобы вернуться в плазматическую мембрану, попадают затем в третий «промежуточный компартмент», получающий новосинтезированные лизосомные гидролазы и белки лизосомной мембраны из аппарата Гольджи. Поскольку среда в этом эндолизосомном компартменте слабокислая, полагают, что именно здесь начинается гидролитическое расщепление эндоцитированного материала. Для превращения эндолизосом в зрелые лизосомы необходимо, чтобы они утратили определенные компоненты мембран, а уровень рН внутри них еще понизился. Как происходит это превращение, неизвестно.
Существует и второй путь транспорта материала в лизосомы. Именно с ним связано разрушение отработанных частей самой клетки-процесс, называемый аутофагией. Известно, например, что в клетках печени среднее время жизни одной митохондрии составляет около 10 дней. На электронных микрофотографиях нормальных клеток можно увидеть лизосомы, содержащие митохондрии и секреторные пузырьки. Вероятно, это отработанные органеллы, которые должны быть утилизированы в лизосомах. Процесс деградации, по-видимому, начинается с окружения органеллы мембранами, происходящими из ЭР, в результате чего образуется аутофагосома. Затем, как полагают, аутофагосома сливается с лизосомой (или эндолизосомой), образуя аутофаголизосому, в которой уже начинается процесс деградации. Этот процесс хорошо отрегулирован; отдельные компоненты клетки могут направляться в лизосомы для расщепления по мере необходимости: например, гладкий ЭР, образовавшийся в клетках печени в ответ на лекарственные препараты, после выведения препарата из организма удаляется путем аутофагии (см. разд. 8.6.2)
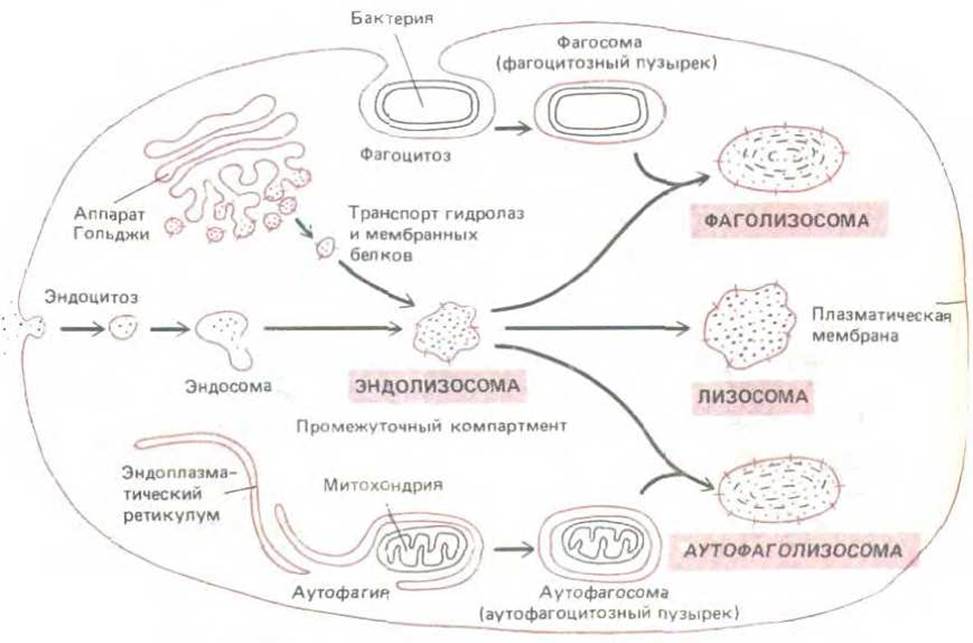
Рис. 8-71. Три возможных пути образования лизосом. В каждом случае образуются морфологически различные лизосомы, расщепляющие материал из разных источников. В центре этих путей находится «промежуточный компартмент», обозначенный здесь как эндолизосома. До недавнего времени традиционно выделяли первичные лизосомы и вторичные лизосомы. Первым термином обозначали вновь образованные лизосомные пузырьки, еще не поглотившие никакого материала. Однако последние данные показывают, что лизосомные гидролазы и мембранные белки лизосом отбираются при помощи разных рецепторов, поэтому вероятнее, что они покидают аппарат Гольджи в отдельных транспортных пузырьках и впервые встречаются в эндолизосоме, которая уже содержит материал для расщепления.
Третий путь поступления материала в лизосомы имеется только у клеток, специализированных для фагоцитоза больших частиц и микроорганизмов. Такие клетки, как макрофаги и нейтрофилы, могут поглощать крупные объекты, образуя фагосомы (см. разд. 6.5.14). Предполагают, что фагосома превращается в фаголизосому тем же способом, который описан для аутофагосомы. Три вида транспорта молекул в лизосомы схематически изображены на рис. 8-71; три типа лизосом. образующихся при этом, могут не отличаться друг от друга ничем, кроме клеточного материала, который они расщепляют. Все чти по сути разнородные органеллы называют одним словом лизосомы.
8-37
8.8.4. Лизосомные ферменты сортируются в аппарате Гольджи мембраносвязанным белком-рецептором, узнающим маннозо-6-фосфат [56]
Для образования лизосом необходим синтез специфических лизосомных гидролаз и мембранных белков. И те, и другие белки синтезируются в ЭР и транспортируются через аппарат Гольджи. Транспортные пузырьки, доставляющие их в эндолизосомы, а затем в лизосомы, отделяются от транс-сети Гольджи. Эти пузырьки должны включать именно лизосомные белки и не включать множество других белков, которые упаковываются в другие транспортные пузырьки и доставляются в другие органеллы.
Каков механизм узнавания лизосомных белков? Что обеспечивает точность отбора? Собственно, эти же вопросы можно задать и в других случаях внутриклеточной сортировки, происходящей с участием транспортных пузырьков. На молекулярном уровне ответ известен только для одного класса ферментов-лизосомных гидролаз. Они имеют уникальный маркер-маннозо-6-фосфат. который присоединяется к N-связанным олигосахаридам этих растворимых лизосомных ферментов. Реакция протекает в пространстве цис-компартмента Гольджи. Соответствующие маннозофосфатные рецепторы группируются на мембране и затем концентрируются в покрытых клатрином окаймленных пузырьках. Они также были выделены и охарактеризованы. Оказалось, что эти рецепторы представляют собой трансмембранные белки, которые связывают лизосомные ферменты, отделяя их таким образом от всех остальных белков и собирая в окаймленные транспортные пузырьки. Эти пузырьки быстро теряют свою кайму и сливаются с эндолизосомами.
В некоторых клетках небольшое количество рецепторов маннозо-6-фосфата присутствует в плазматической мембране, где они участвуют в эндоцитозе лизосомных ферментов, которые были выделены во внеклеточную среду. Благодаря этим рецепторам ферменты через окаймленные ямки попадают к эндосомам, а оттуда к лизосомам. Таким необычным путем, с помощью «старьевщиков» и доставляются в лизосомы гидролазы, которые избежали процесса упаковки в транс-сети Гольджи и были поэтому транспортированы к клеточной поверхности и выведены наружу.
8.8.5. Рецептор маннозо-6-фосфата «курсирует» между специализированными мембранами [57]
Маннозофосфатный рецептор был очищен и охарактеризован в экспериментах in vitro. Оказалось, что он связывает специфический олигосахарид при рН7 и отщепляет его при рН6; именно такой рН существует внутри эндолизосом. Лизосомные ферменты в эндолизосоме отделяются от белка-рецептора маннозо-6-фосфата и начинают расщеплять поглощенный материал, содержавшийся в эндосомах. Отделившись от «своих» ферментов, рецепторы восстанавливают структуру и возвращаются в мембрану транс-сети Гольджи, возможно, в составе окаймленных пузырьков (рис. 8-72). Такой механизм возвращения мембран из эндолизосом обратно в аппарат Гольджи весьма напоминает круговорот мембран между эндосомами и плазматической мембраной при опосредованном рецепторами эндоцитозе (см. разд. 6.5.10). Опосредованный рецепторами транспорт лизосомных гидролаз из аппарата Гольджи к эндолизосомам аналогичен эндоцитозу внеклеточных молекул, направляющему их от плазматической мембраны в эндосомы. В обоих случаях рецепторы собираются в покрытых клатрином участках мембраны (называемых окаймленными ямками); эти участки отшнуровываются от мембраны, образуя покрытые клатрином окаймленные пузырьки. Пузырьки доставляют затем лиганд к следующему компартменту, имеющему кислую среду, и оттуда рецепторы возвращаются в исходную мембрану.
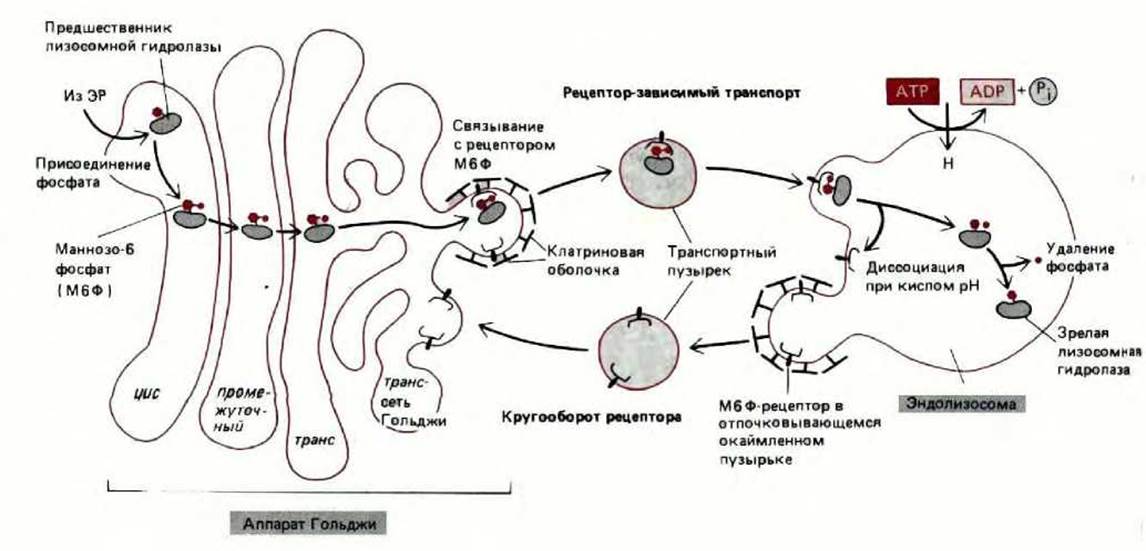
Рис. 8-72. Транспорт вновь образованных лизосомных гидролаз в лизосомы. В цис-аппарате Гольджи предшественники лизосомных гидролаз «метятся» при помощи маннозо-6-фосфатных групп, а в транссети Гольджи отделяются от других типов белков. Это отделение происходит потому, что отпочковывающиеся от транс-сети Гольджи клатриновые окаймленные пузырьки содержат рецепторы маннозо-6-фосфата, связывающие лизосомные гидролазы. Пузырьки утрачивают «кайму» и сливаются с эндолизосомами (см. рис. 8-71). При низком рН, который существует в эндолизосомах, гидролазы отщепляются от рецепторов. Рецепторы возвращаются в аппарат Гольджи для проведения повторных циклов транспорта. Вероятность возвращения гидролазы в аппарат Гольджи вместе с рецептором сильно снижается за счет удаления фосфата от маннозного остатка. Хотя существует два структурно различных маннозо-6-фосфат-рецепторных гликопротеина, сильно отличающихся по размерам, они имеют сходную аминокислотную последовательность и, вероятно, выполняют сходные функции.
Круговорот маннозофосфатного рецептора был прослежен с помощью специфических антител, позволяющих локализовать этот белок в клетке. В норме рецепторы маннозо-6-фосфата обнаруживают в мембранах аппарата Гольджи и эндолизосом, но не в зрелых лизосомах. Если некоторые культивируемые клетки обработать слабым основанием (например аммиаком или хлорохином), которое накапливается внутри органелл с кислой средой и поднимает там рН до нейтрального, то рецепторы исчезают из аппарата Гольджи и появляются в эндолизосомах. Можно вызвать в таких клетках возвращение рецепторов в аппарат Гольджи, либо удалив слабое основание, либо добавив в культуральную среду большое количество маннозо-6-фосфата. При обоих воздействиях рецептор отделяется от связанного с ним фермента в эндолизосоме, в одном случае в результате вторичного закисления среды в органелле, а в другом - за счет конкурентного связывания с рецептором поглощенного маннозо-6- фосфата. Эти эксперименты свидетельствуют о том, что перемещению рецептора обратно в аппарат Гольджи способствует его конформационное изменение, связанное с отщеплением гидролазы.
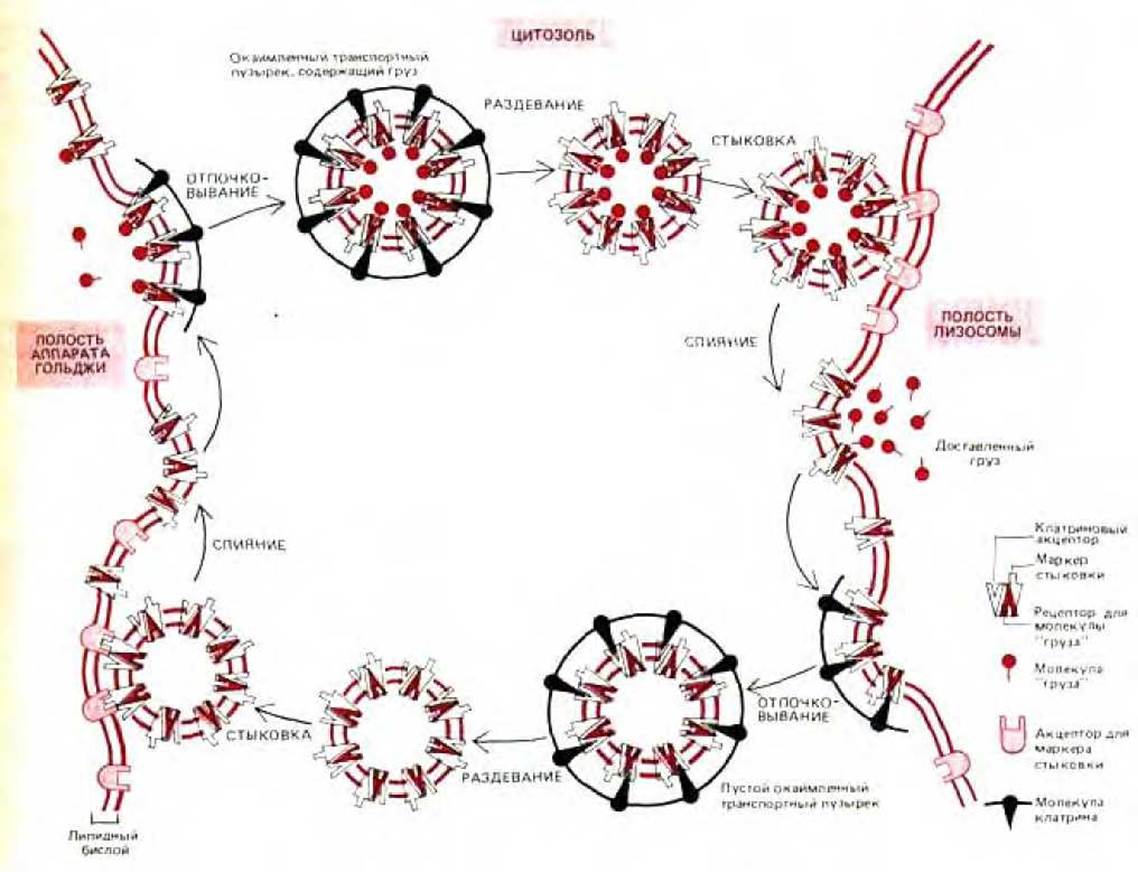
Рис. 8-73, Один из возможных механизмов, позволяющих направлять окаймленные транспортные пузырьки к определенной внутриклеточной мембране. В этой гипотетической модели молекулы «груза» - это лизосомные гидролазы, а «приемщик груза»-это белок-рецептор маннозо-6-фосфата. Изображенные здесь молекулы «маркера стыковки» и «приемщика» пока еще не охарактеризованы. Однако недавно открытые клатрин-связывающие белки, которые также связывают цитоплазматические «хвосты» некоторых мембранных белков, удовлетворяют данному здесь описанию молекул-«приемщиков». (См. Pearse, B.M., ЕМВО J. 7: 3331-3336, 1988.)
Челночная система для рецептора маннозо-6-фосфата, изображенная на рис. 8-72, является специфичной - пузырьки, несущие этот рецептор, сливаются только с нужными органеллами-мишенями, а не, к примеру, с мембранной ЭР. Считают, что клатриновая кайма на формирующихся пузырьках действует подобно «молекулярному фильтру», изолирующему рецептор и его лиганд внутри пузырьков. Однако клатрин не может отвечать за специфичность доставки пузырьков, так как кайма удаляется вскоре после их образования. Эксперименты in vitro показывают, что удаление клатрина катализируется htp70-подобным белком, а соответствующая реакция требует гидролиза АТР. Один или несколько белков, остающихся экспонированными на внешней стороне мембраны пузырька, вероятно служат специфическими «сигналами погрузки», которые узнаются комплементарным «приемщиком» на мембране органеллы-мишени.
Изучение механизмов сортировки лизосомных гидролаз весьма расширило наши представления о многих протекающих в клетках эукариот процессах переноса веществ с помощью транспортных пузырьков. Неважно, что олигосахаридные маркеры, по-видимому, больше нигде не используются, все остальные события-распознавание «груза» мембранным рецептором при отпочковании пузырька, слияние пузырька со специфичной мембраной-мишенью, высвобождение «груза» в компартмент-мишень и возвращение освободившегося рецептора в исходный компартмент-вероятно, являются общими для всех видов везикулярного транспорта.
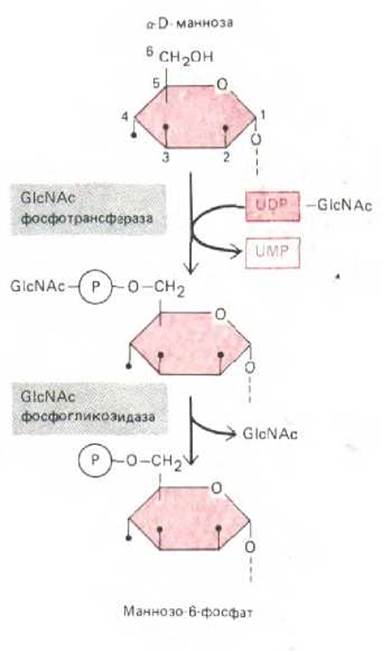
Рис. 8-74. Образование маннозо-6-фосфатного маркера на лизосомной гидролазе происходит в два этапа. Сначала GlcNAc-фосфотрансфераза присоединяет P-GlcNA.c к 6-му углеродному атому некоторых остатков маннозьг N-связапного олигосахарида, связанного с лизосомным гликопротеином-предшественником. Затем фосфогликозидаза отрезает остаток GlcNAc и в результате образуется маннозо-6-фосфатный маркер. Первый фермент специфически активируется сигнальным участком на лизосомных гидролазах (см. рис. 8-75), тогда как фосфогликозидаза является неспецифическим ферментом. Такая модификация некоторых остатков маннозы в цис-компартменте Гольджи защищает их от действия маннозидаз, которые встретятся позже, в промежуточном ком-партменте аппарата Гольджи.
8.8.6. Присоединение к лизосомному ферменту нескольких групп маннозо-6-фосфата усиливает сигнал сортировки [58]
Система отделения лизосомных гидролаз и отправки их в эндолизосомы работает благодаря тому, что маннозофосфатные группы добавляются в аппарате Гольджи только к определенным гликопротеинам. Для этого требуется специфическое узнавание гидролаз ферментами аппарата Гольджи, ответственными за присоединение маннозо-6-фосфата (М6Ф). Поскольку все гликопротеины, попадающие в компартмент Гольджи, имеют идентичные N-связанные олигосахаридные цепи, сигнал, по которому к олигосахариду добавляется М6Ф, должен находиться в самой полипептидной цепи каждой гидролазы.
Для присоединения маннозофосфатных групп к лизосомным гидролазам необходима последовательная работа двух ферментов. N- ацетилглюкозамин-фосфотрансфераза (GlcNAc-фосфотрансфераза) переносит GlcNAc-P-часть молекулы нуклеотид-сахара UDP-GlcNAc к остатку маннозы в олигосахарпде, а второй фермент - фосфогликозидаза-затем удаляет концевой GlcNAc, оставляя фосфат, в результате образуется маннозо-6-фосфат М6Ф (рис. 8-74). Фосфотрансфераза специфически связывается с гидролазой благодаря участку (или сайту) узнавания, не совпадающему с активным центром этой реакции (рис. 8-75). По-видимому, в данном случае сигнал для сайта узнавания представляет собой сигнальный участок, а не сигнальный пептид (см. разд. 8.1.6). Об этом свидетельствует тот факт, что при частичном разворачивании гидролазы распознавание практически прекращается.
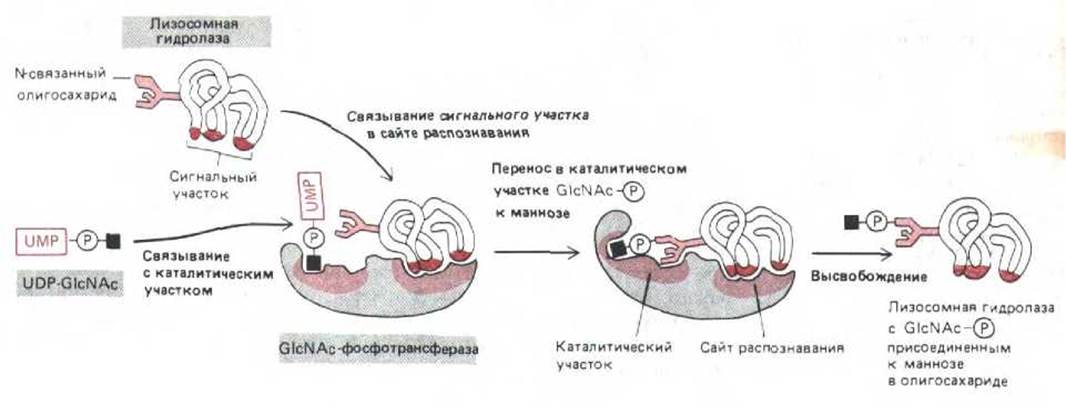
Рис. 8-75. У фермента GlcNAc-фосфотрансферазы, узнающей лизосомные гидролазы в аппарате Гольджи, участок узнавания и активный центр не совпадают. В активном центре связываются богатые маннозой N-связанные олигосахариды и UDP-GlcNAc. Сайт узнавания объединяется с сигнальным участком, имеющимся только на поверхности лизосомных гидролаз и их предшественников.
Как только фосфотрансфераза узнает сигнал на гидролазе, она присоединяет GlcNAc-P к одному или двум маннозным остаткам в каждой олигосахаридной цепи. Поскольку большинство лизосомных гидролаз несут многочисленные олигосахариды, они приобретают много остатков М6Ф, что приводит к многократному усилению сигнала. Если при связывании обычной лизосомной гидролазы с сайтом узнавания фосфотрансферазы Ка составляет 105 л моль, то для множественно фосфорилированной гидролазы и маннозофосфатного рецептора соответствующий показатель равен 104 л/моль, т.е. их связь в 10000 раз прочнее.
8-38
8.8.7. Дефекты GlcNAc-фосфотранеферазы вызывают у человека лизосомные болезни накопления [59]
Лизосомные долети накопления сыграли решающую роль в раскрытии механизма сортировки лизосомных гидролаз. Эти болезни обусловлены генетическими нарушениями, в результате которых одна или несколько лизосомных гидролаз оказываются дефектными. Нерасщепленный субстрат такой гидролазы накапливается в лизосомах, что и обусловливает патологию. Обычно такие болезни вызываются мутацией в структурном гене, кодирующем отдельную гидролазу. Наиболее тяжелые симптомы характеризуют редкую форму патологии, называемую 1-клеточной болезнью (inclusion cell disease). У таких больных в лизосомах фибробластов отсутствуют почти все гидролитические ферменты, а соответствующие нерасщепленные субстраты накапливаются в клетках в виде крупных «включений». 1-клеточная болезнь обусловлена рецессивной мутацией единственного гена. Это означает, что она проявляется только у людей, получивших дефектные копии гена от обоих родителей.
При изучении 1-клеточной болезни оказалось, что в лизосомах все гидролазы отсутствуют, но в крови они обнаруживаются. Из этого следует, что структурные гены, кодирующие их, не повреждены. Аномалия в данном случае вызвана нарушениями процесса сортировки в аппарате Гольджи, в результате чего гидролазы вместо того, чтобы поступать в лизосомы, секретируются. Неправильная сортировка происходит из-за повреждения или отсутствия GlcNAc-фосфотранеферазы. Лизосомные ферменты в таких клетках не фосфорилируются и маннозофос-фатный рецептор не может собрать их в окаймленные пузырьки в транссеги 1 ольджи. Вместо этого они доставляются к клеточной поверхности и секретируются. Те олигосахариды, которые у нормальных лизосомных ферментов содержали бы М6Ф, превращаются в олигосахариды «сложного» типа, содержащие GlcNAc, галактозу и сиаловую кислоту. Это показывает, что в норме фосфорилирование маннозы в цис-компартменте Гольджи предотвращает последующий процессинг олигосахаридов гидролаз в сложные формы в промежуточном и цис-окомпартментах Гольджи.
Интенсивные исследования биохимического механизма 1-клеточной болезни в конце 60-х гг. натолкнули на мысль о том, что все лизосомные ферменты имеют общий маркер. В конце 70-х гг. при сравнении гидролаз у нормальных и больных людей было установлено, что им является маннозо-6-фосфат. Вскоре после этого удалось выделить и очистить рецептор маннозо-6-фосфата, GlcNAc-фосфотрансферазу, кроме того была выяснена роль аппарата Гольджи в механизме сортировки лизосомных гидролаз.
При 1-клеточной болезни лизосомы в клетках некоторых типов, например, в гепатоцитах, содержат нормальный набор лизосомных ферментов. Это означает, что существует и другой механизм, направляющий гидролазы в лизосомы, который используется в одних клетках и не используется в других. Природа этого М6Ф-иезависимого пути в настоящее время неизвестна. Возможно, в данном случае сортировка гидролаз происходит путем прямого узнавания их сигнальных участков. Подобный МбФ-независимый путь существует во всех клетках в транс-сети Гольджи для сортировки лизосомных мембранных белков и направления их в эндолизосомы. Непонятно, почему клетке необходим более чем один способ построения лизосом.
Заключение
Лизосомы специализируются ни внутриклеточном расщеплении веществ. Они содержат уникальные мембранные делки и большое количество разных гидролитических ферментов, которые лучше всего работают при кислых точениях рН (рН5), характерных для содержимого лизосо.м. Кислый рН в лизосомах поддерживается при помощи АТР-зависимой протонной помпы в их мембранах. Вновь синтезированные белки лизосом переносятся в полость ЭР, затем транспортируются через аппарат Гольджи и из транс-сети Голъджи с помощью транспортных пузырьков доставляются в промежуточный компартмент (эндолизосому).
Лизосомные гидролазы содержат N-связанные олигосахариды, которые модифицируются в цис-компартменте Гольджи таким образом, что их остатки маннозы фосфори.шруются. Эти маинозо-6-фосфатньк (М6Ф) группы узнаются в транс-сети Гольджи М6Ф- рецептором, который отбирает гидролазы и помогает упаковывать их в отпочковывающиеся покрытые клатрином пузырьки. Транспортные пузырьки, содержащие рецептор маннозо-6-фосфата. действуют подобно челнокам, доставляя рецептор от транс-сети Гольджи к эндолизосомам и обратно. Низкий уровень рН в эндолизосомах вызывает диссоциацию комплекса лизосомной гидролазы и рецептора, делая транспорт гидролаз однонаправленным.