Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Контроль генной экспрессии
Стратегии генетического контроля
Морфология и функция у различных типов клеток, входящих в состав высшего организма, часто довольно сильно отличаются. Например, нейрон и лимфоцит млекопитающего так мало похожи друг на друга (см. рис. 13-29), что трудно себе представить их владельцами одного и того же генома. Столь большая разница между клетками дала основание для гипотезы, согласно которой гены в процессе дифференцировки клеток могут селективно утрачиваться. Однако теперь известно, что это не так; дифференцировка клеток определяется изменением экспрессии генов, а не их потерей.
10.1.1. В различных типах клеток многоклеточного организма содержится одинаковая ДНК [1]
Разные типы клеток многоклеточного организма отличаются друг от друга тем, что синтезируют и накапливают различные наборы молекул РНК и белков. Эти процессы происходят без необратимых изменений в ДНК. Лучшее доказательство сохранения генома при дифференцировке клеток получено в классических экспериментах на лягушке. Если ядро полностью дифференцированной клетки лягушки ввести в ооцит, ядро которого удалено, инъецированное «донорное» ядро детерминирует развитие из реципиентной яйцеклетки нормального головастика. Поскольку у головастика имеются самые разные дифференцированные клетки, получившие свои последовательности ДНК из ядра исходной донорной клетки, можно сделать вывод, что дифференцированная клетка донора не потеряла никаких важных последовательностей ДНК. Аналогичный вывод следует и из опытов, проведенных на различных растениях. В этом случае кусочки дифференцированной ткани культивировали на искусственной среде, после чего эту ткань разделяли на отдельные клетки. Оказалось, что такая изолированная клетка способна регенерировать целое взрослое растение (рис. 10-1).

Рис. 10-1. Схема эксперимента, который может быть выполнен на различных растениях. Многие дифференцированные растительные клетки сохраняют способность к «дедифференцировке»: в определенных условиях они дают начало клону клеток, который может развиться в целый организм (см. гл. 20).
Другим доказательством того, что в ходе развития позвоночных большие блоки ДНК не теряются и не перестраиваются, служит следующий факт. Митотические хромосомы из разных типов клеток после специального окрашивания имеют одинаковую поперечную исчерченность (см. рис. 9-40). Если исходить из этого критерия, следует признать, что набор хромосом в дифференцированных клетках человеческого тела идентичен. Более того, при сравнении геномов различных клеток методами генной инженерии оказалось, что изменения в экспрессии генов, сопутствующие развитию многоклеточных организмов, как правило, не сопровождаются изменениями в последовательностях ДНК соответствующих генов (некоторые важные исключения приведены в разд. 18.4.2).
10.1.2. В различных типах клеток синтезируются разные наборы белков [2]
Чтобы понять механизм клеточной дифференцировки, прежде всего необходимо знать, насколько отличаются друг от друга разные типы клеток. Полный ответ на этот фундаментальный вопрос еще не получен, но определенные выводы уже сделаны.
1. Существует множество процессов, общих для всех клеток, и, следовательно, все клетки имеют много одинаковых белков. Часть таких белков содержится в больших количествах и легко поддается анализу. Среди них основные структурные белки цитоскелета и хромосом, некоторые белки, входящие в состав эндоплазматического ретикулума и аппарата Гольджи, рибосомные белки и так далее. Многие белки, встречающиеся реже, например, различные ферменты, участвующие в основных реакциях метаболизма, также присутствуют во всех типах клеток.
2. Некоторые белки обнаруживаются в больших количествах лишь в специализированных клетках, а в других типах клеток их нельзя выявить даже самыми чувствительными методами. Например, гемоглобин имеется только в эритроцитах.
3. Если методом двумерного электрофореза в полиакриламидном геле сравнить примерно 2000 наиболее часто встречающихся белков (т.е. белков, содержащихся в количестве 50000 молекул на клетку) в различных типах клеток, то выявляется довольно мало отличий. Проводится ли сравнение двух клеточных линий, выращенных в культуре (например, мышечные и нервные клетки), или клеток двух дифференцированных тканей грызунов (например, печени и легкого), результат оказывается сходным. Большинство белков синтезируется во всех исследованных типах клеток, причем эффективность синтеза различается в зависимости от типа клеток не более, чем в пять раз. Лишь для нескольких процентов белков эта закономерность не соблюдается.

Рис. 10-2. Пять уровней контроля генной экспрессии у эукариот. После синтеза белка его активность может контролироваться за счет регулируемой деградации (G), обратимых модификаций (например, фосфорилирования) и путем перемещения молекулы белка в определенное место клетки.
Судя по имеющемуся числу различных последовательностей мРНК, типичная клетка высших организмов синтезирует от 10000 до 20000 разных белков (см. табл. 9-2), многие из которых присутствуют в настолько низкой концентрации, что их не удается обнаружить даже с помощью двумерного гель-электрофореза. Если эти минорные белки в разных клетках различаются в такой же степени, как и белки, относящиеся к более обильным классам, следует признать, что относительно небольшие изменения в спектре синтезируемых клеткой белков способны очень сильно изменять все ее поведение и структуру.
10-3
10.1.3. Экспрессия гена может регулироваться на каждом этапе пути от ДНК к РНК и к белку [3]
Если различия между клетками разных типов обусловлены тем, какие белки экспрессируются в них, важно знать, на каком уровне осуществляется контроль белкового синтеза. На пути, ведущем от ДНК к белку, этот контроль может реализоваться практически на любом этапе (рис. 10-2). Основными «контрольными точками» могут служить: 1) время и характер транскрипции данного гена (контроль на уровне транскрипции), 2) характер процессинга первичного РНК-транскрипта (контроль ва уровне процессинга), 3) отбор в ядре зрелых мРНК, предназначенных для экспорта в цитоплазму (контроль на уровне транспорта), 4) отбор в цитоплазме мРНК для трансляции на рибосомах (контроль на уровне трансляции), 5) избирательная дестабилизация определенных типов мРНК в цитоплазме (контроль на уровне деградации мРНК), 6) селективная активация, инактивация или компартментация молекул белка после их синтеза (контроль на уровне активности белка).
Для большинства генов наиболее важен контроль на уровне транскрипции. Первые данные о той роли, которую играет контроль на уровне транскрипции в развитии позвоночных, были получены при сравнении молекул мРНК печени с мРНК мозга. Некоторые из этих РНК присутствовали только в клетках печени. С помощью кДНК-зондов показано, что в клетках мозга нет не только соответствующих мРНК, но также и первичных транскриптов, из которых она образовывалась. Для того, чтобы убедиться в этом, из клеток печени и мозга выделяли ядра, а затем их инкубировали с высоко радиоактивными РНК-предшественниками (рибонуклеозидтрифосфатами). В результате все РНК-транскрипты, синтезированные за это время, оказывались радиоактивно меченными. Этот процесс, известный под названием «продолжающегося синтеза в ядре», схематически представлен на рис. 10-3. Меченые молекулы РНК затем тщательно анализировали (рис. 10-4 и 10-5). Достоверно показано, что в гяРНК клеток мозга нет участков гомологии с какой-либо из 11 различных мРНК, специфичных для клеток печени. В этих опытах гяРНК из клеток печени служила положительным контролем, поскольку она заведомо содержит последовательности, гибридизующиеся с кДНК печени. Отсутствие мРНК, специфичных для печени (и следовательно, кодируемых ими белков) в цитоплазме клеток мозга можно отнести в первую очередь за счет блокирования транскрипции соответствующих генов в этих клетках. Другими словами, данные о случайно отобранных специфичных для печени мРНК, свидетельствуют о том, что различия между клетками печени и мозга контролируются в основном на уровне транскрипции.
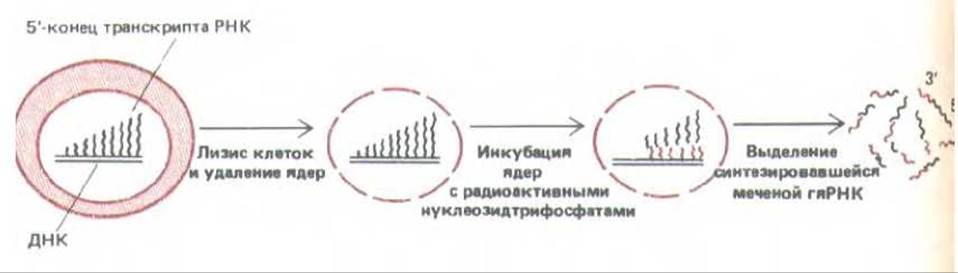
Рис. 10-3. Получение радиоактивно меченной гяРНК. Молекулы РНК-полимеразы после введения метки и лизиса клетки продолжают элонгацию тех же молекул РНК in vitro, при этом исследователь получает высокоактивный препарат тех последовательностей, которые транскрибируются в клетке (первичные транскрипты РНК).

Рис. 10-4. Схема стандартного метода выявления радиоактивно меченных молекул РНК, имеющих определенную нуклеотидную последовательность. В том случае, если молекулы РНК могут образовать гибридный РНК/ДНК дуплекс с одноцепочечным фрагментом ДНК, используемым в качестве специфического зонда, эти молекулы остаются неповрежденными в процессе нуклеазной обработки и легко обнаруживаются по радиоактивной метке. В экспериментах, описанных в тексте, очищенные сегменты ДНК, соответствующие разным генам, были получены с помощью клонирования молекул кДНК, которые, в свою очередь, были синтезированы путем обратной транскрипции суммарной мРНК печени. Каждый из этих фрагментов ДНК использовали в качестве зонда в отдельном эксперименте (см. рис. 10-5).
10-4
10.1.4. Белки-регуляторы могут либо активировать, либо подавлять транскрипцию генов
Клетки эукариот содержат большое количество сайт-специфических ДНК-связывающих белков, основная функция которых состоит во включении или выключении генов. Каждый из этих белков-регуляторов, присутствующих в количестве нескольких копий на клетку (~ 1 молекула на 3000 нуклеосом или 104 копий на клетку млекопитающего), узнает определенные последовательности ДНК, длиной 8-15 нуклеотидов. Присоединение таких белков к ДНК может либо вызвать транскрипцию расположенного рядом гена (позитивная регуляция), либо подавить ее (негативная регуляция) (рис. 10-6). Далее мы расскажем о некоторых механизмах, участвующих в этих процессах (см. разд. 10.2.7). Различные типы клеток многоклеточного организма обладают разными белками-регуляторами, в результате каждый тип клеток транскрибирует свой собственный набор генов.
10.1.5. Комбинации нескольких регуляторных белков, контролирующих активность генов, могут определять развитие многих типов клеток [4]
Принципиальная схема комбинационной регуляции активности гена приведена на рис. 10-7, где каждый пронумерованный элемент соответствует отдельному белку-регулятору. На этой чисто гипотетичной схеме одна материнская клетка дает начало двум типам клеток А и В, различающимся лишь тем, что в одной из них происходит синтез регуляторного белка 1, а в другой-нет. В ходе дальнейшего развития этих клеток в некоторых из них появляются регуляторные белки 2 и 3, а затем 4 и 5. В результате формируются 8 типов клеток (они обозначены буквами от G до N), характеризующиеся различными сочетаниями пяти регуляторных белков. Добавление к приведенной схеме еще двух белков-регуляторов (6 и 7) повлечет за собой образование на следующей стадии 16 типов клеток. Еще 10 подобных стадий в сумме дадут 10000 различных клеточных типов и все это за счет взаимодействия только 25 регуляторных белков.
Таким образом, комбинационная регуляция активности гена весьма эффективна: малое число регулирующих элементов может детерминировать нормирование сложных биологических объектов В гл. 16 будет показано, как эта система функционирует в ходе развития зародыша дрозофилы. Набор регуляторных генов определяет последовательное подразделение эмбриона на отличающиеся друг от друга участки (см. разд. 16.5.5).
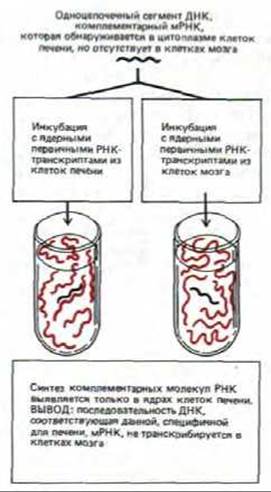
Рис. 10-5. Схема эксперимента, демонстрирующего, что экспрессия генов в клетках млекопитающих контролируется главным образом на уровне транскрипции (см. рис. 10-4).
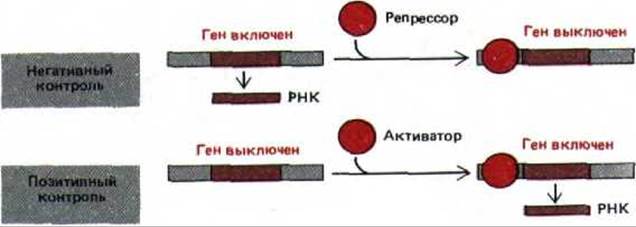
Рис. 10-6. Сравнение позитивной и негативной регуляции. В данном примере показан контроль на уровне транскрипции, однако те же два типа контроля могут быть задействованы на любом из этапов регуляции, представленных на рис. 10-2.
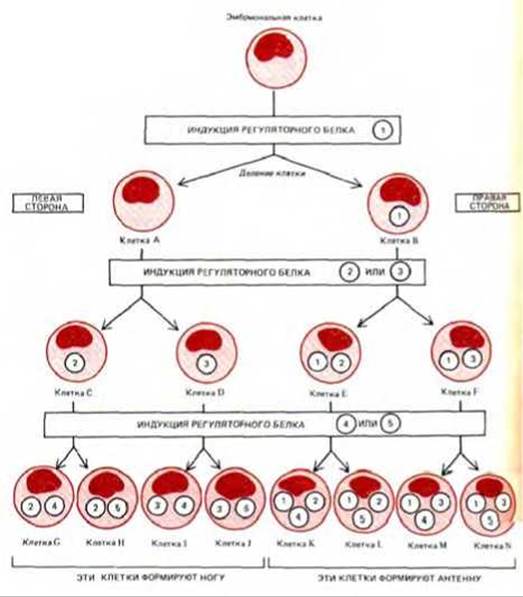
Рис. 10-7. Упрощенная схема дифференцировки клеток эмбриона, иллюстрирующая, каким образом разные комбинации небольшого числа белков-регуляторов могут обеспечить возникновение клеток многих типов. Эта предельно упрощенная схема предполагает, что после каждого деления происходит выбор в пользу синтеза какого-либо одного из двух белков-регуляторов (обозначенных пронумерованными кружочками). При этом сообразно занимаемой условной позиции дочерние клетки, отходящие влево относительно общего плана строения эмбриона (и относительно страницы этой книги), всегда индуцируют синтез белков с четными номерами, тогда как дочерние клетки, отходящие вправо-синтез белков с нечетными номерами. Считается, что синтез каждого белка-регулятора - самоподдерживающийся процесс (см. рис. 10-33 и 10-35). Таким образом, клетки разрастающегося клона будут содержать все увеличивающееся число различных белков-регуляторов, каждый из которых контролирует целую «батарею» генов.
10.1.6. Активность гена обычно зависит от действия нескольких регуляторных белков [5]
На первый взгляд схема комбинационной регуляции активности генов, представленная на рис. 10-7, дает основание для вывода о постепенно накапливающихся различиях между клетками последующих поколений. Например, можно предположить, что добавление регуляторного белка 2 к клеткам С и Е приведет к появлению в этих клетках одного и того же набора дополнительных белков (тех, которые кодируются генами, активируемыми белком-регулятором 2). Подобная точка зрения неверна по очень простой причине. Комбинационная регуляция гена гораздо сложнее этой схемы потому, что различные регуляторные белки взаимодействуют друг с другом. Даже у бактерий для включения одного-единственного гена иногда бывает необходимо взаимодействие двух различных регуляторных белков (см. разд. 10.2.2). У высших эукариот транскрипция какого-либо гена обычно требует совместного действия целого кластера активаторных белков (см. разд. 10.2.9). Например, белок 2 при взаимодействии с активаторным белком 1 может включать в клетке Е иной набор генов, нежели тот, который он включает в клетке С. По-видимому, именно поэтому единственный белок-рецептор стероидного гормона (пример белка-регулятора) в различных типах клеток млекопитающих определяет синтез разных наборов белка (см. разд. 12.2.2). В целом, специфические изменения в экспрессии гена, возникающие в результате синтеза регуляторного белка, зависят от предыстории клеток, так как именно эти предыдущие события и определяют, какие белки-регуляторы уже имеются в клетке (рис. 10-8).
10.1.7. Главные белки-регуляторы активируют сразу много генов [6]
Как отмечалось ранее, в клетке содержится много регуляторных белков, каждый из которых, действуя в комбинации с другими белками этого класса, контролирует многочисленные гены. Вероятно, существует разветвленная схема взаимодействий белков, согласно которой каждый из регуляторных белков контролирует гены, кодирующие другие белки-регуляторы и так далее.

Рис. 10-8. Воздействие вновь синтезированных белков-регуляторов на клетку. Подобное воздействие зависит от того, какие белки- регуляторы уже имеются в клетке и, следовательно, от ее предыстории. На схеме один и тот же ген изображен в клетках А и В. Изначально этот ген в обеих клетках выключен. Однако в клетке А продуцируется белок, изображенный крайним слева и отсутствующий в клетке В. Для простоты принимается, что каждый белок-регулятор либо положительно, либо отрицательно воздействует на транскрипцию, которая определяется их совместным воздействием. В действительности же общее воздействие не обязательно осуществляется по принципу аддитивности. Например, в некоторых случаях два белка-регулятора при связывании с ДНК взаимодействуют друг с другом, причем происходит изменение активности каждого из них.
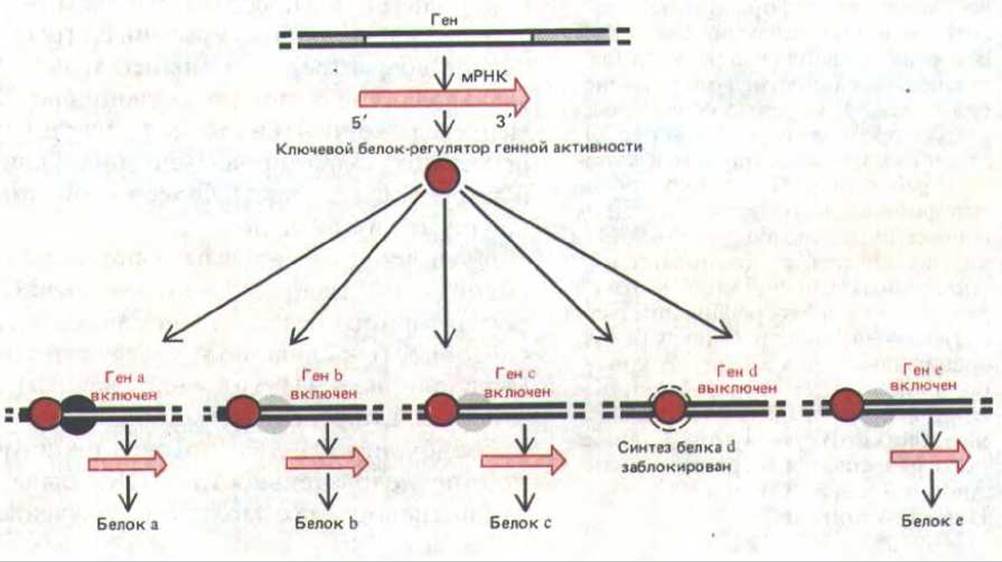
Рис. 10-9. Схема, иллюстрирующая, как «решение» синтезировать один-единственный главный белок-регулятор может воздействовать на образование самых разных белков в клетке.
Однако не все регуляторные белки равны. Некоторые из них (главные белки-регуляторы) обладают решающим, координирующим действием на активность многих генов (рис. 10-9). Например, в гл. 16 будет показано, как ряд мутаций одного-единственного гена у Drosophila превращает одну часть тела мухи в другую. Мутации, вызывающие подобные изменения, известны под названием гомеотических (или гомеозисных). Одна из таких мутаций, названная Antennapedia, обусловливает синтез абберантного главного белка-регулятора. В результате целая группа клеток, в норме образующих антенну, коренным образом меняет свое поведение и формирует ногу; в итоге на свет появляется муха с растущей на голове ногой. О существовании главных регуляторных белков у позвоночных (включая человека) может свидетельствовать следующий факт. Отсутствие одного-единственного белка (рецептора стероидного гормона тестостерона) приводит к тому, что эмбрион с мужским генотипом (XY) развивается в фенотипически почти нормальную женщину (см. разд. 12.2.3). Прямое доказательство участия главных регуляторных белков в развитии позвоночных получено недавно при исследовании клеток скелетной мышцы.
10-5
10.1.8. Один-единственный главный белок-регулятор может превратить фибробласт в миобласт [7]
Клетка скелетной мышцы млекопитающих обычно очень велика и содержит много ядер. Она образуется в результате слияния многих клеток-предшественников, называемых миобластами (см. разд. 17.6.1). Зрелая мышечная клетка отличается от других клеток большим числом присущих только ей белков, включая специфические типы актина, миозина, тропомиозина и тропонина (входящих в состав сократительного аппарата), креатинфосфокиназу (обеспечивающую специализированный метаболизм мышечной клетки) и ацетилхолиновые рецепторы (необходимые для того, чтобы мембрана была чувствительна к нейростимуляции). В пролиферирующих миобластах такие специфичные для мышц белки и соответствующие им мРНК отсутствуют либо обнаруживаются в очень небольших количествах. По мере слияния миобластов в образующихся клетках одновременно увеличивается концентрация мышечно-специфичных белков и их мРНК. Следовательно, контроль за экспрессией соответствующих генов осуществляется на уровне транскрипции. Уровень синтеза многих специфичных для мышцы белков возрастает по меньшей мере в 500 раз. С помощью двумерного электрофореза в полиакриламидном геле показано, что одновременно меняется концентрация многих других белков: некоторые из них перестают синтезироваться, продукция других достигает максимума и затем падает, у части белков происходит сдвиг с одного уровня синтеза на другой и так далее.
Если в культивируемые фибробласты кожи (клетки, которые в норме никогда не экспрессируют мышечно-специфичные гены) ввести ген регуляторного белка из миобласта (myo D1), такие клетки приобретают способность к слиянию и другие свойства мышечных клеток (рис. 10-10). Очевидно myo D1 является главным регуляторным белком, который в норме и определяет «миобласт». Белок myo D1 сосредоточен в клеточном ядре. Исходя из нуклеотидной последовательности ДНК, была определена последовательность аминокислот в его молекуле. Изучение белка myo D1 показало, что он связывается с регуляторними участками генов, специфичных для мышц. Свойства этого замечательного белка подтверждает предположение о том, что главные регуляторные белки способны детерминировать превращение клеток.

Рис. 10-10. Иммунофлуоресцентная микрофотография фибробластов кожи куриного эмбриона, превратившихся в клетки мышц при экспрессии в них гена myo D1, которая была вызвана искусственным путем. Эти фибробласты выращивали в культуре и за три дня до съемки трансформировали рекомбинантной плазмидной ДНК. В состав этой плазмиды входили последовательности, кодирующие белок myoD, которые соединены с промотором/энхансером вирусного происхождения, активным в куриных эмбрионах. Несколько процентов фибробластов включало ДНК и продуцировало белок myoD. Эти клетки слились с образованием удлиненных миофибрилл, которые на этой фотографии помечены антителами, выявляющими белок, специфичный для мышц. В контрольной культуре, трансфицированной другой плазмидой, мышечные клетки отсутствуют. (С любезного разрешения Stephen Tapscott, Andrew Lassar, Robert Davis и Harold Weintraub.)
Заключение
У многоклеточных организмов дифференцировка клеток происходит в результате экспрессии разных генов одного и того же генома, хотя типы клеток на удивление мало отличаются друг от друга по содержанию белков. Экспрессия большинства генов контролируется на уровне транскрипции, что не исключает существенной роли посттранскрипционного контроля. Контроль на уровне транскрипции зависит от регуляторных белков, связывающихся с определенными последовательностями ДНК. В результате присоединения таких белков соответствующие гены либо включаются (позитивный контроль) либо выключаются (негативный контроль). Гены высших эукариот обычно регулируются путем комбинационного воздействия нескольких белков-регуляторов, осуществляющих позитивный и негативный контроль. Главные регуляторные белки играют в системе регуляции активности генов особую роль благодаря тому, что они влияют на активность сразу многих генов: например, экспрессия гена туо D1 может превратить фибробласт в миобласт.