Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Контроль генной экспрессии
Контроль инициации транскрипции
Всего лишь 40 лет назад мысль о том, что ген можно включать или выключать, казалась абсурдной. Гипотеза, сыгравшая такую важную роль в понимании работы клеток, была выдвинута на основании изучения Е. coli, растущей на смеси глюкозы и лактозы (дисахарид). Если бактерии предоставляли выбор источника углерода, она сначала использовала всю глюкозу и лишь затем начинала метаболизировать лактозу. Переключение на лактозу сопровождалось остановкой роста, в течение которой синтезировался фермент ß-галактозидаза, гидролизирующий лактозу до глюкозы и галактозы. Выделение и характеристика мутантных бактерий, обладающих определенными дефектами в регуляции такого переключения, дало толчок биохимическим исследованиям, которые в 1966 г. привели к идентификации и выделению белка-penpeccopa лактозного оперона.
В результате биохимического и генетического изучения белка-репрессора лактозного оперона, репрессора бактериофага лямбда, а также других регуляторных белков у бактерий была сформулирована общая модель регуляции транскрипции у прокариот. Предполагалось, что сайтспецифические белки либо ингибируют, либо стимулируют транскрипцию какого-либо гена, присоединяясь к ДНК рядом с промотором-участком, с которого РНК-полимераза начинает синтез РНК. Считали, что изменение в положении таких регуляторных белков по отношению к ДНК (связывание или отсоединение) включает и выключает гены.
В течение многих лет оставалось неизвестным, можно ли применять эту модель контроля генетической активности к клеткам эукариот. Известно, что ДНК эукариотической клетки упакована с помощью гистоновых белков в нуклеосомы, масса которых равна массе ДНК. Присутствие нуклеосом предполагает существование каких-то иных путей регуляции генов. Об этом же свидетельствует и тот факт, что у эукариот регуляторные белки часто связываются в участках, удаленных на тысячи нуклеотидных пар от промотора, на который они действуют. Возможности изучения механизма регуляции генов эукариот были ограничены главным образом из-за того, что большинство белков- регуляторов присутствует в клетке в очень малых количествах (примерно один из 50000 молекул белка). Только в 1983 г. удалось охарактеризовать два необычно многочисленных (и, возможно, нетипичных) белка-регулятора - большой Т-антиген вируса SV40 и фактор транскрипции TF1IIA гена 5S-pPHK.
В последнее время ситуация в корне изменилась. Благодаря новым методам генной инженерии для биохимического и генетического анализа стало доступным большое число белков-регуляторов эукариот. Кроме того, у бактерий были выявлены белки-регуляторы, осуществляющие свое действие на расстоянии. Данный раздел посвящен тому общему, что объединяет механизмы регуляции транскрипции генов у прокариот и у эукариот. Процессы, которые могут оказаться характерными только для эукариот, мы обсудим позднее в связи с проблемой дифференцировки клеток (см. разд. 10.3.8).
10-8
10.2.1. Белки-репрессоры бактерий связываются вблизи промоторов и подавляют транскрипцию определенных генов [9]
Хромосома Е, coli состоит из единственной кольцевой молекулы ДНК, насчитывающей ~4,7 х 106 нуклеотидных пар. В принципе такого количества достаточно для кодирования примерно 4000 различных белков, однако в конкретный момент времени в клетке синтезируется лишь определенная часть этих белков. Экспрессия многих генов E.coli зависит от внутриклеточного уровня специфических метаболитов.
Изучение генетического контроля утилизации лактозы в клетках Е. coli привело исследователей к выводу о существовании белка-репрессора, который в отсутствие лактозы в среде выключает синтез ß-галактозидазы. Выделение, очистка этого белка и использование его в опытах in vitro позволили расшифровать механизм такой регуляции. Оказалось, что репрессор ингибирует транскрипцию lac-оперона, связываясь с так называемым оператором - последовательностью ДНК длиной 21 нуклеотид, которая перекрывается с расположенным по соседству участком связывания РНК-полимеразы (промотором). До тех пор, пока репрессор остается связанным с оператором, доступ РНК-полимеразы к ее участку связывания закрыт и транскрипция близлежащих областей ДНК не происходит (см. рис. 10-14).
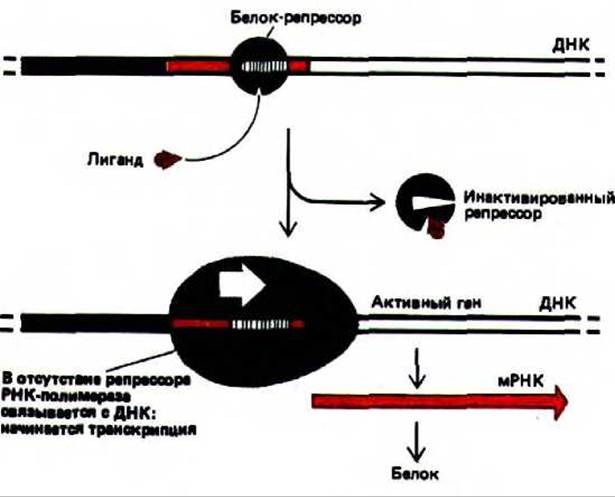
Рис. 10-11. Схема дерепрессии у бактерий. Небольшая специфическая молекула связывается с белком-репрессором, в результате чего происходит изменение его конформации и отделение от ДНК, при этом расположенные рядом гены могут начать транскрибироваться. В случае примера, описанного в тексте, аллолактоза связывается с белком-репрессором лактозного оперона, в результате чего синтезируется единственный транскрипт РНК, кодирующий три белка, которые участвуют в метаболизме лактозы (ß-галактозидаза, галакто-зидпермеаза и галактозидацетилаза). Поскольку три гена, кодирующие эти белки, расположены рядом друг с другом и их регуляция осуществляется строго координирование, кластер этих генов называют лактозным опероном.
Белок-реперессор лактозного оперона отвечает за то, чтобы уровень синтеза ß-галактозидазы - фермента, необходимого для расщепления лактозы, соответствовал потребностям клетки. Лактозный репрессор в свою очередь находится под контролем небольшой углеводной молекулы аллолактозы, которая образуется в клетке в присутствии лактозы. Когда внутриклеточное содержание аллолактозы достигает достаточно высокого уровня, она, выполняя функцию аллостерического регулятора, индуцирует конформационные изменения в молекуле репрессора. При этом его связь с ДНК ослабляется настолько, что он отделяется от нее, освобождая промотор и давая возможность РНК-полимеразе транскрибировать прилежащие области ДНК. В этом случае говорят о дерепрессии гена. Такая система регуляции позволяет E.coli производить фермент, необходимый для расщепления лактозы, лишь тогда, когда это необходимо (рис. 10-11).
В настоящее время известно много других примеров специфической репрессии бактериальных генов. В каждом случае связывание белка- репрессора с определенной последовательностью ДНК приводит к выключению гена. Процесс связывания всегда регулируется определенными сигнальными молекулами, аналогичными аллолактозе. Иногда, как в случае репрессора лактозного оперона, присутствие сигнальных молекул в клетке включает ген или единицу транскрипции, уменьшая сродство белка-репрессора к определенной последовательности ДНК. Но сигнальная молекула может использоваться и для выключения гена с помощью белка-репрессора. Например, аллостерическое изменение, вызванное связыванием сигнальной молекулы с репрессором, может повысить, а не понизить способность репрессора связываться с определенной последовательностью ДНК. Такой механизм действует в случае контроля активности пяти расположенных рядом генов, которые кодируют ферменты, необходимые для синтеза триптофана в клетках E.coli (trp-оперон). Синтез единственной длинной молекулы мРНК, кодирующей эти пять белков, контролируется белком-репрессором, который «садится» на ДНК лишь в том случае, если он связан с триптофаном (сигнальная молекула, включающая этот оперон) (рис. 10-12).
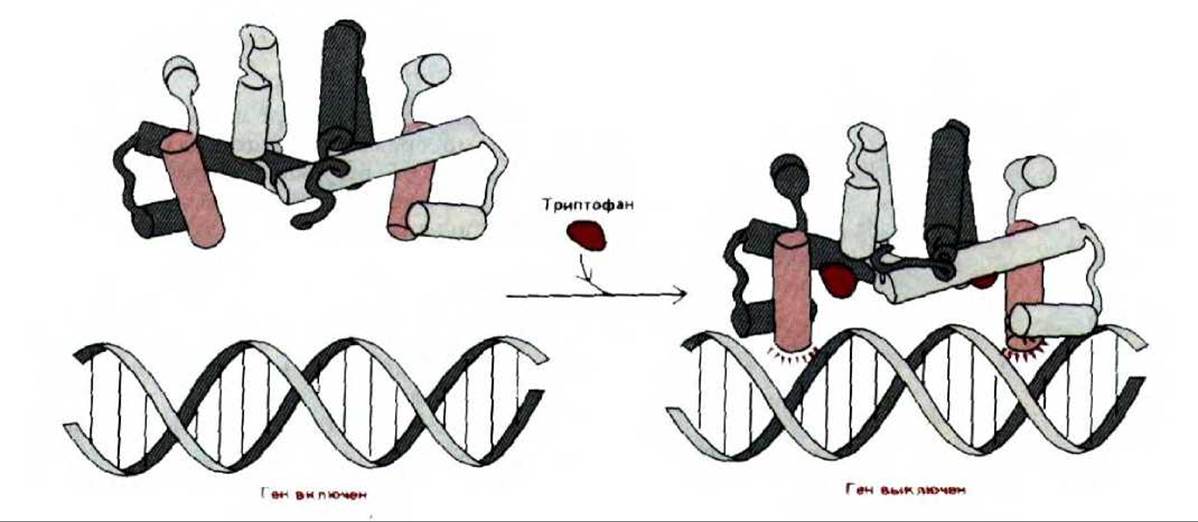
Рис. 10-12. Соединение триптофана с белком-репрессором триптофанового оперона изменяет конформацию репрессора. Конформационные изменения дают возможность этому регуляторному белку тесно связываться со специфической последовательностью ДНК, и, таким образом, блокировать транскрипцию генов, которые кодируют белки, участвующие в синтезе триптофана (trp-оперон). Трехмерная структура этого бактериального белка (спираль-виток-спираль) определена с помощью метода рассеивания рентгеновских лучей и показана как в случае связывания триптофана, так и без него. Связывание триптофана приводит к увеличению расстояния между двумя узнающими спиралями (цветные цилиндры) в димере, что способствует образованию симметрично расположенных водородных связей, изображенных на схеме в виде цветных лучей. (По R. Zhang et al., Nature, 327: 591-597, 1987.)
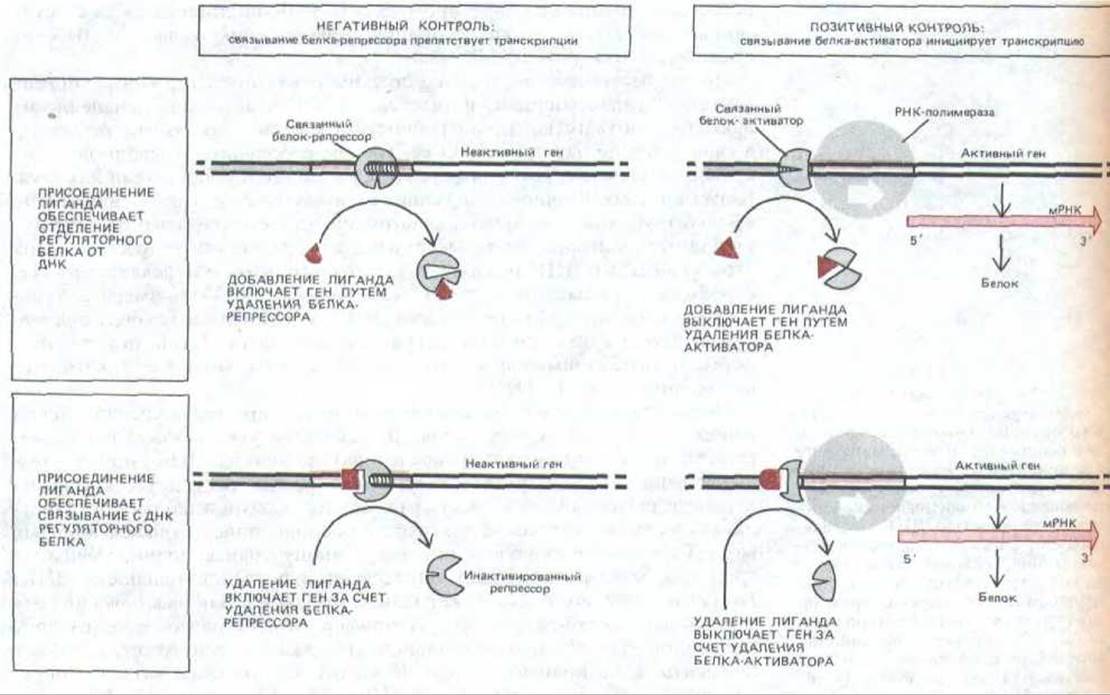
Рис. 10-13. Обобщенная схема различных механизмов, с помощью которых специфические регуляторные белки контролируют транскрипцию генов у прокариот. А. Негативный контроль; Б. Позитивный контроль. Обратите внимание, что лиганд-индуктор может включить ген, либо обеспечивая удаление белка-репрессора (слева вверху), либо способствуя присоединению к ДНК белка-активитора (справа внизу). Аналогичным образом лиганд-ингибитор может выключить ген как путем удаления белка-активатора (справа вверху), так и путем связывания белка-репрессора с ДНК (слева внизу).
В случае laс-оперона повышение концентрации сигнальных молекул способствует освобождению ДНК от репрессора и активации транскрипции, а в случае trp-оперона вызывает связывание репрессора с ДНК и, таким образом, подавляет транскрипцию. Следует, однако, подчеркнуть, что оба описанных механизма в принципе одинаковы: и в том, и в другом случае транскрипция осуществляется в отсутствие регуляторного белка. Генетический контроль такого типа называется негативной регуляцией (рис. 1013, А).
10-10
10.2.2. Бактериальный белок-активатор взаимодействует с РНК-полимеразой и способствует инициации транскрипции [10]
В случае негативной регуляции белок-рецептор связывается с участком, расположенным рядом с промотором, и подавляет активность РНК-полимеразы. Альтернативный способ регуляции генной активности основан на действии белков-активаторов, усиливающих активность РНК-полимеразы. У Е. coli такая позитивная регуляция играет важную роль в активации транскрипционных единиц, обладающих относительно слабыми промоторами, которые сами по себе плохо связываются с полимеразой. Присоединение белка-активатора к специфической последовательности ДНК, расположенной недалеко от промотора, облегчает «посадку» РНК-полимеразы, что в конечном итоге приводит к повышению вероятности транскрипции.
Несмотря на разницу в действии белков-активаторов и белков-репрессоров, по многим свойствам они близки. Более того, оказалось, что определенные бактериальные белки-регуляторы способны функционировать и как репрессоры, и как активаторы: они связываются с различными сайтами и в некоторых из них подавляют транскрипцию, а в других активируют. Активаторы, как и репрессоры, часто соединяются со специфическими сигнальными лигандами, которые либо повышают, либо понижают их сродство к ДНК, и таким путем, соответственно, включают или выключают гены. Такая регуляция транскрипционной активности генов носит название позитивной регуляции, поскольку эффективность синтеза РНК повышается в присутствии регуляторного белка (рис. 10-13, Б).
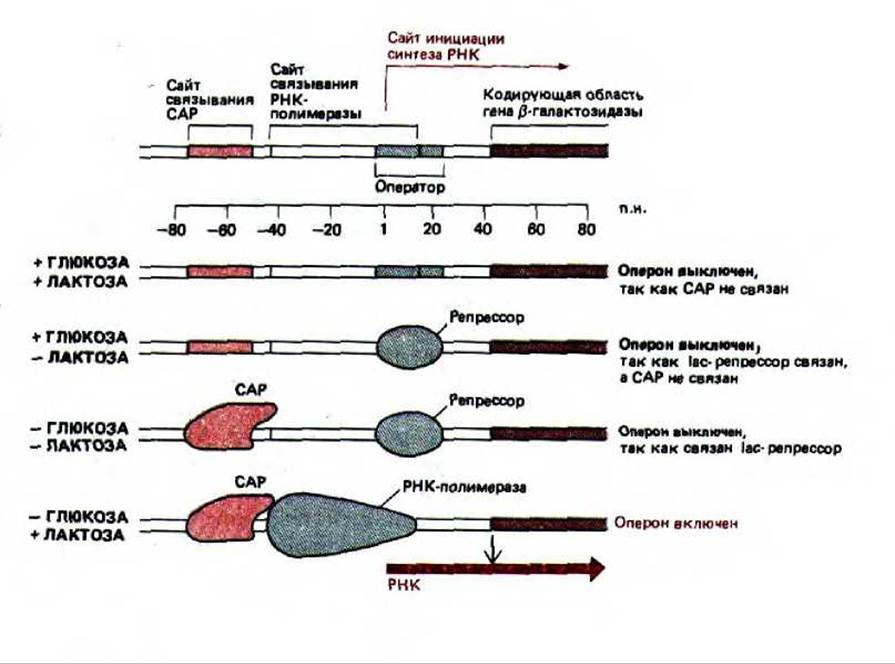
Рис. 10-14. Концентрация глюкозы и лактозы контролирует инициацию транскрипции lac-оперона путем воздействия на белок-репрессор лактозного оперона и САР. При добавлении лактозы происходит увеличение концентрации аллолактозы, которая удаляет белок-репрессор с ДНК (см. рис. 10-11). Добавление глюкозы вызывает уменьшение концентрации сАМР, и поскольку сАМР больше не связывается с САР, этот активаторный белок отделяется от ДНК, выключая таким образом оперон. Связывающие сайты и белки изображены в масштабе. Как показано на схеме, полагают, что САР соприкасается с полимеразой, что помогает ей начать синтез РНК.
Наиболее изученный пример белка-актива тора - белок-активатор катаболизма (САР) Е. coli. Этот белок позволяет бактерии использовать альтернативные источники углерода, если глюкоза - основной его источник, отсутствует.
В случае 1ас-оперона взаимодействие репрессора и САР-белка обусловливает характерную картину экспрессии гена. Как отмечалось выше, в присутствии лактозы аллолактоза разъединяет репрессор и ДНК. Однако этого оказывается недостаточно для активации транскрипции lас-оперона, в связи с тем, что его промотор лишь отдаленно напоминает консенсусную последовательность промоторов Е. coli и, следовательно, обладает очень слабым сродством к РНК-полимеразе. Для транскрипции с этого промотора необходимо, чтобы его связывание с РНК-полимеразой было дополнено присоединением САР-белка на участке, расположенном прямо перед промотором (рис. 10-14). Такая же ситуация характерна для промоторов многих генов, участвующих в метаболизме Сахаров.
Связывание ДНК с САР регулируется глюкозой, это приводит к тому, что другие источники углерода используются клеткой только в отсутствие глюкозы. Недостаток глюкозы обусловливает повышение внутриклеточной концентрации сАМР, выполняющего роль сигнальной молекулы у бактерий и у эукариот. При связывании сАМР с САР-белком последний меняет свою конформацию, в результате чего приобретает способность присоединяться к определенной последовательности ДНК и активировать транскрипцию близлежащих генов. Если глюкозы много, уровень сАМР падает, его молекула отделяется от САР-белка, который при этом превращается в неактивную форму, не способную более связываться с ДНК; в результате клетка переключается на утилизацию глюкозы (см. рис. 10-14).
10-9
10.2.3. Изменения в фосфорилировании белков могут влиять на активность генов [11]
Все ранние работы по белкам-репрессорам были выполнены на бактериях. Выяснилось, что и у лактозного, и у трипто фанового оперона активность этих белков контролируется посредством обратимого связывания небольших специфических молекул. В клетках эукариот белки-регуляторы тоже находятся под контролем небольших сигнальных молекул, таких, например, как сАМР. Эти молекулы осуществляют свое воздействие непрямым путем, влияя на фосфорилирование и дефосфорилирование белка. Хотя у бактерий фосфорилирование не играет такой важной роли в регуляции, и у них существует одна хорошо изученная система контроля, зависящая от фосфорилирования белков. На примере этой системы мы рассмотрим некоторые аспекты регуляции генов, знание которых способствует пониманию более сложной системы регуляции высших эукариот.
Известно, что у бактерий родственные белки контролируют азотный и фосфатный обмен, синтез белков мембраны, хемотаксис и споруляцию. Здесь будет рассмотрен азотный обмен у Е. coli, в котором синтез ряда белков усиливается при нехватке азота. К таким белкам относится глутаминсинтетаза - фермент, играющий наиболее важную роль в усвоении азота и катализирующий реакцию: глутаминовая кислота + аммиак → глутамин.
В активации генов азотного обмена участвует два основных регуляторных компонента: белок ntrC, активирующий белок, способный включать гены лишь тогда, когда он фосфорилирован (ntrC-фосфат), и белок ntr В, который может либо фосфорилировать (благодаря своей киназной активности), либо дефосфорилировать (благодаря своей фосфатазной активности) белок ntrC. Фосфорилирование ntrC происходит в ходе реакций, запускающихся снижением уровня азота, при этом остатки уридинмонофосфата (UMP) присоединяются к регуляторной субъединице ntr В. Такая модификация повышает относительную киназную активность фермента ntr В.
Потребность в азоте определяется соотношением а-кетоглутарата и глутамина, повышение этого показателя стимулирует фосфорилирование ntr С и, таким образом индуцирует транскрипцию гена глутаминсинтетазы (рис. 10-15). Аналогичные цепочки реакций модификации белков происходят и в клетках эукариот, они тоже приводят к фосфорилированию или дефосфорилированию белков-регуляторов, хотя детали этого процесса изучены гораздо хуже.
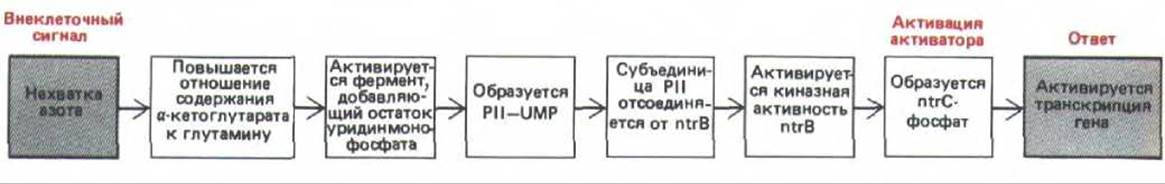
Рис. 10-15. Часть регуляторного каскада, который при нехватке азота активирует гены, участвующие в метаболизме азота у бактерий. Белок Р II служит регуляторной субъединицей белка ntrB. Преимущество подобной многоступенчатой регуляции состоит в том, что она может вызывать значительные изменения в метаболизме в ответ на относительно небольшие изменения в содержании азота. Побочные ответвления этой цепи также обратимо модифицируют другие ферменты, контролируя их каталитическую активность в ответ на изменения концентрации азота.
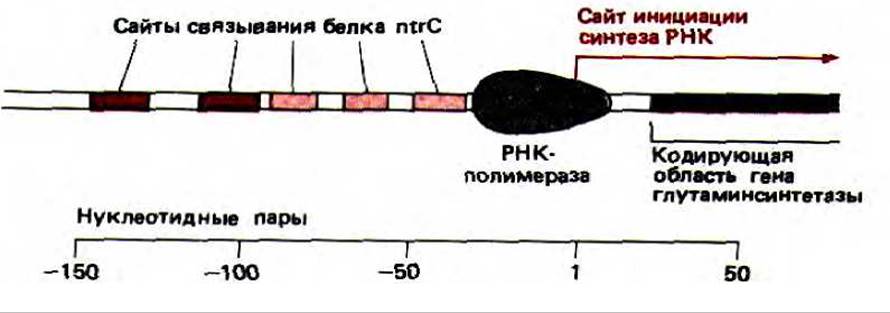
Рис. 10-16. Регуляторная область бактериального гена глутамин-синтетазы. Глутамин-синтетаза катализирует реакцию глутаминовая кислота + аммиак → глутамин. Два ярко окрашенных на рисунке сайта связывают белок ntrC особенно сильно и необходимы для активации транскрипции.
10-10
10.2.4. Гибкость ДНК позволяет регуляторным белкам, связывающимся с отдаленными участками, влиять на транскрипцию генов [11, 12]
Только что описанная двухкомпонентная регулирующая система у бактерий имеет много общего с системой контроля эукариотических генов. Дело в том, что в ДНК существует два сильных участка связывания для белка ntrC, которые расположены на расстоянии 100 или более нуклеотидных пар перед промотором гена глутамин-синтетазы (рис. 10-16). В фосфорилированной форме ntrC (ntrC-фосфат) связывается с ними, и эти два сайти эффективно стимулируют транскрипцию. Более того, стимуляция наблюдается, даже если эти участки «отодвинуть» (методами генетической инженерии) от промотора более чем на ТОО нуклеотидных пар.
Если в отношении прокариот такое «действие на расстоянии» нельзя назвать чем-то необычным, а отношении эукариот этот феномен следует признать широкораспространенным. У прокариот имеется надежное доказательство того, что белки, связавшиеся с отдаленными участками ДНК, действуют по преимуществу так же, как и белки, присоединенные к соседним областям. Например, белок nlrC усиливает способность РНК-полимеразы связываться с промотором и образовывать открытый инициаторный комплекс (см. рис. 9-65). Разделяющая эти сайты ДНК формирует петлю, что позволяет белкам, связавшимся в отдаленных участках, взаимодействовать с полимеразой (рис. 10-17). Такое взаимодействие происходит довольно легко, поскольку ДНК действует как «ограничитель» и белок, связавшийся даже на расстоянии нескольких тысяч нуклеотидных пар, постоянно сталкивается с промотором (рис. 10-18).
10.2.5. Различные сигма-факторы позволяют бактериальной РНК-полимеразе узнавать разные промоторы [11, 13]
В гл. 9 шла речь о том, что у бактерий существует еще один тип контроля генной активности на уровне транскрипции. При обсуждении строения бактериальной РНК-полимеразы отмечалось, что одна из составляющих ее пяти основных полипептидных цепей-сигма (5) фактор - функционирует как фактор инициации. Этот фактор отделяется от ДНК в гот момент, когда полимераза начинает синтез РНК (см. разд. 9.4.1). У бактерий консенсусная последовательность транскрибируемого промотора узнается основной формой РНК-полимеразы, содержащей субъединицу 570. Однако существуют и минорные формы полимераз, в состав которых входят 5-субъединицы, узнающие другие последовательности промотора. Например, субъединица 554 является продуктом гена ntrA и наряду с белками ntrВ и ntrC необходима именно для транскрипции гена глутаминсинтетазы. Вполне возможно, что изменения в окружающей среде могут включать специфический набор генов благодаря синтезу определенного сигма-фактора.
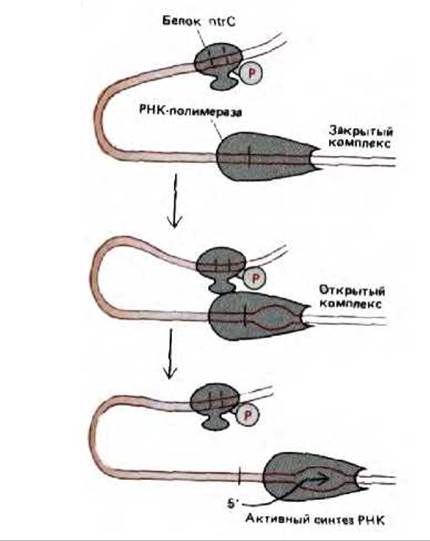
Рис. 10-17. Схема энхансерного воздействия белка ntrC на синтез РНК гена глутамин-синтетазы E. coli. Связываясь с расположенными перед геном последовательностями ДНК, этот регуляторный белок повышает скорость транскрипции РНК-полимеразой. Хотя белок присоединяется к этим сайтам даже когда он не фосфорилирован, лишь фосфорилированная форма (ntrC-фосфат) может активировать транскрипцию. Вероятно, для функционирования белка необходимы контакты с полимеразой, которые увеличивают присущую этому ферменту способность раскручивать ДНК и образовывать открытый комплекс (см. рис. 9-65), как показано на рисунке (см. рис. 10-18).
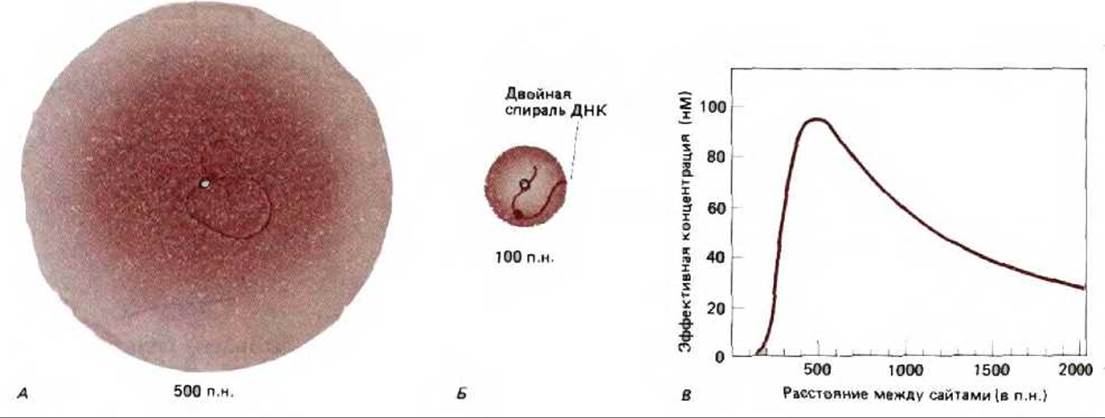
Рис. 10-18. Присоединение двух белков к отдельным сайтам на двойной спирали ДНК может в значительной мере повысить вероятность их взаимодействия. А. Связывание белков с помощью петли ДНК размером 500 нуклеотидных пар повышает частоту их сталкивания. Интенсивность цвета отражает вероятность того, что окрашенный белок будет располагаться в каждой из точек пространства, окружающего белок, обозначенный белым кружочком. Б. Гибкость ДНК такова, что обычная последовательность образует плавный изгиб под углом 90° (изогнутый виток) примерно один раз на каждые 200 нуклеотидных пар. Следовательно, если два белка разделены всего лишь 100 нуклеотидными парами, их контакты относительно ограничены. В таких случаях взаимодействие белков облегчается, если они расположены на одной и той же стороне спирали ДНК (содержащей 10 нуклеотидов на виток). В. Эффективность концентрации окрашенного белка в сайте связывания белого белка как функция разделяющего их расстояния. (С любезного разрешения Gregory Bellomy, по М.С. Mossing and M.T. Record, Science 233: 889-892, 1986.)
Как отличить фактор инициации РНК-полимеразы, например, 554, влияющий на узнавание промотора, от белка-регулятора, такого например, как ntrC? Один из подходов к решению этой задачи основан на том, что 5-факторы прочно соединяются с РНК-полимеразой, но сами по себе не способны связаться с определенными последовательностями ДНК. В отличие от них белки-регуляторы связываются именно с ДНК, но не с РНК-полимеразой. Другой подход учитывает тот факт, что в определенный момент времени с молекулой РНК-полимеразы объединяется лишь одна G-субъединица. Меняя соотношение известного G-фактора, например g70, и испытуемого белка в опытах по транскрипции in vitro, можно прийти к определенному выводу. Если g70 подавляет транскрипцию пропорционально этому соотношению (конкурентное подавление), то исследуемый белок выполняет функцию G-субъединицы.
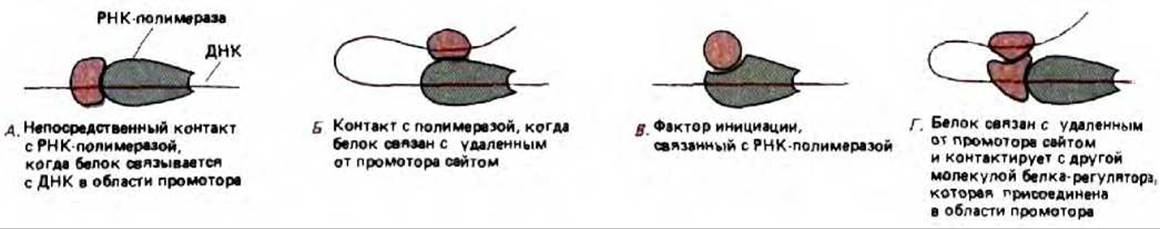
Рис. 10-19. Механизм, посредством которого белки контролируют инициацию транскрипции РНК в бактериальных клетках. Белки могут воздействовать либо стимулируя, либо блокируя ряд стадий, необходимых для начала продуктивного синтеза РНК (см. рис. 9-65). Механизм (Г) был впервые открыт при изучении арабинозного оперона Е. coli. Он представляет собой комбинацию механизмов А и Б, и это единственный из четырех механизмов, до сих пор не обсуждавшийся в тексте. Данный вариант будет разобран ниже на примере эукариот (см. рис. 10-27).
Основные типы механизмов, регулирующих инициацию транскрипции генов у бактерий, представлены на рис. 10-19. Бактериальные системы будут рассмотрены и при обсуждении того, как при конкурентном взаимодействии между белками-регуляторами, может осуществляться молекулярное переключение.
10-11
10.2.6. Потребность в общих факторах транскрипции приводит к появлению дополнительных элементов в системе контроля транскрипции эукариотических генов [14]
Транскрипция у эукариот - гораздо более сложный процесс, чем транскрипция в прокариотических клетках. Три РНК-полимеразы эукариот (полимеразы I, II и III) эволюционно родственны ферменту бактерий, но содержат большее число субъединиц. До сих пор эти ферментативные комплексы охарактеризованы неполностью. Кроме того, бактериальная полимераза узнает последовательность ДНК, а эукариотический фермент обычно ориентируется на комплекс ДНК-белок, образуемый факторами транскрипции.
Здесь и дальше в этом разделе мы будем в основном рассматривать РНК-полимеразу II, синтезирующую все предшественники мРНК. Важной частью комплекса ДНК—белок, который узнается этой полимеразой, является ТАТА-фактор, известный также как фактор транскрипции IID(TFIID). Этот белок связывается с консенсусной последовательностью «ТАТА-боксом»-ТАТААА. Обычно эта последовательность расположена на участке — 25 - — 30 по отношению к сайту инициации транскрипции. Для многих генов, кодирующих белки, положение этой последовательности очень важно как для активности промотора, так и для точного определения сайта инициации цепи РНК. Подобно белкам-регуляторам, ТАТА-фактор представляет собой белок, специфически связывающийся с ДНК. Так как этот белок необходим для транскрипции большинства (а возможно и всех) генов, транскрибируемых полимеразой II, считают, что он служит составной частью общего механизма транскрипции, а не является белком-регулятором. Результаты опытов, проведенных in vitro, свидетельствуют о том, что после связывания ТАТА- фактора с ДНК в области промотора, этот фактор обычно остается в составе стабильного транскрипционного комплекса, участвующего в многократных циклах транскрипции, осуществляемой РНК-полимеразой II (см. рис. 9-69).
Представляется вероятным, что все механизмы, используемые бактерией для контроля активности РНК-полимеразы, реализуются и в эукариотических клетках (см. рис. 10-19). Однако образование стабильного транскрипционного комплекса на ДНК с участием ТАТА-фактора несомненно усложняет регуляцию генов у эукариот. На основании опытов in vitro можно сделать вывод, что основная функция некоторых активирующих белков у эукариот состоит в том, что они помогают ТАТА-фактору соединиться с ДНК в области промотора.
10-11
10.2.7. Большинство генов эукариот находится под контролем промоторов и энхансеров [15]
Методы генной инженерии значительно расширили наши возможности при изучении генов эукариот. Исследователь может по-своему усмотрению перестроить нуклеотидную последовательность любого фрагмента ДНК, получить множество копий этой последовательности и присоединить ее к любому другому гену, создав, таким образом, новый ген. Для того, чтобы судить о функции сконструированного гена, его либо вводят путем трансфекции в культивируемые клетки, либо (что гораздо сложнее) получают трансгенное животное, у которого этот ген стабильно включился в одну из хромосом.
Использование всех этих методик позволило идентифицировать регуляторные области эукариотических генов даже в отсутствие каких- либо прямых данных о связывающихся с ними белках-регуляторах. Оказалось, что участок ДНК вблизи сайта инициации синтеза РНК чрезвычайно важен для успешной транскрипции (элемент, расположенный перед промотором). Обычно он насчитывает в длину около 100 нуклеотидных пар и включает в себя ТАТА-бокс. Еще большее удивление вызвал тот факт, что для эффективной транскрипции нужны последовательности, довольно значительно удаленные от промотора (энхансеры). Как и в случае сайта связывания белка ntrC у бактерий, энхансеры у эукариот воздействуют на транскрипцию, находясь на расстоянии.
Первый изученный энхансер представляет собой небольшой фрагмент генома вируса SV40, усиливающий транскрипцию вирусных генов, продукт которых необходим на ранних стадиях инфекции. В 1981 г. было показано, что если к гену -глобина присоединить этот небольшой фрагмент вируса, то уровень транскрипции гена ß-глобина повышается более чем в 100 раз. Меняя положение и ориентацию этого участка вируса SV40, удалось сформулировать следующие выводы. Энхансер - это регуляторная последовательность ДНК, которая:
1) активирует транскрипцию со связанного с ней промотора, причем транскрипция начинается с обычного сайта инициации синтеза РНК;
2) действует в двух ориентациях (нормальная или инвертированная);
3) оказывает влияние, находясь на расстоянии более 100 нуклеотидных пар в обе стороны от промотора.
В настоящее время известно, что в регуляции большинства генов высших эукариот участвуют элементы, расположенные непосредственно перед промотором, и один или два энхансера, лежащие вдали от сайта инициации синтеза РНК (см. рис. 10-22, А). Хотя обычно энхансеры находятся на расстоянии нескольких тысяч нуклеотидных пар от регулируемого ими промотора, некоторые из них могут быть удалены более чем на 20000 нуклеотидных пар. Как энхансеры, так и элементы, расположенные перед промотором, соединяются с сайт-специфическими ДНК-связывающими белками, которые и опосредуют их действие. Часть этих регуляторных белков, по-видимому, присутствует во всех тканях, тогда как другие обнаруживаются только в определенных типах клеток.
10-11
10.2.8. Большинство энхансеров и элементов, расположенных перед промотором, - это последовательности, которые связывают белки, участвующие в комбинационном контроле [15, 16]
Активность каждого энхансера и элемента, расположенного перед промотором, обычно направлена на участок последовательности длиной от 100 до 200 нуклеотидных пар. Элемент такого размера содержит сайты связывания многих белков, и, как правило, может быть разделен методами генетической инженерии на меньшие, частично сохраняющие активность фрагменты ДНК. Функционирование обоих типов регуляторных последовательностей зависит от связывания специфических белков и потому часто ограничено тем типом клеток, в которых эти белки имеются. Лишь некоторые регуляторные элементы (такие, как энхансер вируса SV40) могут проявлять активность почти во всех клетках. Большинство энхансеров характеризуются ярко выраженной специфичностью и активны в клетках, экспрессирующих именно тот ген, с которым они обычно связаны. Примером может служить энхансер гена ß-глобина курицы.
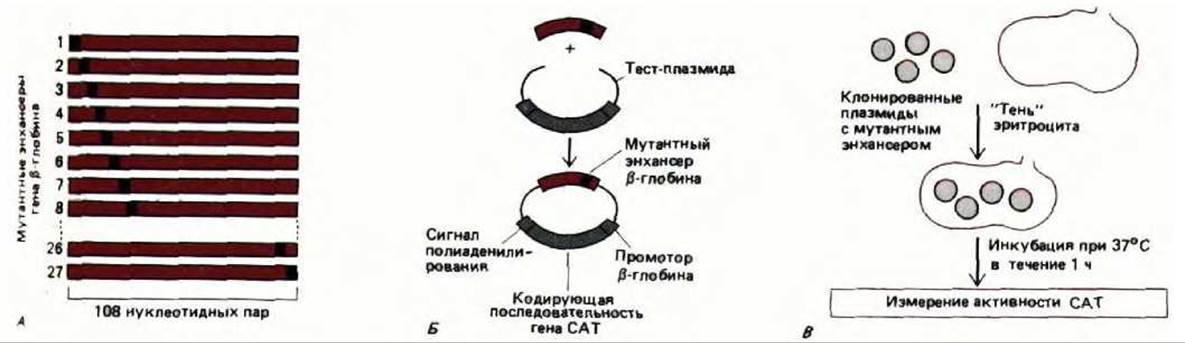
Рис. 10-20. А, Конструирование ряда мутантов по регуляторной области путем олигонуклеотиднаправленного мутагенеза. У каждого мутанта изменен блок из четырех нуклеотидных пар. Таким образом, для изучения 108 нуклеотидов в энхансере ß-глобина необходимо получить 27 последовательных мутантов. Б. Встраивание мутантного энхансера ß-глобина в специальную тест-плазмиду. Олигонуклеотид и клонирующий сайт «сшиваются» ДНК-лигазой. Белок, образуемый рекомбинантным геном, представляет собой бактериальный фермент хлорамфениколацетилтрансферазу (CAT), активность которого легко определить. В. Исследование мутантных энхансеров по их воздействию на синтез РНК. Синтез РНК измеряется косвенным образом по количеству белка, образуемого рекомбинантным геном (т. е. по активности CAT).
Энхансер ß-глобина курицы расположен позади транскрипционной единицы ß-глобина. В последовательных поколениях эритроцитов (и только в них), он образует гиперчувствительный к нуклеазе сайт. Этот факт свидетельствует о том, что в эритроцитах с энхансером связаны белки-регуляторы. Для того чтобы идентифицировать их, следует определить, какая именно последовательность нуклеотидов необходима для проявления активности энхансера. Для этого мутантные последовательности энхансера объединяли с маркерным геном. Продукт такого гена легко определить; это дает возможность судить о влиянии любой мутации энхансера на транскрипцию: каждую рекомбинантную конструкцию вводили в эритроциты курицы и регистрировали эффективность экспрессии гена-маркера (рис. 10-20). Те нуклеотиды, которые при таком тестировании оказываются необходимыми для активности энхансера, можно считать участками связывания специфических белков. С помощью данной методики было установлено, что таких белков-три (рис. 10-21). Содержание каждого из них в клетке очень мало, но благодаря тому, что сайты их связывания известны, можно клонировать кодирующие последовательности ДНК и, следовательно, получать эти регуляторные белки в неограниченном количестве (см. разд. 9.1.7).
Результаты, полученные при изучении энхансеров и элементов, лежащих перед промотором, позволили сформулировать следующие выводы.
1. Регуляторные элементы имеют модульное строение и состоят из серии определенных последовательностей нуклеотидов. Каждая такая серия содержит по 8-15 нуклеотидов и соединяется с соответствующей ей серией белков-регуляторов. Некоторые из этих белков присутствуют лишь в отдельных типах клеток, но есть и такие, которые присущи клеткам всех типов.
2. Существуют белки-регуляторы, связывание которых способствует активации транскрипции, другая группа регуляторных белков, напротив, подавляет транскрипцию. Общее воздействие регуляторного элемента зависит от комбинации связавшихся белков, а для каждого отдельного элемента эффект может меняться по мере развития клетки. Например, энхансер способен не только активировать, но и подавлять транскрипцию (см. рис. 10-22, Б). Таким образом, первоначальное название, данное этим элементам, не совсем верно отражает их функцию.
3. Энхансеры и элементы, лежащие перед промотором, по-видимому, связывают много одинаковых белков. Это может означать, что оба типа контролирующих элементов пользуются при воздействии на транскрицию одним и тем же механизмом.
4. При анализе вновь обнаруженных регуляторных элементов генов позвоночных оказалось, что многие из соединяющихся с ними белков охарактеризованы ранее как регуляторы других генов. Возможно, это объясняется тем, что у высших эукариот транскрипция контролируется относительно небольшим числом белков-регуляторов (табл. 10-1). Белки, которые связываются с элементами, лежащими перед промотором, для выполнения своей функции кооперируются с белками, связанными с энхансером. Их суммарный эффект на активность гена - результат взаимоисключающих активирующих и подавляющих воздействий (рис. 10-22). Полагают, что изменение в балансе позитивно и негативно действующих белков-регуляторов обусловливает разную эффективность транскрипции гена ß-глобина на разных стадиях развития эритроцита курицы (рис. 10-23).
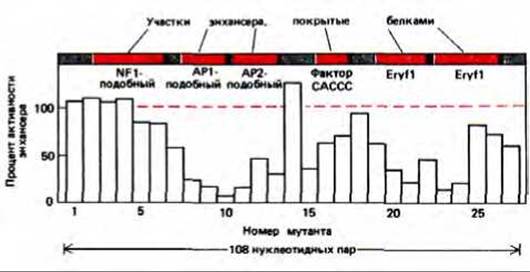
Рис. 10-21. Сопоставление данных по активности мутантного энхансера, описанного на рис. 10-20, В с расположением сайтов связывания белков с нормальным энхансером. Цветные полоски на рисунке соответствуют частям нормальной последовательности энхансера, которые закрываются указанными белками. Эти данные получены при смешивании нормальной последовательности энхансера с экстрактами эритроцитов курицы и последующем анализе смеси методами электрофореза и футпринтинга. Активность выражена как «процент активности энхансера»: цифра 100 означает, что данный мутант стимулирует синтез РНК также, как и нормальный энхансер; 0-синтез РНК не превышает транскрипцию в отсутствие энхансера. Результаты показывают, что наибольший вклад в стимуляцию транскрипции энхансером дают белки API-подобный, АР2- подобный и Егуй, однако по отдельности ни один из этих белков не может обеспечить полноценную активность энхансера (рис. 10-23).
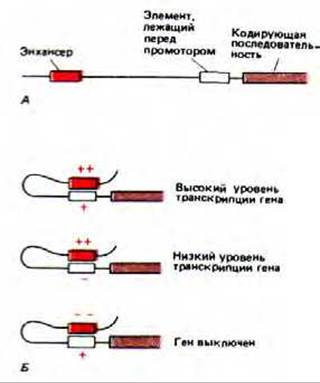
Рис. 10-22. Транскрипционная активность гена определяется совместным действием белков-регуляторов, связанных с элементом, расположенным перед промотором, и белков, связанных с энхансером. А. Типичное расположение двух типов регуляторных элементов относительно кодирующей последовательности. Б. Примеры совместного действия белков, связанных с этими двумя элементами. В зависимости от того, какие белки связались, каждый отдельный элемент в данном примере обладает либо слабым положительным (+), либо сильным положительным (+ +), либо слабым отрицательным (—), либо сильным отрицательным (— —) действием, как это показано на рисунке.
Таблица 10-1. Некоторые хорошо охарактеризованные белки-регуляторы млекопитающих и соответствующие специфические сайты связывания с ДНК.
|
Название белка |
Масса белка. кДа1) |
Сайт связывания с ДНК2) |
Примечания |
|
jun (или AP1) |
36 |
TGANTCA ACTNAGT |
Продукт протоонкогена, который может связываться с белком fos, продуктом другого протоонкогена. Активность индуцируется С-киназой; родственные белки, кодируемые множественными генами |
|
АР2 |
48 |
CCCCAGGC GGGGTCCG |
Активность индуцируется С-киназой |
|
ATF (или 43 CREB) |
(TилиG)(ТилиА)CGTCA (А С)(А T)GCAGT |
Активность индуцируется А-киназой |
|
|
SP1 |
85 |
GGGCGG CCCGCC |
Связывается с промоторами многих генов «домашнего хозяйства» |
|
OTF1 |
90 |
ATTTGCAT TAAACGTA |
Встречается во всех клетках млекопитающих. Один из многих белков, связывающихся с одной и той же октамерной последовательностью |
|
NF1 (или CTF) |
52-66 |
GCCAAT CGGTTA |
Многие белки, кодируемые альтернативно сплайсируемой РНК, считываемой с одного гена |
|
SRF |
67 |
GATGCCCATA CTACGGGTAT |
Участвует в кратковременной активации транскрипции протоонкогена fos (и других генов) факторами роста. В виде димера связывается с симметричной последовательностью ДНК (указан лишь сайт связывания мономера) |
1) ДНК, колирующая каждый из этих белков, была клонирована, и затем определена аминокислотная последовательность соответствующего белка.
2) Во многих случаях известна лишь часть распознаваемой последовательности ДНК. N обозначает любой нуклеотид.

Рис. 10-23. Известные белки-регуляторы, контролирующие экспрессию гена ß-глобина курицы в ходе нормального развития эритроцита. Здесь суммированы данные экспериментов, описанных на рис. 10-20 и 10-21; аналогичных опытов, проведенных с мутантными элементами, расположенными перед промотором, а также результаты анализа другого типа. А. Связывающие участки белков-регуляторов и их действие. Следует отметить, что энхансер у этого гена расположен за кодирующей последовательностью. Белки, не отмеченные + (активация) или — (подавление), по-видимому, не оказывают существенного влияния на транскрипцию, поскольку мутация их сайта связывания не сказывается на уровне транскрипции (см. рис. 10-21). Б. Относительные количества регуляторных белков на разных стадиях развития. Числами 0, 1 и 2 обозначено отсутствие, промежуточный и высокий уровень транскрипции соответственно, по нелинейной шкале. Имеющиеся в настоящее время данные не дают точного объяснения, почему ген включается между 4 и 9 днями развития. (С любезного разрешения Gary Felsenield.)
10-12
10-13
10.2.9. Большинство регуляторных белков содержит домены, функция которых различна [17]
Механизм действия регуляторных белков на гены в большинстве случаев хорошо не изучен. Известно только, что одного связывания с ДНК для влияния на транскрипцию недостаточно. Например, у белка gа14 функции связывания с ДНК и активации транскрипции выполняют разные домены. Этот белок-активатор включает транскрипцию многих дрожжевых генов, участвующих в превращении галактозы в глюкозу при выращивании клеток дрожжей на среде с галактозой. Белок ga14 соединяется со специфической последовательностью в 17 нуклеотидных пар, которая у дрожжей выполняет роль энхансера (UAS upstream activating sequence). Белок ga14 содержит около 900 аминокислотных остатков, а для связывания с этой специфической последовательностью размером 17 нуклеотидных пар достаточно аминоконца длиной 73 аминокислотных остатка, который образует серию «цинковых пальцев» (см. разд. 9.1.9). Однако сам по себе ДНК-связывающий домен не способен активировать транскрипцию. Но и в отсутствие этого домена остальная часть последовательности, по-видимому, тоже не активна. Эксперименты по «обмену доменов» показали, что в этом белке функция связывания с ДНК и активации транскрипции присущи разным доменам (рис. 10-24).
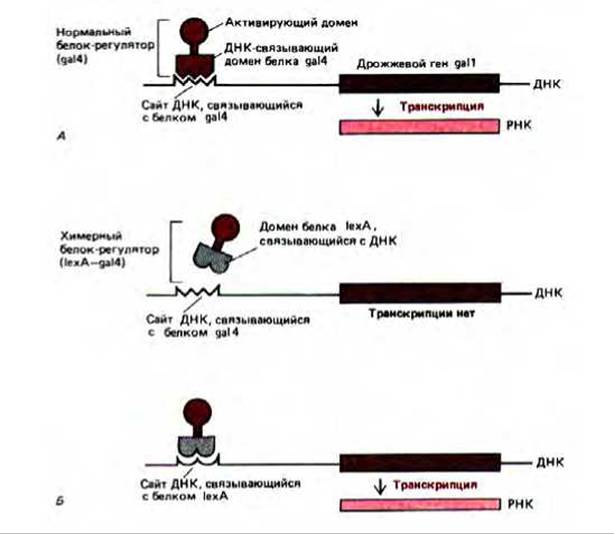
Рис. 10-24. Описание эксперимента, позволяющего выявить в составе белка-активатора ga14 у дрожжей, независимые ДНК-связывающие и активирующие транскрипцию домены. Функциональный белок-активатор может быть получен при соединении карбоксиконцевой части белка ga14 и ДНК-связывающего домена бактериального белка-регулятора (белок 1ехА) методом слияния генов. Полученный таким образом бактериально-дрожжевой гибрид будет активировать транскрипцию дрожжевых генов, если перед этими генами встроить специфический сайт, необходимый для его связывания. А. Нормальная активация транскрипции белком ga14. Б. Химерный белок-регулятор для проявления своей активности нуждается в сайте ДНК, связывающем белок 1ехА. Аналогичные эксперименты продемонстрировали наличие отдельных доменов такого типа и у других эукариотических белков-регуляторов.
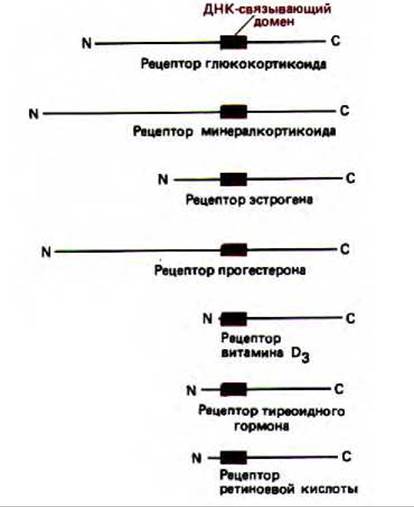
Рис. 10-25. Эволюционно родственные белки-регуляторы, принадлежащие к семейству рецепторов стероидных гормонов. Короткие домены, связывающие ДНК в каждом рецепторе, выделены цветом. Опыты по обмену доменов свидетельствуют о том, что многие гормон-связывающие, активирующие транскрипцию и ДНК-связывающие домены в этих рецепторах могут действовать как взаимозаменяемые модули.
Сходные результаты получены и для регуляторных белков млекопитающих. Например, хорошо изучено действие белков-регуляторов, относящихся к семейству рецепторов стероидных гормонов. Эти рецепторные белки обеспечивают ответ клеток на различные липид-растворимые гормоны, активируя или подавляя активность определенных генов, В состав этих белков-рецепторов входит центральный ДНК-сязывающий домен, содержащий около 100 аминокислотных остатков. Как и в случае ga14, этот домен несет серию «цинковых пальцев» и узнает специфическую последовательность ДНК. У некоторых белков, входящих в состав семейства, домен, активирующий транскрипцию, находится на аминоконце. Кроме того, все рецепторы на карбоксильном конце белка содержат гормон-связывающий домен (рис. 10-25). Эксперименты по обмену доменов показали их взаимозаменяемость. Например, замена ДНК-связывающего домена рецепторного белка глюкокортикоида на ДНК-связывающий домен рецептора эстрогена приводит к тому, что
модифицированный глюкокортикоидный рецептор связывается с энхансером, который в норме активирует гены, чувствительные к эстрогену. В результате эти гены начинают транскрибироваться в ответ на воздействие глюкокортикоидов, а не эстрогенов. Аналогичным образом введение гормон-связывающего домена глюкокортикоидного рецептора в другой белок-регулятор, не принадлежащий к этому семейству, приводит к тому, что для активности такого модифицированного белка требуются глюкокортикоиды. Каждый из доменов этих рецепторных белков кодируется одним или несколькими отдельными экзонами. Анализ последовательностей ДНК, которые кодируют различные белки, входящие в семейство рецепторов стероидных гормонов (рис. 10-25), дает основание предположить, что каждый белок возник в результате случайных хромосомных обменов, при которых собрались вместе домены разных белков-регуляторов (см. разд. 10.5.4).
10-5
10.2.10. Эукариотические белки-регуляторы могут включаться и выключаться [18]
Подобно другим членам семейства рецепторных белков стероидных гормонов, рецепторы глюкокортикоида и эстрогена напоминают бактериальный белок САР (см. разд. 3.3.6) в том отношении, что они могут активироваться в результате соединения небольших сигнальных молекул с отдельными доменами, которые связывают лиганды. Другие эукариотические белки-регуляторы, вероятно, активируются и инактивируются путем фосфорилирования либо при связывании с другими белками, изменяющими их активность (см. табл. 10-1). Эти и другие известные на сегодняшний день пути контроля активности белков, регулирующих экспрессию генов в клетках эукариот, представлены на рис. 10
26.
10.2.11. Механизм действия энхансера до конца не выяснен [15, 19]
Механизмы, регулирующие транскрипцию генов эукариот, демонстрируют высокую консервативность. Например, дрожжевой белок ga14 стимулирует транскрипцию генов млекопитающих в культуре клеток человека, если в этих генах содержится последовательность UAS гена ga14. Сходным образом, если в дрожжевых клетках синтезируется рецепторный белок эстрогена человека, то дрожжевые гены, связанные с энхансером человека, чувствительным к эстрогену, включаются при добавлении этого гормона.
Подобный консерватизм функций не связан с консерватизмом аминокислотной последовательности. Результаты секвенирования многих генов, детерминирующих регуляторные белки у дрожжей и человека, свидетельствуют о том, что домены, ответственные за активацию транскрипции у этих видов, не обладают явным сходством. Как в клетках дрожжей, так и в клетках человека, достаточный уровень активации генов достигается и в том случае, если домен регуляторного белка, активирующий транскрипцию, замешен на область, богатую кислыми аминокислотами (глутаминовая кислота и аспарагиновая кислота). Этот факт может говорить о том, что механизм активации относительно прост.

Рис. 10-26. Различные способы активации регуляторных белков в эукариотических клетках. Известны примеры для каждого из этих механизмов. А. Белок-регулятор синтезируется лишь в случае необходимости и быстро распадается при протеолизе, таким образом, его накопления не происходит. Б. Связывание с лигандом. В. Фосфорилирование либо другая ковалентная модификация. Г. Образование комплекса с отдельным белком, который выступает в роли домена, активирующего транскрипцию.
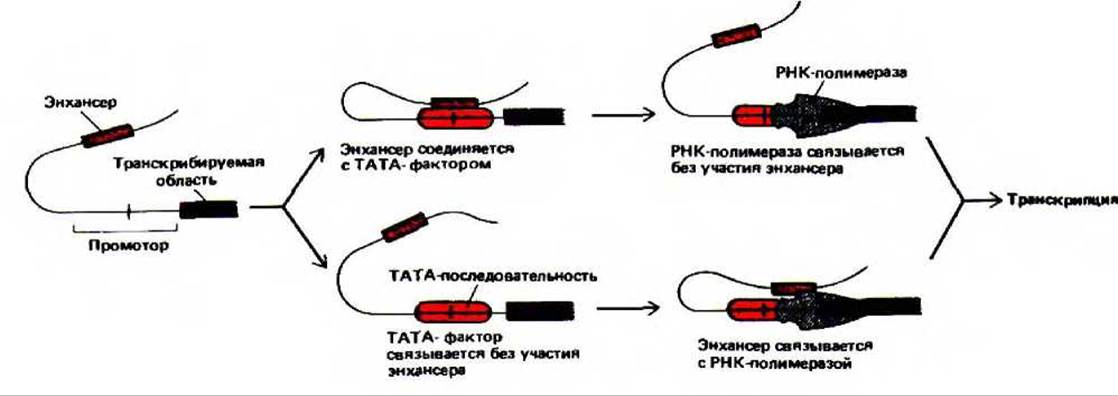
Рис. 10-27- Две модели действия энхансера в эукариотических клетках, основанные на образовании петли ДНК, наблюдаемой у бактерий (см. рис, 10-17). В данном примере энхансер расположен перед кодирующей последовательностью, однако петля может образоваться и если энхансер расположен позади кодирующей последовательности, как в случае гена ß-глобина (см. рис. 10-23).
Один из предполагаемых механизмов действия энхансера основан на результатах изучения бактериальных систем. Известно, что в клетках бактерий началу транскрипции способствует образование петли ДНК. Это согласуется с данными о том, что энхансеры обычно наиболее эффективны, когда они находятся вблизи промотора; с увеличением расстояния их активность постепенно падает. На рис. 10-27 приведена схема двух вариантов действия энхансера с образованием петли. Предложены и другие гипотезы о механизме действия этого регуляторного элемента. 1. Энхансер может действовать на большом расстоянии, активируя ДНК-топоизомеразу, которая вносит торсионное напряжение в большую петлю ДНК. используя для этого энергию гидролиза АТР. 2. Энхансер может влиять на транскрипцию, действуя как сайт посадки мобильных белков, которые связываются с ДНК и затем движутся вдоль ее молекулы. 3. Энхансер может связывать белки, которые способствуют присоединению близлежащего гена к определенной области ядра, где локализованы факторы транскрипции.
Позже будет показано, что некоторые сайты ДНК оказывают значительное воздействие на транскрипцию, будучи удаленными от промотора на расстояние 50000 и более нуклеотидных пар (см. разд. 10.3.12). Механизм действия таких сайтов, вероятно, отличается от механизма функционирования энхансеров.
Заключение
У прокариот регуляторные белки обычно связываются со специфическими последовательностями ДНК вблизи сайта инициации транскрипции и либо подавляют, либо активируют транскрипцию соседних генов. Благодаря гибкости ДНК ее молекула может образовывать петли, что позволяет белкам, присоединившимся на некотором расстоянии от промотора, влиять на РНК-полимеразу. Воздействие на расстоянии весьма распространено в клетках эукариот, где экспрессию генов часто контролируют энхансеры, удаленные от промотора на тысячи нуклеотидных пар.
У многих эукариотических генов, кодирующих белки и транскрибируемых РНК-полимеразой II, непосредственно перед сайтом инициации транскрипции находится последовательность, называемая «ТАТА-бокс».
Перед инициацией синтеза РНК необходимо, чтобы фактор, играющий важную роль в транскрипции (ТАТА-фактор, TFIID), образовал стабильный транскрипционный комплекс. Последовательности, примыкающие к ТАТА-боксу, формируют нужный для транскрипции элемент (элемент, расположенный перед промотором). И энхансер, и предпромоторный элемент содержат серию коротких нуклеотидных последовательностей, связывающихся с соответствующими регуляторными белками. Эти белки взаимодействуют друг с другом; в результате этого взаимодействия происходит включение или выключение генов. С помощью методов рекомбинантной ДНК показано, что регуляторные белки часто состоят из нескольких доменов, каждый из которых обладает своей функцией.