Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Рост и деление клеток
Регуляция клеточного деления у многоклеточных организмов
У одноклеточных организмов, таких как дрожжи, бактерии или простейшие, отбор благоприятствует тому, чтобы каждая отдельная клетка росла и делилась как можно быстрее. Поэтому скорость деления клеток обычно лимитируется только скоростью поглощения питательных веществ из окружающей среды и переработки их в вещество самой клетки. В отличие от этого у многоклеточного животного клетки специализированы и образуют сложное сообщество, так что главная задача здесь - выживание организма, а не выживание или размножение отдельных его клеток. Для того чтобы многоклеточный организм выжил, некоторые его клетки должны воздержаться от деления, даже если нет недостатка в питательных веществах. Но когда возникает надобность в новых клетках, например при репарации повреждения, ранее не делившиеся клетки должны быстро переключаться на цикл деления; а в случаях непрерывного «износа» ткани скорости новообразования и отмирания клеток всегда должны быть сбалансированы. Поэтому здесь должны существовать сложные регуляторные механизмы более высокого уровня, чем тот, который действует у таких простых организмов, как дрожжи. Этот раздел и посвящен такому «социальному контролю» на уровне отдельной клетки. В гл. 17 и 21 мы познакомимся с тем, как он функционирует в многоклеточной системе для поддержания и обновления тканей тела и какие его нарушения происходят при раке, а в гл. 16 увидим, как еще более сложная система управляет клеточным делением в процессах индивидуального развития.
13.3.1. Различия в частоте деления клеток обусловлены разной длительностью паузы после митоза [16]
Клетки человеческого тела, число которых достигает 1013, делятся с весьма разными скоростями. Нейроны или клетки скелетной мышцы не делятся совсем; другие, например клетки печени, обычно делятся только раз в один или два года, а некоторые эпителиальные клетки кишечника, чтобы обеспечить постоянное обновление внутренней выстилки кишки, делятся чаще чем два раза в сутки (рис. 13-22). Большинство клеток позвоночных располагается где-то в этих временных пределах: они могут делиться, но обычно делают это не так часто. Почти все различия в частоте деления клеток обусловлены разницей в длине промежутка между митозом и S-фазой; медленно делящиеся клетки останавливаются после митоза на недели и даже годы. Наоборот, время, за которое клетка проходит ряд стадий от начала S-фазы до окончания митоза, очень коротко (у млекопитающих обычно от 12 до 24 ч) и удивительно постоянно, каким бы ни был интервал между последовательными делениями.

Рис. 13-22. Деление и миграция клеток в эпителиальной выстилке тонкой кишки мыши. Все клеточные деления происходят только в нижней части трубчатых впячиваний эпителия, называемых криптами. Новообразованные клетки перемешаются вверх и образуют эпителий кишечных ворсинок, где они осуществляют переваривание и всасывание питательных веществ из просвета кишки. Большая часть эпителиальных клеток имеет короткий период жизни и слущивается с кончика ворсинки не позднее чем через пять дней после выхода из крипты. Однако кольцо примерно нз 20 медленно делящихся «бессмертных» клеток (их ядра выделены более темным цветом) остаются связанными с основанием крипты. Эти так называемые стволовые клетки дают при делении две дочерние клетки: в среднем одна из них остается на месте и далее снова функционирует как недифференцированная стволовая клетка, а другая мигрирует наверх, где дифференцируется и входит в состав эпителия ворсинки. (С изменениями из С. S. Pptten, R. Schofield, L G. Lajtha, Biochim. Biophys. Acta 560: 281-299, 1979.)
Время нахождения клеток в непролиферирующем состоянии (так называемой фазе G0) меняется в зависимости не только от их типа, но и от обстоятельств. Половые гормоны побуждают клетки в стенке матки быстро делиться на протяжении нескольких дней в каждом менструальном цикле, чтобы замещать ткань, утраченную при менструации; потеря крови стимулирует пролиферацию предшественников кровяных клеток; повреждение печени заставляет выжившие клетки этого органа делиться раз или два в сутки, пока не будет возмещена потеря. Точно так же эпителиальные клетки, окружающие рану, приступают к усиленному делению для восстановления поврежденного эпителия (рис. 13-23).
Для регулирования пролиферации клеток каждого типа в соответствии с потребностью существуют тщательно отлаженные и высокоспецифичные механизмы. Однако, хотя важность такой регуляции очевидна, ее механизмы трудно анализировать в сложном контексте целого организма. Поэтому детальное изучение регуляции клеточного деления обычно проводят на культуре клеток, где легко изменять внешние условия и длительное время наблюдать за клетками.
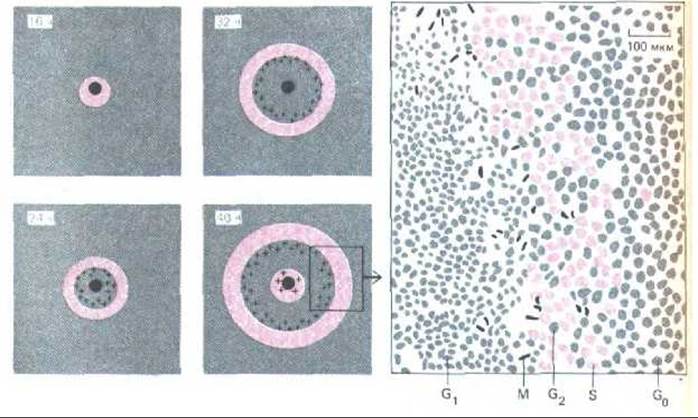
Рис. 13-23. Пролиферация клеток эпителия в ответ на ранение. Эпителий хрусталика повреждали с помощью иглы и спустя определенное время добавляли 3Н-тимидин для мечения клеток в фазе S (выделены цветом); затем вновь фиксировали и приготовляли препараты для рідиоавтографии. На схемах слева участки с клетками в фазе S выделены цветом, а с клетками в фазе М - отмечены крестиками; черное пятно в центре - место нанесения раны. Стимуляция клеточного деления постепенно распространяется от раны, вовлекая в деление покоящиеся клетки в фазе G0, я это приводит к необычно сильной реакции на относительно малое повреждение. На 40-часовом препарате клетки, далеко отстоящие от раны, вступают в фазу S первого цикла деления, тогда как клетки около самой раны вступают в S-фазу второго цикла деления. Рисунок справа соответствует участку, заключенному на схеме слева в прямоугольник; он сделан по фотографии 36-часового препарата, окрашенного для выявления клеточных ядер. (По С. Harding, J. R. Reddan, N.J. Unakar, M. Bagchi, Int. Rev. Cytol. 31: 215-300, 1971.)
13.3.2. Когда условия для роста становятся неблагоприятными, клетки животных, так же как и дрожжевые клетки, останавливаются в критической точке в G1 - в точке рестрикции [17]
При изучении клеточного цикла in vitro в большинстве случаев используются стабильные клеточные линии (разд. 4.3.4), способные размножаться неопределенно долго. Это линии, специально отобранные для поддержания в культуре; многие из них - так называемые нетрансформированные клеточные линии - широко используются в качестве моделей пролиферации нормальных соматических клеток.
Фибробласты (такие, как различные типы мышиных клеток ЗТЗ) обычно делятся быстрее, если расположить их в культуральной чашке не слишком плотно и использовать культуральную среду, богатую питательными веществами и содержащую сыворотку - жидкость, получаемую при свертывании крови и очищенную от нерастворимых сгустков и кровяных клеток. При нехватке каких-либо важных питательных веществ, например аминокислот, или при добавлении в среду ингибитора белкового синтеза клетки начинают вести себя примерно так же, как описанные выше дрожжевые клетки при недостатке питания: средняя продолжительность фазы Gt возрастает, но на остальной части клеточного цикла все это почти не сказывается. Как только клетка прошла через G1, она уже неизбежно и без задержки проходит фазы S, G2 и М независимо от условий среды. Эту точку перехода в поздней фазе G1 часто называют точкой рестрикции (R), потому что именно здесь клеточный цикл еще может приостановиться, если внешние условия препятствуют его продолжению. Точка рестрикции соответствует точке старта в клеточном цикле дрожжей; так же как и у дрожжей, она может отчасти служить механизмом, регулирующим размеры клетки. Однако у высших эукариот ее функция более сложна, чем у дрожжей, и в фазе G1 может быть несколько слегка различающихся точек рестрикции, связанных с различными механизмами контроля клеточной пролиферации.
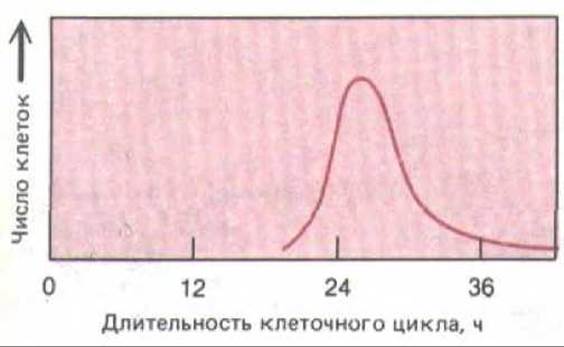
Рис. 13-24. Разброс величин длительности клеточного цикла, наблюдаемый обычно в гомогенной популяции клеток in vitro. Такие данные получают, наблюдая отдельные клетки под микроскопом и прямо отмечая время между последовательными делениями.
13.3.3. Длительность цикла пролиферирующих клеток, по-видимому, имеет вероятностный характер [18]
Индивидуальные клетки, делящиеся в культуре, можно непрерывно наблюдать с помощью цейтраферной киносъемки. Такие наблюдения показывают, что даже у генетически идентичных клеток длительность цикла весьма изменчива (рис. 13-24). Количественный анализ показывает, что время от одного деления до следующего содержит случайно меняющуюся компоненту, причем изменяется она главным образом за счет фазы G1. По-видимому, по мере того как клетки приближаются к точке рестрикции в GJ (рис. 13-25), они должны некоторое время «выждать», прежде чем перейти к оставшейся части цикла, причем для всех клеток вероятность в единицу времени пройти точку R примерно одинакова. Таким образом, клетки ведут себя подобно атомам при радиоактивном распаде; если в первые три часа через точку R прошла половина клеток, в следующие три часа через нее пройдет половина оставшихся клеток, еще через три часа - половина тех, что останутся, и т. д. Возможный механизм, объясняющий такое поведение, был предложен ранее, когда речь шла об образовании активатора S-фазы (разд. 13.1.5). Однако случайные изменения длительности клеточного цикла означают, что первоначально синхронная клеточная популяция через несколько циклов утратит свою синхронность. Это неудобно для исследователей, но может быть выгодно для многоклеточного организма: в противном случае большие клоны клеток могли бы проходить митоз одновременно, а поскольку клетки во время митоза обычно округляются и утрачивают прочную связь друг с другом, это серьезно нарушало бы целостность ткани, состоящей из таких клеток.
13-15
13-16
13.3.4. Для пролиферации клеток разного типа требуются разные факторы роста [19, 20]
Условия, при которых клетка будет расти и делиться, для животной клетки значительно сложнее, чем для дрожжевой. Если клетки позвоночных в стандартной искусственной культуральной среде полностью лишить кровяной сыворотки, то они в большинстве случаев не смогут проходить точку рестрикции, даже если в среде имеются все необходимые питательные вещества; при этом они перестанут также и расти. Анализы показывают, что незаменимыми компонентами сыворотки являются высокоспецифичные белки, присутствующие в очень малых концентрациях (порядка 10-9 - 10-11 М). Клеткам разного типа необходимы разные наборы таких белков. Некоторые из белков сыворотки прямо и специфически участвуют в стимуляции клеточного деления, и их называют факторами роста. Таков, например, тромбоцитарный фактор роста, или PDGF (plateled-derived growth factor). Способ его выделения был подсказан тем фактом, что культивируемые фибробласты делятся при наличии в среде сыворотки, но не делятся в присутствии плазмы- жидкого компонента крови, который получают, удаляя кровяные клетки, но не позволяя крови свертываться. При свертывании крови тромбоциты (разд. 17.5) начинают высвобождать содержимое своих секреторных пузырьков, и среди высвобождаемых веществ (наряду с факторами, вызывающими свертывание) оказывается PDGF. В основном именно он делает возможным деление фибробластов в культуре. По-видимому, PDGF обладает таким же действием и в организме, где он стимулирует клетки соединительной ткани и гладкой мускулатуры к делению при заживлении ран (рис. 13-26). Клетки, реагирующие на PDGF, имеют на своей плазматической мембране специальные рецепторы для него (и для некоторых других факторов роста). У клеток иных типов имеются другие наборы рецепторов, взаимодействующие с другими факторами роста (табл. 13-1); некоторые из этих факторов тоже содержатся в сыворотке.
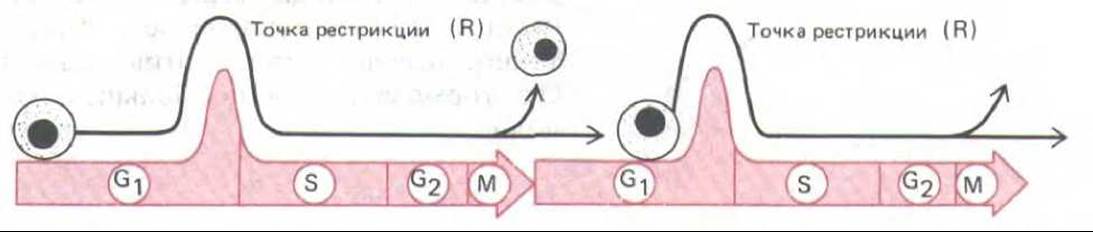
Рис. 13-25. Эта схема показывает, что быстро делящиеся клетки млекопитающих в культуре задерживаются на какое-то время в поздней фазе G1 в точке, которая, возможно, соответствует точке рестрикции (R). Если белковый синтез блокирован, то они могут оставаться в этой точке неопределенно долгое время. Непрерывное наблюдение над клетками под микроскопом показывает, что генетически идентичные клетки, в том числе и две дочерние клетки - продукты одного деления - часто задерживаются на разное время перед прохождением точки R. Это позволяет думать, что задержка обусловлена каким-то случайным процессом (см. текст).

Рис. 13-26. Предполагаемая роль тромбоцитарного фактора роста (PDGF) в заживлении ран. PDGF секретируется в поврежденном участке кровяными пластинками и макрофагами, а также, возможно, эндотелиальными и гладкомышечными клетками пораненных кровеносных сосудов. Он вызывает пролиферацию фибробластов и клеток гладкой мускулатуры, стимулирует фибробласты к дополнительной выработке внеклеточного матрикса и хемотаксически привлекает фибробласты и макрофаги. Заживление - сложный процесс, в котором наряду с PDGF участвуют и многие другие факторы.
Поскольку факторы роста секретируются в малых количествах, их трудно выделять. Эта трудность усугубляется сложностью их действия, так как большинство типов клеток, видимо, реагирует на специфическую комбинацию факторов роста, а не на какой-то один специфический фактор. Хотя до сих пор было охарактеризовано сравнительно немного различных факторов роста (меньше 30), многие из них повторно находили в других условиях и давали им другие названия - только позднее выяснялось, что это были уже известные молекулы. Из этого, возможно, следует, что имеется лишь небольшое число факторов роста, которые, действуя в разных комбинациях, избирательно регулируют пролиферацию каждого из многочисленных типов клеток высших животных; и становится ясно, что те же самые факторы действуют в определенных условиях как регуляторы других процессов, в особенности процессов клеточной дифференцировки. Некоторые факторы роста циркулируют в крови, но большинство действует как локальные химические медиаторы. Класс локальных химических медиаторов, возможно, включает и большое число еще плохо изученных факторов, помогающих регулировать деление и дифференцировку клеток в процесе развития организма (разд. 16.2.3). В дополнение к факторам роста, стимулирующим клеточное деление, есть и противоположно действующие факторы, которые его тормозят, хотя по большей части они охарактеризованы менее полно.
Таблица 13.1. Некоторые факторы роста и их действие
|
Фактор |
Состав |
Типичные эффекты |
|
Тромбоцитарный фактор роста (PDGF) |
АА, АВ или ВВ Цепь А 125 аминокислот Цепь В- 160 аминокислот |
Стимулирует деление соединительнотканных клеток (разд. 13.3.4) и клеток нейроглии (разд. 16.3.7) |
|
Фактор роста эпидермиса (ФРЭ, EGF) |
53 аминокислоты |
Стимулирует деление клеток многих типов (разд. 12.3.13) |
|
Инсулиноподобные факторы роста I и II (IGF-I и IGF-II) |
70 и 73 аминокислоты соответственно |
Действует совместно с PDGF и ФРЭ, стимулируют деление жировых и соединительнотканных клеток |
|
Трансформирующий фактор роста Р (TGF-P) |
Две цепи по 112 аминокислот в каждой |
Усиливает или подавляет (в зависимости от типа клетки) реакцию большинства клеток на другие ростовые факторы, регулирует дифференцировку некоторых клеток (разд. 16.2.3 и 17.7.1) |
|
Фактор роста фибробластов (ФРФ, FGF) |
У кислого ФРФ 140 аминокислот, у основного- 146 |
Стимулирует деление клеток многих типов, включая фибробласты, эндотелиальные клетки (разд. 17.3.7) и миобласты (разд. 17.6.1), индуцирует образование мезодермы у эмбриона Xenopus (разд. 16.2.3) |
|
Интерлейкин-2 (IL-2) Фактор роста нервов (ФРН, NEG) |
153 аминокислоты Две цепи по 1 1 8 аминокислот в каждой |
Стимулирует пролиферацию Т-лимфоцитов (разд. 18.6.11) Способствует росту аксонов и выживанию симпатических нейронов и некоторых сенсорных и центральных нейронов (разд. 19.7.10) |
|
Факторы роста клеток системы кроветворения (IL-3; GM-CSF, M-CSF; G- CSF, эритропоэтин) |
См. табл. 17-2 в разд. 17.5.8 |
13.3.5. Соседние клетки конкурируют за факторы роста [20, 21]
С помощью таких факторов роста, как PDGF, клетки одного типа могут контролировать пролиферацию клеток другого типа. Но важно и то, что клетки одного и того же типа в ткани взаимодействуют друг с другом и согласовывают скорость деления, чтобы поддерживать надлежащую плотность популяции. «Социальный» контроль такого рода четко проявляется при реакциях на повреждение. Например, когда поврежден эпителий, клетки по краям раны стимулируются к делению (см. рис. 13-23) и наползанию на обнаженную поверхность до тех пор, пока она вновь не будет закрыта; в этот момент быстрая пролиферация и движение клеток прекращаются. Сходное явление можно наблюдать на диссоциированных клетках в культуре. Эпителиальные клетки или фибробласты, помещенные в чашку, в присутствии сыворотки будут «приклеиваться» к поверхности, распластываться и делиться до тех пор, пока не образуется сплошной монослой, в котором соседние клетки соприкасаются. После этого нормальные клетки перестают делиться-явление, известное как торможение пролиферации, зависимое от плотности. Если такой монослой «поранить» иглой таким образом, чтобы на чашке образовалась свободная от клеток полоска, клетки с краев этой полоски начинают продвигаться на свободное место и делиться (рис. 13-27).

Рис. 13-27. Клетки, разбросанные по поверхности культуральной чашки, нормально пролиферируют до тех пор, пока не сольются в непрерывный монослой. На рисунке показана последовательность событий после соскабливания полоски клеток. Клетки по краям «раны» распластываются и возобновляют рост и деление, продолжающиеся до заполнения разрыва между ними. Когда монослой вновь становится непрерывным, клеточная пролиферация почти полностью прекращается.
Вначале такие явления объясняли «контактным торможением» клеточного деления, но это, видимо, не отражает сути дела. Плотность клеточной популяции, при которой клетки в сплошном монослое перестают делиться, увеличивается с повышением концентрации факторов роста в среде. Кроме того, оказалось, что если культуральная жидкость будет протекать по поверхности чашки с островками клеток, то клетки, омываемые средой, только что прошедшей над другими клетками, будут делиться медленнее, чем те, которые омываются средой, прошедшей над свободными от клеток участками. Создается впечатление, что в среде, протекавшей над клетками, недостает каких-то важных питательных веществ или факторов роста. Кстати, это можно было бы предсказать. В самом деле, PDGF обычно присутствует в среде в концентрации около 10-10 М (примерно одна молекула в объеме сферы диаметром 3 мкм). Один фибробласт имеет около 105 рецепторов PDGF, каждый из которых обладает очень высоким сродством к фактору роста. Таким образом, у каждой клетки достаточно рецепторов, чтобы связать все молекулы PDGF в объеме сферы диаметром около 150 мкм. Кроме того, полагают, что значительная часть PDGF, связанного рецепторами клеточной поверхности, быстро поглощается путем эндоцитоза и разрушается (разд. 6.5.12). Из этого ясно, что соседние клетки конкурируют между собой за малейшие количества факторов роста. Такого рода конкуренция была бы важна как для клеток в ткани, так и для культивируемых клеток, - она предотвращала бы рост популяции выше некоторого уровня ее плотности.
13-14
13.3.6. Нормальные животные клетки в культуре перестают делиться при откреплении от субстрата [22]
Конкуренция за факторы роста и питательные вещества - не единственный фактор, влияющий на скорость деления в клеточной культуре. Форма клеток во время их распластывания и движения по поверхности субстрата на свободные места тоже сильно влияет на их способность делиться. При культивировании нормальных клеток в суспензии, когда они не прикреплены к твердой поверхности и поэтому имеют округлую форму, они почти никогда не делятся (зависимость деления от прикрепления). Влияние распластывания клеток на пролиферацию можно продемонстрировать при выращивании клеток на субстратах с различной адгезивностью поверхности или на таких субстратах, где имеются лишь крошечные адгезивные участки, на которых клетка может прикрепиться, но не может распластаться. Частота деления клеток возрастает с увеличением степени их распластывания. Возможно, что сильно распластанные клетки могут улавливать больше молекул фактора роста и поглощать больше питательных веществ благодаря своей большей поверхности. Однако некоторые типы клеток (например, клетки ЗТЗ), почти не способные к пролиферации в суспензии, охотно делятся, как только им удается вступить в контакт с участком субстрата, даже если этот участок настолько мал, что клетка не может на нем распластаться (рис. 13-28). Такие «фокальные» контакты являются местами соединения (хотя и непрямого) внутриклеточных актиновых филаментов с молекулами внеклеточного матрикса (разд. 11.2.8). Эти и другие наблюдения определенно наводят на мысль, что контроль клеточного деления каким-то образом связан с организацией цито-скелета. Хотя механизм и функции этой связи не ясны, можно думать, что зависимость деления клеток от их прикрепления, вероятно, позволяет ткани сохранять целостность и предотвращает пролиферацию клеток, обособившихся от нормального окружения.
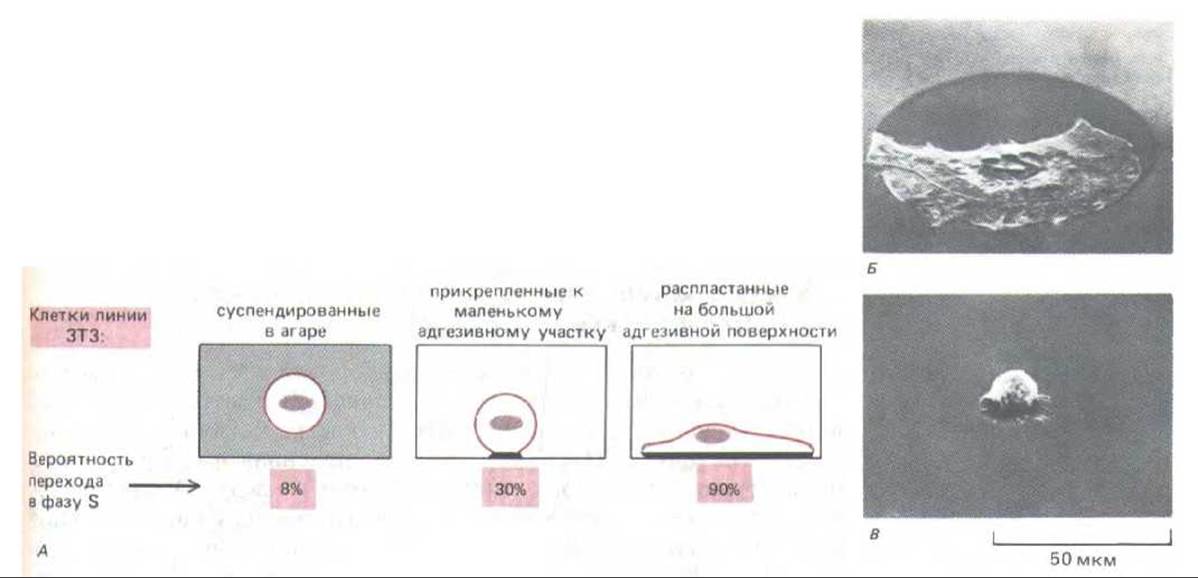
Рис. 13-28. Зависимость клеточного деления от размеров клеток и от их прикрепления. В представленном на этом рисунке опыте клетки растут либо в суспензии, либо прикрепленными к участкам адгезивного материала (палладия) на неадгезивной поверхности; от величины этих участков зависит степень распластывания клеток и возможность их деления. В культуральную среду добавляли 3Н-тимидин и спустя 1-2 дня фиксировали культуру и получали радиоавтографы для определения процента клеток, перешедших в фазу S. А. Округленные клетки линии ЗТЗ в суспензии делятся очень редко, но прикрепление к очень малому участку - такому, что он не позволяет клетке распластаться, дает им возможность делиться значительно чаще. Б и В. Снимки, сделанные с помощью сканирующего электронного микроскопа, позволяют сравнить клетку, распластанную на большом адгезивном участке, с клеткой, прикрепленной к маленькому участку. (Фотографии из С. O'Neill, P. Jordan, G. Ireland, Cell 44: 489-496, 1986. Copyright Cell Press.)
13.3.7. Деление клеток сопровождается изменениями в межклеточных соединениях
Зависимость между прикреплением клетки и ее делением имеет несколько аспектов. С одной стороны, для большинства нормальных клеток позвоночных необходимо прикрепление, чтобы перейти точку рестрикции; с другой стороны, для клеток, уже прошедших эту точку, для окончания цикла деления прикрепление необязательно - обычно они при этом теряют контакты и округляются, переходя в М-фазу. Этот цикл прикрепления и открепления, вероятно, позволяет перегруппировать адгезивные контакты как между клетками, так и между клетками и матриксом, чтобы встроить вновь возникшие дочерние клетки в ткань, перед тем как они смогут начать следующий цикл деления.
Ослабление контактов, видимо, составляет важную особенность пролиферативного поведения большинства типов клеток. Например, в ранней стадии реакции фибробластов на PDGF отмечается разрушение их фокальных контактов (разд. 13.4.6). Поразительно то, что потеря управляемости роста у раковых клеток почти всегда связана с необратимым уменьшением клеточной адгезивности, которое проявляется также в потере фокальных контактов при выращивании таких клеток в культуре. Связь между клеточным делением и прикреплением - весьма запутанная проблема, о чем мы будем говорить позднее; этим обусловлен и существенный пробел в нашем понимании трансформации, превращающей нормальную клетку в раковую (разд. 13.4.7).
13.3.8. Клетки, которые не должны делиться, переходят в состояние покоя - G0 [17, 23]
Когда еще нет предпосылок для деления, здоровая клетка почти всегда будет находиться в фазе G1 клеточного цикла. Когда обстоятельства становятся благоприятными для митоза, клетка возобновляет свое продвижение по циклу. Например, клетка, лишенная факторов роста, возобновляет цикл при добавлении сыворотки в среду. Однако после добавления сыворотки фаза S начинается почти всегда со значительной задержкой, которая обычно на несколько часов больше общей длительности фазы G1 у нормально пролиферирующих клеток. Лишение фактора роста переводит клетку в непролиферирующее и сильно измененное состояние, в котором она не может пройти точку рестрикции. Выход из этого состояния представляет собой сложный процесс, требующий много времени и состоящий из ряда стадий, различающихся по чувствительности к факторам роста.
Связь между отсутствием сыворотки и циклом клеточного деления была выяснена при изучении клеток ЗТЗ в культуре. Точку рестрикции в клеточном цикле можно выявить через 3,5 ч после завершения митоза. Отсутствие сыворотки (или воздействие ингибитора белкового синтеза) в течение всего лишь часа в период до этой точки останавливает клетку в фазе G1 и приводит к тому, что после добавления сыворотки возможна 8-часовая задержка (по принципу «всё или ничего») перед возобновлением цикла. Такое же отсутствие сыворотки после точки рестрикции не приводит к задержке в текущем цикле деления, но такая задержка возникает при прохождении фазы G1 следующего цикла. Эти наблюдения можно интерпретировать довольно просто. В пролиферативном состоянии клетка содержит набор молекул, которые позволяют ей проходить точку рестрикции; когда точка пройдена, эти молекулы, хотя они обычно остаются, уже не нужны для прохождения фаз S, G2 и М, которые следуют автоматически. Эти «разрешающие деление» молекулы быстро разрушаются в период отсутствия сыворотки и уже значительно дольше синтезируются заново после ее добавления. Разрушение может происходить в любой фазе цикла, но его последствия никак не проявятся, пока клетка не дойдет до точки рестрикции. Если всё это так, то состояние клетки определяется двумя независимыми параметрами: 1) фазой хромосомного цикла и 2) наличием или отсутствием молекул, разрешающих деление, т.е. определяющих пролиферативное состояние клетки. Клетка, не имеющая «разрешения» делиться, будет неспособна пройти точку рестрикции и остановится в этой точке; говорят, что она остановлена в состоянии покоя, или в состоянии G0.
Исследования на клеточных культурах выявляют роль внешних факторов, обратимо управляющих выбором между пролиферацией и покоем. Однако у многоклеточных организмов клетки многих типов переходят в состояние G0 в результате окончательной дифференцировки и теряют способность делиться независимо от внешних стимулов. Образование таких клеток обычно регулируется специальными механизмами с участием стволовых клеток, о которых пойдет речь в гл. 17.
13.3.9. Хромосомный цикл может становиться независимым от роста клеток [24]
Клетка в состоянии G0, находясь в покое в отношении хромосомного цикла, в то же время обычно отличается от пролиферирующей клетки также и балансом между синтезом и распадом белков; если делящаяся клетка в фазе G1 растет, то клетка в состоянии G0 поддерживает постоянные размеры. Клетки G0 обычно содержат меньше рибосом и меньшее количество РНК, чем соответствующие клетки GJ, и синтез белка у них идет более чем в два раза медленнее. Когда факторы роста стимулируют клетку G0 к пролиферации, изменение скорости белкового синтеза у нее обычно коррелирует с воздействием на хромосомный цикл: так же как и у дрожжей, рост и деление клетки координируются так, чтобы поддерживались нормальные размеры клеток.
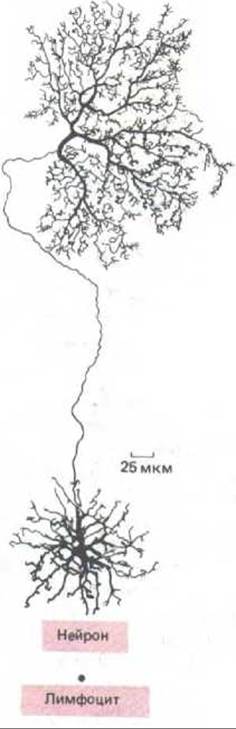
Рис. 13-29. Сравнение размеров нейрона из сетчатки млекопитающего и лимфоцита; обе клетки содержат одинаковое количество ДНК. В процессе развития нейрон растет непрерывно, оставаясь в состоянии G0. За это время отношение цитоплазмы к ДНК чрезвычайно сильно возрастает (для некоторых нейронов с коэффициентом 10s). [В. В. Boycott. In: Essay on the Nervous System (B. Bellairs and E. G. Gray eds.). Oxford, U. K. Clarendon Press, 1974]
Однако связь между синтезом белка и хромосомным циклом не жесткая. При подходящей комбинации ингибиторов белкового синтеза и факторов роста у культивируемых клеток можно подавить белковый синтез без задержки в прохождении хромосомного цикла или, наоборот, стимулировать синтез белков без стимуляции клеточного деления. Кроме того, специализированные клетки разных типов очень сильно различаются по ядерно-плазменному отношению, и некоторые клетки в состоянии Gq, такие как нейроны, могут почти неограниченно расти без репликации ДНК (рис. 13-29).
13-17
13.3.10. Вероятность перехода в G0 обычно увеличивается с числом клеточных делений: старение клетки [25]
У млекопитающих и птиц большинство нормальных клеток проявляет поразительную несклонность делиться неопределенно долго. Это отличает их от стабильных культивируемых клеточных линий, таких как ЗТЗ, в которых, видимо, произошли какие-то генетические изменения, делающие их «бессмертными». Например, фибробласты, взятые от человеческого плода, при выращивании в стандартной среде осуществляют только около 50-удвоений популяции; к концу этого периода пролиферация замедляется и затем останавливается, и все клетки, пробыв некоторое время в состоянии покоя, погибают. Такие же клетки, взятые от 40-летнего человека, перестают делиться примерно после 40-удвоений, а от 80-летнего - примерно после 30-удвоений. Фибробласты от животных с более короткой продолжительностью жизни прекращают деление в культуре после меньшего числа циклов. По аналогии со старением организма в целом это было названо клеточным старением. Клеточное старение представляет собой загадочный феномен. Короткие запрограммированные серии клеточных делений, которые заканчиваются дифференцировкой, - характерная особенность эмбрионального развития (разд. 16.3.4), однако трудно представить себе, как клетки могли бы в течение долгого времени отсчитывать свои митотические циклы и останавливаться, пройдя, скажем, 50 делений. Согласно одной из теорий, клеточное старение - это результат катастрофического накопления самовоспроизводящихся ошибок биосинтетических механизмов клетки; эти ошибки несущественны в природных условиях, где большинство животных гибнет от других причин задолго до того, как у них подвергнется старению значительное число клеток. С этой точки зрения клеточное старение просто отражает черты несовершенства в физиологии клетки, которые вполне естественны при очень слабом давлении отбора, направленного на их элиминацию. Однако в этом случае необходимо было бы объяснить, каким же образом клетки зародышевого пути, «бессмертные» клетки культивируемых линий и даже обычные соматические клетки при некоторых специальных условиях (описанных ниже) способны к бесконечной пролиферации. Другая гипотеза состоит в том, что клеточное старение-это результат механизма, который выработался для защиты от рака путем ограничения роста опухолей. Однако подобная защита представлялась бы неэффективной, так как пятидесяти циклов деления вполне достаточно для развития опухоли внушительных размеров. Еще одно предположение состоит в том, что старение клеток в весьма искусственных условиях клеточной культуры отражает тенденцию клеточной пролиферации в организме к постепенному замедлению с возрастом и что такое поведение клеток выработалось как способ стабилизации размеров взрослого организма.
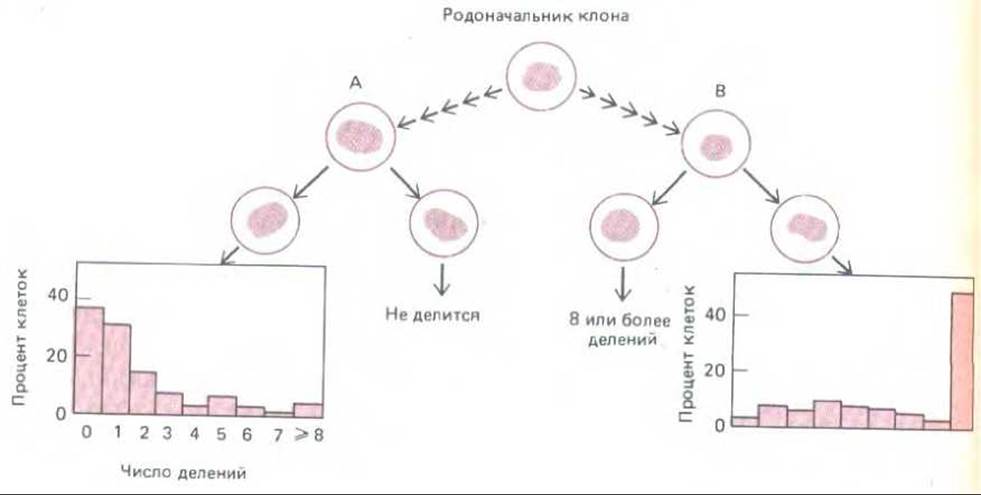
Рис. 13-30. Демонстрация различий в наследуемой способности клеток к делению. Отдельные клетки в клоне, даже будучи генетически идентичными, различаются по числу циклов деления, которые они могут осуществить. Здесь представлены разные пары сестринских клеток из одного исследованного клона, а также гистограммы, показывающие число клеток, проходящих то или иное число делений. Если одна из сестринских клеток не делится совсем, то другая обычно либо тоже не делится, либо проходит мало делений (слева); но если одна из сестринских клеток делится 8 и более раз, то другая обычно тоже претерпевает 8 и более делений (справа). Этот пример выявляет наследуемые различия между генетически идентичными клетками по числу циклов деления, которые они способны осуществить. Однако эти различные наследуемые состояния не вполне стабильны, так что иногда сестринские клетки ведут себя по-разному. Дальнейшие исследования показали, что по мере старения популяции в клетках происходят случайные переходы к пониженной способности делиться. (По данным J. R. Smith, R.G. Whitney, Science 207: 8284, 1980.)
Какова бы ни была функция клеточного старения, есть много данных о том, что на этот процесс сильно влияют факторы внеклеточной среды. Например, эпидермальные клетки из кожи ребенка стареют примерно после 50 циклов деления, если в среде отсутствует фактор роста эпидермиса, и после 150 циклов, если этот фактор имеется. «Бессмертные» клетки ЗТЗ проявляют признаки старения при недостатке факторов роста. Клетки от нормальных мышиных эмбрионов могут продолжать делиться бесконечно без малейших признаков старения, если их поместить в химическую среду определенного состава, содержащую вместо сыворотки набор очищенных факторов роста; добавление же сыворотки приводит к остановке пролиферации. Это позволяет предположить, что старение частично обусловлено какими-то компонентами сыворотки, которые тормозят пролиферацию клеток, перевешивая действие факторов роста.
Некоторые наследственные аномалии у человека, такие как синдром Вернера, приводят к преждевременному старению. Фибробласты, взятые от больных, обычно умирающих раньше 50 лет, в культуре перестают делиться после необычно малого числа митотических циклов. Интересно то, что эти фибробласты нечувствительны к PDGF и фактору роста фибробластов, но могут энергично делиться под действием других факторов роста.
Хотя в клеточной популяции при определенных условиях старение наступает в предсказуемое время, на уровне отдельной клетки оно не является жестко запрограммированным. В клоне по видимости идентичных нормальных фибробластов, растущих в стандартных условиях, одни клетки делятся многократно, тогда как другие - всего несколько раз. Индивидуальные клетки, по-видимому, перестают делиться в результате случайного перехода в иное состояние, вероятность которого возрастает в каждом последующем поколении клеток, пока не наступит момент, когда в популяции совсем не останется делящихся клеток (рис. 13-30).
Исследования на клеточных клонах показывают, что клетки, которые во всех других отношениях идентичны, различаются по способности к делению. Видимо, переход стареющей клетки в непролиферирующее состояние - это просто конечный результат ряда случайно распределенных во времени этапов ухудшения экспрессии генов, регулирующих готовность клеток проходить точку рестрикции. Молекулярная природа таких событий начинает проясняться благодаря исследованию раковых клеток, которые, помимо прочего, «бессмертны» и не подвержены старению.
Заключение
Клеточное деление у многоклеточных животных зависит от сложных «социальных» регуляторных механизмов, и пролиферация различных типов клеток контролируется различными сочетаниями белковых факторов роста. Они действуют в очень малых концентрациях, и многие из них служат локальными химическими медиаторами, позволяющими регулировать плотность клеточной популяции. Кроме того, большинство нормальных клеток неспособно делиться без прикрепления к внеклеточному матриксу. При недостатке факторов роста или при невозможности прикрепиться к матриксу клетки останавливаются после митоза, переходя в особое состояние покоя — G0 из которого после добавления факторов роста они могут выйти лишь через несколько часов. Когда клетка вышла из состояния G0 и прошла точку рестрикции в G1, она быстро проходит фазы S, G2 и М независимо от прикрепления или факторов роста. В пролиферирующей клеточной популяции переход через точку рестрикции представляет собой событие типа «всё или ничего», которое, подобно радиоактивному распаду, характеризуется определенной вероятностью осуществления. В дополнение к непосредственному контролю клеточной пролиферации существуют еще долговременные механизмы, приводящие к старению и прекращению деления нормальных соматических клеток млекопитающих в культуре после ограниченного числа циклов деления.