Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Рост и деление клеток
Механика клеточного деления
В этом последнем разделе мы будем говорить о событиях в фазе М - кульминации клеточного цикла. В этот сравнительно короткий период хромосомы конденсируются, а содержимое родительской клетки, удвоившееся благодаря синтетической активности в предшествующей интерфазе, распределяется между двумя дочерними клетками (рис. 13-42).
По-видимому, на молекулярном уровне фаза М инициируется каскадом фосфорилирования белков, запускаемым при появлении М-стимулирующего фактора (MPF), и заканчивается при дефосфорилировании, которое возвращает белки в их интерфазное состояние (разд. 13.2.5). В свою очередь фосфорилирование белков в течение М-фазы, вероятно, ответственно за многие морфологические изменения, сопровождающие митоз, в том числе и за конденсацию хромосом, разрушение ядерной оболочки и изменения цитоскелета, описанные ниже. Первое хорошо видимое проявление наступающей фазы М состоит в постепенном уплотнении дисперсного интерфазного хроматина в нитевидные хромосомы. Эта конденсация хромосом необходима для их последующего упорядоченного расхождения в дочерние клетки и сопровождается фосфорилированием многочисленных молекул гистона Н1, имеющихся в клетке (до шести фосфатных групп на одну молекулу H1). Поскольку гистон H1 присутствует в количестве примерно одной молекулы на нуклеосому и известно, что он участвует в упаковке нуклеосом (разд. 13.2.5), то его фосфорилирование киназой MPF (разд. 9.1.12) в начале фазы М должно быть главной причиной конденсации хромосом. Такое молекулярное объяснение, пока еще гипотетическое, показывает, на каком уровне в конечном счете должен описываться весь клеточный цикл.
Кто-то сказал, что хромосомы в митозе напоминают покойника на похоронах: они дают повод для действий, но не принимают в них активного участия. Активная роль принадлежит двум особым цитоскелетным структурам, которые временно образуются в М-фазе. Первым появляется двухполюсное митотическое веретено, состоящее из микротрубочек и связанных с ними белков. Сначала оно выстраивает реплицированные хромосомы в плоскости деления клетки; затем каждая хромосома разделяется на две дочерние, которые разводятся нитями веретена к противоположным сторонам клетки. Вторая цитоскелетная структура, необходимая в М-фазе животных клеток, - это сократимое кольцо из актиновых и миозиновых филаментов, появляющееся чуть позже под плазматической мембраной. Это кольцо втягивает мембрану внутрь, разделяя клетку на две, и тем самым обеспечивает, что каждая дочерняя клетка получит не только один полный набор хромосом, но и половину содержимого цитоплазмы и органелл родительской клетки. Эти две цитоскелетные структуры содержат разные наборы белков и в некоторых специализированных клетках могут формироваться независимо друг от друга. Однако их образование обычно тесно скоординировано, так что разделение цитоплазмы (цитокинез) происходит сразу же после окончания деления ядра (митоза), последнее относится и к растительным клеткам, хотя, как мы увидим, их жесткие стенки требуют иного механизма цитокинеза.
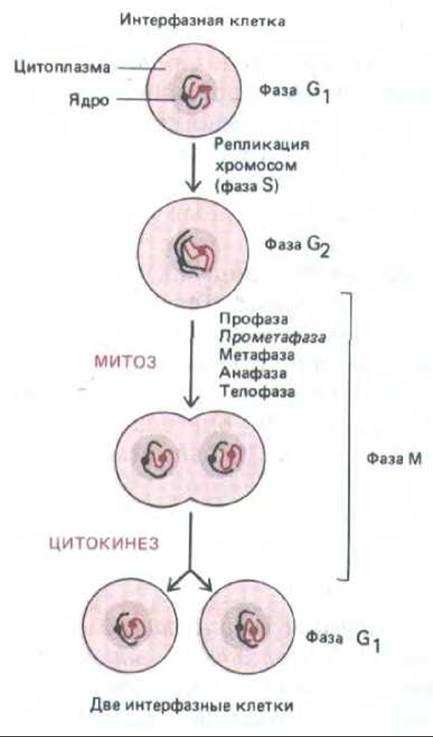
Рис. 13-42. М-фаза клеточного цикла начинается после фазы G2 и заканчивается к началу фазы G1 следующего цикла. Она состоит из пяти стадий деления ядра (митоза) и деления цитоплазмы (цитокинеза).
В сделанном только что описании речь шла об зукариотических клетках. Клетки бактерий не содержат ни актиновых филаментов, ни микротрубочек; в них обычно имеется только одна хромосома, и после ее репликации две копии распределяются между дочерними клетками с помощью механизма, который связан с прикреплением хромосомы к плазматической мембране бактерии (см. разд. 13.5.18). Сложный митотический аппарат, вероятно, стал необходим лишь с появлением клеток, содержавших гораздо большее количество ДНК в нескольких отдельных хромосомах. Главное назначение этого аппарата - точно распределять реплицированные хромосомы между двумя дочерними клетками. Точность такого распределения была исследована на дрожжевых клетках, и оказалось, что одна ошибка приходится примерно на 105 клеточных делений.
13.5.1. М-фазу традиционно подразделяют на шесть стадий [35]
Основная стратегия деления клеток у зукариотических организмов удивительно постоянна. Первые пять стадий фазы М составляет митоз, шестой является цитокинез. Эти шесть стадий образуют динамическую последовательность, сложность и красоту которой трудно оценить по описаниям или по серии статических изображений. Описание митоза основано на наблюдениях двоякого рода: на результатах световой микроскопии живой клетки (нередко в сочетании с микрокиносъемкой) и на данных световой и электронной микроскопии фиксированных и окрашенных клеток. Различные стадии клеточного деления кратко описаны на схеме 13-1. Пять стадий митоза - профаза, прометафаза, метафаза, анафаза и телофаза - осуществляются в строго определенном порядке; цитокинез начинается во время анафазы и продолжается до конца митотического цикла (рис. 13-43). Световые микрофотографии деления типичной животной и типичной растительной клеток приведены на рис. 13-44 и 13-45 соответственно.
В животном и растительном царствах встречаются бесчисленные вариации всех стадий деления, обобщенно представленных на схеме 131. Мы будем упоминать некоторые из этих вариаций при более близком ознакомлении с механизмами деления клетки, так как они могут помочь нам понять действие разных частей митотического аппарата млекопитающих.
13.5.2. Образование митотического веретена в М-фазе клетки сопровождается разительными изменениями динамических свойств микротрубочек [36]
Из гл. 11 мы знаем, что главным центром организации микротрубочек у большинства животных клеток служит центросома - скопление аморфного материала, окружающее пару центриолей (разд. 11.4.4). Во время интерфазы материал центросомы инициирует рост микротрубочек, который направлен к периметру клетки, в то время как их начальные участки (минус-концы) остаются связанными с центросомой. Это интерфазное скопление микротрубочек, расходящихся от центросомы, представляет собой динамичную, непрерывно меняющуюся структуру, в которой отдельные микротрубочки все время возникают и распадаются. Новые микротрубочки растут путем пристраивания молекул тубулина к плюс-концам; спорадически и, по-видимому, случайно индивидуальные микротрубочки становятся нестабильными и подвергаются быстрому, «катастрофическому» распаду, добавляя свои молекулы-субъединицы к пулу неполимеризованного тубулина, содержащегося в цитоплазме (см. схему 11-2).
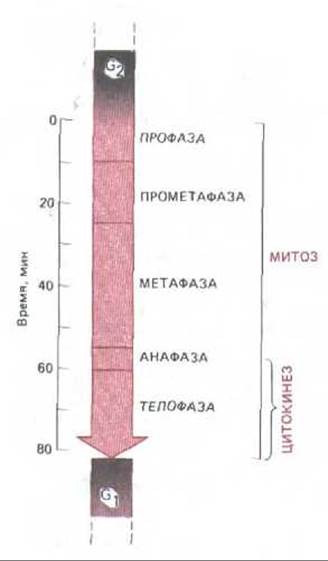
Рис. 13-43. Временной ход митоза и цитокинеза, типичный для клетки млекопитающего. Точные цифры для разных клеток различны. Обратите внимание, что цитокинез начинается еще до окончания митоза. Началом профазы (и, следовательно, фазы М в целом) считают тот момент клеточного цикла, когда впервые становятся видимыми конденсированные хромосомы; это несколько произвольный критерий, так как степень конденсации хромосом постепенно увеличивается уже в поздней фазе G2.
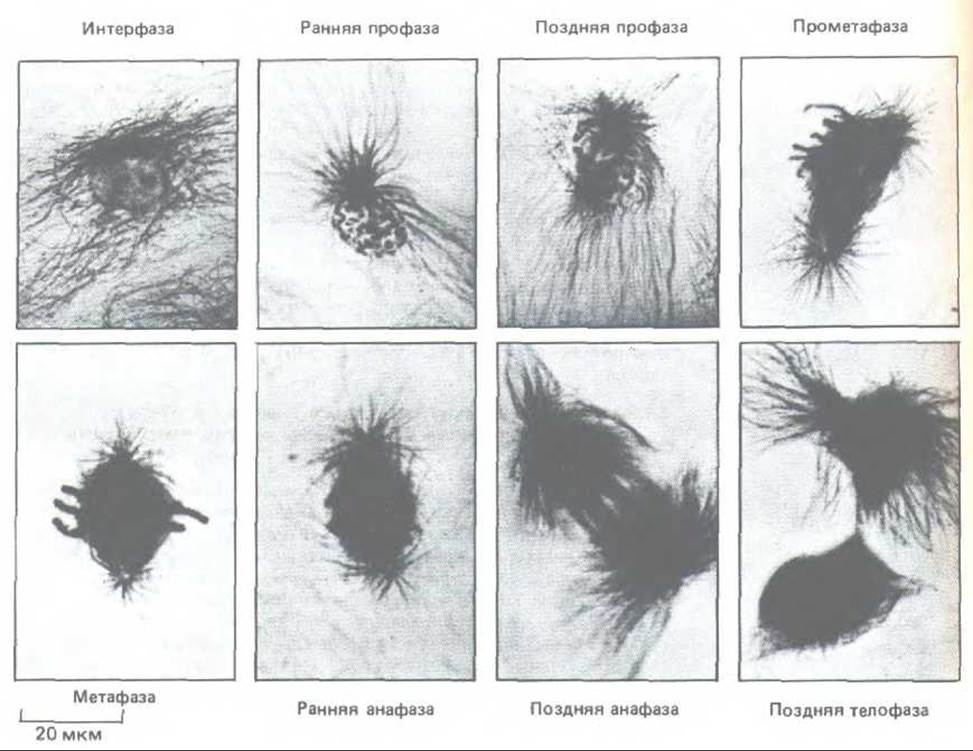
Рис. 13-44. На этих световых микрофотографиях культивируемых клеток сумчатого (клеток РІК) показан ход митоза в животной клетке. Микротрубочки видны благодаря окрашиванию антителами с золотом; хроматин окрашен толуидиновым синим. Главные события митоза на уровне световой микроскопии известны уже более 100 лет. В интерфазе центросома, содержащая пару центриолей, служит центром интерфазного скопления микротрубочек. В ранней профазе единственная центросома содержит две пары центриолей (на снимке не видны); в поздней профазе центросома делится, в результате чего образовавшиеся звезды отходят друг от друга. В прометафазе разрушается ядерная оболочка, и это позволяет микротрубочкам веретена взаимодействовать с хромосомами. В метафазе уже ясно видна двухполюсная структура веретена и все хромосомы выстраиваются в его экваториальной области. В ранней анафазе все хроматиды одновременно разделяются и под действием нитей веретена начинают двигаться к полюсам. В течение поздней анафазы полюса веретена все дальше отходят друг от друга, еще более раздвигая две группы хроматид. В телофазе формируются дочерние ядра, и в поздней телофазе почти полностью завершается цитокинез; между дочерними клетками сохраняется остаточное тельце. (Фотографии любезно предоставлены М. de Brabander.)
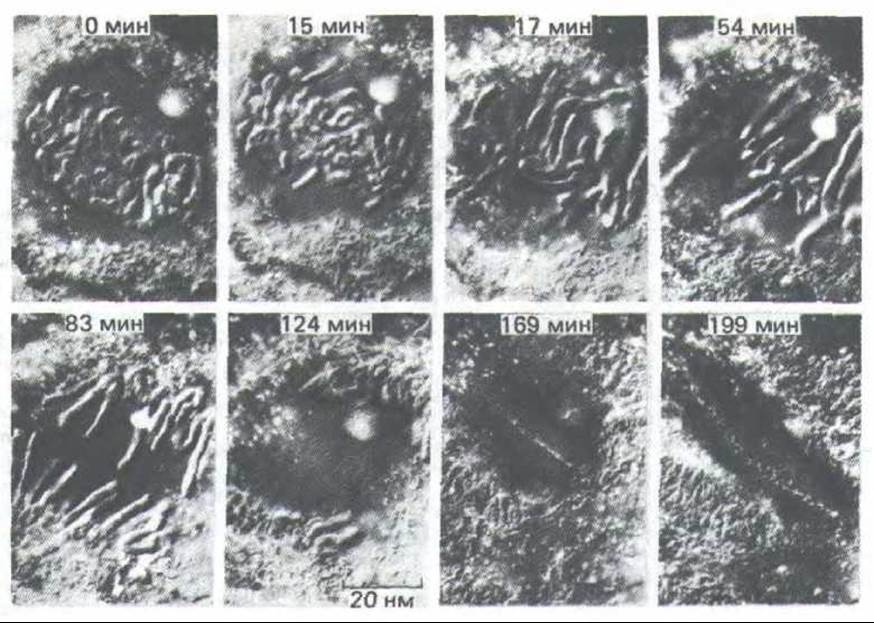
Рис. 13-45. Ход митоза в типичной растительной клетке. Микрофотографии живой клетки Haemanthus (лилейные), полученные с помощью метода дифференциального интерференционного контраста (разд. 4.1.5). Необычно крупные хромосомы в этой клетке легко наблюдать.

Рис. 13-46. Центросомный цикл. В интерфазной клетке центросома удваивается с образованием двух полюсов митотического веретена. В большинстве животных (но не растительных) клеток пара центриолей (показанных как пара коротких черных отрезков) погружена в материал центросомы (выделен цветом), от которого растут микротрубочки. В определенный момент фазы Gt две центриоли расходятся на несколько микрон. В течение фазы S возле каждой старой центриоли под прямым углом к ней начинает формироваться дочерняя центриоль. Рост дочерних центриолей обычно завершается в фазе G2. Вначале обе пары центриолей остаются погруженными в единую массу центросомного материала, образующего одну центросому. В ранней фазе М каждая пара центриолей становится частью отдельного центра организации микротрубочек, от которого отходит радиальный пучок микротрубочек - звезда. Две звезды, первоначально лежавшие бок о бок около ядерной оболочки, теперь отходят друг от друга. В поздней профазе пучки полюсных микротрубочек, принадлежащие двум звездам и взаимодействующие между собой, избирательно удлиняются, по мере того как два центра расходятся по двум сторонам ядра. Таким способом быстро формируется митотическое веретено.
ПРОФАЗА
Переход из фазы G2 в фазу М, как это видно в микроскоп, совершается постепенно. Хроматин, который в интерфазе выглядит диффузным, конденсируется в отчетливо видимые хромосомы. Для каждого вида характерно совершенно определенное число хромосом. Каждая хромосома во время предшествующей фазы S радуплицировалась и состоит теперь из двух сестринских хроматид. В каждой из хроматид имеется специфический участок ДНК, называемый центромерой, который необходим для их правильного расхождения. В конце профазы цитоплазматические микротрубочки, составляющие часть интерфазного цитоскелета, распадаются и начинается образование веретена — главного компонента митотического аппарата. Веретено представляет собой двухполюсную структуру, состоящую из микротрубочек и связанных с ними белков. Сборка веретена происходит вначале вне ядра.
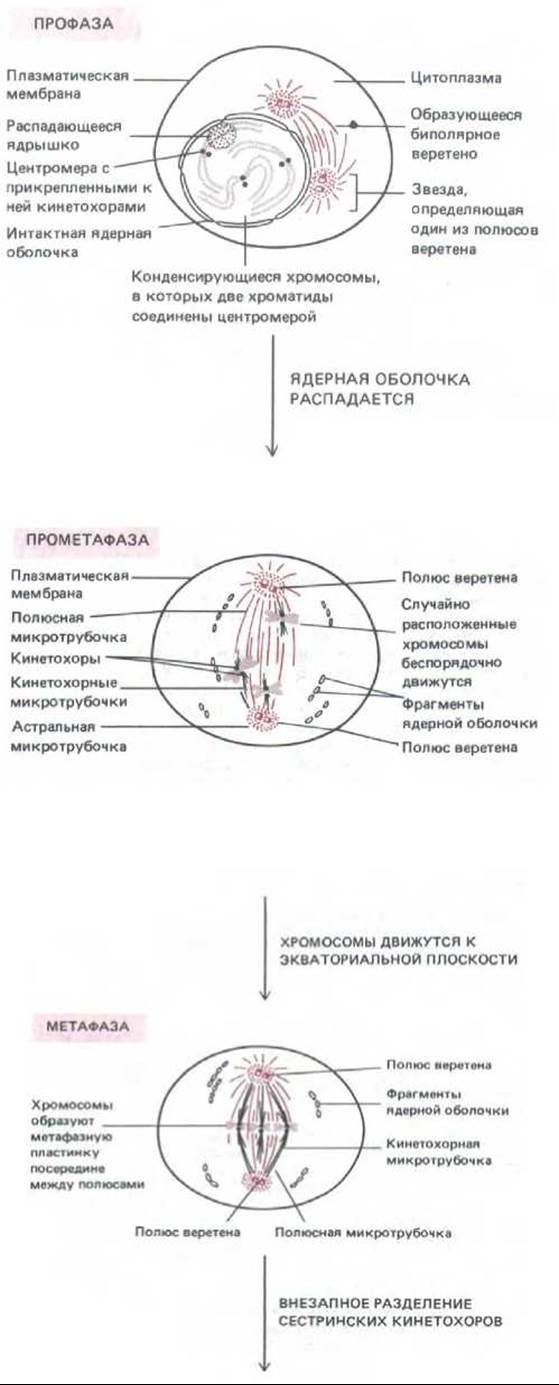
Схема 13-1. Шесть стадий клеточного деления.
ПРОМЕТАФАЗА
Про метафаза начинается с быстрого распада ядерной оболочки на мелкие мембранные пузырьки, неотличимые от фрагментов эндоплазматического ретикулума. Эти пузырьки остаются видимыми около веретена во время митоза. Микротрубочки веретена, которые находились вне ядра, могут теперь проникнуть в ядерную область. У хромосом на каждой центромере образуются особые белковые комплексы, называемые кинетохорами; они прикрепляются к некоторым из микротрубочек веретена, получающим теперь название кинетохорных микротрубочек. Остальные микротрубочки веретена называют полюсными, а те, которые лежат вне веретена, — астральными. Кинетохорные микротрубочки идут в противоположных направлениях от двух сестринских хроматид каждой хромосомы и тянут их в разные стороны, что приводит к интенсивному движению хромосом.
МЕТАФАЗА
Кинетохорные микротрубочки в конце концов приводят каждую хромосому в экваториальную плоскость на полпути между полюсами веретена. Хромосомы образуют здесь метафазную пластинку, в которой они удерживаются натяжением кинетохорных микротрубочек, отходящих от них к противоположным полюсам веретена.
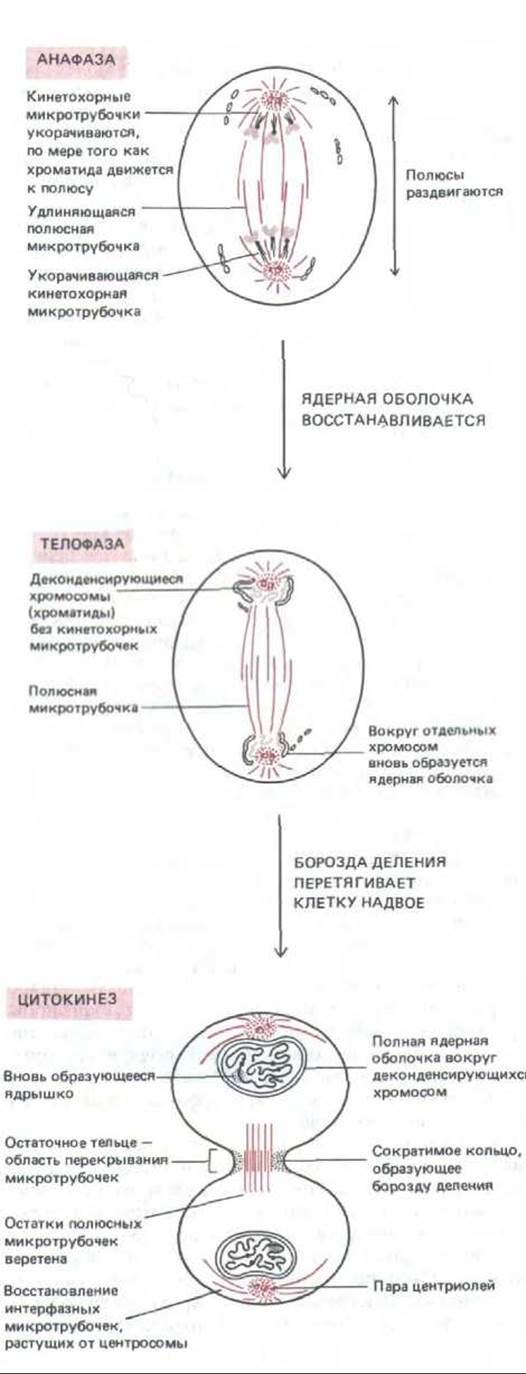
АНАФАЗА
Запускаемая специфическим сигналом, анафаза начинается с внезапного разделения парных кинетохоров каждой хромосомы, после чего ее две хроматиды начинают медленно расходиться к соответствующим полюсам. Все хроматиды движутся с одинаковой скоростью около 1 мкм/мин. Здесь можно различать движение двоякого рода. Во время анафазы А кинетохорные микротрубочки укорачиваются, по мере того как хромосомы приближаются к полюсам. Во время анафазы В происходит удлинение полярных микротрубочек и полюсы веретена еще дальше отодвигаются друг от друга. Анафаза обычно длится всего лишь несколько минут.
ТЕЛОФАЗА
В телофазе (от греч. telos — конец) разделившиеся дочерние хроматиды подходят к полюсам и кинетохорные микротрубочки исчезают. Полярные микротрубочки продолжают удлиняться, после чего вокруг каждой группы дочерних хроматид образуется новая ядерная оболочка. Конденсированный хроматин начинает разрыхляться, появляются вновь ядрышки (исчезнувшие в профазе), и митоз заканчивается.
ЦИТОКИНЕЗ
Это процесс разделения цитоплазмы, он обычно начинается где-то в анафазе. На схеме показано, как он протекает в животных клетках. Мембрана в экваториальной области (между двумя дочерними ядрами) начинает втягиваться внутрь по направлению к оси веретена; в результате образуется борозда деления, которая постепенно углубляется, пока не дойдет до остатков веретена, расположенного между ядрами. Этот мостик, называемый остаточным тельцем, может некоторое время сохраняться, а затем разрушается, что ведет к полному разделению дочерних клеток.
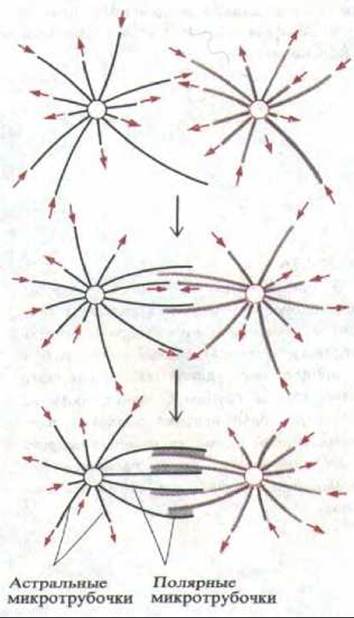
Рис. 13-47. Модель образования двухполюсного) митотического веретена путем селективной стабилизации взаимодействующих микротрубочек.
Новые микротрубочки отрастают в случайных направлениях от двух центросом (представленных кружками), к которым они прикреплены своими минус-концами. Их плюс-концы «динамически нестабильны» и резко переходят от равномерного роста к быстрому укорочению, при котором часто деполимеризуется вся микротрубочка (разд. 11.4.3). Когда две микротрубочки от противоположных центросом взаимодействуют в зоне их перекрывания, белки, связанные с микротрубочками, сшивают их друг с другом (показано серым цветом), прикрывая и стабилизируя таким образом их плюс-концы и уменьшая вероятность деполимеризации.
Как показано на рис. 13-46, в центросоме на протяжении всего1 клеточного цикла происходят изменения. Где-то в фазе S пара центриолей реплицируется, оставаясь внутри одного скопления центросомного материала. В профазе центросома расщепляется и каждая дочерняя центросома становится центром отдельной звезды - структуры из микротрубочек, концы которых погружены в материал центросоми. Микротрубочки обеих звезд удлиняются до соприкосновения друг с другом, после чего две центросомы расходятся. Затем, в прометафазе, ядерная оболочка разрушается, и это позволяет микротрубочкам от каждой центросомы проникать в ядро и взаимодействовать с хромосомами. Две дочерние центросомы называют теперь двумя полюсами веретена.
Как полагают, только что описанные события обусловлены происходящими в профазе существенными изменениями стабильности микротрубочек и свойств центросомы. Мы уже упоминали о том, что, судя по имеющимся данным, фактор MPF вызывает переход в фазу М, инициируя каскад фосфорилирования целого ряда белков (разд. 13.2.5).
При этом фосфорилируются некоторые молекулы, взаимодействующие с микротрубочками, поскольку при переходе клетки в профазу время полужизни средней микротрубочки уменьшается примерно в 20 раз (от примерно 5 мин до 15 с, см. рис. 13-48). Это, видимо, связано с резким повышением вероятности того, что типичная растущая микротрубочка начнет укорачиваться в результате какого-то изменения на ее плюсконце (разд. 11.4.3, схема 11-2), а также происходящего в профазе изменения центросомы, сильно увеличивающего ее способность к образованию новых микротрубочек (это можно наблюдать in vitro). Этих двух изменений достаточно для того, чтобы объяснить, почему в начале фазы М отмечается быстрый переход от сравнительно малого числа длинных микротрубочек, отходящих от центросомы к периферии клетки (интерфазное скопление микротрубочек), к большому числу коротких микротрубочек, окружающих каждую центросому (см. профазу на рис. 13-46).
Полагают, что в ходе митоза удлиняющиеся концы микротрубочек, отходящих от полюсов веретена, наталкиваются на структуры, которые связываются с ними и стабилизируют их против катастрофического разрушения. Поскольку каждый полюс испускает микротрубочки в разных направлениях, такая избирательная стабилизация и создает характерную двухполюсную форму митотического веретена, в котором большинство микротрубочек отходит от двух полюсов к экваториальной пластинке, находящейся на полпути между ними. Те микротрубочки, которые пересекают экватор, могут селективно стабилизироваться присоединяющимися к ним белками - эти белки сшивают соседние параллельные микротрубочки противоположной полярности (рис. 13-47). В метафазе веретено в клетках высших животных и растений может содержать до нескольких тысяч микротрубочек, тогда как у некоторых грибов их всего лишь около 40.
Хотя некоторые микротрубочки в веретене частично стабилизированы против спонтанного разрушения, большинство из них продолжает обмениваться своими субъединицами с пулом растворенных молекул тубулина в цитозоле. Этот обмен может быть непосредственно измерен с помощью метода, представленного на рис. 13-48. Его можно также выявить, помещая митотические клетки в условия, обратимо сдвигающие равновесие между полимеризацией и деполимеризацией тубулина, и наблюдая двойное лучепреломление микротрубочек веретена в поляризованном свете (рис. 13-49). Если митотические клетки поместить в тяжелую воду (D2O) или обработать таксолом (эти воздействия подавляют разборку микротрубочек), то нити веретена будут удлиняться. Такое стабилизированное веретено не может тянуть хромосомы, и митоз останавливается. Но митоз блокируется и при прямо противоположном воздействии, если нити веретена обратимо разрушить с помощью одного из трех агентов, подавляющих сборку тубулина в микротрубочки, - колхицина, низкой температуры или высокого гидростатического давления. Тот факт, что ни стабилизированные, ни деполимеризованные микротрубочки веретена не в состоянии перемещать хромосомы, указывает на то, что для правильного функционирования веретена необходимо тонкое равновесие между сборкой и разборкой. Прежде чем рассматривать механизм таких движении, мы опишем более подробно организацию веретена и расположение хромосом в митозе.
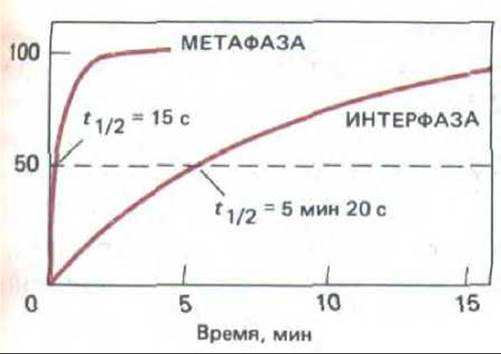
Рис. 13-48. Результаты исследования, показывающие, что микротрубочки в М-фазной клетке в среднем гораздо более динамичны, чем в интерфазе. В клетки млекопитающих в культуре инъецировали тубулин с ковалентне присоединенным флуоресцентным красителем. По прошествии времени, необходимото для включения флуоресцентного тубулина в микротрубочки, в небольшом участке весь тубулин обесцвечивали интенсивным лазерным лучом. Восстановление флуоресценции в облученном участке микротрубочек, вызванное заменой их обесцвеченных субъединиц необеспеченным флуоресцентным тубулином из пула субъединиц в растворе, было затем представлено в виде функции времени. Время 50%-ного восстановления флуоресценции, ti,2, как полагают, равно времени, необходимому для того, чтобы половина микротрубочек в этом участке деполимеризовалась и восстановилась. (По данным W. М. Saxon et al., J. Cell Biol. 99: 2175-2187, 1984, by copyright permission of the Rockefeller Univ. Press.)
13-25
13.5.3. Во время митоза хромосомы прикрепляются к микротрубочкам своими кинетохорами [37]
Реплицированные хромосомы прикрепляются к митотическому веретену с помощью структур, называемых кинетохорами, В начале М- фазы каждая хромосома состоит из двух сестринских хроматид, спаренных по всей их длине, но соединенных главным образом возле их центромер-специализированных последовательностей ДНК, необходимых для расхождения хромосом. В поздней профазе на каждой центромере образуется по одному зрелому кинетохору, т. е. имеется теперь два кинетохора (на двух сестринских хроматидах), ориентированных в противоположных направлениях. В метафазе к каждому кинетохору уже прикреплены микротрубочки (рис. 13-50). У большинства организмов кинетохор представляет собой крупный, состоящий из многих белков комплекс, который на электронных микрофотографиях выглядит как пластинчатая трехслойная структура (рис. 13-51). Число микротрубочек, связанных с каждым кинетохором, у разных видов весьма различно: например, у человека их бывает от 20 до 40, а у дрожжей и некоторых других микроорганизмов - только одна, т.е. одной микротрубочки оказывается достаточно, чтобы тянуть хромосому.

Рис. 13-49. Изолированное метафазное веретено. Использованы три различных метола световой микроскопии: дифференциальный интерференционный контраст (А), фазовый контраст (Б) и микроскопия в поляризованном свете (В). (С любезного разрешения Е. D. Salmon, R.R. Segall, J. Cell Biol. 86: 355-365, 1980. Repr. by copyright permission of the Rockefeller Univ. Press.)

Рис. 13-50. Схематическое изображение метафазной хромосомы с ее двумя сестринскими хроматидамн, к которым прикреплены кинетохорные микротрубочки.
Информация, определяющая специфическую конструкцию кинетохора в специфическом участке хромосомы, должна быть заключена в самой последовательности ДНК центромеры. У дрожжей центромер-ную ДНК можно выявить генетическим методом, благодаря ее способности обеспечивать регулярное наследование плазмид; без ее содействия плазмиды распределяются между дочерними клетками неравномерно и теряются. С помощью методов молекулярной генетики показано, что у дрожжей Saccharomyces ccrevisiae все 17 хромосом содержат разные центромерные последовательности длиной около 110 пар оснований (рис. 13-52); тем не менее во всех этих последовательностях имеются значительные гомологичные участки, которые могут инвертироваться или перемещаться из одной хромосомы в другую без потери функции. Центромерная последовательность дрожжей связывает специфические белки, которые, видимо, инициируют формирование многобелкового комплекса (кинетохора), а этот комплекс в свою очередь связывается с концом одной микротрубочки. Как полагают, у млекопитающих центромеры состоят из других, гораздо более длинных последовательностей ДНК и формируют более крупные кинегохоры, способные связывать много микротрубочек.
Неожиданная возможность изучать белки кинетохора у млекопитающих появилась, когда стало известно, что у больных некоторыми формами склеродермы (болезни неизвестной природы, связанной с прогрессирующим фиброзом соединительной ткани кожи и других органов), образуются антитела, специфически реагирующие с кинетохорами. Если такие антитела с флуоресцентной меткой использовать для окрашивания делящихся клеток, получается определенный рисунок флуоресцирующих пятен, каждое из которых отмечает положение кинетохора. Такой же пятнистый рисунок создается и в неделящихся клетках; при этом число пятен в клетке соответствует числу ее хромосом (рис. 13-53), и можно думать, что какой-то предшественник кинетохора связан с каждой центромерой даже в интерфазном ядре. Антитела склеродермы сделали также возможным клонирование генов, кодирующих некоторые из многочисленных белков, ассоциированных с кинетохорами, так что теперь эти обычно редкие белки можно производить в больших количествах, используя метод рекомбинантной ДНК, а затем изучать их взаимодействие друг с другом, с ДНК и с микротрубочками.
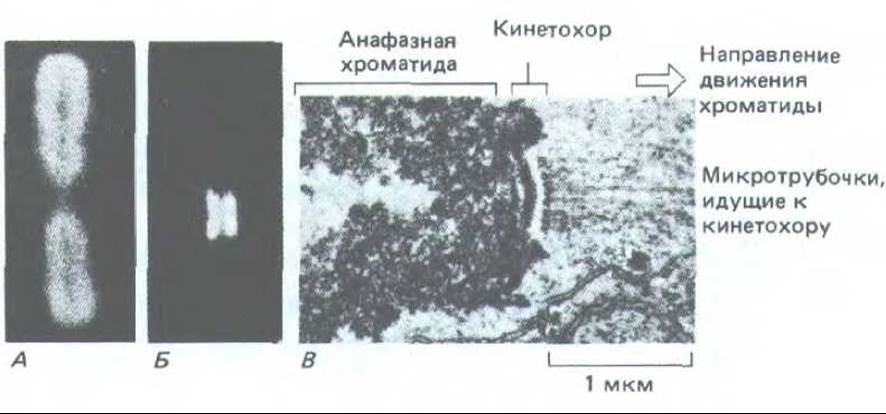
Рис. 13-51. Кинетохоры. В метафазной хромосоме (А), окрашенной аутоантителами человека, реагирующими со специфическими белками кинетохора, выявляются два кинетохора, каждый из которых связан со своей хроматидой (S). На электронной микрофотографии В- анафазная хроматида с микротрубочками, прикрепленными к кинетохору. Хотя большинство кинетохоров трехслойные, тот, который показан здесь (из зеленой водоросли), имеет необычно сложную структуру с дополнительными слоями. (А и Б с любезного разрешения Bill Brinkley; С - из J.D. Pickett-Heaps, L. С. Fowke, Aust. J. Biol. Sci. 23: 71-92, 1970. Repr. by permission of CSIRO.)

Рис. 13-52. Последовательность ДНК в типичной центромере дрожжей Saccharomyces cerevisiae. Представленной здесь последовательности достаточно, чтобы обеспечить правильное расхождение хроматид; она служит для сборки белков кинетохора, к которым прикрепляется одна микротрубочка.
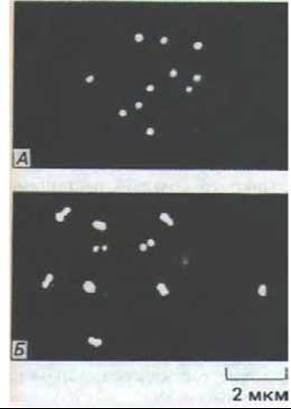
Рис. 13-53. Иммунофлуоресцентное окрашивание кинетохоров в интерфазных клетках с помощью антител, специфически связывающихся с белком кинетохора. В использованных клетках сумчатого относительно мало хромосом. А. В клетках, находящихся в фазе G1, окрашивается один кинетохор на хромосому. Б. В фазе G2 на одну хромосому окрашиваются два кинетохора. (S. L. Brenner, В. В. Brinkley, Cold Spring Harbor Symp. Quant. Biol. 46: 241-254, 1982.)
Как микротрубочки и кинетохоры соединяются друг с другом? Их связывание имеет ряд уникальных особенностей. Если химически помеченный тубулин инъецировать в митотическую клетку в метафазе, он будет непрерывно включаться в микротрубочки около точки их прикрепления к кинетохору (рис. 13-54). Как мы увидим позже, в анафазе имеет место обратная реакция: молекулы тубулина отделяются от микротрубочки в участке вблизи кинетохора, так что последний перемещается по направлению к полюсу веретена. Здесь трудно понять то, что кинетохор, несмотря на присоединение и удаление молекул тубулина, сохраняет прочную механическую связь с микротрубочками - ведь именно за эту точку прикрепления они тянут хромосомы сквозь протоплазму. Таким образом, кинетохор, по-видимому, действует наподобие скользящего ошейника, поддерживая боковую связь с субъединицами полимеризованного тубулина около конца микротрубочки и позволяя в то же время добавлять или удалять на этом конце молекулы тубулина (см. ниже рис. 13-61).
13-28
13.5.4. По-видимому, кинетохоры захватывают плюс-концы микротрубочек, отходящих от полюса веретена [38]
Распад ядерной оболочки, знаменующий конец профазы и начало лрометафазы, позволяет митотическому веретену взаимодействовать с хромосомами. Конечный результат этого взаимодействия состоит в том, что каждому дочернему ядру будет передано в точности по одной хроматиде каждой хромосомы. В этом процессе распределения хроматид важную роль играют прикрепленные к кинетохорам микротрубочки, которые 1) ориентируют каждую хромосому относительно оси веретена таким образом, чтобы ее два кинетохора были обращены к двум противоположным полюсам клетки, и 2) перемещают каждую хромосому в экваториальную плоскость клетки, где хромосомы образуют метафазную пластинку. В клетках млекопитающих этот процесс занимает 10-20 мин и завершается к концу прометафазы.

Рис. 13-54. Опыт, показывающий, что метафазные микротрубочки кинетохора растут с конца, прикрепленного к кинетохору (плюсконца). В метафазную клетку млекопитающего in vitro инъецировали тубулин, ковалентне связанный с малой органической молекулой (биотипом). Спустя 1 мин клетку фиксировали и окрашивали антителами к биотину, связанными с золотыми шариками, а затем приготовляли срезы для электронной микроскопии. Участки микротрубочек, включавшие биотинилированный тубулин в течение минуты после инъекции, усыпаны темными точками золота (цветные стрелки), а участки, существовавшие ранее, не окрашены (черные стрелки). (Фотография любезно предоставлена Luise Evans.)
Для прометафазы характерна чрезвычайно высокая активность веретена, которое как бы стремится захватить все хромосомы и расположить их в виде метафазной пластинки. И действительно, хромосомы энергично вращаются и движутся туда и сюда между полюсами, так как их кинетохоры присоединены к микротрубочкам, растущим от одного и от другого полюса веретена, и эти микротрубочки тянут их в разные стороны. Первоначальное прикрепление хромосомы обычно происходит тогда, когда она находится у одного из полюсов, и в это время микротрубочки присоединяются только к одному кинетохору; в конце концов и второй кинетохор связывается с микротрубочками, растущими уже от другого полюса. Эти беспорядочные движения хромосом в прометафазе и их окончательная случайная ориентация обеспечивают случайное распределение хроматид между дочерними клетками, что очень важно для перекомбинирования генов во время аналогичного деления ядра в мейозе (разд. 15.2.7).
От полюса отходят только плюс-концы микротрубочек, и именно эти концы связываются с кинетохорами. Таким образом, кинетохор действует как «колпачок» («cap»), в какой-то мере предохраняющий плюс-конец микротрубочки от деполимеризации, точно так же как центромера у полюса веретена предохраняет от деполимеризации минус-конец. Неудивительно поэтому, что прикрепленные к кинетохору микротрубочки, прикрытые с обоих концов, необычайно стабильны. Другие микротрубочки веретена (называемые полюсными) менее стабильны.
Хотя микротрубочки кинетохора стремятся подтянуть хромосому к соответствующему полюсу (см. ниже), какая-то другая сила, по-видимому, отталкивает те хромосомы, которые подходят к полюсу слишком близко. Если плечи хромосомы отделить с помощью лазерной микрохирургии от кинетохора, то у них будет заметна тенденция удаляться от ближайшего полюса веретена, даже если они не прикреплены к микротрубочкам или к какой-либо иной клеточной структуре. Одно из возможных объяснений-то, что быстрая полимеризация микротрубочек веретена в направлении от каждого полюса создает «общий поток», который увлекает всякую крупную незакрепленную структуру, такую как плечи хромосом, дальше от полюсов.
13.5.5. Сестринские хроматиды прикрепляются своими кинетохорами к противоположным полюсам веретена [39]
В ранней прометафазе оба кинетохора одной хромосомы могут прикрепиться к нитям от одного и того же полюса веретена. Однако такая или иная аномальная конфигурация, которая привела бы к ошибке в расхождении хромосом, почти всегда исправляется. По-видимому, сбалансированное расположение, при котором сестринские кинетохоры прикреплены к разным полюсам веретена, наиболее стабильно. На возможную причину этого указывают результаты экспериментов, в которых изучался механизм прикрепления хромосом к митотическому веретену.
Изящные опыты, в которых с помощью тончайших стеклянных игл можно было тянуть или толкать хромосомы в живой митотической клетке, показали, что определенный кинетохор не должен быть обязательно направлен к определенному полюсу, подобно концу магнитной стрелки: если хромосому перевернуть, тот же кинетохор может установить связь и с противоположным полюсом. Более того, в прометафазе можно путем микроманипуляции заставить оба кинетохора какой-либо хромосомы связаться с одним и тем же полюсом веретена. Если такая аномальная связь сохранится, то вся хромосома (как пара соединенных сестринских хроматид) будет двигаться к соответствующему полюсу. Как правило, однако, такая связь нестабильна - обычно к хромосоме присоединяются новые микротрубочки от другого полюса с тем, чтобы образовать правильную сбалансированную конфигурацию. С другой стороны, если движению неправильно связанной хромосомы препятствовать стеклянной иглой, то связь этой хромосомы только с одним полюсом становится стабильной: видимо, соединение микротрубочек с кинетохором укрепляется тянущей силой, направленной к полюсу. Поэтому только хромосомы, соединенные с обоими полюсами, будут сохранять связь с микротрубочками и, таким образом, стабильно взаимодействовать с веретеном.
Усилие, развиваемое микротрубочками от разных полюсов, не только стабилизирует взаимодействие этих микротрубочек с кинетохорами, но также в конечном счете приводит каждую хромосому в плоскость метафазной пластинки, о чем сейчас и пойдет речь.
13.5.6. Сбалансированные силы, направленные к противоположным полюсам, удерживают хромосомы в метафазной пластинке [40]
Почему хромосомы в метафазе выстраиваются на равном расстоянии от обоих полюсов веретена, образуя метафазную пластинку? Опыты по перемещению хромосом стеклянной иглой показывают, что сила, приложенная к кинетохору, пропорциональна длине прикрепленных к нему нитей, т. е. она уменьшается по мере приближения кинетохора к тому полюсу, с которым он соединен (рис. 13-55). Каждая хромосома соединена как бы «пружиной» с каждым из двух полюсов веретена, так что любое смещение к какому-то одному полюсу создает противодействующую силу в обратном направлении. Веретено, образующееся в результате такого взаимодействия в метафазе, показано на рис. 1356.
Эти силы продолжают действовать на хромосомы и после того, как те расположились в виде метафазной пластинки. Поэтому и здесь хромосомы совершают колебательные движения в обоих направлениях, поддерживая равновесие этих сил. Если нити, прикрепленные к одному из пары метафазных кинетохоров, разрушить лучем лазера, то вся хромосома тотчас начнет двигаться к тому полюсу, связь с которым не нарушена. Точно так же, если в метафазе две хроматиды разъединить, то они начнут двигаться к противоположным полюсам, как в анафазе. Судя по этим результатам, как только два кинетохора каждой хромосомы разделятся, хроматиды начинают расходиться к полюсам под действием тех же самых сил, которые раньше привели к образованию метафазной пластинки.
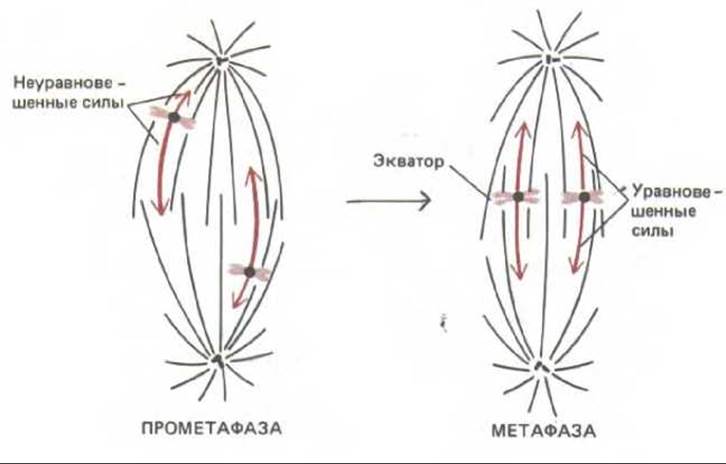
Рис. 13-55. Хромосомы случайным образом попадают в веретено во время прометафазы и в конце концов выстраиваются в экваториальной плоскости веретена, так как сила, действующая на каждый кинетохор, тем меньше, чем он ближе к полюсу. Поэтому хромосомы, оказавшиеся на экваторе, удерживаются там под действием уравновешенных сил притяжения к двум полюсам.
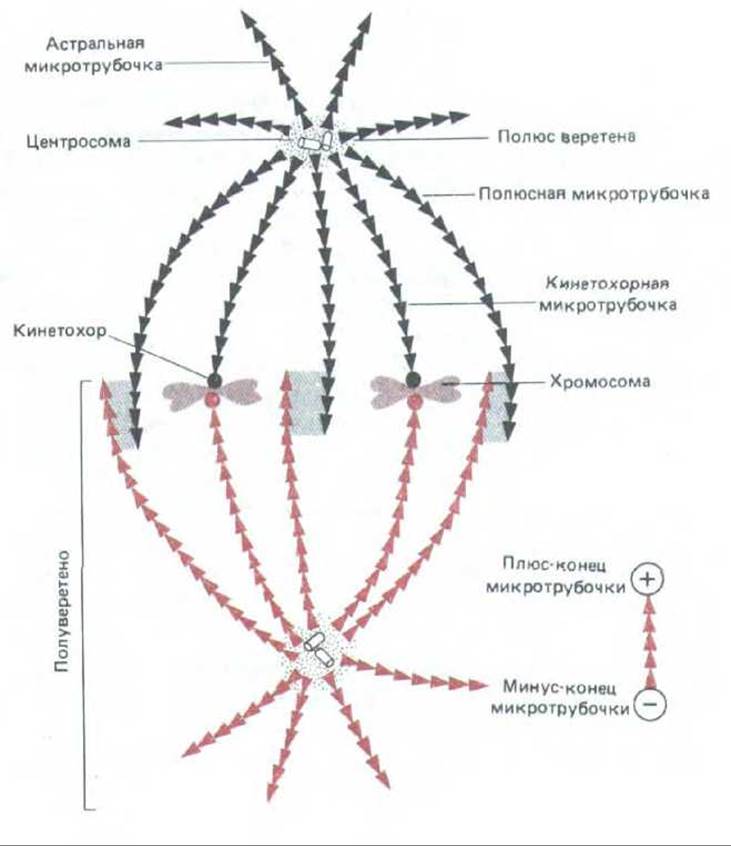
Рис. 13-56. Упрощенная схема мятотического веретена в метафазе. Веретено строится из двух полуверетен (показанных черным и красным цветом), каждое из которых включает кинетохоры, полюсные микротрубочки и микротрубочки звезды. Полярность микротрубочек показана направлением стрелок. Полюсные нити веретена, отходящие от его противоположных полюсов, имеют зону перекрывания (изображена серым цветом), где связанные с микротрубочками белки могут сшивать их. Обратите внимание, что в этой зоне микротрубочки антипараллельны.
Метафаза занимает значительную часть периода митоза (см. рис. 13-43), как будто клетки выжидают, пока все их хромосомы не расположатся надлежащим образом в экваториальной плоскости. Некоторые эксперименты подкрепляют это представление. Многие клетки останавливаются в митозе на несколько часов или дней, если их обработать такими агентами, как колхицин или винбластин, деполимеризующими микротрубочки; в самом деле, этот способ остановки клеточного цикла широко используют, когда нужно получить большое количество митотических клеток для цитологического анализа их конденсированных хромосом (разд. 9.2.3). После удаления агента митотическое веретено быстро регенерирует, и нередко нормальный митоз возобновляется, как только хромосомы правильно расположатся в метафазной пластинке. Высказывалось предположение, что хромосома с неприсоединенным кинетохором служит источником диффундирующего фактора, который в норме задерживает переход к анафазе, предоставляя дополнительное время для правильного присоединения. Если такой фактор существует, то при воздействии агентов, разрушающих веретено, следует ожидать появления мощного сигнала, приводящего к продлению метафазы.
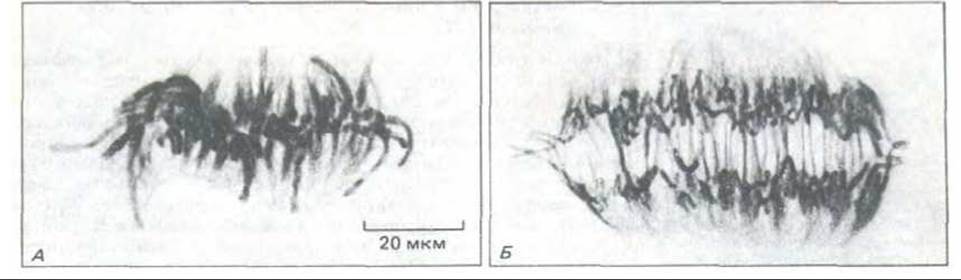
Рис. 13-57. Расхождение хромосом в анафазе клетки из эндосперма Haemanthus. При переходе от метафазы (А) к анафазе (Б) хромосомы растаскиваются полюсными микротрубочками. Клетки окрашены антителами к тубулину, меченными золотом. (С любезного разрешения Andrew Bajer.)
13.5.7. В анафазе сестринские хроматиды внезапно расходятся [41]
Как мы только что видели, метафаза - относительно стабильное состояние, и при обычных условиях многие клетки в течение часа и более пребывают в этой стадии, когда их хромосомы совершают лишь колебательные движения в метафазной пластинке. Анафаза начинается внезапным синхронным расщеплением всех хромосом на сестринские хроматиды, каждая из которых имеет свой кинетохор (рис. 13-57). Сигнал к началу анафазы исходит не от самого веретена, поскольку даже хромосомы, не прикрепленные к веретену, разделяются на хроматиды в то же самое время, что и прикрепленные. Судя по результатам некоторых экспериментов, этот сигнал должен быть связан с повышением концентрации Са2+ в цитозоле. Во-первых, непрерывное наблюдение над клетками, содержащими флуоресцентный индикатор ионов кальция (разд. 4.2.3), показывает, что в некоторых клетках в анафазе происходит быстрое, но кратковременное десятикратное повышение внутриклеточного уровня Са2+. Во-вторых, микроинъекция небольших количеств кальция в культивируемые клетки на стадии метафазы может привести к преждевременному наступлению анафазы. В-третьих, у полюсов веретена обычно видны скопления мембранных пузырьков, и специальная электронно-микроскопическая техника позволяет установить, что эти пузырьки богаты кальцием. Таким образом, возможно, что пузырьки, связанные с веретеном, выделяют С2+ для инициации анафазы (рис. 13-58), подобно тому как саркоплазматический ретикулум высвобождает Са2+ для инициации сокращения скелетной мышцы (разд. 11.1.14).

Рис. 13-58. На этой электронной микрофотографии видно скопление специально окрашенных мембранных пузырьков (напоминающих цитоплазматичсский ретикулум) около полюса веретена; пузырьки вытянуты вдоль микротрубочек веретена. (Метафазная клетка из листа ячменя; фото предоставлено Peter Hepler, из J. Cell Biol. 86: 490-499, 1980, by copyright permission of the Rockefeller Univ. Press.)
13.5.8. Расхождение хромосом в анафазе состоит из двух процессов [42]
Как только каждая хромосома расщепилась в ответ на анафазный сигнал, две ее хроматиды начинают двигаться к противоположным полюсам веретена, где они будут включены в ядра новых клеток. По-видимому, это движение - результат двух независимых процессов, происходящих в веретене (рис. 13-59). Первый из них состоит в перемещении хроматид к полюсам и связан с укорочением микротрубочек, прикрепленных к кинетохорам; обычно этот процесс называют анафазой А. Второй процесс - раздвигание самих полюсов, связанное с удлинением полярных микротрубочек и называемое анафазой В. Эти два процесса можно различить по их избирательной чувствительности к некоторым ядам. Например, низкая концентрация хлоралгидрата предотвращает раздвигание полюсов и удлинение полярных микротрубочек (анафаза В), но не действует ни на микротрубочки кинетохоров, ни на движение хроматид к полюсам (анафаза А). Относительный вклад каждого из этих процессов в окончательное расхождение хромосом существенно различен в зависимости от организма. Например, у клеток млекопитающих анафаза В начинается вскоре после начала движения хроматид к полюсам и заканчивается, когда веретено достигает длины в 1,5-2 раза больше метафазной. У некоторых других клеток, таких как дрожжи, анафаза В начинается только после того, как хроматиды доходят до места своего назначения, а у некоторых простейших анафаза В преобладает и веретено становится в 15 раз длиннее, чем в метафазе.
13.5.9. Во время анафазы А происходит распад микротрубочек, прикрепленных к кинетохорам [43]
При движении хромосом от области метафазной пластинки к полюсам веретена на них воздействуют удивительно большие силы. Измерения с помощью тонких стеклянных игл дают оценку около 10-5 дин на хромосому, что в 10000 раз больше силы, необходимой для того, чтобы просто продвигать хромосому через цитоплазму с наблюдаемой скоростью. Очевидно, должен существовать какой-то мощный «мотор» для перемещения хромосом, однако скорость их движения должна лимитироваться не вязкостью среды, а чем-то другим. Как уже отмечалось, тот же «мотор» мог бы осуществлять стягивание хромосом в метафазную пластинку.
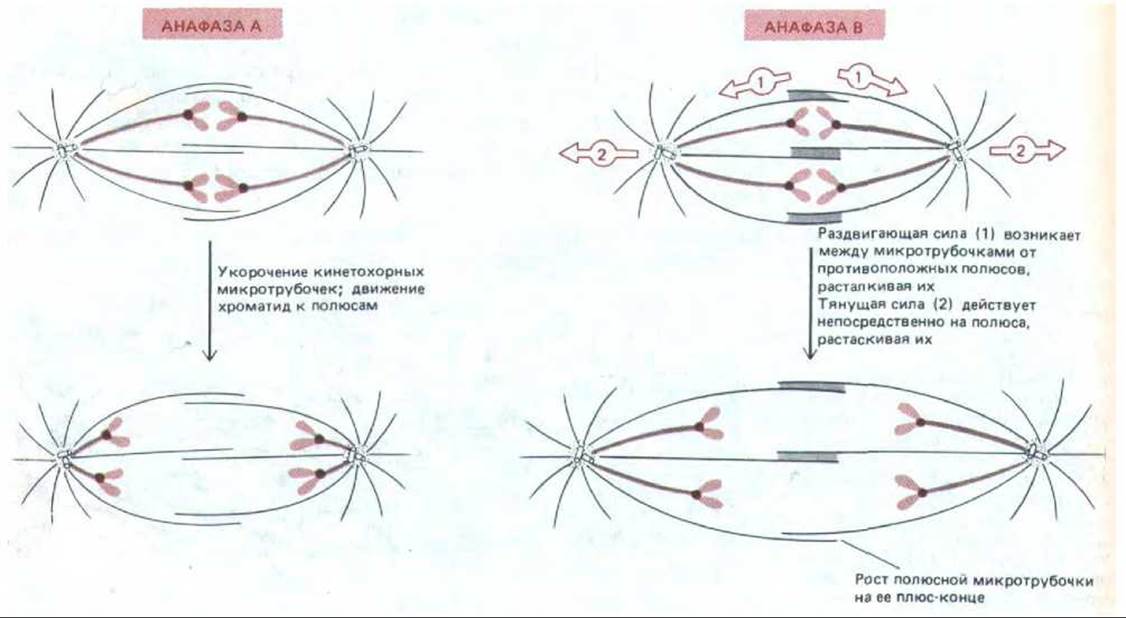
Рис. 13-59. Различные силы, действующие в анафазе при расхождении сестринских хроматид. А. Хроматиды оттягиваются к противоположным полюсам в результате укорочения кинетохорных микротрубочек (движение, называемое анафазой А). Б. В то же время оба полюса веретена отодвигаются дальше друг от друга (движение, называемое анафазой В). Возможно, что силы, обусловливающие анафазу В, подобны тем, которые приводят к расщеплению центросомы и расхождению дочерних центросом с образованием двух полюсов веретена в профазе (см. рис. 13-46). Есть данные о том, что за анафазу В ответственны две отдельные силы: 1) удлинение и скольжение полюсных микротрубочек расталкивают оба полюса, и в то же время 2) другие силы, воздействующие на звезды, тянут полюса в противоположные стороны.
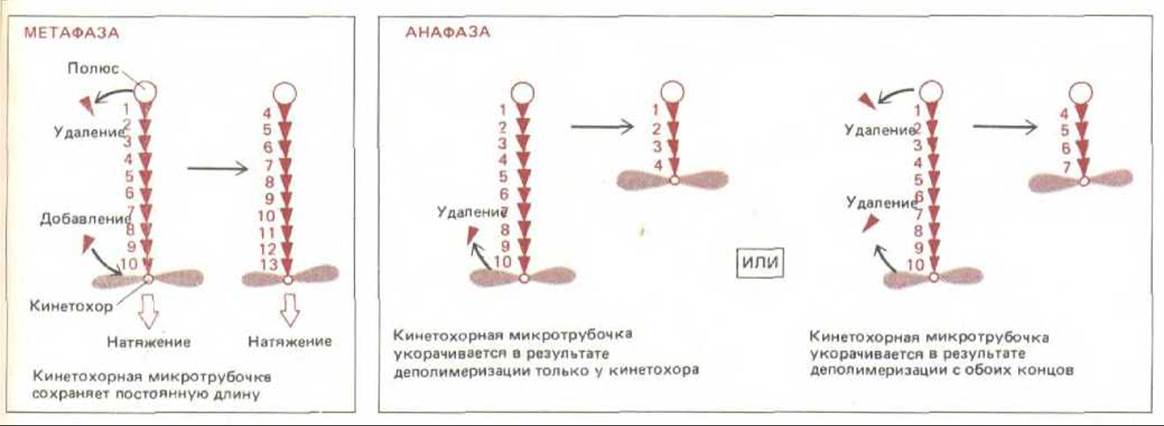
Рис. 13-60. Поведение кинетохорных микротрубочек меняется при переходе от метафазы к анафазе. А. В метафазе на плюс-конце микротрубочки у кинетохора происходит добавление субъединиц тубулина, а на минус-конце у полюса-удаление. Таким образом, субъединицы непрерывно перемещаются в сторону полюса, так что микротрубочки сохраняют постоянную длину и остаются под натяжением. Б. В анафазе натяжение снимается и кинетохор начинает быстро передвигаться по микротрубочке, удаляя при этом субъединицы с ее плюс-конца (слева); в результате этого прикрепленная к нему хроматида перемешается к полюсу веретена. По крайней мере у некоторых организмов движение хроматид частично обусловлено одновременным укорочением микротрубочек также и у полюса (справа).
По мере того как хромосомы движутся к полюсам, микротрубочки, прикрепленные к их кинетохорам, распадаются, так что в телофазе их почти не видно. Участок, где происходит потеря ими субъединиц, можно определить, введя в клетку меченый тубулин во время метафазы. Было установлено, что меченые субъединицы сначала добавляются к тому концу микротрубочки, который связан с кинетохором, а затем теряются в ходе анафазы А. Это указывает на то, что кинетохор в анафазе как бы «проедает» свой путь к полюсам вдоль своих микротрубочек. В пользу такого вывода говорит и тот факт, что анафазные кинетохоры движутся в сторону стационарной метки, поставленной на микротрубочки. Распад микротрубочек у кинетохоров, полюсов или в обоих этих местах, вероятно, необходим для перемещения хромосом к полюсам (рис. 13-60), так как их движение прекращается, если деполимеризацию микротрубочек блокировать добавлением таксола или D2O.
Механизм, с помощью которого кинетохор, а вместе с ним и хромосома движется по веретену во время анафазы А, остается неизвестным. Две его возможные модели схематически представлены на рис. 13-61. Согласно первой модели, кинегохор при движении вдоль прикрепленной к нему микротрубочки гидролизует АТР, а плюс-конец микротрубочки по мере его обнажения деполимеризуется. В другой модели деполимеризация микротрубочки сама по себе приводит к пассивному движению кинетохора. оптимизирующему энергию связывания его с микротрубочкой. Третья возможность, не показанная на рис. 13-61, состоит в том. что микротрубочки не ответственны прямо за возникновение силы, движущей кинетохор к полюсам, а просто регулируют движение, вызываемое какой-то другой структурой. Предполагали, например, что существует система эластичных белковых нитей (возможно, сходных с очень длинными эластичными филаментами поперечнополосатой мышцы - см. разд. 11.1.13), которые связывают кинетохор с полюсом и постепенно подтягивают к нему.

Рис. 13-61. Создание кинетохором силы, движущей хромосому к полюсу в анафазе: две альтернативные модели. А. В кинетохоре имеются «шагающие» белки, сходные с динеином или кинезином; они продвигаются по микротрубочке, используя для этого энергию гидролиза АТР (разд. 10.4.9). Б. Движение хромосом обусловлено распадом микротрубочек: по мере того как субъединицы тубулина диссоциируют, кинетохор, чтобы сохранить связь с микротрубочкой, должен скользить в направлении полюса. Те же механизмы могут использоваться у полюса веретена, который тоже, видимо, способен сохранять связь с микротрубочками, допуская в то же время их контролируемую деполимеризацию (см. рис. 13-60).
Независимо от природы механизма, создающего силу, нужно еще объяснить драматическое изменение в полимеризации микротрубочек у кинетохора при переходе от метафазы к анафазе (в метафазе преобладает полимеризация, в анафазе - распад, см. рис. 13-60). Возможно, что это связано просто с резким уменьшением тянущего усилия, приложенного к кинетохору, в анафазе; ослабление натяжения могло бы непосредственно изменять динамику полимеризации микротрубочек или же приводить к химическим изменениям в кинетохоре.
13.5.10. В анафазе В, возможно, действуют две различные силы [44]
В анафазе В увеличивается расстояние между двумя полюсами веретена, и в отличие от анафазы А это сопровождается сборкой микротрубочек. По мере расхождения полюсов полюсные микротрубочки между ними удлиняются, по-видимому путем сборки на своих дистальных плюс-концах.
И удаление полюсов веретена друг от друга в анафазе, и степень перекрывания полюсных микротрубочек в экваториальной зоне сильно варьируют от вида к виду. Зона перекрывания микротрубочек веретена особенно велика у многих диатомовых водорослей (рис. 13-62), у которых митоз происходит внутри ядерной оболочки (разд. 13.5.18). Как показала кропотливая реконструкция трехмерной структуры целых веретен диатомовых водорослей по сотням серийных срезов для электронной микроскопии, у этих водорослей полюсные микротрубочки обоих полуверетен перекрываются в центральной зоне, вблизи от экватора веретена. В анафазе эти две группы антинараллельных микротрубочек, по-видимому, скользят друг по другу, расходясь в противоположные стороны.
Анафазные движения можно также изучать на лизированных клетках диатомей. В такой модельной системе митотическое веретено легко доступно для макромолекул, так что на ней можно испытывать действие различных макромолекулярных агентов, в том числе и специфических антител. Ингибиторы, присоединяющиеся к актину или миозину (в частности, антитела к миозину) не оказывают никакого влияния на движение анафазных хромосом, так что за это движение вряд ли ответственна актомиозиновая система вроде той, которая действует в мышцах. Вместо этого силу здесь могли бы создавать белки, подобные динеину, связанному с микротрубочками в ресничках и жгутиках (разд. 11.3.7), или кинезину, участвующему в быстром аксонном транспорте (разд. 10.4.9). Эти два белка присоединяются к микротрубочкам и вызывают направленное движение за счет гидролиза АТР. но пока не известно, играют ли они существенную роль в митозе.
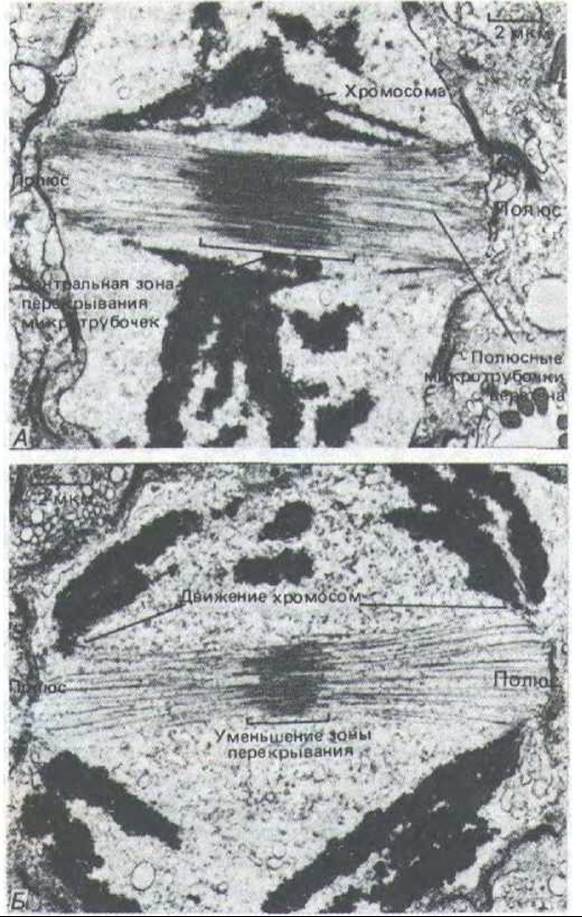
Рис. ІЗ-62. Эти электронные микрофотографии показывают, как удлиняется веретено и уменьшается степень перекрывания полюсных микротрубочек при митозе у диатомовой водоросли. А. Метафаза. Б. Поздняя анафаза. (С любезного разрешения Jeremy D. Pickett-Heaps.)
В клетках высших организмов перед формированием веретена ядерная оболочка разрушается, и поэтому астральные микротрубочки (те, которые направлены от митотического веретена, см. рис. 13-56) могут играть более важную роль в анафазе В, чем у диатомовых. Например, в яйцах некоторых морских беспозвоночных можно разрушить микротрубочки веретена, не блокируя при этом анафазу В. Это позволяет думать, что полюса веретена раздвигаются под влиянием тянущих сил - вероятно, в результате притяжения между астральными микротрубочками и кортексом клетки. Сходные взаимодействия могли бы играть роль и в случаях асимметричного деления клетки (разд. 13.5.13).
13.5.11. В телофазе ядерная оболочка образуется сначала вокруг отдельных хромосом [45]
К концу анафазы хромосомы полностью разделяются на две идентичные группы, по одной у каждого полюса веретена. В последней стадии митоза-телофазе-вокруг каждой группы хромосом вновь образуется ядерная оболочка, так что получаются два дочерних интерфазных ядра. В связи с распадом и восстановлением ядерной оболочки нужно рассмотреть по меньшей мере три ее компонента:
1) наружную и внутреннюю ядерные мембраны, являющиеся продолжением мембран эндоплазматического ретикулума;
2) лежащую под ними ядерную ламину - тонкую двумерную сеть промежуточных филаментов, состоящих из ядерных ламииов, которая взаимодействует с внутренней ядерной мембраной, хроматином и ядерными порами (разд. 11.5.5);
3) ядерные поры, образованные крупными комплексами из недостаточно охарактеризованных белков (разд. 8.3.1).
В профазе многие белки фосфорилируются. Если фосфорилирование молекул гистона Н1, по-видимому, способствует конденсации хромосом (разд. 13.1.10), то фосфорилирование ядерных ламинов участвует в регуляции распада и восстановления ядерной оболочки. Фосфорилирование ламинов происходит во многих различных участках каждой полипептидной цепи и поэтому приводит к их распаду и, как следствие, к разрушению ядерной ламины. Затем - вероятно, в ответ на другой сигнал - сама ядерная оболочка распадается на, мелкие мембранные пузырьки.
Резкий переход от метафазы к анафазе, по-видимому, приводит к дефосфорилированию многих белков (в том числе молекул гистона Н1 и ламинов), которые были фосфорилированы в профазе. Вскоре после этого, в телофазе, пузырьки ядерной мембраны связываются с поверхностью отдельных хромосом и сливаются, восстанавливая ядерные мембраны, которые лишь частично окружают группы хромосом перед полным восстановлением ядерной оболочки (рис. 13-63); одновременно восстанавливаются и ядерные поры, а дефосфорилированные ламины вновь агрегируют, образуя ядерную ламину. Один из белков ламины (ламин В) на протяжении всего митоза остается связанным с фрагментами ядерной мембраны и, возможно, способствует их воссоединению в телофазе. После восстановления ядерной оболочки возобновляется синтез РНК, что ведет к появлению ядрышка (разд. 9.4.19), а хроматин деконденсируется и переходит в дисперсное состояние, характерное для интерфазы.
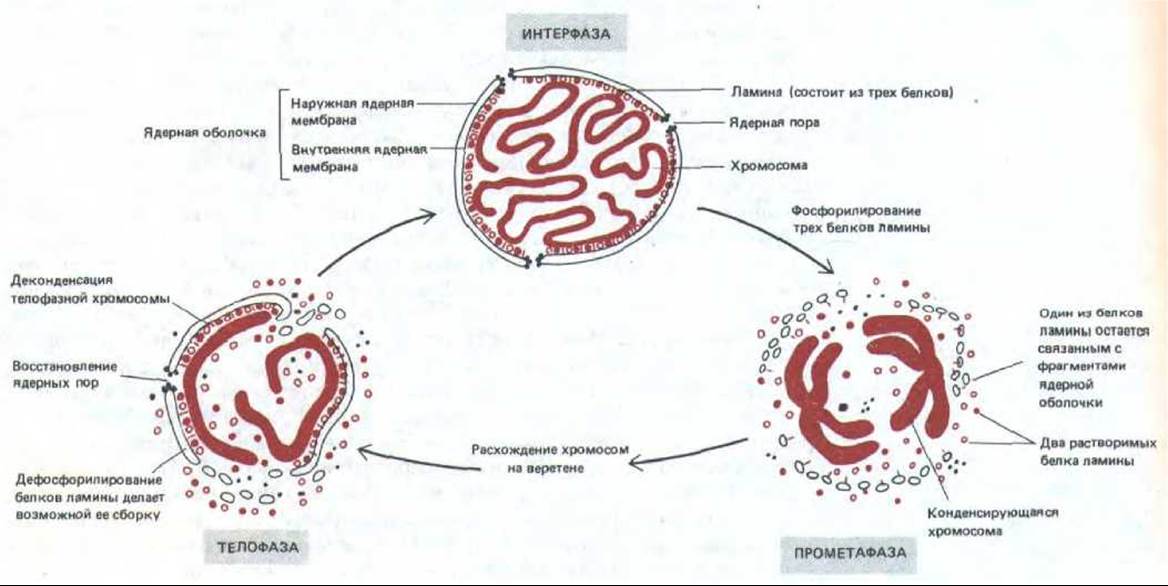
Рис. 13-63. Схема циклических изменений ядерной оболочки во время митоза. В прометафазе ядерные мембраны распадаются на мелкие пузырьки и вновь восстанавливаются в телофазе. Между этими двумя фазами, когда ядерная оболочка разрушена, а ядерные поры и ядерная ламина распались на субъединицы, осуществляются все процессы, в результате которых два набора хромосом расходятся к противоположным полюсам. Как показано на рисунке, новая ядерная оболочка каждой дочерней клетки образуется в результате слияния мембранных пузырьков вокруг группирующихся индивидуальных хромосом; при этом большая часть цитоплазматических компонентов не попадает в новое ядро.
И распад, и восстановление ядерной структуры могут происходить в неочищенных экстрактах яиц Xenopus, разумеется, если эти экстракты приготовлены из клеток соответствующих стадий клеточного цикла (из мнтотических для распада и из интерфазных для восстановления). В таких экстрактах весь процесс, в котором участвуют ламина, ядерные поры и ядерные мембраны, протекает, по всей видимости, нормально в ответ на циклы фосфорилирования и дефосфорилирования. Таким образом, подобные системы in vitro могут служить тест-объектами при идентификации и очистке белков, катализирующих распад и восстановление ядерной оболочки в клетке, в том числе и белков (таких, как MPF), регулирующих эти процессы. Для восстановления ядра к таким экстрактам нужно добавлять ДНК, причем полное восстановление ядерной оболочки происходит вокруг очищенных молекул ДНК, взятой от любого организма, даже от бактериального вируса. Таким образом, хотя здесь и должны участвовать белки, связывающиеся с ДНК, маловероятно, чтобы при этом распознавались специфические последовательности нуклеотидов.
Интересно, что распад ядерной оболочки не является необходимым для митоза. Действительно, позднее мы увидим, что у низших эукариот ядерная оболочка во время митоза не разрушается; принято говорить, что эти организмы обладают не «открытым», а «закрытым» веретеном.
13.5.12. Метафазу и интерфазу можно рассматривать как альтернативные «устойчивые» состояния клетки [46]
На рис. 13-64 схематически представлена одна из современных гипотез относительно митотического цикла. В ней принята в некотором смысле точка зрения химика на митоз, где интерфаза и метафаза рассматриваются как два альтернативных «устойчивых» состояния клетки, а другие стадии митоза - просто как необходимые переходные состояния между ними. Предполагается, что в конце интерфазы происходит включение некоего механизма («М-фазного переключателя»), побуждающего клетку проходить через профазу и прометафазу до более устойчивого метафазного состояния. В конце метафазы этот механизм внезапно выключается, и клетка проходит через анафазу и телофазу, возвращаясь к интерфазе, которая при выключенном регуляторе наиболее устойчива.

«включено» и «выключено». Согласно этой гипотезе, включение приводит к фосфорилированию многих белков, происходящему только в митотической клетке. Серия структурных изменений, связанных со сборкой веретена, не требует специальных триггеров: скорее это ряд энергетически выгодных этапов на пути к стабильному метафазному состоянию. Это состояние продолжается до тех пор, лока анафазный триггер не поставит переключатель в положение «выключено», а дефосфорилирование белков не восстановит прежние глобальные параметры. Это запускает новую серию структурных изменений (включая расхождение хромосом), что опять приводит клетку к стабильному интерфазному состоянию.
Такую точку зрения на митоз подкрепляют данные об изменениях, происходящих с микротрубочками цитоскелета (см. рис. 13-48), а также о внезапных изменениях в активности и степени фосфорилирования некоторых белков, участвующих в митозе, на границах интерфаза/профаза (включение) и метафаза/анафаза (выключение) (см. разд. 13.1.10). Положение «переключателя» могло бы соответствовать уровню активности MPF в клетке (см. обсуждение цикла MPF в разд. 13.1.11 и рис. 13-15).
13-30
13.5.13. Митотическое веретено определяет место, где происходит разделение цитоплазмы при цитокинезе
Во время цитокинеза разделяется цитоплазма. Хотя деление ядра и разделение цитоплазмы, как правило, взаимосвязаны, эта связь не всегда неразрывна. Даже в норме за делением ядра может не следовать цитокинез. Например, в раннем зародыше Drosophila происходит в циклов ядерных делений без разделения цитоплазмы; в результате образуется одна большая клетка с 6000 ядер, расположенных в один слой около ее поверхности. Одноядерные клетки образуются позже при дроблении цитоплазмы вокруг всех этих ядер (разд. 16.5.2),
Хотя митозу не всегда непосредственно сопутствует цитокинез, митотическое веретено играет важную роль в определении того, когда и как он будет происходить. Цитокинез обычно начинается в анафазе, продолжается во время телофазы и захватывает часть последующего периода интерфазы. Первым видимым признаком цитокинеза у животных клеток бывает образование небольшой складки плазматической мембраны, появляющейся в анафазе и называемой бороздой деления (рис. 13-65). Эта борозда всегда образуется в плоскости метафазной пластинки, под прямым углом к длинной оси митотического веретена. Если в анафазе на достаточно раннем этапе веретено переместить с помощью микроманипулятора, то наметившаяся борозда исчезнет и появится новая в соответствии с новым положением веретена. Изящные опыты на яйцах морского ежа Echinarachnius показывают, что борозда дробления будет формироваться посередине между звездами, образовавшимися из двух центросом, даже если центросомы не связаны митотическим веретеном (рис. 13-66). Позднее, когда процесс зашел уже достаточно далеко, цитокинез будет продолжаться и в том случае, если веретено и его звезды удалить пипеткой или разрушить колхицином.
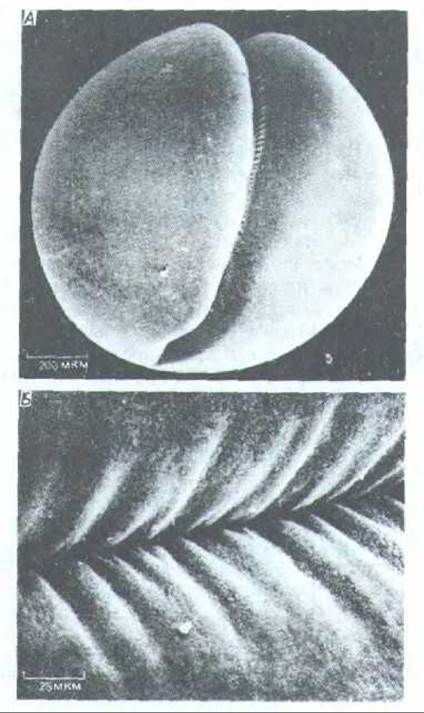
Рис. 13-65. Начало дробления яйца лягушки. Микрофотографии, полученные с помощью сканирующего электронного микроскопа. Образование борозды обусловлено активностью сократимого кольца, находящегося под мембраной. А. Вид клеточной поверхности при малом увеличении. Б. Участок борозды при большом увеличении. (H.W. Beams. R.G. Kessel, Am. Sci. 64: 279-290, 1976.)

Рис. 13-66. Опыт, демонстрирующий влияние положения веретена на плоскость деления. Если митотическое веретено механически сместить на одну сторону клетки, то борозда дробления не дойдет до противоположной стороны клетки. Последующие деления будут происходить не только по экваторам двух митотических веретен (как это происходит в норме), но и между двумя соседними звездами, не связанными митотическим веретеном. Видимо, сократимый пучок из актиновых филаментов, создающий борозду дробления, всегда образуется в участке, лежащем посередине между двумя звездами. Это означает, что звезды каким-то образом изменяют окружающую область клеточного кортекса.
Большинство клеток делится симметрично. Борозда деления образуется по экватору родительской клетки, так что дочерние клетки будут одинаковой величины и с примерно одинаковыми свойствами. В период эмбрионального развития, однако, бывает много случаев, когда клетки делятся асимметрично: борозда разделяет две разные клетки, которые будут развиваться разными путями. Деления такого рода часто строго определены пространственно. Например, они могут происходить в определенных плоскостях по отношению к поверхности эпителиального пласта или приводить к обособлению участков цитоплазмы с разными наборами органелл. Независимо от того, будет ли деление симметричным или асимметричным, положение борозды, а значит, и плоскости деления всегда определяется положением митотического веретена. При надобности веретено может запрограммированным образом поворачиваться, занимая нужное положение в клетке и соответственно ориентируя плоскость деления (рис. 13-67). Кажется вероятным, что эти движения веретена определяются изменениями в отдельных участках клеточного кортекса, который сдвигает полюса веретена с помощью микротрубочек звезды. Видимо, сходный механизм определяет положение центросомы в поляризованной клетке (разд. 11.4.5). Структура кортекса, который богат актином, рассмотрена в гл. 11 (разд. 11.2).
Микротрубочки и пучки актиновых филаментов, находившиеся в интерфазной цитоплазме, во время митоза разрушаются. Однако цитоплазматические промежуточные филаменты во многих клетках сохраняются в целости. В таких клетках сеть промежуточных филаментов, окружающая интерфазное ядро, во время митоза растягивается, охватывая оба дочерних ядра, и в конце концов расчленяется на две части бороздой деления (рис. 13-68).
13.5.14. Актин и миозин создают силу, необходимую для цитокинеза
Разделение цитоплазмы происходит в результате сокращения кольца, состоящего главным образом из актиновых филаментов. Этот пучек филаментов, называемый сократимым кольцом (рис. 13-69), прикрепляется к внутренней стороне плазматической мембраны с помощью неидентифицированных белков. Сократимое кольцо образуется в начале анафазы, и механизм его сборки неизвестен; сила, которую оно создает, достаточна, чтобы согнуть тонкую стеклянную иглу, введенную в клетку. Нет сомнения в том, что источником силы здесь, так же как и в мышцах, служит взаимное скольжение актиновых и миозиновых филаментов. Например, в лизированных митотических клетках добавление субфрагментов инактивированного миозина блокирует миозин-связывающие участки актина, останавливая таким образом разделение цитоплазмы. Точно так же введение антител к миозину в яйца морского ежа вызывает сглаживание борозды дробления, но на ядерный митоз не влияет. Тем не менее в точности не известно, как взаимодействие актина и миозина втягивает плазматическую мембрану в борозду дробления.
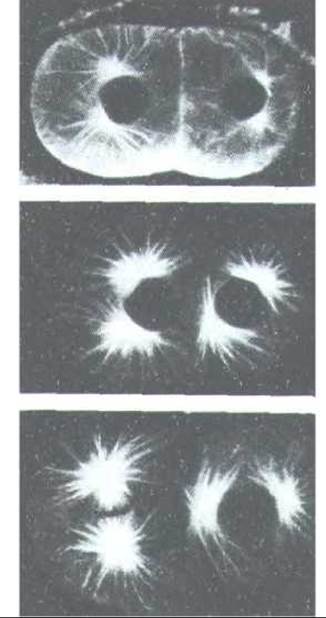
Рис. 13-67. Точно запрограммированный поворот митотического веретена на двуклеточной стадии зародыша нематоды Caenorhabditis elegans при подготовке к делению с образованием четырех определенным образом расположенных клеток. (С любезного разрешения John White.)
В процессе нормального деления клетки сократимое кольцо не становится толще по мере углубления борозды. Это позволяет предполагать, что оно постепенно уменьшается в объеме за счет потери части филаментов. После завершения цитокинеза сократимое кольцо полностью распадается, а плазматическая мембрана в области борозды стягивается, окружая так называемое остаточное тельце, которое еще связывает две дочерние клетки. Остаточное тельце содержит остатки двух групп полярных микротрубочек, тесно упакованных вместе с материалом плотного матрикса (рис. 13-70).
Цитокинез, при котором из одной клетки образуются две, сильно увеличивает общую площадь клеточной поверхности. Поэтому двум дочерним клеткам требуется больше материала плазматической мембраны, чем исходной клетке. В животных клетках биосинтез вещества мембраны непосредственно перед делением усиливается. Избыточная мембрана у готовящихся к делению клеток, по-видимому, хранится в виде выступов (blebs) на их поверхности.
13.5.15. У высших растений цитокинез осуществляется совершенно иным способом [49]
Большинство клеток высших растений окружено жесткой клеточной стенкой, и поэтому механизм цитокинеза существенно отличается от только что описанного для животных клеток. Вместо образования двух дочерних клеток путем их отшнуровки с помощью сократимого кольца, лежащего под поверхностью клетки, цитоплазма разделяется здесь в результате образования новой стенки на границе между дочерними клетками. Образующаяся перегородка точно определяет относительное положение двух новых клеток в растении. Из этого следует, что ориентация плоскостей клеточного деления и увеличение размеров клеток определяют форму растения (см. гл. 20).
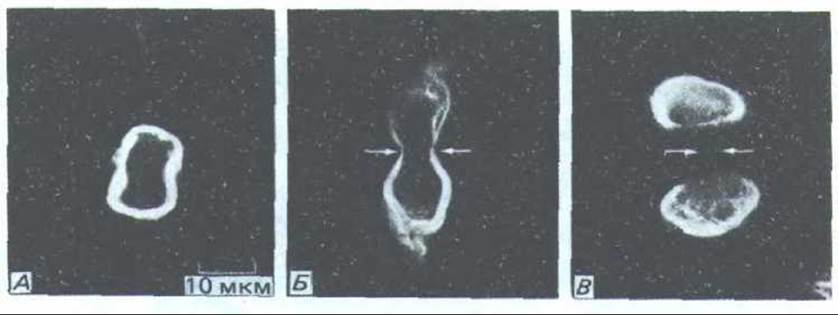
Рис. 13-68. Во время митоза зону ядра окружает пучок промежуточных филаментов. Микрофотографии получены после окрашивания пермеабилизиро ванных клеток флуоресцентными антителами, которые связываются с промежуточными филаменгами. А-анафаза; Б-ранняя телофаза (стрелками указано положение сократимого кольца); В-поздняя телофаза. (S. Н. Blose, Ргос. Natl. Acad. Sci. USA 76: 3372-3376, 1979.)

Рис. 13-69. Электронная микрофотография дна борозды, образующейся при делении животной клетки. Сверху для ясности приведена схема борозды деления. (Н. W. Beams, R. G. Kessel, Am. Sci. 64: 279-290, 1976.)
Новая поперечная перегородка, или клеточная пластинка, начинает строиться в плоскости между двумя дочерними ядрами в ассоциации с остаточными полюсными микротрубочками веретена, которые образуют цилиндрическую структуру, называемую фрагмопластом. Эта структура, соответствующая микротрубочкам остаточного тельца животных клеток, состоит из двух групп противоположно ориентированных микротрубочек, расположенных параллельно друг другу (см. рис. 20-42). Микротрубочки, вероятно, прикреплены к поверхности ядра, так что их плюс-концы погружены в электроноплотный диск в экваториальной плоскости. Как показано на рис. 13-71, мелкие ограниченные мембраной пузырьки, происходящие в основном из аппарата Гольджи и наполненные предшественниками клеточной стенки, приходят в контакт с микротрубочками по обе стороны фрагмопласта и транспортируются вдоль них к экваториальной области клетки. Здесь они сливаются, образуя дисковидную, окруженную мембраной структуру - раннюю клеточную пластинку. Молекулы полисахаридов, высвобождаемые этими пузырьками, связываются между собой в ранней клеточной пластинке, образуя пектин, гемицеллюлозу и другие компоненты первичной клеточной стенки. Теперь этот диск должен расширяться, пока его края не дойдут до стенки материнской клетки. Чтобы это стало возможным, микротрубочки раннего фрагмопласта претерпевают изменения по периферии ранней клеточной пластинки. Здесь с ними приходят в контакт новые пузырьки, которые затем сливаются на экваторе, расширяя пластинку. Этот процесс повторяется до тех пор, пока растущая клеточная пластинка не достигнет плазматической мембраны материнской клетки и мембраны не сольются, полностью разделяя две новые дочерние клетки (см. рис. 20-41 и 20-42). Затем в клеточной пластинке откладываются микрофибриллы целлюлозы, завершая построение новой клеточной стенки (рис. 13-71 и 13-72).
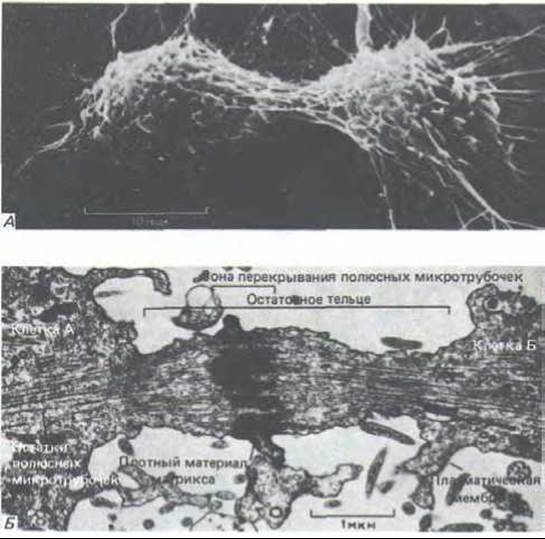
Рис. 13-70. А, Животная клетка в культуре в конце: деления: остаточное тельце остается связанным с обеими дочерними клетками. Микрофотография, полученная с помощью сканирующего электронного микроскопа. Б. Электронная микрофотография остаточного тельца делящейся животной клетки. Деление практически полностью завершено, но дочерние клетки еще связаны тонким цитоплазматическим мостиком. [С любезного разрешения Guenter Albrecht-Buehler (A) и J.M. Millins (Б).]
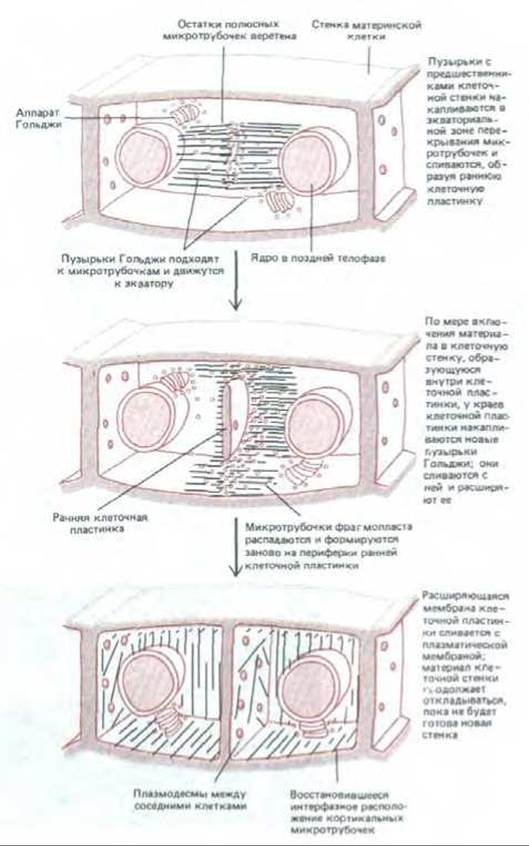
Рис. 13-71. Ход цитокинеза в клетках высших растений, имеющих жесткую клеточную стенку.
С пузырьками образующейся клеточной пластинки связаны элементы эндоплазматического ретикулума, которые часто оказываются включенными в эту пластинку. Впоследствии они превращаются в плазмодесми - сложно устроенные поры, пронизывающие зрелую клеточную стенку и соединяющие цитоплазму всех клеток растения (см. разд. 20.2.1 и рис. 20-20).

Рис. 13-72. Цитокинез в растительной клетке. Клеточная пластинка (между двумя стрелками) формируется в плоскости, перпендикулярной плоскости рисунка. Одна клетка (А) сфотографирована с применением метода дифференциального интерференционного контраста; другая окрашена антителами со связанными частицами золота, которые метят два скопления микротрубочек, входящих в состав фрагмопласта. В обоих случаях стрелками указана плоскость клеточной пластинки. [С любезного разрешения Jeremy D. Pickett-Heaps (А) и Andrew Bajer (Б).]
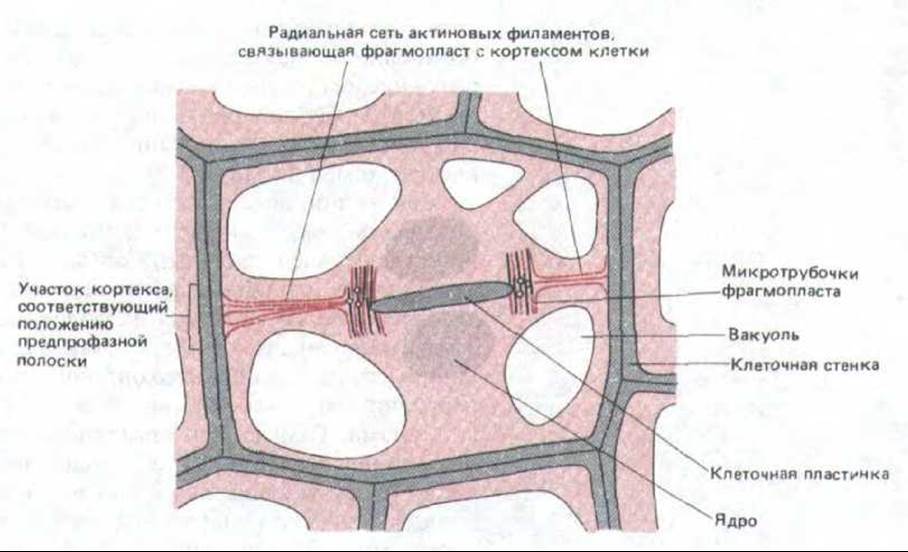
Рис. 13-73. Организация актиновых филаментов в растительной клетке во время цитокинеза. Актиновые филаменты (выделенные темнокрасным цветом) формируют радиальную сеть, которая простирается от концов фрагмопласта до клеточного кортекса, образуя вокруг клетки кольцо. Эта сеть, по-видимому, определяет плоскость образования клеточной пластинки. Другая группа актиновых филаментов расположена параллельно микротрубочкам, участвующим в образовании новой клеточной пластинки в фрагмопласте. Еще одна группа актиновых филаментов (на рисунке не показана) подходит к кортексу из области двух дочерних ядер через большую центральную вакуоль, свойственную растительным клеткам (разд. 20.40.7); эти филаменты помогают поддерживать тонкие цитоплазматические мостики, пересекающие вакуоль.
Так же как и у животных, митоз и цитокинез у растений могут быть разобщены. Так, например, в эндосперме семян митозы происходят без цитокинеза, что приводит к образованию гигантской многоядерной клетки. Значительно позднее, когда митотическое веретено уже давно распалось, между отдельными ядрами строятся новые клеточные стенки, так что образуются отдельные клетки.
Для определения точного положения и формы клеточной стенки одного митотического веретена обычно не достаточно. Место соединения будущей пластинки со стенкой материнской клетки, по-видимому, определяется очень рано, еще до начала митоза, узким пучком микротрубочек - предпрофазным пояском, расположенным непосредственно под плазматической мембраной (см. разд. 20.5.5 и рис. 20-64). Хотя эти микротрубочки в начале митоза исчезают, от них зависит, в каком участке кортекса будет прикрепляться радиальная сеть актиновых филаментов, которая сохраняется на протяжении всей фазы М и должна будет направлять растущий край клеточной пластинки к надлежащей зоне кортекса (рис. 13-73). Таким образом, актин играет важную роль и в делении клеток с жесткими стенками, где активное сокращение не играет, по-видимому, никакой роли. Поскольку актин участвует также в формировании клеточных септ у грибов, возможно, что он направляет цитокинез у всех эукариот.
13.5.16. Цитокинез должен обеспечить правильное распределение цитоплазматических органелл [50]
Ядро-это только одна из многих клеточных органелл, для удвоения которых необходима предшествующая органелла того же типа. Например, рибосомы могут спонтанно собираться из своих компонентов, но для их построения нужны другие рибосомы, чтобы синтезировать необходимые белки. С другой стороны, митохондрии и хлоропласта не способны к спонтанной самосборке и могут образовываться только путем роста и разделения предсуществующих органелл (разд. 7.5.1). Точно так же механизмы роста ряда других органелл, например аппарата Гольджи и эндоплазматического ретикулума, таковы, что трудно представить себе их новообразование в отсутствие хотя бы фрагментов соответствующих структур (см. гл. 8). У некоторых водорослей, имеющих только один хлоропласт или только один аппарат Гольджи, органелла, присутствующая в одном-единственном экземпляре, перед цитокинезом расщепляется на две половинки, которые затем и распределяются между дочерними клетками (см. рис. 7-67). Примером такого же явления служат дупликация и сегрегация центросомы в животных клетках (см. рис. 13-46).
Как же при делении клеток высших эукариот разделяются различные органеллы, окруженные мембраной (за исключением ядра)? В большинстве случаев число этих органелл достаточно велико (см. табл. 8-1), чтобы и при случайном распределении их в процессе цитокинеза каждая дочерняя клетка получала их более или менее представительный набор. Таким образом, хотя клетка млекопитающего не выживет, не получив, например, ни одной митохондрии, вполне возможно, что для надежной передачи их дочерним клеткам не требуется никакого специального механизма. Разумеется, органеллы, присутствующие в клетках в большом количестве, будут всегда успешно наследоваться, если в среднем их число будет удваиваться в каждом клеточном поколении. Другие органеллы, такие как аппарат Гольджи и эндоплазматический ретикулум, во время митоза распадаются на более мелкие фрагменты и пузырьки. Такое раздробление, вероятно, способствует их равному распределению между дочерними клетками.
13-26
13.5.17. В особых случаях определенные клеточные компоненты могут передаваться только одной дочерней клетке
До сих пор мы рассматривали клеточное деление как механизм, предназначенный для получения двух одинаковых клеток из одной. Однако в процессе развития и поддержания тканей сложных многоклеточных организмов деление во многих случаях бывает явно неравным. В особенности это относится к ранним делениям дробления, когда большое оплодотворенное яйцо подразделяется на клетки меньшей величины, из которых должны будут развиться разные части организма (разд. 16.2.2). Мы уже говорили о том, что асимметричное положение веретена во время митоза может приводить к появлению двух клеток неодинаковых размеров (разд. 13.5.13), однако образование дочерних клеток, различающихся в биохимическом отношении, составляет особую проблему.
Поразительным примером такого процесса может служить поведение группы своеобразных гранул в яйце нематоды Caenorhabditis elegans. В цитоплазме неоплодотворенного яйца эти «Р-гранулы» распределены равномерно, но непосредственно перед первым делением они перемещаются к заднему концу клетки и поэтому попадают только в один из двух бластомеров (рис. 13-74). Такое неравное распределение повторяется в ряде последующих клеточных делений, так что в конце концов гранулы оказываются только в тех клетках, которые будут формировать зародышевую линию (т. е. в предшественниках яиц и сперматозоидов). Возможно, что Р-гранулы играют какую-то роль в дальнейшей дифференцировке этих клеток.
Р-гранулы будут передвигаться к заднему концу клетки даже у мутантов, у которых митотическое веретено повернуто под прямым углом к нормальному положению. Кроме того, результаты экспериментов с ингибиторами цитоскелета позволяют предполагать, что направленное движение Р-гранул зависит не от микротрубочек, а от актиновых филаментов (оно блокируется цитохалазином D). Хотя неравномерное распределение гранул, по-видимому, определяется каким-то асимметричным свойством актинового цитоскелета, молекулярный механизм их направленного перемещения остается неизвестным. Заманчивой кажется мысль, что подобные механизмы могли бы определять передвижение многих обычно невидимых компонентов клетки и что получающиеся в результате этого неравные дочерние клетки программировались бы таким образом для дальнейшей дифференцировки (разд. 16.4.1).
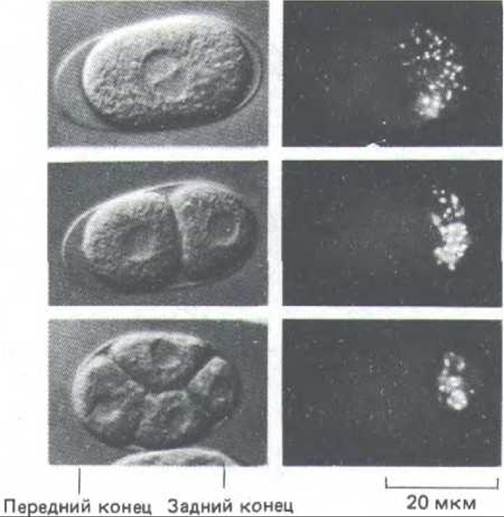
Рис. 13-74. Запрограммированная асимметричная передача цитоплазматического компонента одной из дочерних клеток в двух первых делениях оплодотворенного яйца нематоды Caenorhabditis elegans. Слева представлены живые клетки, сфотографированные с применением метода дифференциального интерференционного контраста; справа - те же клетки, окрашенные антителами к Р-гранулам. Эти мелкие гранулы с неизвестной функцией (0,5-1 мкм в диаметре) распределены в цитоплазме неоплодотворенного яйца случайным образом. (С любезного разрешения Susan Strome.)
13.5.18. Сложный митотический процесс высших организмов развился постепенно из механизмов деления прокариот [52]
В прокариотических клетках разделение ДНК и цитоплазмы представляет собой единый процесс. Во время репликации ДНК две копии хромосомы прикреплены к особым участкам клеточной мембраны, которые постепенно раздвигаются в результате роста мембраны между ними. Деление цитоплазмы происходит между двумя точками прикрепления ДНК таким образом, что каждая дочерняя клетка получает по одной хромосоме (рис. 13-75). С появлением эукариот геном усложнился, увеличились размеры и число хромосом. Возникла необходимость в создании более сложного механизма распределения хромосом между дочерними клетками.
Ясно, что митотический аппарат не мог выработаться сразу. У многих примитивных эукариот, например у динофлагелляты Crypthecodinium cohnii, митоз остался процессом, связанным с мембраной, а ядерная мембрана взяла на себя роль плазматической мембраны прокариот. Промежуточное положение этой крупной одноклеточной водоросли отражено также в биохимии ее хромосом, содержащих, подобно прокариотическим хромосомам, сравнительно мало ассоциированных белков. Ядерная мембрана у С. cohnii сохраняется на протяжении всего митоза, а микротрубочки веретена целиком располагаются вне ядра. Там, где микротрубочки давят на ядерную оболочку, она впячивается внутрь, образуя ряд параллельных сквозных каналов (рис. 13-75). Хромосомы прикрепляются к внутренней мембране ядерной оболочки в области этих каналов, и разделение хромосом полностью происходит на внутренней поверхности этой мембраны. Таким образом, внеядерное «веретено» (представляющее собой жесткий стержень без каких-либо динамических свойств) используется просто для придания ядерной мембране определенной формы, от которой будет зависеть плоскость деления.
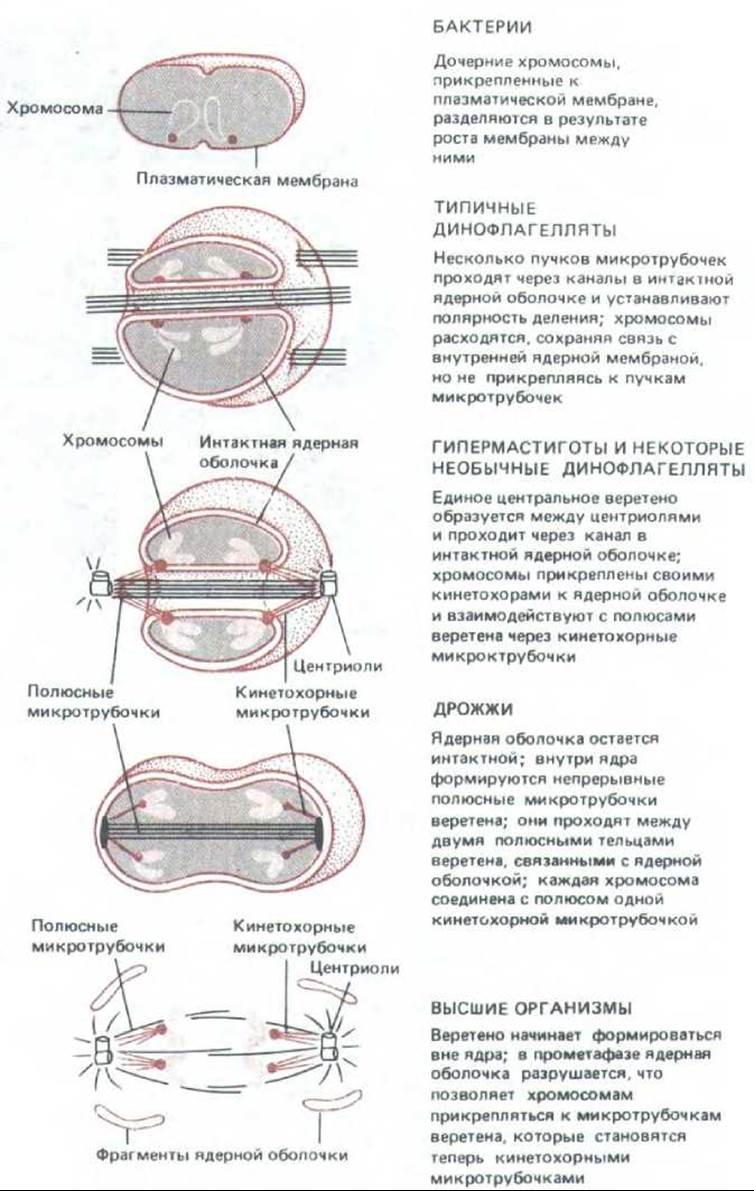
Рис. 13-75. У разных организмов используются разные механизмы расхождения хромосом. Некоторые из них могли быть переходными стадиями в эволюции митотического веретена высших организмов. Во всех примерах, за исключением бактерий, показан только центральный, ядерный участок клетки.
Несколько более развитое, но все еще внеядерное веретено свойственно гипермастиготам, у которых ядерная оболочка в процессе митоза тоже сохраняется. Эти крупные простейшие из кишечника насекомых особенно четко иллюстрируют независимость удлинения веретена и движения хромосом, приводящего к разделению хроматид, поскольку сестринские кинетохоры еще до их связывания с веретеном расходятся в стороны в результате роста ядерной мембраны, к которой они прикреплены. Только тогда, когда кинетохоры оказываются вблизи полюсов веретена, у них появляется возможность с помощью кинетохорных нитей прикрепиться к веретену. Поскольку нити веретена остаются отделенными от хромосом ядерной оболочкой, Кинетохорные нити, образующиеся вне ядра, должны каким-то образом прикрепиться к хромосомам через ядерную мембрану. После этого прикрепления кинетохоры подтягиваются к полюсам обычным способом (13-75).
Следующий этап в эволюции механизмов митоза представлен группой организмов с веретеном внутри интактного ядра. У дрожжей веретено состоит из непрерывного внутриядерного пучка микротрубочек, который тянется от одного полюса до другого и удлиняется в процессе митоза (см. рис. 13-75 и 13-16). У других видов, таких как диатомовые водоросли, непрерывное веретено заменяется двумя обычными полуверетенами, у которых концы микротрубочек переплетаются, образуя зону перекрывания. И у дрожжей, и у диатомовых водорослей хромосомы соединены с веретеном своими кинетохорами и расхождение хромосом происходит примерно так же, как в клетках млекопитающих, если не считать того, что весь этот процесс обычно происходит внутри ядерной оболочки. Пока еще не удалось убедительно объяснить, почему у высших растений и животных вместо этого выработался митогический аппарат, требующий контролируемого и обратимого разрушения ядерной оболочки.
Заключение
Процесс клеточного деления состоит из деления ядра (митоз) и следующего за ним деления цитоплазмы (цитокинез). Митоз начинается с профазы - переходного периода, когда расщепление центросомы приводит к образованию двух полюсов веретена, организующего в дальнейшем распределение ядерного материала. В это же время начало фазы М сопровождается заметным усилением фосфорилирования определенных белков. Видимо, в результате этого в митотической клетке создается необычайно динамичная система микротрубочек. После разрушения ядерной оболочки в прометафазе кинетохоры конденсированных хромосом могут захватываться и стабилизироваться группами микротрубочек, в большом числе отходящих от обоих полюсов веретена. Эти микротрубочки тянут кинетохоры к противоположным полюсам, и в результате хромосомы располагаются во время метафазы по экватору веретена. В анафазе это натяжение внезапно ослабевает, когда сестринские хроматиды отделяются друг от друга и расходятся к разным полюсам. В добавление к этому часто раздвигаются и оба полюса. В конечной стадии митоза, телофазе, вокруг каждой группы разделившихся хромосом вновь формируется ядерная оболочка, когда белки, фосфорилированные в начале фазы М, вновь дефосфорилируются.
Клеточное деление заканчивается разделением цитоплазмы (цитокинезом); хромосомы деконденсируются, и на них возобновляется синтез РНК. По-видимому, цитокинез у столь различных эукариотических организмов, как животные, растения и грибы, направляется организованными пучками актиновых филаментов. Крупные органеллы, ограниченные мембранами, такие как аппарат Гольджи и эндоплазматический ретикулум, во время фазы М разделяются на более мелкие фрагменты и пузырьки, что обеспечивает их равномерное распределение между дочерними клетками. Однако при цитокинезе может происходить и запрограммированное асимметричное распределение материала. Например, клетка может делиться с образованием неравных по величине дочерних клеток, или же какой-то компонент цитоплазмы может перед цитокинезом скапливаться на одной стороне клетки и передаваться только одной из двух в остальном одинаковых дочерних клеток.
Литература
Общая
Baserya R. The Biology of Cell Reproduction. Cambridge, MA, Harvard University Press, 1985.
Beach D., Basilica C., Newport J., eds. Cell Cycle Control in Eukaryotes. Cold Spring Harbor NY, Cold Spring Harbor Laboratory, 1988.
John P.C.I., ed. The Cell Cycle. Cambridge U.K., Cambridge University Press, 1981.
Mitchison J. M. The Biology of the Cell Cycle. Cambridge U. K., Cambridge University Press, 1971.
Pollack R. Readings in Mammalian Cell Culture, 2nd ed. Cold Spring Harbor, NY, Cold Spring Harbor Laboratory, 1981. (An anthology, including many important papers on cell growth and division.)
Prescott D.M. Reproduction of Eukaryotic Cells. New York, Academic Press, 1976.
Цитированная
1. Baser да R. The Biology of Cell Reproduction. Cambridge, MA, Harvard University Press, 1985.
Howard A., Pelc S. R. Nuclear incorporation of P32 as demonstrated by autoradiographs. Exp. Cell Res., 2, 178-187,1951.
Lloyd D., Poole R. K., Edwards S. W. The Cell Division Cycle. New York, Academic Press, 1982.
Mitchison J. M. The Biology of the Cell Cycle. Cambridge, U. K., CambridgeUniversity Press, 1971.
2. Van Dilla M.A., Trujillo Т. Т., Mullaney P.P., Coulter J.R. Cell microfluorometry: a method for rapid fluorescence measurement. Science, 163, 1213-1214, 1969.
3. Creanor J., Mitchison J. M. Patterns of protein synthesis during the cell cycle of the fission yeast Schizosaccharomyces pombe. J. Cell Sci., 58,
263-285, 1982.
Pardee А. В., CoppockD.L., Yang H.C. Regulation of cell proliferation at the onset of DNA synthesis. J. Cell Sci., Suppl. 4, 171-180, 1986.
4. Rao P. N., Johnson R. T. Mammalian cell fusion: studies on the regulation of DNA synthesis and mitosis. Nature, 225, 159 164, 1970.
5. Xeros N. Deoxyribonucleotide control and synchronization of mitosis. Nature, 194, 682-683, 1962.
6. Mitchison J. M. The Biology of the Cell Cycle, pp. 234-244. Cambridge, U. K., Cambridge University Press, 1971.
Schlegel R., Pardee A. B. Caffeine-induced uncoupling of mitosis from the completion of DNA replication in mammalian cells. Science, 232, 1264-1266, 1986.
7. Johnson R. Т., Rao P. N. Mammalian cell fusion: induction of premature chromosome condensation in interphase nuclei. Nature, 226, HT-122, 1970.
8. Blow J. J., Laskey R. A. A role for the nuclear envelope in controlling DNA replication within the cell cycle. Nature, 332, 546 548, 1988.
9. Kirschner M., Newport J., Gerhart J. The timing of early developmental events in Xenopus. Trends Genet., 1, 41-47, 1985.
10. Gerhart J., Wu M., Kirschner M. Cell cycle dynamics of an M-phase-specific cytoplasmic factor in Xenopus laevis oocytes and eggs. J. Cell Biol., 98, 1247-1255, 1984.
Lohka M. J., Hayes M. K., Mailer J. L. Purification of maturation-promoting factor, an intracellular regulator of early mitotic events. Proc. Natl. Acad. Sci. USA, 85, 3009-3013, 1988.
Newport J., Kirschner M. Regulation of the cell cycle during early Xenopus development. Cell, 37, 731-742, 1984.
11. Hara K., Tydeman P., Kirschner M. A cytoplasmic clock with the same period as the division cycle in Xenopus eggs. Proc. Natl. Acad. Sci. USA, 77, 462-466, 1980.
Kimelman D., Kirschner M., Scherson T. The events of the midblastula transition in Xenopus are regulated by changes in the cell cycle. Cell, 48, 399-407, 1987.
Pines J., Hunt T. Molecular cloning and characterization of the mRNA for cyclin from sea urchin eggs. EMBO J., 6, 2987-2995, 1987.
Swenson K. I.. Farrell K. M., Ruderman J. V. The clam embryo protein cyclin A induced entry into M phase and the resumption of meiosis in Xenopus oocytes. Cell, 47, 861 870, 1986.
12. Nurse P. Cell cycle control genes in yeast. Trends Genet., 1, 51-55, 1985.
Pringle J. R., Hartwell L. H. The Saccharomyces cerevisiae cell cycle. In: The Molecular Biology of the Yeast Saccharomyces, Life Cycle and Inheritance (J. N. Starthern, E. W. Jones, J. R. Broach, eds.), pp. 97-142. Cold Spring Harbor, NY, Cold Spring Harbor Laboratory, 1981. Watson J. D., Hopkins N. H., Roberts J. W., Weiner A. M. Molecular Biology of the Gene, 4th ed., pp. 550-592. Menlo Park, CA, Benjamin- Cummings, 1987.
13. Hartwell L.H. Cell division from a genetic perspective. J. Cell Biol., 77, 627-637, 1978.
Nurse P. Genetic analysis of the cell cycle. Symp. Soc. Gen. Microbiol., 31, 291-315, 1981.
14. Hayles J, NurseP. Cell cycle regulation in yeast. J. Cell Sci., Suppl. 4, 155-170, 1986.
Johnston G. C., Pringle J. R., Hartwell L. H. Coordination of growth with cell division in the yeast Saccharomyces cerevisiae. Exp. Cell Res., 105, 79-98, 1977.
Prescott D. M. Changes in nuclear volume and growth rate and prevention of cell division in Amoeba proteus resulting from cytoplasmic amputations. Exp. Cell Res., 11, 94-98, 1956.
15. Dunphy W.G., Brizuela L., Beach D., Newport J. The Xenopus cdc2 protein is a component of MPF, a cytoplasmic regulator of mitosis. Cell, 54, 423-431, 1988.
Gautier J., Nor bur у С., Lohka M., Nurse P., Mailer J. Purified maturation-promoting factor contains the product of a Xenopus homolog of the fission yeast cell cycle control gene cdc2+. Cell, 54, 433-439, 1988.
Lee M. G., Nurse P. Complementation used to clone a human homologue of the fission yeast cell cycle control gene cdc2. Nature, 327, 31-35, 1987.
Murray A. W. A mitotic inducer matures. Nature, 335, 207-208, 1988.
Solomon M. et al. Cyclin in fission yeast. Cell, 54, 738-740, 1988.
16. Cheng H, LeBlond C. P. Origin, differentiation and renewal of the four main epithelial cell types in the mouse small intestine. Am. J. Anat., 141, 461-480, 1974. Goss R.J. The Physiology of Growth. New York, Academic Press, 1978.
17. Pardee A. B. A restriction point for control of normal animal cell proliferation. Proc. Natl. Acad. Sci. USA, 71, 1286-1290, 1974.
18. Brooks R. F. The transition probability model: successes, limitations and deficiencies. In: Temporal Order (L. Rensing, N.I. Jaeger, eds.). Berlin, Springer, 1985. Shields R. Transition probability and the origin of variation in the cell cycle. Nature, 267, 704-707, 1977.
Smith J.A., Martin L. Do cells cycle? Proc. Natl. Acad. Sci. USA, 70, 1263-1267, 1973.
19. DeuelT.F. Polypeptide growth factors: roles in normal and abnormal growth. Annu. Rev. Cell Biol., 3, 443-492, 1987.
Evered D., Nugent J., Whelan J., eds. Growth Factors in Biology and Medicine. Ciba Foundation Symposium 116. London, Pitman, 1985.
Sato G., ed. Hormones and Cell Culture. Cold Spring Harbor, NY, Cold Spring Harbor Laboratory, 1979.
Wang J.L., Hsu Y.-M. Negative regulators of cell growth. Trends Biochem. Sci., 11, 24-27, 1986.
20. Ross R., Raines E. W., Bowen-Pope D. F. The biology of platelet-derived growth factor. Cell, 46, 155-169, 1986.
Stiles C.D. The molecular biology of platelet-derived growth factor. Cell, 33, 653-655, 1983.
21. Dunn G.A., Ireland G. W. New evidence that growth in 3T3 cell cultures is a diffusion-limited process. Nature, 312, 63-65, 1984.
Holley R. W., Kierman J. A. "Contact inhibition" of cell division in 3T3 cells. Proc. Natl. Acad. Sci. USA, 60, 300 304, 1968.
Stoker M. G. P. Role of diffusion boundary layer in contact inhibition of growth. Nature, 246, 200-203, 1973.
22. Folkman J., Moscona R. Role of cell shape in growth control. Nature, 273, 345-349, 1978.
O'Neill C., Jordan P., Ireland G. Evidence for two distinct mechanisms of anchorage simulation in freshly explanted and 3T3 mouse fibroblasts. Cell, 44, 489-496, 1986.
23. Brooks R.F. Regulation of the fibroblast cell cycle by serum. Nature, 260, 248-250, 1976.
Larsson O., Zetterberg A., Engstrom W. Consequences of parental exposure to serum-free medium for progeny cell division. J. Cell Sci., 75, 259-268, 1985.
Zetterberg A., Larsson O. Kinetic analysis of regulatory events in Gl leading to proliferation or quiescence of Swiss 3T3 cells. Proc. Natl. Acad. Sci. USA, 82, 5365-5369, 1985.
24. Baser да R. The Biology of Cell Reproduction, pp. 103-113. Cambridge, MA, Harvard University Press, 1985.
Larsson 0., Dafgard E., Engstrom W., Zetterberg A. Immediate effects of serum depletion on dissociation between growth in size and cell division in proliferating 3T3 cells. J. Cell. Physiol., 127, 267-273, 1986.
25. Bauer E. et al. Diminished response of Werner's syndrome fibroblasts to growth factors PDGF and FGF. Science, 234, 1240-1243, 1986. Hayflick L. The limited in vitro lifetime of human diploid cell strains. Exp. Cell Res., 37, 614 636, 1965.
Holiday R., ed. Genes, Proteins, and Cellular Aging. New York, Van Nostrand, 1986. (An anthology of papers on cell senescence.)
Loo D. Т., Fuquay J. L, Rawson C. L., Barnes D. W. Extended culture of mouse embryo cells without sensecence: inhibition by serum. Science, 236, 200-202, 1987.
Rheinwald J.G., Green H. Epidermal growth factor and the multiplication of cultured human epidermal keratinocytes. Nature, 265, 421 424, 1977.
Smith J. R., Whitney R. G. Intraclonal variation in proliferative potential of human diploid fibroblasts: stochastic mechanism for cellular aging.
Science, 207, 82-84, 1980.
26. Kahn P., Grqf Т., eds. Oncogenes and Growth Control. Berlin, Springer, 1986.
Watson J.D., Hopkins N.H., Roberts J. W., Weiner A.M. Molecular Biology of the Gene, 4th ed., pp. 961 1096. Menlo Park, CA, Benjamin- Cummings, 1987.
27. Feramisco J., Ozanne В., Stiles C., eds. Cancer Cells 3: Growth Factors and Transformation. Cold Spring Harbor, NY, Cold Spring Harbor Laboratory, 1985
Temin H. M., Rubin H. Characteristics of an assay for Rous Sarcoma virus and Rous sarcoma cells in tissue culture. Virology, 6, 669 688, 1958.
28. Bishop J. M. Viral oncogenes. Cell, 42, 23-38, 1985.
Martin G.S. Rous sarcoma virus: a function required for the maintenance of the transformed state. Nature, 227, 1021 1023, 1970.
Swanstrom R., Parker R. C, Varmus H. E., Bishop J. M. Transduction of a cellular oncogene the genesis of Rous sarcoma virus. Proc. Natl. Acad. Sci. USA, 2519 2523, 1983.
Varmus H. Cellular and viral oncogenes. In: The Molecular Basis of Blood Diseases (G. Stamatoyannopoulos, A. W. Nienhuis, P. Leder, P. W. Majerus. eds.), pp. 271-345. Philadelphia, Saunders, 1987.
29. Harris H. The genetic analysis of malignancy. J. Cell Sci., Suppl. 4, 431 444, 1986 Klein G. The approaching era of the tumor suppressor genes.
Science, 238 1539 1545, 1987.
Weinbercj R.A. A molecular basis of cancer. Sci. Am., 249(5), 126 142, 1983.
30. Doolittle R. F. el al. Simian sarcoma virus oncogene, -sis, is derived from the gene (or genes) encoding a platelet-derived growth factor. Science, 221, 275 277, 1983
Marshall C.J. Oncogenes. J. Cell Sci., Suppl. 4, 417 430, 1986.
Waterfield M. D. et al. Platelet-derived growth factor is structurally related to th putative transforming protein p28sls of simian sarcoma virus. Nature, 304, 35-39 1983.
31. Almendral J. M. et al. Complexity of the early genetic response to growth factors in mouse fibroblasts. Мої. Cell. Biol., 8, 2140 2148, 1988.
Hunter T. The proteins of oncogenes. Sci. Am., 251(2), 70-79, 1984.
Robertson M. Molecular associations and conceptual connections. Nature, 334, 100 102, 1988.
Yu С. L., Tsai M. H., Stacey D. W. Cellular ras activity and phospholipid metabolism. Cell, 52, 63-71, 1988.
32. Herman В., Pledger W.J. Platelet-derived growth factor-induced alterations in vinculin and actin distributions in BALB/c-ЗТЗ cells. J. Cell Biol., 100, 1031 1040, 1985.
Hirst R., Horwitz A.. Buck C., Rohrschneider L. Phosphorylation of the fibronectin receptor complex in cells transformed by oncogenes that encode tyrosine kinases. Proc. Natl. Acad. Sci. USA, 83, 6470 6474, 1986.
Jove R., Hanafusa H. Cell transformation by the viral src oncogene. Annu. Rev. Cell Biol., 3, 31 56, 1987.
33. Burger M. M. Proteolytic enzymes initiating cell division and escape from contact inhibition of growth. Nature, 227, 170-171, 1970.
Sulivan L. M., Quigley J. P. An anticatalytic monoclonal antobody to avian plas-minogen activator: its effect on behavior of RSV-transformed chick fibroblasts. Cell, 45, 905-915, 1986.
34. Adamson E.D. Oncogenes in development. Development, 99, 449 471, 1987.
Bryant P.J., Bryant S. V., French V. Biological regeneration and pattern formation. Sci. Am., 237(1), 67-81, 1977.
Fankhauser G. Nucleo-cytoplasmic relations in amphibian development. Int. Rev. Cytol., 1, 165-193, 1952.
35. Bajer A.S., Mole-Bajer J. Spindle Dynamics and Chromosome Movements. New York, Academic Press, 1972.
Mclntosh J.R. Mechanisms of mitosis. Trends Biochem. Sci., 9, 195-198, 1984.
Mazia C. Mitosis and the physiology of cell division. In: The Cell (J. Brachet, A. E. Mirsky, eds.), Vol. 3, pp. 77-412. London, Academic Pess, 1961.
Wilson E. B. The Cell in Development and Heredity, 3rd ed. with corrections. New York, Macmillan Company, 1928. (Reprinted, New York, Garland, 1987.)
36. Inoue S., Sato H. Cell motility by labile association of molecules: the nature of mitotic spindle fibers and their role in chromosome movement. J. Gen. Physiol., 50, 259-292, 1967.
Karsenti E., Maro B. Centrosomes and the spatial distribution of microtubules in animal cells. Trends Biochem. Sci., 11, 460 463, 1986.
Kirschner M., Mitchison T. Beyond self-assembly: from microtubules to morphogenesis. Cell, 45, 329-342, 1986.
Kuriyama R., Borisy G. G. Microtubule-nucleating activity of centrosomes in Chinese hamster ovary cells is independent of the centriole cycle but coupled to the mitotic cycle. J. Cell Biol., 91, 822 826, 1981.
Saxton W. M. et al. Tubulin dynamics in cultured mammalian cells. J. Cell Biol., 99, 2175-2186, 1984.
37. Clarke L., Carbon J. The structure and function of yeast centromeres. Annu. Rev. Genet., 19, 29-56, 1985.
Earnsham W. C. et al. Molecular cloning of cDNA for CENP-B, the major human centromere autoantigen. J. Cell Biol., 104, 817-829, 1987. Mitchison T.J., Evans L., Schulze E., Kirschner M. Sites of microtubule assembly and disassembly in the mitotic spindle. Cell, 45, 515-527, 1986.
Peterson J. В., Ris H. Electron microscopic study of the spindle and chromosome movement in the yeast Saccharomyces cerevisiae. J. Cell Sci., 22, 219-242, 1976.
Rieder C. L. The formation, structure and composition of the mammalian kinetochore fiber. Int. Rev. Cytol., 79, 1-58, 1982.
38. Euteneuer U., Mclntosh J. R. Structural polarity of kinetochore microtubules in PtKj cells. J. Cell Biol., 89, 338-345, 1981.
Mitchison T.J., Kirschner M. W. Properties of the kinetochore in vitro. II. Microtubule capture and ATP-dependent translocation. J. Cell Biol., 101, 766-777, 1985.
Rieder С. L., Davison E. A., Jensen C.W., Cassimeris L., Salmon E. D. Oscillatory monooriented movements of chromosomes and their position relative to the spindle pole result from the ejection properties of the aster and half-spindle. J. Cell Biol., 103, 581 591, 1986.
Roos U.-P. Light and electron microscopy of rat kangaroo cells in mitosis. III. Patterns of chromosome behavior during prometaphase.
Chromosoma, 54, 363-385, 1976.
39. Begg D.A., EllisG.W. Micromanipulation studies of chromosome movement. J. Cell Biol., 82, 528-541, 1979.
Nicklas R. B. The forces that move chromosomes in mitosis. Annu. Rev. Biophys. Biophys. Chem., 17, 431-450, 1988.
Nicklas R. В., Kubai D. F. Microtubules, chromosome movement, and reorientation after chromosomes are detached from the spindle by micromanipulation. Chromosoma, 92, 313-324, 1985.
40. Hays T.S., Wise D., Salmon E.D. Traction force on a kinetochore at metaphase acts as a linear function of kinetochore fiber length. J. Cell Biol., 93, 374-382, 1982.
McNeill P. A., Berns M. W. Chromosome behavior after laser microirradiation of a single kinetochore in mitotic PtK2 cells. J. Cell Biol., 88, 543-553, 1981.
Ostergren G. The mechanism of coordination in bivalents and multivalents. The theory of orientation by pulling. Hereditas, 37, 85-156, 1951.
41. Hepler P. K., Callaham D. A. Free calcium increases during anaphase in stamen hair cells of Tradescantia. J. Cell Biol., 105, 2137-2143, 1987. Murray A. W., Szostak J. W. Chromosome segregation in mitosis and meiosis. Annu. Rev. Cell Biol., 1, 289-315, 1985.
Wolniak S. M. The regulation of mitotic spindle function. Biochem. Cell Biol., 66, 490-514, 1988.
42. Ris H. The anaphase movement of chromosomes in the spermatocytes of grasshoppers. Biol. Bull. (Woods Hole), 96, 90-106, 1949.
43. Gorbsky G. J., Sammak P. J., Borisy G. G. Microtubule dynamics and chromosome motion visualized in living anaphase cells. J. Cell Biol., 106, 1185-1192, 1988.
Mitchison T.J. Microtubule dynamics and kinetochore function in mitosis. Annu. Rev. Cell Biol., 4, 527 549, 1988.
Nicklas R. B. Measurements of the force produced by the mitotic spindle in anaphase. J. Cell Biol., 97, 542-548, 1983.
Spurck T. P., Pickett-Heaps J. D. On the mechanism of anaphase A: Evidence that ATP is needed for microtubule disassembly and not generation of polewards force. J. Cell Biol., 105, 1691-1705, 1987.
44. Aist J. R., Berns M. W. Mechanics of chromosome separation during mitosis in Fusarium (Fungi imperfecti): new evidence from ultrastructural and laser micro-beam experiments. J. Cell Biol., 91, 446-458, 1981.
Masuda H., Cande W. Z. The role of tubulin polymerization during spindle elongation in vitro. Cell, 39, 193-202, 1987.
Pickett-Heaps J. D. Mitotic mechanisms: an alternative view. Trends Biochem. Sci., 11, 504-507, 1986.
45. Gerace L., Blobel G. The nuclear envelope lamina is reversibly depolymerized during mitosis. Cell, 19, 277 287, 1980.
Gerace L., Burke B. Functional organization of the nuclear envelope. Annu. Rev. Cell Biol., 4, 335-374, 1988.
Swanson J.A,, McNeil P.L. Nuclear reassembly excludes large macromolecules. Science, 238, 548-550, 1987.
46. Kirschner M. W., Newport J., Gerhart J, The timing of early developmental events in Xenopus. Trends Genet., 1, 41-47, 1985.
47. Rappaport R. Establishment of the mechanism of cytokinesis in animal cells. Int. Rev. Cytol., 105, 245-281, 1986.
Tolle H. G., Weber K., Osborn M. Keratin filament disruption in interphase and mitotic cells-how is it induced? Eur. J. Cell Biol., 43, 35-47, 1987.
White J. G., Borisy G. G. On the mechanism of cytokinesis in animal cells. J. Theor. Biol., 101, 289-316, 1983.
48. DeLozanne A., Spudich J. A. Disruption of the dictyostelium myosin heavy chain gene by homologous recombination. Science, 236, 1086-1091,
1987.
Knecht D.A., Loomis W.F. Antisense RNA inactivation of myosin heavy chain gene depression in Dictyostelium discoideum. Science, 236, 1081-1086, 1987.
Mabuchi I., Okuno M. The effect of myosin antibody on the division of starfish blastomeres. J. Cell Biol., 74, 251-263, 1977.
Schroeder Т. Е. Actin in dividing cells: contractile ring filaments bind heavy meromyosin. Proc. Natl. Acad. Sci. USA, 70, 1688 1692, 1973.
49. Gunning B. E, S., Wick S. M. Preprophase bands, phragmoplasts and spatial control of cytokinesis. J. Cell Sci. Suppl. 2, 157-179, 1985.
Huffaker T.C., Hoyt M.A., Botstein D. Genetic analysis of the yeast cytoskeleton. Annu. Rev. Genet., 21, 259-284, 1987.
Lloyd C. W. The plant cytoskeleton: the impact of fluorescence microscopy. Annu. Rev. Plant Physiol., 38, 119-139, 1987.
Pickett-Heaps J. D., Northcote D. H. Organization of microtubules and endoplasmic reticulum during mitosis and cytokinesis in wheat meristems. J. Cell Sci., 1, 109-120, 1966.
50. Lucocq J. M., Warren G. Fragmentation and partitioning of the Golgi apparatus during mitosis in HeLa cells. EMBO J., 6, 3239-3246, 1987.
51. Hill D.P., Strome S. An analysis of the role of microfilaments in the establishment and maintenance of asymmetry in Caenorhabditis elegans. Dev. Biol., 125, 75 84, 1988.
Kenyan C. Cell lineage and the control of Caenorhabditis elegans development. Phil. Trans. R. Soc. Lond. (Biol.), 312, 21-38, 1985.
52. Donachie W.D., Robinson A.C. Cell division: parameter values and the process in Escherichia coli and Salmonella typhimurium. Cellular and Molecular Biology (F.C. Neidhardt, et al., eds.), pp. 1578-1593. Washington, DC, American Society for Microbiology, 1987.
Heath I. B. Variant mitoses in lower eukaryotes: indicators of the evolution of mitosis? Int. Rev. Cytol., 64, 1-80, 1980.
Kubai D.F. The evolution of the mitotic spindle. Int. Rev. Cytol., 43, 167-227, 1975.
Wise D. The diversity of mitosis: the value of evolutionary experiments. Biochem. Cell Biol., 66, 515-529, 1988.