Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Клеточная адгезия, соединения между клетками и внеклеточный матрикс
Внеклеточный матрикс
Ткани состоят не только из клеток. Значительную часть их объема занимает внеклеточное пространство, заполненное сложной сетью макромолекул, составляющих внеклеточный матрикс (рис. 14-20). Этот матрикс включает разнообразные полисахариды и белки, которые секретируются самими клетками и организуются в упорядоченную сеть. Описывая межклеточные соединения, мы рассматривали главным образом эпигелиальные ткани, при описании же внеклеточного матрикса мы будем иметь дело в основном с соединительными тканями (рис. 14-21). В таких тканях матрикс обычно занимает больший объем, чем клетки, окружает их со всех сторон и определяет механические свойства ткани. У позвоночных соединительные ткани образуют структурный каркас тела, но их доля в разных органах весьма различна: в коже и костях, например, они являются основным компонентом, а в головном и спинном мозгу составляют лишь незначительную часть.

Рис. 14-20. Электронная микрофотография, показывающая при небольшом увеличении клетки, окруженные внеклеточным матриксом. В данном случае это еще не дифференцированные клетки конечности раннего куриного эмбриона. (С любезного разрешения Cheryll Tickle.)
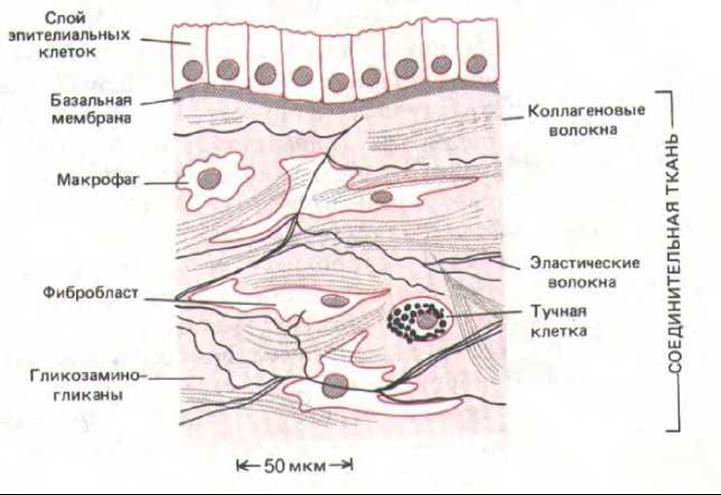
Рис. 14-21. Соединительная ткань, подстилающая слой эпителиальных клеток.
Различия в соотношениях разных типов макромолекул и в способе их организации во внеклеточном матриксе порождают необычайное разнообразие форм, каждая из которых очень хорошо приспособлена к функциональным потребностям данной ткани. Матрикс может обызвествляться, образуя твердые, как камень, структуры кости или зуба, может формировать прозрачное вещество роговицы глаза или принимать форму каната, что придает сухожилиям огромную прочность на разрыв. На границе между эпителием и соединительной тканью матрикс образует базальную мембрану - чрезвычайно тонкую, но плотную прокладку, играющую важную роль в регуляции поведения клеток. Мы ограничимся описанием внеклеточного матрикса позвоночных, но интересные и своеобразные структуры того же рода встречаются и у многих других организмов; таковы, например, клеточные стенки бактерий и растений, кутикула червей и насекомых, раковины моллюсков. Стенки растительных клеток будут детально рассмотрены в гл. 20.
До недавнего времени внеклеточный матрикс позвоночных считали сравнительно инертным каркасом, стабилизирующим физическую структуру тканей. Но сейчас стало ясно, что он играет значительно более активную и сложную роль в регуляции поведения контактирующих с ним клеток - влияет на их развитие, миграцию, пролиферацию, форму и метаболизм. Молекулярный состав внеклеточного матрикса достаточно сложен, но, хотя наше понимание его организации пока еще фрагментарно, идет быстрый прогресс в изучении его главных компонентов.
14.2.1. Внеклеточный матрикс состоит в основном из фибриллярных белков, погруженных в гидратированный полисахаридный гель
Макромолекулы внеклеточного матрикса в основном секретируются in situ находящимися в нем клетками. В большинстве соединительных тканей в этом участвуют главным образом фибробласты (рис. 14-22). В некоторых специализированных соединительных тканях, таких как хрящ и кость, эту функцию выполняют особые фибробластоподобные клетки, имеющие собственные названия: например, хрящ образуют хондробласты, а кость-остеобласты. Два главных класса макромолекул, образующих матрикс, - это 1) полисахариды гликозаминогликаны, обычно ковалентне связанные с белком в форме протеогликанов, и 2) фибриллярные белки двух функциональных типов: преимущественно структурные (например, коллаген и эластин) и в основном адгезивные (например, фибронектин и ламинин). Молекулы гликозаминогликана и протеогликана образуют сильно гидратированное гелеподобное «основное вещество», в которое погружены фибриллярные белки. Водная фаза полисахаридного геля обеспечивает диффузию питательных веществ, метаболитов и гормонов между кровью и клетками ткани; коллагеновые волокна укрепляют и упорядочивают матрикс, а резино-подобные эластиновые волокна придают ему упругость. Адгезивные белки способствуют прикреплению клеток к внеклеточному матриксу: фибронектин участвует в прикреплении фибробластов и подобных им клеток к матриксу в соединительных тканях, а ламинин - в прикреплении эпителиальных клеток к базальной мембране.
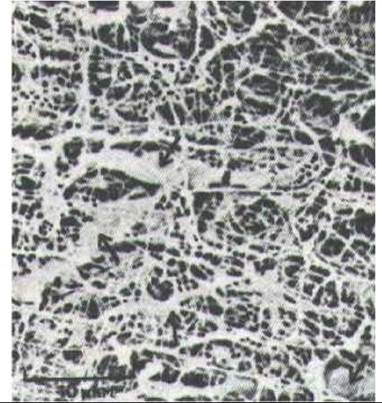
Рис. 14-22. Фибробласты (указаны стрелками) в соединительной ткани роговицы куриного эмбриона. Микрофотография, полученная с помощью сканирующего электронного микроскопа. Внеклеточный матрикс, окружающий фибробласты, состоит в основном из коллагеновых волокон (эластических волокон в роговице нет). Гликозаминогликаны, образующие гидратированный гель в пустотах волокнистой сети, при высушивании препарата осели на поверхности коллагеновых волокон. (С любезного разрешения Robert Trelsta.)
14.2.2. Цепи гликозаминогликанов занимают большие объемы пространства и образуют гидратированные гели [10]
Гликозамнногликаны - это длинные неразветвленные полисахаридные цепи, состоящие из повторяющихся дисахаридных звеньев. Их называют гликозаминогликанами потому, что один из двух остатков в повторяющемся дисахариде - это всегда аминосахар (N-ацетилглюкозамин или N-ацетилгалактозамин). В большинстве случаев один из этих аминосахаров сульфатирован, а второй представляет собой уроновую кислоту. Наличие у многих сахарных остатков сульфатных или карбоксильных групп придает гликозаминогликанам большой отрицательный заряд (рис. 1423). По типу сахарных остатков, типу связей между ними, а также по числу и положению сульфатных групп различают четыре главные группы гликозаминогликанов; это 1) гиалуроновая кислота, 2) хондроитинсульфат и дерматансульфат, 3) гепарансульфат и гепарин и 4) кератансулъфат (табл. 14-2).
Полисахаридные цепи недостаточно гибки, чтобы, подобно многим полипептидным цепям, складываться в компактные глобулярные структуры. Кроме того, они в высокой степени гидрофильны. Поэтому гликозаминогликаны стремятся принять конформацию очень рыхлого, неупорядоченного клубка, который занимает огромный для своей массы объем (рис. 14-24), и образуют гели даже в очень низких концентрациях. Благодаря высокой плотности отрицательных зарядов их молекулы притягивают множество таких осмотически активных ионов, как Na+, что ведет к присасыванию в матрикс большого количества воды. Это создает давление набухания (тургор), позволяющее матриксу противостоять сжимающим силам (в противоположность коллагеновым волок нам, противодействующим растяжению). Именно таким образом сопротивляется сжатию, например, матрикс хряща.
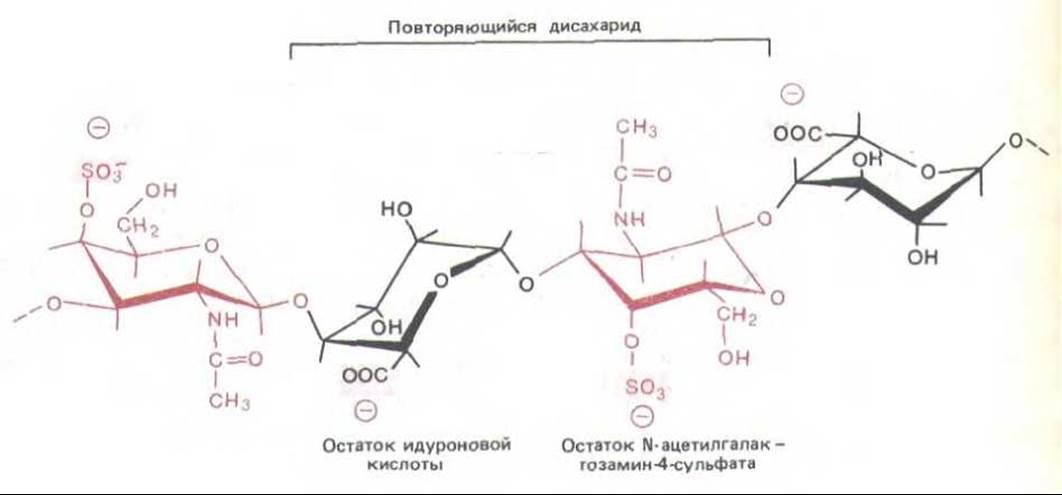
Рис. 14-23. Гликозаминогликаны представляют собой длинные линейные полимеры, состоящие из повторяющейся дисахаридной последовательности. Здесь представлена небольшая часть цепи дерматансульфата; обычно эти цепи содержат от 70 до 200 сахарных остатков. Очень высокая плотность отрицательных зарядов вдоль цепи обусловлена присутствием карбоксильных и сульфатных групп.
Таблица 14-2. Гликозаминогликаны
|
Группа |
Гликозамино гликан |
Мол. масса |
Повторяющийся дисахарид (А-В)n |
Число сульфогрупп на дисахарид |
Связь с белком |
Другие сахара |
Распределение в организме |
|
|
Остаток А |
Остаток В |
|||||||
|
1 |
Гиалуроновая кислота |
4000-8∙106 |
D-глюкуроновая кислота |
N-ацетил-D-глюкозамин |
0 |
0 |
Различные соединительные ткани, кожа, стекловидное тело, хрящ, синовиальная жидкость |
|
|
2 |
Хондроитин-сульфат |
5000-50000 |
» |
N-ацетил-В- галактозамин |
0,2-2,3 |
+ |
D-галактоза, D-ксилоза |
Хрящ, роговица, кости, кожа, артерии |
|
Дерматансульфат |
15000-40000 |
D-глкжуроновая кислота или L- идуроновая кислота11 |
» |
1,0-2,0 |
+ |
» |
Кожа, кровеносные сосуды, сердце, сердечные клапаны |
|
|
3 |
Гепаран-сульфат |
5000-12000 |
» |
N-ацетил-D- глюкозамин |
0,2-2,0 |
+ |
» |
Легкие, артерии, поверхность клеток, базальные мембраны |
|
Гепарин |
6000-25000 |
» |
» |
2,0-3,0 |
+ |
» |
Легкие, печень, кожа, тучные клетки |
|
|
4 |
Кератан-сульфат |
4000-19000 |
D-галактоза |
» |
0,9-1,8 |
+ |
D-галактозамин, D-манноза, L-фруктоза, сиаловая кислота |
Хрящ, роговица, межпозвоночные диски |
1) L-идуроновая кислота - продукт эпимеризации D-глюкуроновой кислоты по месту присоединения карбоксильной группы. Таким образом, дерматансульфат - это модифицированная форма хондроитинсульфата, и два типа повторяющихся дисахаридов обычно чередуются в одной и той же гликозаминогликановой цепи
Количество гликозаминогликанов в соединительной ткани обычно составляет менее 10% от содержания фибриллярных белков. Поскольку, однако, они образуют рыхлый гидратированный гель, цепи гликозаминогликана заполняют большую часть межклеточного пространства, обеспечивая ткани механическую опору и в то же время не препятствуя быстрой диффузии водорастворимых молекул и миграции клеток.
14.2.3. Гиалуроновая кислота, по-видимому, облегчает миграцию клеток во время морфогенеза и регенерации тканей [11]
Гиалуроновая кислота (называемая также гиалуронатом или гиалуронаном), которая может содержать до нескольких тысяч сахарных остатков, - относительно простая молекула, она состоит из повторяющейся последовательности несульфагированных дисахаридных единиц (рис. 14-25). Это вещество встречается в различных количествах во всех тканях и жидкостях тела взрослых животных, особенно много его у ранних зародышей. Гиалуроновую кислоту ввиду простоты ее структуры предположительно считают эволюционно самой ранней формой гликоза-миногликана, однако она не является типичной среди большинства гликозаминогликанов. Все другие гликозаминогликаны 1) содержат сульфатированные сахара, 2) чаще всего содержат несколько различных дисахаридных единиц, образующих более сложные последовательности, 3) имеют гораздо более короткие цепи, содержащие менее 300 сахарных остатков, и 4) ковалентно связаны с белками.
Появляется все больше данных о том, что гиалуроновая кислота выполняет особую функцию там, где происходит миграция клеток, например в процессах эмбрионального развития и при заживлении ран, В периоды клеточной миграции она образуется в больших количествах, а после прекращения миграции избыток ее разрушается ферментом гиалуронидазой. Такая последовательность событий была обнаружена в разнообразных тканях. Это позволяет предполагать, что локальное увеличение синтеза гиалуроновои кислоты, притягивающей воду и тем самым вызывающей набухание матрикса, служит общей стратегией облегчения миграции клеток при морфогенезе и регенерации. Гиалуроновая кислота является также важным компонентом синовиальной (суставной) жидкости, где она играет роль смазки.
14.2.4. Протеогликаны состоят из длинных цепей гликозаминогликана, ковалентно связанных с сердцевинным белком [12]
За исключением гиалуроновои кислоты, все гликозаминогликаны ковалентно связаны с белком в форме протеогликанов. Как и в случае гликопротеинов (разд. 8.6.6), полипептидная цепь (сердцевинный белок] протеогликана синтезируется на рибосомах, связанных с мембранами, и «протаскивается» через мембрану в просвет эндоплазматического ретикулума. Полисахаридные цепи добавляются к сердцевинному белку главным образом в аппарате Гольджи: первым к сериновому остатку этого белка присоединяется специальный литерный трисахарид, служащий «затравкой» для роста полисахарида; затем с помощью специфических гликозилтрансфераз один за другим добавляются сахарные остатки (рис. 1426). По мере удлинения цепи в аппарате Гольджи многие из полимеризованных сахарных остатков ковалентно модифицируются в результате ряда последовательных и координированных реакций сульфатирования (разд. 8.7.4) и эпимеризации, которые изменяют конфигурацию функциональных групп вокруг одного из углеродных атомов в молекуле сахара. Сульфатирование сильно увеличивает отрицательный заряд протеогликанов.
Обычно Протеогликаны сильно отличаются от гликопротеинов природой, числом и расположением сахарных боковых цепей. Гликопротеины обычно содержат от 1 до 60% углеводного компонента в виде многочисленных относительно коротких (как правило, менее 15 сахарных остатков) разветвленных олигосахаридных цепей, связанных с атомами кислорода и азота; эти цепи имеют переменный состав и часто оканчиваются сиаловой кислотой (разд. 8.7.1). Хотя сердцевинный белок протеогликана сам может быть гликопротеином, протеогликаны могут содержать по массе до 95% углевода, большая часть которого представлена различным числом (от одной до нескольких сотен) неразветвленных цепей гликозаминогликана, в типичных случаях каждая примерно из 80 сахарных остатков, обычно без сиаловой кислоты. Кроме того, если гликопротеины редко имеют мол. массу больше 3-105, то протеогликаны могут быть значительно крупнее. Например, один из наиболее полно охарактеризованных протеогликанов - главный компонент хряща, - как правило, содержит около 100 цепей хондроитинсульфата и примерно 50 цепей кератансульфата, связанных с сердцевинным белком, который богат серином и состоит из более чем 2000 аминокислот. Его общая молекулярная масса составляет около 3 ∙ 106, что соответствует примерно одной цепи гликозаминогликана на каждые 20 аминокислотных остатков (рис. 14-27). С другой стороны, многие протеогликаны значительно меньше и имеют только от 1 до 10 гликозаминогликановых цепей.
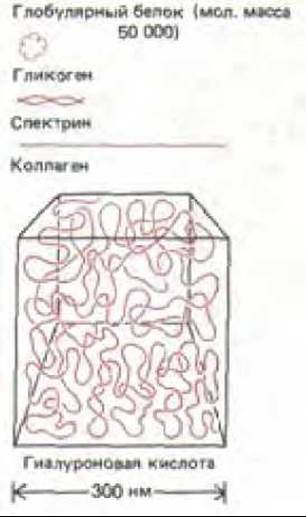
Рис. 14-24. Относительные объемы молекул различных белков, гликогеновой гранулы и одной гидратированной молекулы гиалуроновой кислоты с мол. массой около 8∙106.
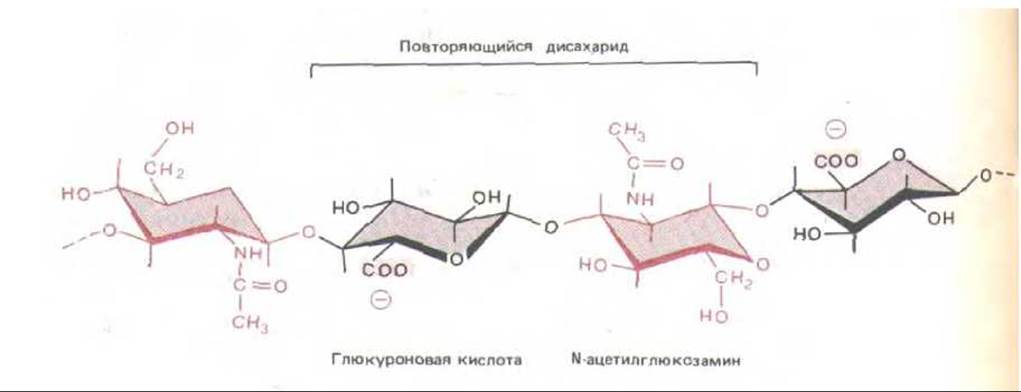
Рис. 14-25. Повторяющаяся дисахаридная последовательность гиалуроновои кислоты - относительно простого гликозаминогликана, состоящего из одной очень длинной цепи, в которой может быть до нескольких тысяч сахарных остатков. Обратите внимание на отсутствие сульфатных групп.
В принципе строение протеогликанов допускает почти неограниченное разнообразие. Они могут существенно различаться по содержанию белка, по величине молекул и по числу и типу гликозаминогликановых цепей в молекуле. Кроме того, хотя для них всегда характерны повторяющиеся последовательности дисахаридов, длина и состав цепей гликозаминогликанов могут сильно варьировать, так же как и пространственное расположение гидроксильных, сульфатных и карбоксильных групп вдоль цепи. Поэтому задача идентификации и классификации протеогликанов по содержащимся в них сахарам чрезвычайно сложна. К настоящему времени многие сердцевинные белки секвенированы с помощью метода рекомбинантной ДНК, и в будущем классификация протеогликанов, вероятно, станет более осмысленной, когда будет основана на структуре их сердцевинных белков, а не гликозаминогликанов.

Рис. 14-26. Схема соединения гликозаминогликановой цепи с серином сердцевинного белка в молекуле протеогликана. К серину [который часто находится внутри последовательности Asp (или Glu)-Asp-(или Glu)-X-Ser-Gly-X-Gly, где X -любая аминокислота] присоединен специфический «линкерный трисахарид». Остальная часть цепи гликозаминогликана, построенная в основном из повторяющихся дисахаридных единиц (состоящих в свою очередь из двух моносахаридов А и В, приведенных в табл. 14-2), синтезируется позднее путем последовательного присоединения сахарных остатков.

Рис. 14-27. Молекула главного протеогликана хряща. Она состоит из множества гликозаминогликановых цепей, ковалентно связанных с сердцевинным белком. В дополнение к гликозаминогликановым цепям сердцевинный белок содержит еще олигосахаридные цепи, присоединенные к атомам азота или кислорода (на рисунке не показаны). Большинство протеогликанов меньше того, который здесь изображен, и гликозаминогликановые цепи у них часто имеются лишь в определенных областях полипептидной цепи сердцевинного белка. Внизу для сравнения в том же масштабе изображена молекула типичного гликопротеина (панкреатической рибонуклеазы В).
14.2.5. Цепи гликозаминогликанов могут располагаться во внеклеточном матриксе высокоуноридоченным образом [13]
Ввиду структурной гетерогенности молекул протеогликанов кажется маловероятным, чтобы их роль сводилась лишь к созданию гидратированного пространства вокруг клеток и между ними. Было показано, что in vitro протеогликаны связывают различные секретируемые сигнальные молекулы, и можно предполагать, что они выполняют эту функцию и в тканях, локализуя таким образом действие сигнальных лигандов; например, фактор роста фибробластов (разд. 13.3.1, табл. 13-1) связывается с протеогликаном гепарансульфатом как in vitro, так и в тканях. Протеогликаны могут образовывать гели с разной величиной пор и разной плотностью зарядов и служить фильтрами, регулирующими движение молекул и клеток в соответствии с их размерами и/или зарядом. Судя по некоторым данным, протеогликаны выполняют подобную функцию в базальной мембране почечных клубочков, фильтрующей молекулы из кровотока в мочу (разд. 14.2.16).
Способ организации гликозаминогликанов и протеогликанов во внеклеточном матриксе еще плохо изучен. Биохимические исследования показывают, что в матриксе эти молекулы специфическим образом связаны друг с другом и с фибриллярными белками. Было бы странным, если бы такие взаимодействия не играли никакой роли в организации матрикса. Было установлено, что главный протеогликан хряща, содержащий кератансульфат и хондроитинсульфат (см. выше), организован во внеклеточном матриксе в крупные агрегаты, нековалентно связанные через свои сердцевинные белки с макромолекулой гиалуроновой кислоты. Примерно 100 мономеров протеогликана связаны с одной цепью гиалуроновой кислоты, образуя гигантский комплекс с мол. массой в 100 млн. или больше, занимающий объем, равный объему бактерии. Выделенный из ткани, этот комплекс хорошо виден в электронном микроскопе (рис. 14-28).
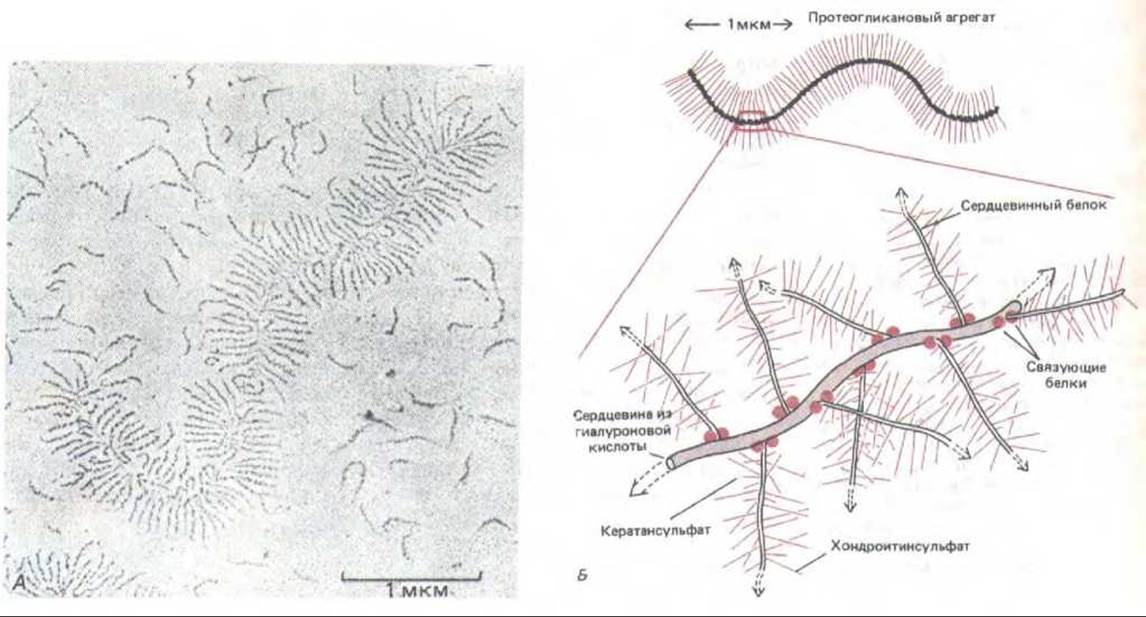
Рис. 14-28. А. Электронная микрофотография агрегата протеогликанов из эмбрионального хряща коровы (напыление платиной). Видно также много свободных молекул протеогликана. Б. Схема строения гигантского протеогликанового агрегата, показанного на фото А. Он состоит примерно из сотни протеогликановых мономеров (вроде изображенного на рис. 14-27), нековалентно присоединенных к одной молекуле гиалуроновой кислоты с помощью двух связующих белков, которые одновременно соединены как с сердцевинным белком протеогликана, так и с цепью гиалуроновой кислоты, и стабилизируют таким образом агрегат. Молекулярная масса такого комплекса может достигать 108 и более, а занимаемый им объем равен объему бактериальной клетки (около 2-10-12 см3). (А-с любезного разрешения Lawrence Rosen-berg.)
Однако попытки определить с помощью электронной микроскопии пространственное расположение молекул протеогликана, когда они находятся в ткани, оказались безуспешными. Так как эти молекулы хорошо растворимы в воде, при фиксации они легко вымываются из внеклеточного матрикса во время обработки срезов в водных растворах. Недавно протеогликаны удалось увидеть в почти нативном состоянии в хряще, быстро замороженном при очень низкой температуре (— 196°С) и высоком давлении с последующей фиксацией и окраской в замороженном состоянии (рис. 14-29). Вместо этого можно использовать катионный краситель с относительно низкой плотностью заряда в сочетании с более традиционной фиксацией. При таком окрашивании протеогликаны сухожилия из хвоста крысы выглядят как нитевидные структуры, обвивающие коллагеновые фибриллы с регулярными интервалами около 65 нм (рис. 14-30). Такой интервал соответствует продольному смещению параллельных молекул коллагена относительно друг друга в этих фибриллах (разд. 14.2.8). Такого рода упорядоченное расположение молекул, вероятно, весьма обычно во внеклеточном матриксе, и при том разнообразии, которое свойственно молекулам коллагена и прогеогликанов, могут получаться сложные и многообразные структуры.
Известно, что из некоторых полисахаридных цепей создаются высокоупорядоченные спиральные или лентовидные образования. Например, у высших растений микрофибриллярный компонент клеточных стенок построен из цепей целлюлозы (полиглюкозы), плотно упакованных в лентовидную кристалл о подобную структуру (см. рис. 20-5). In vitro две различные полисахаридные цепи могут специфически взаимодействовать друг с другом, образуя участки с регулярной спиральной структурой (рис. 14-31); такое межполисахаридное взаимодействие могло бы происходить и во внеклеточном матриксе. Если конформаций молекул протеогликанов могут быть столь же разнообразными, как их химическое строение, то мы едва только начинаем понимать их организацию.

Рис. 14-29. Электронная микрофотография протсогликанов внеклеточною матрикса из хряща крысы. Ткань была быстро заморожена при — 196 С, зафиксирована и окрашена в замороженном состоянии (процесс, называемый замещением в замороженном состоянии), чтобы предотвратить сжатие протеогликановых цепей. Видно, что молекулы протеогликанов образуют тонкую волокнистую сеть, в которую погружено одно поперечноисчерченное коллагеновое волокно. Более темные участки протео-гликановых молекул сердцевинные белки; более светлые нити-цепи гликозаминогликана. (Е. В. Hunziker, R.K. Schcnk, J. cell Biol. 98: 277-282, 1985 by copyright permission of the Rockefeller Univ. Press.)

Рис. 14-30. Электронная микрофотография продольного среза сухожилия из хвоста крысы. Препарат контрастирован медьсодержащим красителем для выявления молекул протеогликанов. Сухожилие состоит из плотно упакованных коллатеновых фибрилл; несколько таких фибрилл видны на фотографии. Молекулы протеогликана имеют вид тонких нитей, окружающих каждую коллагеновую фибриллу через равные интервалы примерно в 65 нм (например, указанные стрелками b); это указывает на специфическое взаимодействие молекул коллагена и протеогликанов. В тех местах, где не видно протеогликановых нитей, пересекающих коллагеновые фибриллы (как в участке, отмеченном двойной стрелкой а), плоскость среза, видимо, прошла прямо через фибриллу. (J. E. Scott, Biochem. J. 187: 887-891, 1980. Copyright 1980. Amer. Chem. Soc.)
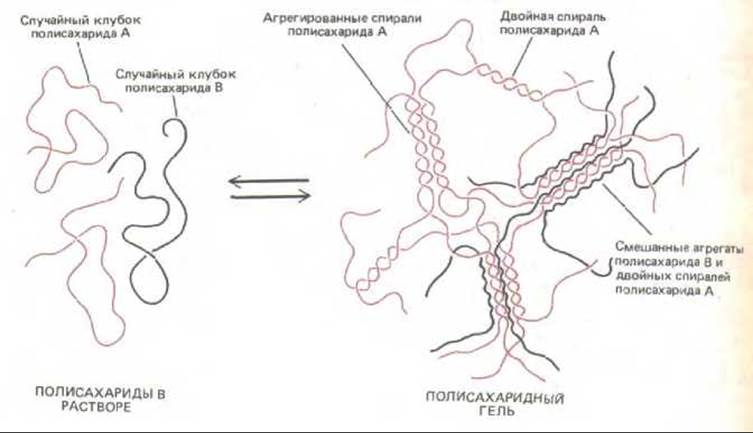
Рис. 14-31. Некоторые из упорядоченных конформаций, которые могут принимать две разные полисахаридные цепи, А и Б, при образовании геля in vitro. Поскольку взаимодействие между молекулами ограничено определенными участками их цепей (так называемыми соединительными участками) и не распространяется на всю молекулу, каждая цепь может объединиться более чем с одним партнером и таким путем образовать решетку геля. К гелеобразующим полисахаридам относятся, в частности, агары (из водорослей) и пектины (из высших растений).
Не все протеогликаны являются секретируемыми компонентами внеклеточного матрикса. Некоторые из них входят в состав плазматической мембраны, и иногда такие протеогликаны содержат сердцевинный белок, ориентированный поперек липидного бислоя. Протеогликаны клеточных мембран обычно состоят лишь из небольшого числа гликозаминогликановых цепей и, по-видимому, играют какую-то роль в прикреплении клеток к внеклеточному матриксу и в организации макромолекул матрикса, секретируемых клетками.
14-12
14.2.6. Главный белок внеклеточного матрикса - коллаген
Коллагены - это семейство весьма своеобразных фибриллярных белков, имеющихся у всех многоклеточных животных. Они секретируются главным образом клетками соединительной ткани и у млекопитающих занимают среди белков первое место по количеству, составляя около 25% всего белка. Характерная особенность молекул коллагена - их жесткая трехцепочечная спиральная структура. Три полипептидные цепи, называемые a-цепями (каждая примерно из 1000 аминокислот), скручены в одну регулярную суперспираль наподобие каната и образуют молекулу коллагена длиной около 300 нм и толщиной 1,5 нм. Коллагены содержат очень много пролина и глицина, которые оба играют важную роль в формировании трехцепочечной спирали. Пролин благодаря своей кольцевой структуре стабилизирует левозакрученную спиральную конформацию каждой a-цепи с тремя аминокислотными остатками на один виток. Глицин, наименьшая из аминокислот (вместо боковой цепи у нее только один атом водорода), повторяется на каждом третьем месте на протяжении всего центрального участка a-цепи; это дает возможность трем спиральным a-цепям плотно прилегать друг к другу с образованием законченной коллагеновой суперспирали (рис. 14-32).
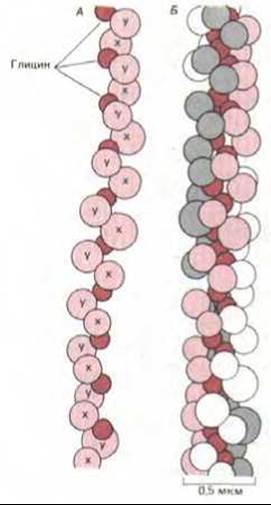
Рис. 14-32. А. Модель одной a-цепи коллагена, в которой каждая аминокислота представлена шариком. Цепь образует левозакрученную спираль с тремя аминокислотными остатками на один виток и с глицином (выделен темным цветом) в каждой третьей позиции. Таким образом, a- цепь состоит из длинной серии триплетов Gly-X-Y, где X и Y могут быть любой аминокислотой (хотя обычно одна из них - пролин). Б. Модель участка молекулы коллагена, в которой три a-цепи скручены в спиральный жгут. Одна a-спираль выделена светло-красным цветом, другая - серым, а третья - белым. Глицин - единственная аминокислота, которая достаточно мала, чтобы помещаться в тесном осевом пространстве тройной спирали. Показана только небольшая часть молекулы; вся молекула достигает в длину около 300 нм, а каждая цепь состоит примерно из 1000 аминокислотных остатков. (Зарисовки с модели В. L. Trus.)
Таблица 14-3. Четыре главных типа коллагена и их свойства
|
Тип |
Формула1) |
Полимерная форма |
Отличительные черты |
Местонахождение в организме |
|
І |
[al(I)]2a2(I) |
Фибрилла |
Мало гидроксилизина, мало углевода, толстые фибриллы |
Кожа, сухожилия, кость, связки, роговица, внутренние органы (составляет 90% всего коллагена в организме) |
|
ІІ |
[a 1(II)]3 |
Фибрилла |
Много гидроксилизина, много углевода, фибриллы тоньше, чем у типа I |
Хрящ, межпозвоночные диски, хорда, стекловидное тело глаза |
|
ІІІ |
[a 1(ІІІ)]3 |
Фибрилла |
Много гидроксипролина, мало гидроксилизина, мало углевода |
Кожа, кровеносные сосуды, внутренние органы |
|
IV |
[a l(IV)]2a 2(IV) |
Базальная мембрана |
Очень много гидроксилизина, много углевода; сохраняет концевые пептиды проколлагена |
Назальные мембраны |
1) Обратите внимание, что в коллагенах I и IV два типа a-цепей, а в коллагенах II и III-только один тип a-цепей. В таблице представлены только четыре главных типа коллагена, но сейчас известно более 10 типов коллагена и около 20 типов a-цепей.
До сих пор идентифицировано около 20 различных цепей коллагена, каждая из которых кодируется отдельным геном. В разных тканях экспрессируются различные комбинации этих генов. Хотя в принципе из таких двадцати a-цепей можно составить более 1000 видов трехцепочечных молекул коллагена, фактически было обнаружено только около 10 видов. Наиболее изучены типы I, II, III и IV (табл. 14-3). Типы I, II и III - фибриллярные коллагены. Это главные типы коллагенов, встречающихся в соединительных тканях, из них особенно широко распространен тип I. После того как молекулы этих трех типов коллагена переходят из клеток в межклеточное пространство, они организуются в упорядоченные полимеры, называемые коллагеновыми фибриллами. Это тонкие (толщиной 10-300 нм) канатовидные структуры длиной во много микрометров, ясно видимые на электронных микрофотографиях (рис. 14-33). Эти фибриллы часто группируются в более крупные пучки толщиной в несколько микрометров, которые видны уже в обычный микроскоп как коллагеновые волокна. Молекулы коллагена типа IV встречаются только в базальной мембране, вместо образования фибрилл они организуются в плоскую сеть, которая составляет значительную часть всей базальной мембраны (разд. 14.2.11). Как располагаются в тканях молекулы коллагена остальных типов, неясно.

Рис. 14-33. Электронная микрофотография части фибробласта, окруженного коллагеновыми фибриллами, в соединительной ткани. Сильно развитый гранулярный эндоплазматический ретикулум фибробласта отражает способность клетки к активному синтезу и секреции коллагена и других макромолекул внеклеточного матрикса. (С любезного разрешения Russell Ross.)
Многие белки с повторяющимися последовательностями аминокислот возникли в результате дупликаций участков ДНК (разд. 10.5.4). Именно так, видимо, появились и фибриллярные коллагены. Действительно, гены, кодирующие a-цепи таких коллагенов, очень велики (30-40 тысяч п. н.) и содержат около 50 экзонов. Большинство экзонов состоит из 54 или кратного 54 числа нуклеотидов, поэтому можно предположить, что эти коллагены возникли в результате множественных дупликаций первоначального гена, содержавшего 54 нуклеотида; сказанное не относится к коллагену типа IV, который, очевидно, возник другим путем.
14-13
14.2.7. Секретируемые коллагены имеют на обоих концах неспиральные участки [14, 15]
Отдельные полипептидные цепи коллагена синтезируются на рибосомах, связанных с мембраной, и переходят в просвет эндоплазматического ретикулума в виде более длинных предшественников, называемых про-а-цепями. У этих предшественников имеется не только короткий «сигнальный пептид» на аминном конце, необходимый для того, чтобы «протащить» секретируемый белок через мембрану ретикулума (разд. 8.6.5), но и группы других дополнительных аминокислот, называемые пропептидами, на аминном и карбоксильном концах. В просвете эндоплазматического ретикулума остатки пролина и лизина гидроксилируются с образованием гидроксипролина и гидроксилизина соответственно. Затем каждая про-а-цепь с помощью водородных связей объединяется с двумя другими в трехцепочечную спиральную молекулу, известную как проколлаген (рис. 14-34). Секретируемые формы фибриллярных коллагенов (но не коллаген типа IV) во внеклеточном пространстве преобразуются в молекулы коллагена путем отщепления пропептидов (см. ниже).
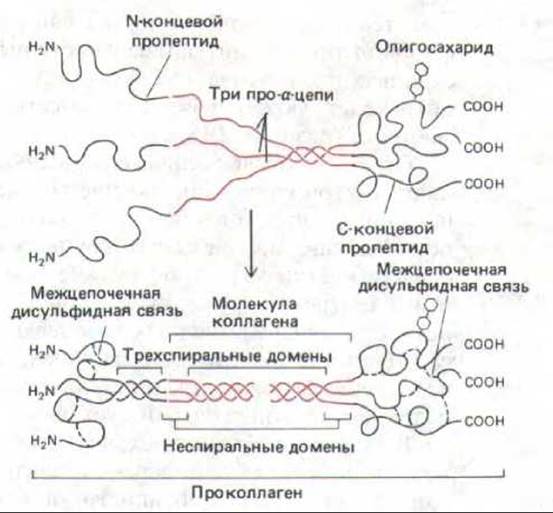
Рис. 14-34. В молекулах фибриллярного коллагена a-цепи вначале синтезируются в форме про-а-цепей, содержащих дополнительные пептиды на обоих концах (выделены черным цветом), которые позднее отщепляются. По-видимому, С-концевой пропептид способствует формированию тройной спирали при сборке молекулы проколлагена. Обратите внимание, что С-концевые пропептиды в молекуле проколлагена ковалентне соединены между собой дисульфидными связями и часто содержат олигосахаридную цепь. Аминоконцевые пропептиды образуют короткий трехцепочечный «миниколлагеновый» участок. Окончательная молекула коллагена содержит только часть молекулы проколлагена, выделенную красным цветом; остальные участки расщепляются.
В других белках остатки гидроксипролина и гидроксилизина (рис. 14-35) встречаются редко. Почему они присутствуют в коллагене? Есть косвенные указания на то, что гидроксильные группы остатков гидроксипролина образуют водородные мостики между цепями, стабилизирующие трехцепочечную спираль. В частности, условия, препятствующие гидроксилированию пролина (например, недостаток аскорбиновой кислоты - витамина С), ингибируют формирование спирали проколлагена. В нормальных условиях коллагены непрерывно (хотя и медленно) расщепляются специфическими внеклеточными ферментами - коллагеназами. При цинге - заболевании, развивающемся у человека при нехватке витамина С в пище,-негидроксилированные про-а-цепи не способны образовать тройную спираль и тотчас же разрушаются; поэтому в результате постепенной потери существовавшего ранее нормального коллагена в матриксе кровеносные сосуды становятся чрезвычайно хрупкими, а зубы начинают шататься. Это означает, что распад и замещение коллагена происходят здесь относительно быстро. Однако во многих других тканях взрослого организма обновление коллагена (и других макромолекул внеклеточного матрикса) в норме происходит очень медленно; крайним примером может служить кость, где молекулы коллагена существуют около 10 лет до распада и замещения. Для сравнения отметим, что у большинства клеточных белков время полужизни измеряется часами или днями.
Гидроксилирование остатков лизина играет иную роль: оно необходимо для осуществления необычной разновидности гликозилирования (функция которого неизвестна) и имеет решающее значение для поперечной сшивки молекул коллагена при его организации во внеклеточном пространстве (разд. 14.2.9).
14.2.8. Молекулы проколлагена типов I, II и III после их секреции расщепляются с образованием молекул коллагена, которые объединяются в фибриллы [16]
После секреции пропептиды молекул проколлагена типов I, II и III разрушаются специфическими ферментами уже вне клетки, и проколлаген превращается в коллаген (называемый также тропоколлагеном). Образовавшиеся молекулы коллагена толщиной 1,5 нм объединяются во внеклеточном пространстве в значительно более крупные коллагеновые фибриллы (толщиной 10-300 нм). Фибриллы образуются частично за счет тенденции молекул коллагена к самосборке. Однако образование фибрилл происходит вблизи клеточной поверхности, часто в глубоких складках плазматической мембраны, и лежащий под нею кортикальный цитоскелет может влиять на место, скорость и ориентацию сборки фибрилл (разд. 14.2.18).

Рис. 14-35. Структура остатков гидроксипролина и гидроксилизина -двух измененных аминокислот, обычно содержащихся в коллагене.
Пропептиды выполняют по меньшей мере две функции: 1) направляют внутри клетки построение трехцепочечных молекул коллагена; и 2) поскольку они отщепляются только после секреции, они препятствуют образованию внутри клетки крупных коллагеновых фибрилл, что имело бы для клетки катастрофические последствия. Однако столь же важно и избавиться от уже выполнивших свою задачу пропептидов. При некоторых наследственных заболеваниях, например при синдроме Элерса-Дэнлоса, этот процесс нарушен, а потому нарушено и образование коллагеновых фибрилл; в результате больные обладают хрупкой кожей и чрезмерно подвижными суставами.
В электронном микроскопе фиксированные и окрашенные фибриллы коллагена выглядят поперечно исчерченными с периодом 67 нм. Такая картина отражает особенности упаковки отдельных молекул в фибриллу: как показано на рис. 14-36, они располагаются так, что соседние молекулы сдвинуты друг относительно друга почти на четверть своей длины (на 67 нм). Такое расположение, по-видимому, максимально повышает прочность агрегата на растяжение и создает исчерченность, видимую на негативно контрастированных фибриллах (рис. 14-37). Однако все еще не ясно, как при таких сдвигах молекулы упакованы в трехмерной цилиндрической фибрилле.
После того как коллагеновые фибриллы сформировались во внеклеточном пространстве, их прочность сильно возрастает благодаря созданию ковалентных сшивок между остатками лизина внутри коллагеновых молекул и между ними (рис. 14-38). Ковалентные связи такого типа встречаются только в коллагене и эластине. Если блокировать их образование, содержащие коллаген ткани становятся хрупкими и такие структуры, как кожа, сухожилия и кровеносные сосуды, будут легко разрываться. Количество и тип сшивок изменяются от ткани к ткани. Например, в ахилловом сухожилии, для которого прочность на разрыв очень важна, такие сшивки в коллагене особенно многочисленны.

Рис. 14-36. Схема ступенчатого расположения молекул коллагена (они изображены в виде стрелок) в коллагеновой фибрилле. Молекулы в соседних рядах сдвинуты друг относительно друга на 67 нм, а промежутки между молекулами в продольном ряду составляют 35 нм. При такой величине этого промежутка продольное расположение молекул повторяется через каждые пять рядов, так что, например, молекулы в рядах 1 и 6 лежат точно друг против друга.
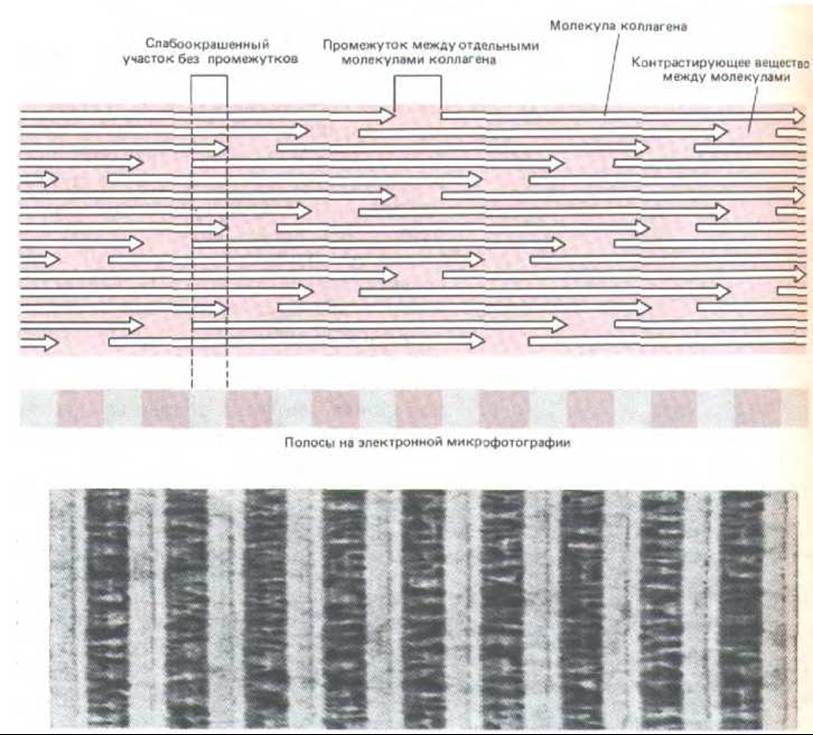
Рис. 14-37. Эта схема объясняет, каким образом ступенчатое расположение молекул коллагена приводит к поперечной исчерченности фибриллы после негативного контрастирования. Поскольку контрастирующее вещество заполняет только промежутки между молекулами в каждом ряду, эти промежутки выглядят как темные полосы. Внизу - электронная микрофотография негативно контрастированной фибриллы (любезно предоставлена Robert Horne.)

Рис. 14-38. Внутримолекулярные и межмолекулярные сшивки между модифицированными боковыми цепями лизина в коллагеновой фибрилле. Сшивки образуются в несколько этапов. Вначале некоторые остатки лизина и гидроксилизина дезаминируются внеклеточным ферментом лизилоксидазой, и здесь появляются альдегидные группы, обладающие высокой реакционной способностью. Затем эти группы самопроизвольно реагируют с образованием ковалентных связей друг с другом или с другими остатками лизина или гидроксилизина, так что в сшивке может участвовать более двух аминокислотных боковых цепей. Некоторые из образуемых связей относительно нестабильны и в конце концов модифицируются, превращаясь в разнообразные более стабильные сшивки. Обратите внимание, что большинство сшивок образуется между короткими неспиральными сегментами на обоих концах молекул коллагена (см. рис. 14-35).
14.2.9. Организация коллагеновых фибрилл во внеклеточном матриксе приспособлена к потребностям ткани [17]
Коллагеновые фибриллы имеют разную толщину и по-разному организуются в различных тканях. Например, в коже млекопитающих они расположены наподобие прутьев в плетеных изделиях и поэтому сопротивляются нагрузкам по всем направлениям. В сухожилии они собраны в параллельные пучки, уложенные вдоль главной оси, а в зрелой костной ткани и роговице их расположение напоминает чередующиеся слои в фанере - фибриллы каждого слоя уложены параллельно друг другу почти под прямым углом к фибриллам соседних слоев. Так же организованы они и в коже головастика (рис. 14-39).
Сами клетки соединительной ткани определяют размер и расположение коллагеновых фибрилл. В клетках могут экспрессироваться один или несколько генов для разных типов молекул фибриллярного проколлагена (в том числе и минорные типы, не представленные в табл. 14-3), и клетки могут таким образом регулировать распределение молекул после их секреции. Контролируя порядок, в котором последовательно отщепляются пропептиды аминного и карбоксильного концов, секретируя наряду с коллагеном различные виды и количества неколлагеновых макромолекул матрикса и направляя формирование коллагеновых фибрилл в тесной взаимосвязи с плазматической мембраной, клетки могут определять геометрию и свойства фибрилл в своем ближайшем окружении. Наконец, образование большего или меньшего числа сшивок в коллагене зависит от требуемой прочности на растяжение. На рис. 14-40 схематически представлены этапы синтеза фибриллярного коллагена и сборки структур высшего порядка.
14.2.10. Клетки могут участвовать в организации секретируемых ими коллагеновых фибрилл, изменяя натяжение матрикса [18]
Есть еще один механизм, с помощью которого выделяющие коллаген клетки определяют пространственную организацию образуемого ими матрикса. Фибробласты воздействуют на выработанный ими коллаген, ползая по нему и растягивая его, что способствует уплотнению его в слои и вытягиванию в волокна. Такая механическая роль фибробластов в структурировании коллагенового матрикса была наглядно продемонстрирована in vitro. Если поместить фибробласты в культуральную чашку с переплетением случайно ориентированных коллагеновых фибрилл, образующих гель, то клетки, передвигаясь, начнут тянуть за собой фибриллы из окружающего геля и последний сожмется до малой доли своего первоначального объема. Подобным же способом группа фибробластов может окружить себя капсулой из плотно упакованных коллагеновых волокон, ориентированных тангенциально.

Рис. 14-39. Электронная микрофотография поперечного среза кожи головастика. Видно, что слои коллагеновых фибрилл, подобно слоям дерева в фанере, уложены так, что фибриллы соседних слоев пересекаются под прямым углом. Такое расположение встречается также в зрелой костной ткани и в роговице. (С любезного разрешения Jerome Gross.)

Рис. 14-40. Схема различных внутриклеточных и внеклеточных событий при образовании коллагеновой фибриллы. В качестве примера того, как фибриллы могут упорядочение располагаться во внеклеточном пространстве, показана их последующая сборка в большое коллагеновое волокно, видимое в световой микроскоп. Ковалентные сшивки, стабилизирующие внеклеточные агрегаты, не показаны. У человека известно много наследственных заболеваний, при которых нарушается образование коллагеновых фибрилл, что не удивительно при столь большом числе ферментативных реакций, участвующих в этом процессе.
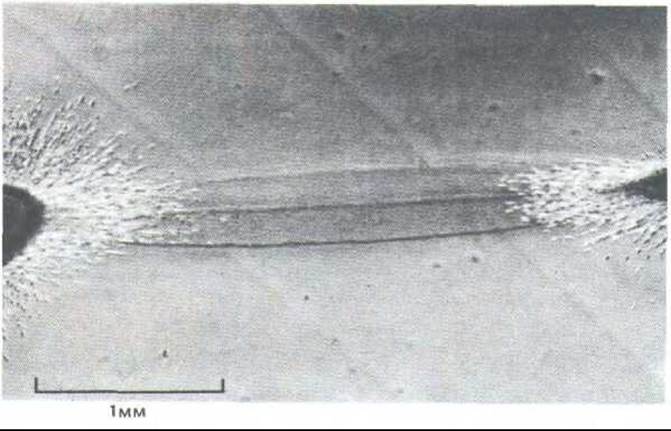
Рис. 14-41. Микрофотография участка между двумя кусочками сердца куриного эмбриона. Эти эксплантаты, содержавшие много фибробластов и мышечных клеток, росли на коллагеновом геле в течение 4 дней. Обратите внимание, что между эксплантатами образуется плотная полоса из параллельных коллагеновых волокон. (D. Stopak, А. К. Harris. Dev. Biol. 90: 383-398, 1982.)
Если два кусочка эмбриональной ткани с фибробластами поместить на некотором расстоянии друг от друга на коллагеновый гель, то коллаген организуется в компактную полосу ориентированных волокон, соединяющих оба эксплантата (рис. 14-41). Затем фибробласты будут мигрировать из обоих эксплантатов вдоль этих параллельных волокон. Таким образом, фибробласты влияют на расположение коллагеновых волокон, а эти волокна в свою очередь воздействуют на распределение фибробластов. Вполне возможно, что фибробласты играют сходную роль и в организации внеклеточного матрикса на макроуровне, участвуя, например, в создании сухожилий и связок, а также прочных, плотных слоев соединительной ткани, окружающих и скрепляющих большинство органов.
14.2.11. Молекулы коллагена типа IV организованы в ламинарную сеть [19]
Молекулы коллагена типа IV в некоторых отношениях отличаются от фибриллярного коллагена. Во-первых, регулярная повторяющаяся последовательность аминокислот Gly-X-Y в a-цепи типа IV во многих участках прерывается, локально нарушая спиральную трехцепочечную структуру молекулы коллагена. Во-вторых, молекулы «проколлагена» типа IV не расщепляются после выхода из клетки и, таким образом, сохраняют свои пропептиды; взаимодействуя через неотщепленные пропептидные домены, они организуются в пластоподобную многослойную сеть, а не в фибриллы. Электронно-микроскопические исследования показывают, что эти молекулы, по-видимому, ассоциируются пропептидами своих карбоксильных концов в димеры, которые при дальнейшей ассоциации образуют обширную сеть (рис. 14-42). Дисульфидные и другие ковалентные сшивки стабилизируют такие ассоциации. По-видимому, слои коллагена типа IV составляют основу всех базальных мембран; другие компоненты базальной мембраны будут обсуждаться позже (разд. 14.2.15).
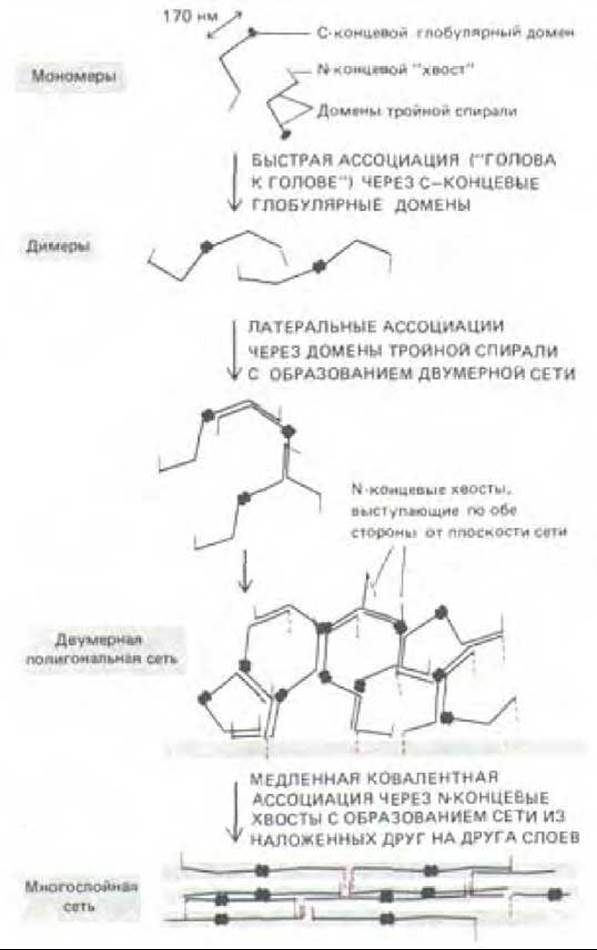
Рис. 14-42. Гипотетическая схема сборки молекул коллагена IV в многослойную сеть, составляющую основу всякой базальной мембраны. Модель основана на электронных микрофотографиях препаратов (с круговым напылением) таких молекул в процессе их сборки in vitro. (По данным P. D. Yurchenco, Е. С. Tsilibary, A. S. Charonis, H. Furthmayr. J. Histochem. Cytochem. 34: 93-102, 1986.)
14.2.12. Эластин-это белок с изменчивой случайной конформацией и поперечными сшивками, придающий тканям упругость [20]
Некоторые ткани, например кожа, кровеносные сосуды и легкие, должны быть не только прочными, но и эластичными. Обширная сеть эластических волокон внеклеточного матрикса придает этим тканям необходимую им способность сжиматься после временного растяжения. Главный компонент таких волокон - эластин - это весьма гидрофобный негликозилированный белок (около 830 аминокислотных остатков в длину), который, подобно коллагену, необычайно богат пролином и глицином, но в отличие от коллагена содержит очень мало гидроксипролина и совсем не содержит гидроксилизина. Молекулы эластина секретируются во внеклеточное пространство, где образуют волокна и слои, в которых эти молекулы связаны множеством сшивок в разветвленную сеть (рис. 14-43). Сшивки образуются между остатками лизина с помощью того же механизма, что и в коллагене (см. рис. 14-38). Функция эластина (в отличие от функции большинства других белков) требует того, чтобы его пептидные цепи оставались развернутыми и сохраняли гибкую случайную конформацию (рис. 14-44). Именно такая структура сети из сшитых между собой, произвольным образом изогнутых эластических волокон позволяет всей сети растягиваться и снова сжиматься, подобно резиновой ленте (рис. 14-45). Эластиновые волокна могут растягиваться по крайней мере в пять раз больше, чем резиновая лента такого же поперечного сечения. Вплетенные в сеть эластических волокон длинные нерастяжимые коллагеновые фибриллы ограничивают растяжимость всей сети и тем самым предотвращают разрыв ткани.
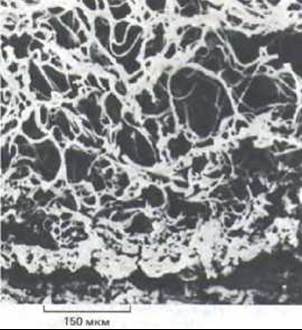
Рис. 14-43. Густая сеть эластических волокон в срезе соединительной ткани кожи (дермы) человека. Микрофотография, полученная с помощью сканирующего электронного микроскопа. Для того чтобы убрать коллаген и гликоз-аминогликаны, ткань подвергали нагреву под давлением. (Т. Tsuji, R. М. Lavker, A. M. Kligman. J. Microscop. 115: 165-173, 1978.)
![]()
Рис. 14-44. Схема различных случайных конформаций молекулы эластина. В отличие от большинства белков эластин не приобретает какой-то уникальной структуры, а постоянно переходит от одной частично развернутой случайной конформаций к другой, третьей и т.д.
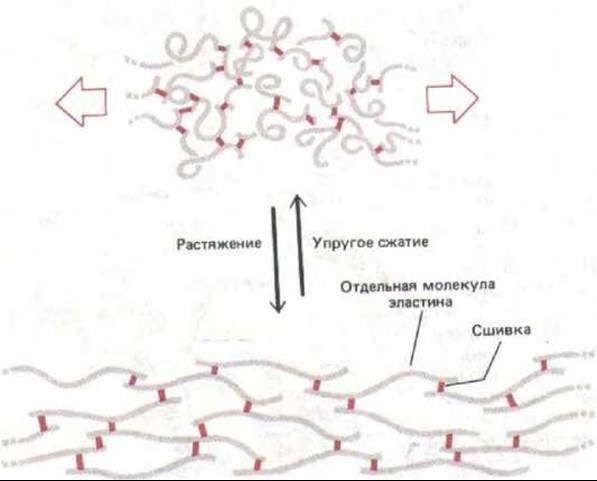
Рис. 14-45. Молекулы эластина связаны ковалентными сшивками (выделенными цветом) в обширную сеть. Поскольку каждая молекула в такой сети способна растягиваться и сжиматься, то и вся сеть растягивается и сжимается, подобно резине.
Эластические волокна состоят не только из эластина. Они содержат также гликопротеин, который в основном распределен в виде микрофибрилл по поверхности волокна. Эластические волокна формируются в тесной связи с плазматической мембраной клетки, секретирующей эластин и микрофибриллярный гликопротеин. Микрофибриллы появляются раньше самого эластина и, возможно, помогают клетке организовать из выделяемых ею молекул эластина волокна и слои, образующиеся во внеклеточном матриксе.
14-14
14.2.13. Фибронектин внеклеточный гликопротеин, способствующий адгезии между клеткой и матриксом [21]
Внеклеточный матрикс содержит несколько адгезивных гликопротеинов, которые связываются и с клетками, и с другими макромолекулами матрикса, способствуя прикреплению клеток к матриксу. Из них лучше всего охарактеризован фибронектин - крупный, образующий фибриллы гликопротеин, встречающийся во всем животном царстве. Это димер, состоящий из двух одинаковых субъединиц (каждая почти из 2500 аминокислотных остатков); субъединицы соединены парой дисульфидных связей вблизи от карбоксильных концов и свернуты в серию глобулярных доменов, разделенных участками гибкой полипептидной цепи (рис. 14-46). Как показывает секвенирование, молекула фибронектина состоит в основном из трех коротких много раз повторяющихся последовательностей аминокислот, и это позволяет предполагать, что ген, кодирующий фибронектин, образовался в результате многократной дупликации трех малых генов.
Существуют три формы фибронектина: 1) растворимая димерная форма (фибронектин плазмы), которая циркулирует в крови и тканевых жидкостях и, как полагают, способствует свертыванию крови, заживлению ран и фагоцитозу; 2) олигомеры фибронектина, которые могут быть временно прикреплены к поверхности клеток (поверхностный фибронектин); 3) труднорастворимая фибриллярная форма фибронектина во внеклеточном матриксе (матриксный фибронектин). В поверхностных и матриксных агрегатах димеры фибронектина связаны друг с другом дополнительными дисульфидными сшивками.
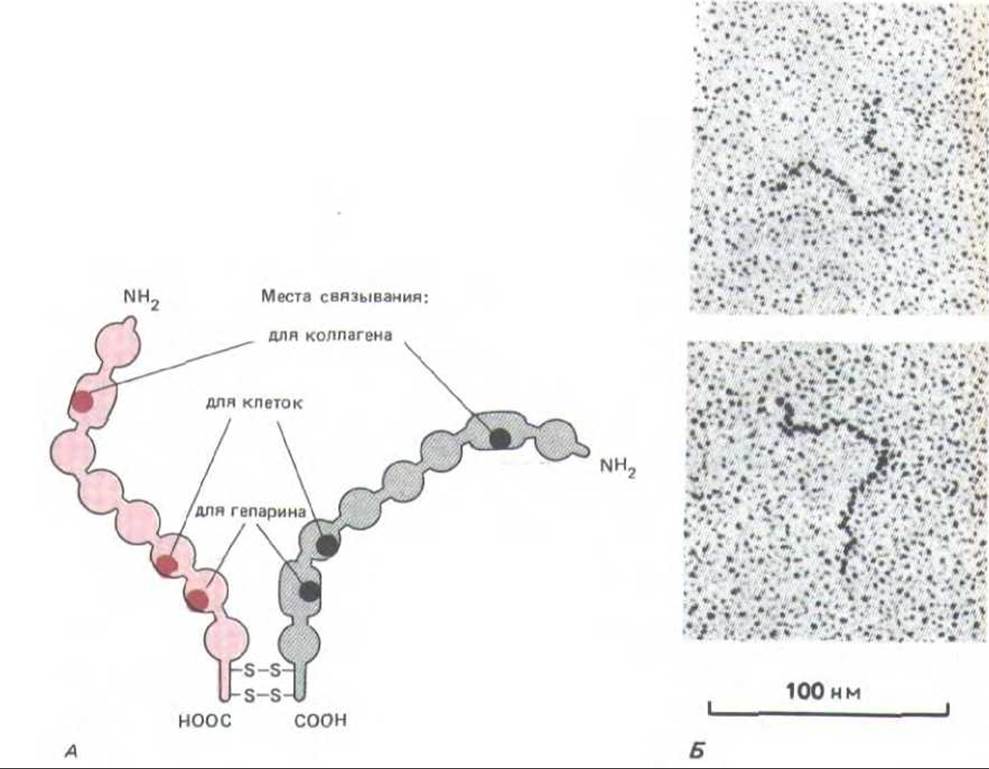
Рис. 14-46. А. Схематическое изображение структуры димера фибронектина. Б. Электронные микрофотографии отдельных молекул, напыленных платиной. Две полипептидные цепи сходны, но не идентичны; вблизи карбоксильного конца они соединены двумя дисульфидными связями. Каждая цепь свернута в ряд глобулярных доменов, соединенных гибкими полипептидными сегментами. Отдельные домены предназначены для связывания с той или иной молекулой или клеткой (это указано для трех доменов). Для простоты отмечены не все известные участки связывания. [Б-J. Engel et al. J. Моl. Віоl. 150: 97-120, 1981. Copyright Academic Press Inc. (London) Ltd.]
Фибронектин - многофункциональная молекула, в которой различные глобулярные домены играют разную роль. Например, один домен связывается с коллагеном, другой - с гепарином, третий - со специфическими рецепторами на поверхности клеток различных типов и т. д. (см. рис. 14-46). Таким образом фибронектин участвует в организации матрикса и способствует прикреплению к нему клеток.
Роль различных доменов, в особенности доменов, связывающихся с клетками, была изучена путем расщепления молекулы на отдельные домены протеолитическими ферментами или путем синтеза специфических белковых фрагментов химическим методом или с помощью рекомбинантных ДНК. Так, из протеолитических фрагментов был выделен домен, ответственный за связывание с клеткой, и определена его аминокислотная последовательность. Были приготовлены синтетические пептиды, соответствующие различным сегментам этого домена, и удалось выяснить, что за связывающую активность ответственна специфическая трипептидная последовательность (Arg-Gly-Asp, или R-G-D). Пептиды, содержащие эту RGD-последовательность, конкурируют за места связывания на клетке и таким образом ингибируют прикрепление клеток к фибронектину; когда же эти пептиды связываются с твердой поверхностью, они обусловливают прикрепление к ней клеток. RGD-последовательность содержится не только в фибронектине - она является общей для многочисленных внеклеточных адгезивных белков и узнается целым семейством гомологичных рецепторов клеточной поверхности, связывающих эти белки (разд. 14.2.17). Хотя в молекулах, узнаваемых этими рецепторами, имеется общая трипептидная последовательность, каждый рецептор специфически узнаёт свою собственную небольшую группу адгезивных молекул; таким образом, связывание с рецептором должно также зависеть и от других участков адгезивной белковой последовательности.
Фибронектин важен не только для клеточной адгезии, но и для миграции клеток. В зародышах беспозвоночных и позвоночных он, по-видимому, во многих случаях направляет миграцию. Например, большие количества фибронектина находятся вдоль пути передвижения клеток проспективной мезодермы при гаструляции у амфибий (разд. 16.1.4). Миграцию этих клеток можно подавить либо путем инъекции в бластоцель антител к фибронектину, либо путем введения полипептидов, содержащих трипептид, связывающийся с клетками, но без тех доменов фибронектина, которые связываются с матриксом. Полагают, что фибронектин способствует миграции клеток, помогая их прикреплению к матриксу. Такое действие должно быть тонко сбалансировано так, чтобы сцепление клеток с матриксом происходило, но не приводило к их иммобилизации. Позднее мы вернемся к вопросу о том, как может быть достигнут такой баланс многочисленными адгезивными молекулами, которые участвуют в определении путей морфогенетических движений.
14.2.14. Множественные формы фибронектина синтезируются при альтернативном сплайсинге РНК [22]
Фибронектин, будучи представителем обширного семейства RGD-coдержащих адгезивных молекул, и сам по себе, как уже отмечалось, может существовать во многих формах; даже в одном димере полипептидные цепи могут слегка различаться. И тем не менее все различные полипептидные цепи фибронектина кодируются одним большим геном; у крысы его длина составляет более 70 тысяч п. н., и он содержит около 50 экзонов, т. е. это один из самых крупных генов охарактеризованных до настоящего времени. При транскрипции получается одна длинная молекула РНК, которая подвергается сплайсингу в разных вариантах, при которых в зависимости от типа клеток образуется одна или несколько из примерно 20 различных мРНК. Неясно, чем определяется выбор вариантов сплайсинга РНК и каковы функциональные различия получающихся при этом полипептидных цепей. Судя по некоторым данным, одной из функций альтернативного сплайсинга РНК-транскрипта для фибронектина человека состоит в добавлении к определенным молекулам фибронектина дополнительного связывающегося с клетками домена, отличного от RGD-содержащего участка.
Фибронектин - не единственный секретируемый гликопротеин, участвующий в адгезии между клетками и матриксом. Например, тенасцин тоже является внеклеточным адгезивным гликопротеин ом, однако он встречается значительно реже, чем фибронектин, и наиболее обычен в эмбриональных тканях. В нервной системе он секретируется глиальными клетками, и полагают, что некоторые нейроны связываются с ним через посредство специфического протеогликана клеточной поверхности. Тенасцин представляет собой крупный комплекс из шести связанных дисульфидными сшивками полипептидных цепей, расходящихся из центра, подобно спицам колеса (см. рис. 14-51).
Некоторые клетки, особенно эпителиальные, секретируют внеклеточный адгезионный гликопротеин иного типа, называемый ламинином, который является одним из основных белков всех базальних мембран. Он связывается как с эпителиальными клетками (а также с клетками некоторых других типов), так и с коллагеном типа IV-главным типом коллагена в базальной мембране.
14.2.15. Базальная мембрана-это специализированная форма внеклеточного матрикса, содержащая в основном коллаген типа IV, протеогликаны и ламинин [23]
Базальная мембрана представляет собой тонкий слой специализированного внеклеточного матрикса, подстилающий пласты эпителиальных клеток; кроме того, она окружает отдельные мышечные волокна, жировые клетки и шванновские клетки (которые, наматываясь на периферические нервные волокна, образуют миелин). Таким образом, базальная мембрана отделяет эти клетки или клеточные слои от окружающей или подстилающей их соединительной ткани. В других местах, например в почечных клубочках или легочных альвеолах, базальная мембрана расположена между двумя различными слоями клеток и служит здесь высокоэффективным фильтром (рис. 14-47). Однако роль базальных мембран не сводится просто к функциям структурной опоры и фильтра. Они способны определять полярность клеток, влиять на клеточный метаболизм, упорядочивать белки в прилегающих плазматических мембранах, вызывать дифференцировку клеток и, подобно фибронектину, служить специфическими «магистралями» для клеточных миграций.
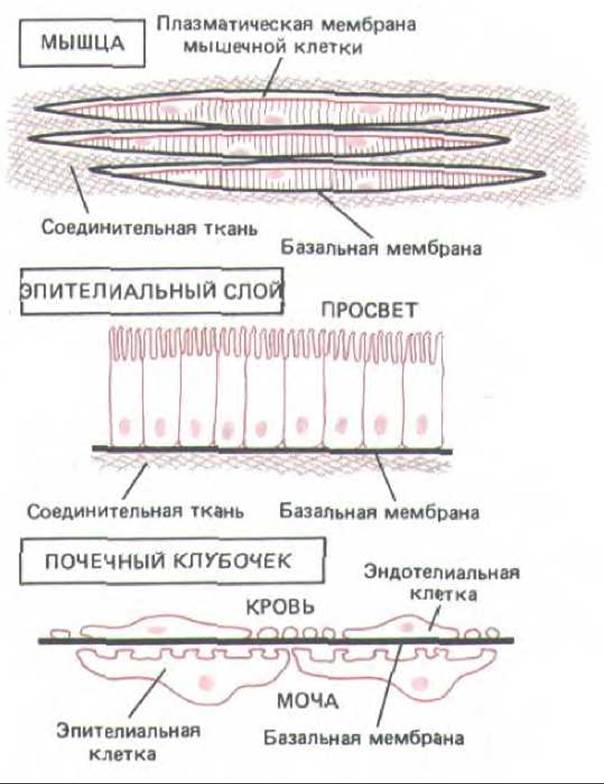
Рис. 14-47. Три варианта расположения базальной мембраны (представлена черной линией). Базальная мембрана клетки может окружать (например, мышечные), подстилать слои эпителиальных клеток или располагаться между двумя клеточными слоями (как в почечных клубочках). Обратите внимание, что в почечных клубочках в обоих слоях клеток имеются разрывы, так что барьером проницаемости, определяющим, какие молекулы из крови перейдут в мочу, служит базальная мембрана. Поскольку в клубочках эта мембрана-результат слияния двух базальных мембран, образованных эндотелиальными и эпителиальными клетками, то она вдвое толще большинства таких мембран.

Рис. 14-48. Базальная мембрана роговицы куриного эмбриона. Микрофотография, полученная с помощью сканирующего электронного микроскопа. Часть эпителиальных клеток (Эп) была удалена, чтобы показать верхнюю поверхность базальной мембраны (БМ). Обратите внимание, что с нижней поверхностью мембраны взаимодействует густая сеть коллагеновых фибрилл (К). Макромолекулы базальной мембраны синтезируются лежащими на ней эпителиальными клетками. (С любезного разрешения Robert Trelstad.)
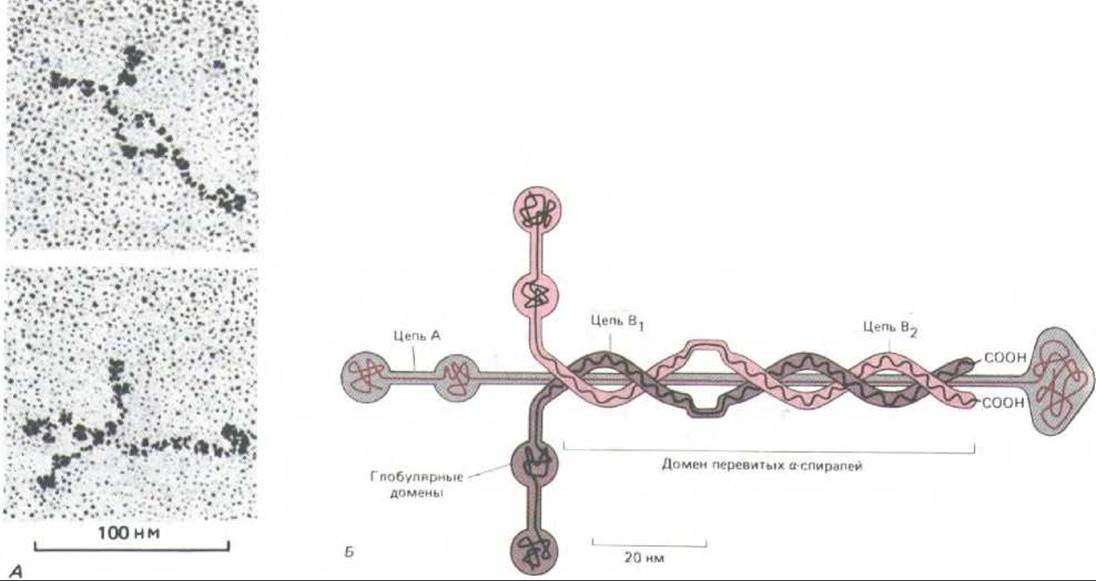
Рис. 14-49. А. Электронные микрофотографии молекул ламинина (препарат, напиленный платиной). Б, Схема структуры ламинина. Этот мультидоменный гликопротеин состоит из трех полипептидных цепей (А, В, и В2), соединенных дисульфидными связями в форме асимметричного креста. [A-J. Engel et al. J. Моl. BioL, 150, 97-120, 1981. Copyright Acad. Press Inc. (London) Ltd; Б-по В.L.. Hogan et al. In: Basement Membranes (S. Shibata, ed.), pp. 147-154. Amsterdam, Elsevier, 1985.]
Базальная мембрана в основном синтезируется лежащими на ней клетками (рис. 14-48). Это, по существу, плотная прослойка из коллагена типа IV (см. рис. 14-42) с дополнительными специфическими молекулами по обе ее стороны, которые способствуют прикреплению ее к соседним клеткам или матриксу. Хотя состав базальных мембран несколько меняется от ткани к ткани и даже от участка к участку (разд. 14.2.17), все эти мембраны содержат коллаген типа IV вместе с протеогликанами (в основном гепарансульфатами) и гликопротеинами лиминином и энтактином. Ламинин представляет собой крупный (мол. масса около 850000) комплекс из трех очень длинных полипептидных цепей, расположенных в форме креста и удерживаемых вместе дисульфидными связями (рис. 1449). Подобно фибронектину, он состоит из нескольких функциональных доменов: один из них связывается с коллагеном типа IV, один - с гепарансульфатом и один или несколько других - с белковыми рецепторами ламинина на клеточной поверхности. Полагают также, что с каждой молекулой ламинина прочно связана одна гантелевидная молекула энтактина в месте соединения коротких ветвей «креста» с длинной ветвью.
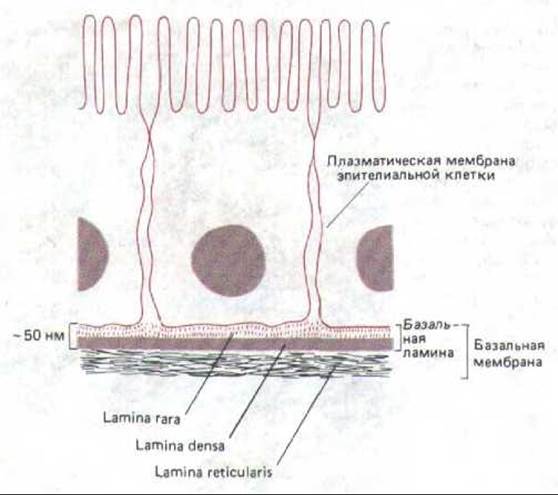
Рис. 14-50. Структура базальной мембраны, подстилающей эпителиальные клетки, как она видна на поперечных срезах в электронном микроскопе.

Рис. 14-51. Сравнение формы и размеров некоторых важнейших макромолекул внеклеточного матрикса.
Как видно на электронно-микроскопических препаратах после обычной фиксации и контрастирования, большинство базальних мембран состоит из двух слоев: электронопрозрачного слоя (lamina lucida, или гага), прилегающего к плазматической мембране клеток, находящихся на базальной мембране (обычно это эпителиальные клетки), и лежащего под ним электроноплотного слоя (lamina densa). В некоторых случаях имеется еще третий слой, содержащий коллагеновые фибриллы (lamina reticularis) и связывающий базальную мембрану с подлежащей соединительной тканью. Некоторые авторы называют «базальной мембраной» весь комплекс из трех слоев (рис. 14-50), толщина которого обычно достаточна для того, чтобы его можно было видеть в обычный микроскоп. Детальная молекулярная организация базальной мембраны еще не исследована, хотя электронная микроскопия с использованием меченых антител показывает, что lamina densa, по-видимому, состоит в основном из коллагена типа IV с молекулами протеогликана на обеих ее сторонах; как полагают, ламинин присутствует главным образом на той стороне lamina densa, которая обращена к плазматической мембране, где он участвует в прикреплении эпителиальных клеток к базальной мембране, тогда как фибронектин помогает связыванию макромолекул матрикса и клеток соединительной ткани на противоположной стороне.
На рис. 14-51 сравниваются размеры и форма некоторых важнейших макромолекул базальной мембраны.
14.2.16. Вязальные мембраны выполняют многообразные и сложные функции [24]
Функции базальной мембраны чрезвычайно разнообразны. В почечных клубочках необычно толстая базальная мембрана работает как молекулярный фильтр, регулируя переход молекул из крови в мочу (см. рис. 14-47). Для этой функции, по-видимому, необходимы протеогликаны, так как их удаление с помощью специфических ферментов ведет к утрате фильтрующих свойств мембраны. Базальная мембрана может также служить избирательным барьером для клеток. Например, базальная мембрана, подстилающая эпителиальный слой, обычно предотвращает контакт фибробластов подлежащей соединительной ткани с эпителиальными клетками, но не препятствует прохождению через нее макрофагов, лимфоцитов и нервных волокон.
Базальная мембрана играет важную роль в процессе регенерации ткани после повреждения. При нарушении целости мышечной, нервной или эпителиальной ткани сохранившаяся базальная мембрана служит субстратом для миграции регенерирующих клеток. Таким образом легко восстанавливается исходная архитектура ткани. Наиболее яркий пример роли базальной мембраны в регенерации мы находим при изучении нервномышечного соединения, в котором нервная клетка передает стимул волокну скелетной мышцы.
В месте нервно-мышечного контакта (синапса) базальная мембрана имеет особое химическое строение, распознаваемое, например, антителами, которые связываются с ней исключительно в этом участке. Одна из функций базальной мембраны здесь состоит, по-видимому, в координировании пространственной организации компонентов по обе стороны синапса. Данные в пользу центральной роли базальной мембраны синаптического соединения в восстановлении синапса после повреждения мышцы или нерва будут обсуждаться в гл. 19 (разд. 19.8.3). Такие исследования ясно показывают, что мы еще многого не знаем о химической и функциональной специализации базальной мембраны. Они позволяют также предположить, что минорные (но пока не идентифицированные) компоненты внеклеточного матрикса могут играть решающую роль в управлении процессами морфогенеза в эмбриональном развитии.
14.2.17. Интегрины способствуют связыванию клеток с внеклеточным матриксом [25]
Чтобы понять, как внеклеточный матрикс взаимодействует с клетками, нужно изучить молекулы клеточной поверхности, связывающиеся с компонентами матрикса, а также молекулы самого матрикса. Как уже отмечалось, некоторые протеогликаны являются интегральными компонентами плазматической мембраны; их сердцевинный белок либо пронизывает липидный бислой, либо ковалентне присоединен к нему. Связываясь с большинством компонентов внеклеточного матрикса, эти протеогликаны способствуют прикреплению клеток к матриксу. Однако компоненты матрикса тоже прикрепляются к клеточной поверхности с помощью специфических рецепторных протеогликанов. Ввиду таких сложных взаимодействий между макромолекулами матрикса во внеклеточном пространстве вопрос о том, где кончаются компоненты плазматической мембраны и где начинается внеклеточный матрикс, - в значительной степени семантический. Например, гликокаликс клетки часто состоит из компонентов обеих этих структур (см. разд. 6.3.1).
Рецепторы матрикса отличаются от поверхностных клеточных рецепторов для гормонов и других растворимых сигнальных молекул тем, что связывают свои лиганды с относительно низким сродством (Ка = 106-108 л/моль), и тем, что их концентрация на поверхности клеток примерно в 10100 раз больше. Поэтому такие рецепторы, вероятно, могут функционировать кооперативно, а клетки могут отвечать на организованную группу лигандов в матриксе, а не на отдельные молекулы. В пользу этого предположения говорит то, что растворимые фрагменты матрикса, прикрепляющиеся к клеткам, обычно не вызывают у клетки ответ, вызываемый теми же компонентами, закрепленными в матриксе.
Рецептор фибронектина на фибробластах млекопитающих - один из наиболее изученных рецепторов для компонентов матрикса. Первоначально он был идентифицирован как гликопротеин плазматической мембраны, который связывается в колонке с фибронектином и может быть элюирован с помощью небольшого белка, содержащего прикрепляющуюся к клетке последовательность RGD (разд. 14.2.13). Рецептор представляет собой нековалентно связанный комплекс из двух различных высокомолекулярных полипептидных цепей, называемых а- и ß-цепями. Он работает как трансмембранный линкер, осуществляя взаимодействие между актином цитоскелета внутри клетки и фибронектином во внеклеточном матриксе (рис. 14-52). Позднее мы увидим, что такие взаимодействия через плазматическую мембрану могут поляризовать и клетку и матрикс. Было охарактеризовано много других рецепторов для матрикса, в том числе таких, которые связывают коллаген и ламинин, и показано, что они родственны рецептору фибронектина на фибробластах. Называемые интегринами, все они являются гетеродимерами с а- и ß-цепями, гомологичными цепям рецептора для фибронектина. Вероятно, большинство из них узнаёт последовательности RGD в компонентах матрикса, с которыми они связываются.
Имеется по крайней мере три семейства в огромном суперсемействе интегринов; члены одного семейства имеют одну общую а-цепь, но различаются своими ß-цепями. Одно из семейств включает рецептор фибробластов для фибронектина и по меньшей мере еще пять других членов. Другое семейство включает рецептор на кровяных пластинках, связывающий некоторые компоненты матрикса, в том числе фибронектин и фибриноген - белок, взаимодействующий с пластинками в процессе свертывания крови: при болезни Гланцмана - наследственном дефиците этих рецепторов - у больных плохо свертывается кровь. Третье семейство интегринов составляют рецепторы, находящиеся главным образом на поверхности лейкоцитов; один из них носит название LFA-1 (lymphocyte function associated), другой -Mac-1, так как он в основном встречается на макрофагах. Эти рецепторы участвуют как в межклеточных взаимодействиях, так и во взаимодействиях клеток с матриксом; они играют решающую роль в способности этих клеток бороться с инфекцией. Люди с наследственным дефицитом лейкоцитарной адгезии неспособны синтезировать ß-субъединицу; поэтому их лейкоциты лишены целого семейства рецепторов, и больные подвержены повторным бактериальным инфекциям. Ряд гликопротеинов клеточной поверхности, участвующих в позиционно-специфической клеточной адгезии у личинок Drosophila, тоже принадлежат к суперсемейству интегринов, однако их отношение к трем семействам, свойственным млекопитающим, неизвестно.

Рис. 14-52. Рецептор фибронектина на клеточной поверхности и его субъединицы. Судя по электронным микрофотографиям изолированных рецепторов, форма молекулы близка к изображенной на рисунке. Глобулярная «головка» выступает над липидным бислоем более чем на 20 нм. Связываясь с фибронектином снаружи и с цитоскелетом внутри клетки (через прикрепительный белок талин), рецептор действует как трансмембранный линкер. Обе цепи, а и ß, гликозилированы (на схеме не показано) и удерживаются вместе нековалентными связями. Первоначально а-цепь синтезируется в виде одной полипептидной цепи с мол. весом 140000, которая затем расщепляется на малую трансмембранную цепь и большую внеклеточную цепь, соединенные дисульфидной связью. Внеклеточная часть ß-цепи состоит из повторяющихся участков, богатых цистеином, что указывает на большое число межцепочечных дисульфидных связей (не показаны). Рецептор фибронектина принадлежит к обширному суперсемейству гомологичных рецепторов для матрикса, называемых интегринами, большинство из которых узнает последовательности RGD связываемых ими внеклеточных белков.
Однако не все рецепторы для матрикса принадлежат к этому суперсемейству. Например, некоторые клетки, по-видимому, используют для прикрепления к коллагену неродственный трансмембранный гликопротеин, а у многих клеток, как уже упоминалось, имеются интегральные мембранные протеогликаны, прикрепляющие клетки к внеклеточному матриксу.
14.2.18. Цитоскелет и внеклеточный матрикс взаимодействуют через плазматическую мембрану [26]
Макромолекулы внеклеточного матрикса оказывают поразительное воздействие на поведение клеток в культуре, влияя не только на их движение, но и на форму, полярность, метаболизм и дифференцировку. Например, клетки эпителия роговицы при росте на искусственных поверхностях производят очень мало коллагена; если же культивировать их на ламинине, коллагене или фибронектине, то они накапливают и секретируют коллаген в больших количествах. Другие примеры влияния внеклеточного матрикса на метаболизм и дифференцировку клеток будут обсуждаться в гл. 17 (разд. 17.7.1).
Матрикс может также влиять на организацию цитоскелета клетки. Обычно базальные поверхности эпителиальных клеток, растущих на пластике или стекле, имеют неправильную форму, а прилегающий к ним изнутри цитоскелет дезорганизован. Но когда те же клетки растут на подложке из подходящих макромолекул внеклеточного матрикса, базальные поверхности становятся гладкими, а цитоскелет над ними - таким же упорядоченным, как в интактной ткани. Сходные результаты были получены на культурах фибробластов, подвергшихся опухолевой трансформации. Трансформированные клетки часто вырабатывают меньше фибронектина, чем нормальные культивируемые клетки, и отличаются от них поведением: например, они слабо прикрепляются к субстрату и неспособны распластываться на нем или формировать организованные внутриклеточные пучки актиновых филаментов, известных под названием стрессовых волокон (разд. 11.1.17). У некоторых из таких клеток недостаток фибронектина по крайней мере частично ответствен за их аномальное поведение: если клетки растут на матриксе из организованных волокон фибронектина, то они распластываются и формируют внутриклеточные стрессовые волокна, лежащие параллельно волокнам внеклеточного фибронектина.
Взаимодействие между внеклеточным матриксом и цитоскелетом бывает двусторонним: внутриклеточные актиновые филаменты могут влиять на расположение секретируемых молекул фибронектина. Например, в культуре поблизости от фибробластов волокна внеклеточного фибронектина выстраиваются по направлению смежных внутриклеточных стрессовых волокон (рис. 14-53). Если такие клетки обработать цитохалазином, который разрушает внутриклеточные актиновые филаменты, то волокна фибронектина отделяются от клеточной поверхности (точно так же, как во время митоза, когда клетка округляется). Ясно, что должна существовать связь между внеклеточным фибронектином и внутриклеточными актиновыми филаментами через плазматическую мембрану фибробласта. Такую связь осуществляют рецепторы фибронектина, о которых уже говорилось, что эти трансмембранные белки соединяют фибронектин с актиновыми филаментами через такие внутриклеточные прикрепительные белки, как талин (см. разд. 11.2,8. и рис. 14-52). Участок рецептора, связывающий талин, содержит остаток тирозина, фосфорилирование которого тирозин-специфической протеинкиназой, по-видимому, инактивирует этот участок и таким образом разрушает связь между фибронектином и кортикальными актиновыми филаментами. Как полагают, прикрепление клеток к матриксу может регулироваться таким путем специфическими факторами роста, активирующими тирозин-специфические киназы (см. рис. 13-37).

Рис. 14-53. Иммунофлуоресцентные микрофотографии внеклеточных волокон фибронектина (А) и внутриклеточных пучков актиновых филаментов (Б) в трех культивируемых фибробластах крысы. Для выявления фибронектина использованы антитела к фибронектину с присоединенным родамином, а для выявления актина-антитела к актину с присоединенным флуоресцеином. Обратите внимание, что направление волокон фибронектина совпадает с направлением пучков актиновых нитей. (R. О. Hynes, А. Т. Destree. Cell 15: 875-886, 1978. Copyright Cell Press.)
Поскольку цитоскелет клеток способен упорядочивать секретируемые ими макромолекулы матрикса, а те в свою очередь организуют цитоскелет контактирующих с ними клеток, внеклеточный матрикс может в принципе распространять упорядочивание от клетки к клетке (рис. 1454). Таким образом, можно полагать, что внеклеточный матрикс играет центральную роль в создании и поддержании ориентации клеток в тканях и органах в процессе развития; например, параллельное расположение фибробластов и коллагеновых волокон в сухожилии мог бы частично отражать именно такие взаимодействия между клетками и матриксом. Трансмембранные рецепторы для матрикса служат в этом процессе упорядочивания «посредниками».
Заключение
Клетки в соединительных тканях погружены в сложный внеклеточный матрикс, который не только скрепляет клетки и ткани, но и влияет на развитие, полярность и поведение контактирующих с ним клеток. Матрикс содержит различные волокнообразующие белки, вплетенные в гидратированный гель, состоящий из сети цепочек гликозаминогликанов. Гликозаминогликаны представляют собой разнородную группу длинных, отрицательно заряженных полисахаридных цепей, которые (за исключением гиалуроновой кислоты) ковалентна связаны с белками, образуя молекулы протеогликанов.

Рис. 14-54. Гипотетическая схема передачи упорядоченности от клетки к клетке через внеклеточный матрикс. Для простоты на рисунке показано, как одна клетка влияет на ориентацию соседних клеток, но та же схема позволяет объяснить и взаимное влияние клеток друг на друга.
Существуют волокнообразующие белки двух функциональных типов: преимущественно структурные (коллаген и эластин) и главным образом адгезивные (такие, как фибронектин и ламинин). Фибриллярные коллагены (типы I, II и III) представляют собой канатовидные трехспиральные молекулы, которые во внеклеточном пространстве агрегируют в длинные фибриллы, а те в свою очередь могут организовываться в разнообразные высокоупорядоченные структуры. Молекулы коллагена типа IV организуются в пластоподобные сети, составляющие основу всех базальных мембран. Молекулы эластина благодаря многочисленным поперечным сшивкам образуют сеть волокон и слоев, которые могут растягиваться и вновь сокращаться, придавая матриксу упругость. Фибронектин и ламинин служат примерами крупных адгезивных гликопротеинов матрикса; фибронектин очень широко распространен в соединительных тканях, а ламинин содержится главным образом в базальной мембране. Благодаря своим множественным прикрепительным доменам такие белки способствуют клеточной адгезии и участвуют в организующем влиянии внеклеточного матрикса на клетки. Многие из этих адгезивных гликопротеинов содержат общую трипептидную последовательность (RGD), которая составляет часть структуры, узнаваемой интегринами - членами суперсемейства гомологичных трансмембранных рецепторов для компонентов матрикса.
Все белки и полисахариды матрикса локально секретируются клетками, соприкасающимися с матриксом; в тесном взаимодействии с наружной поверхностью плазматической мембраны эти молекулы могут упорядочиваться. Поскольку структура и ориентация матрикса в свою очередь влияет на ориентацию контактирующих с ним клеток, весьма вероятно, что упорядоченность будет распространяться по матриксу от клетки к клетке.