Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Клеточная адгезия, соединения между клетками и внеклеточный матрикс
Межклеточное узнавание и адгезия
До сих пор мы рассматривали, как межклеточные соединения и внеклеточный матрикс удерживают клетки вместе в зрелых тканях и органах. Но каким образом клетки объединяются друг с другом на начальных стадиях формирования тканей? Существуют по меньшей мере два принципиально различных способа. Чаще всего ткань образуется из «клеток-основательниц», потомки которых остаются вместе просто потому, что они прикреплены к макромолекулам внеклеточного матрикса и/или к другим клеткам (рис. 14-55). Конкретные особенности таких соединений и определяют структуру клеточного ансамбля. Эпителиальные клеточные пласты обычно возникают именно таким путем, и процессы эмбрионального развития животных в значительной части сводятся к формированию, изгибанию и дифференцировке таких клеточных пластов, что приводит к созданию тканей и органов взрослого организма. Как правило, все клетки раннего зародыша организованы в эпителии, и только позже некоторые клетки изменяют свои адгезивные свойства, выходят из пластов и формируют ткани других типов (разд. 16.1.4-16.1.11).
Другая стратегия формирования ткани представляется более сложной и включает миграцию клеток: одна клеточная популяция проникает в другую и объединяется с ней (а иногда и с другими мигрирующими клетками), формируя ткань смешанного происхождения. Например, в зародышах позвоночных клетки нервного гребня выселяются из эпителиальной (нервной) трубки, в состав которой они первоначально входили, и по определенным путям мигрируют во многие другие участки. Там они группируются и дифференцируются в различные ткани, в том числе и элементы периферической нервной системы (рис. 14-56). Для такого процесса нужен какой-то механизм, направляющий клетки к месту их назначения, например секреция растворимого химического агента, привлекающего мигрирующие клетки (путем хемотаксиса), или отложение во внеклеточном матриксе адгезивных молекул типа фибронектина (разд. 14.2.13), направляющих миграцию клеток по определенным путям (путем контактной ориентировки).

Рис. 14-55. Простейший механизм образования ткани из клеток. Потомки клеток-основательниц удерживаются в эпителиальном слое с помощью базальной мембраны и механизмов межклеточной адгезии (включая специализированные межклеточные соединения).
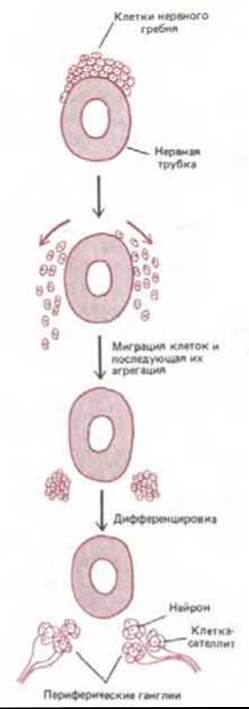
Рис. 14-56. Пример более сложного механизма построения ткани из клеток. Клетки нервного гребня мигрируют из эпителия на верхней поверхности нервной трубки и направляются во многие другие участки зародыша, где образуют различные группы клеток и ткани. Здесь показано, как эти клетки объединяются и дифференцируются в два скопления нейронов периферической нервной системы. Такие скопления называют ганглиями. Другие клетки нервного гребня в ганглии дифференцируются в опорные (сателлитные) клетки, окружающие нейроны.

Рис. 14-57, Световая микрофотография ползущего плазмодия миксомицета Dictyostelium discoideum. (С любезного разрешения David Francis.)
Достигнув места назначения, мигрирующая клетка должна узнавать другие клетки соответствующего типа, чтобы формировать вместе с ними ткань. Даже в тканях, образующихся без миграции, составляющие их клетки, по-видимому, специфически узнают друг друга: если такую развивающуюся ткань диссоциировать на отдельные клетки, то они предпочтительно вновь ассоциируют друг с другом, а не с клетками другой ткани (разд. 14.3,4). По-видимому, такое специфическое межклеточное узнавание способствует тому, что клетки развивающейся ткани остаются в контакте друг с другом и отделены от клеток соседних тканей.
В попытках понять, как узнают друг друга клетки в развивающихся животных тканях, были проведены остроумные эксперименты на некоторых простых микроорганизмах, способных переходить от одноклеточного существования к многоклеточному и обратно. Независимо от их значения как возможных моделей межклеточного взаимодействия у животных эти организмы интересны и сами по себе.
14.3.1. Миксамебы слизевика при голодании агрегируют с образованием многоклеточных плодовых тел [28]
Слизевик (миксомицет) Dictyostelium discoideum представляет собой эукариотический организм, геном которого только в 10 раз больше, чем у бактерии, и в 100 раз меньше, чем у человека. Эти организмы живут в лесной подстилке в виде отдельных подвижных клеток, называемых миксамебами, питающихся бактериями и дрожжами и при оптимальных условиях делящихся раз в несколько часов (в лабораторных условиях их можно выращивать в жидкой синтетической среде). Когда запасы пищи истощаются, миксамебы перестают делиться и собираются вместе, образуя крошечные (1-2 мм) многоклеточные червеобразные существа (плазмодии), ползающие наподобие слизней и оставляющие за собой след из слизи (рис. 14-57). Каждый плазмодий формируется путем агрегации до 100000 клеток и проявляет черты поведения, не свойственные свободноживущим миксамебам. Например, плазмодий чрезвычайно чувствителен к свету и теплу и может мигрировать по направлению к такому слабому источнику света, как флуоресцирующий циферблат часов; по-видимому, такое поведение помогает ему двигаться в направлении более благоприятных условий. По мере движения клетки приступают к дифференцировке, результатом которой примерно через 30 ч после начала агрегации будет образование миниатюрной, напоминающей растение структуры, состоящей из ножки и плодового тела (рис. 14-58). В плодовом теле содержится множество спор, которые могут долгое время выживать даже в крайне неблагоприятных условиях. На рис. 14-59 схематически показаны сложные миграции клеток, происходящие при формировании ножки и плодового тела. Клетки на переднем конце плазмодия становятся участком ножки, следующие за ними дифференцируются в споры, а замыкающие - в подошву. И клетки ножки, и споры покрываются внеклеточным матриксом (в виде целлюлозных стенок), и в конце концов все клетки, за исключением спор, погибают. Только при наступлении благоприятных условий споры прорастают в свободноживущих миксамеб, возобновляющих цикл (рис. 14-60).

Рис. 14-58. Разные стадии образования плодового тела Dictyostelium discoideum. (Световые микрофотографии; с любезного разрешения John Bonner.)
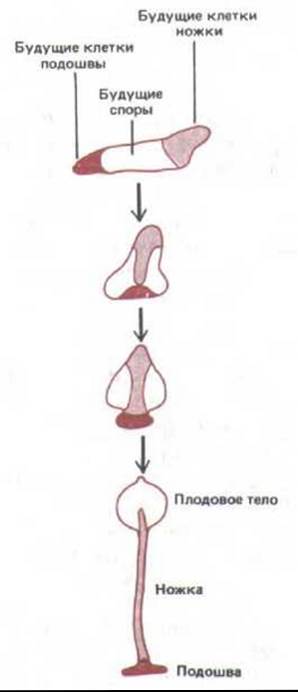
Рис. 14-59. Миграции клеток при формировании плодового тела у Dictyostelium discoideum. Клетки передней части слизевика перемещаются вниз и образуют ножку, а клетки средней части мигрируют вверх и дифференцируются в споры, образующие плодовое тело.
14.3.2. Амебы слизевика агрегируют в результате хемотаксиса [29]
При формировании плазмодия отдельные клетки слизевика агрегируют в результате хемотаксиса, который нам придется рассмотреть, прежде чем обсуждать роль межклеточной адгезии. Одна из реакций на голодание у миксамеб состоит в том, что они начинают вырабатывать и выделять сАМР, который служит хемотаксическим сигналом, привлекающим других миксамеб. (Как мы знаем из гл. 12, в прокариотических и животных клетках сАМР служит внутриклеточным сигналом; Dictyostelium-единственный организм, у которого он действует еще и как внеклеточная сигнальная молекула.) По-видимому, агрегация инициируется случайным образом: любые клетки, начинающие первыми секретировать циклический AMP, привлекают другие клетки и таким образом становятся центрами агрегации. Циклический AMP, вырабатываемый такими «клетками-инициаторами», секретируется отдельными «импульсами» и связывается специфическими рецепторами на поверхности соседних голодающих амеб, направляя тем самым их движение в сторону источника циклического AMP. Такой хемотаксический ответ можно продемонстрировать, нанеся из микропипетки ничтожное количество сАМР на любой участок поверхности клетки голодающей миксамебы. Ответом будет немедленное образование псевдоподии, растущей в сторону пипетки (рис. 14-61); псевдоподия прикрепляется к поверхности, на которой находится клетка, и тянет клетку в том же направлении. Как только образуется центр агрегации, зона его влияния быстро расширяется, так как агрегирующие клетки не только отвечают на сигнал циклического AMP, но и передают его от клетки к клетке. Каждый импульс циклического AMP побуждает соседние клетки не только к движению к источнику импульса, но и к испусканию собственного импульса в виде циклического AMP. Этот новый, высвобождающийся с небольшой задержкой импульс в свою очередь ориентирует находящиеся рядом клетки, вызывая у них тоже выброс сАМР, и т.д. Таким образом возникают регулярные чередующиеся волны циклического AMP, распространяющиеся из каждого центра агрегации, заставляя более удаленных миксамеб двигаться внутрь концентрическими или спиральными волнами, которые можно видеть на кадрах цейтраферных фильмов (рис. 14-62). Преимущество такой системы передачи состоит в том, что по мере распространения из центра сигнал постоянно возобновляется, не ослабляясь на большом расстоянии. В отличие от этого сигнал, распространяющийся только путем диффузии, постепенно ослабевает по мере распространения. Это различие можно ясно увидеть, сравнивая процесс агрегации у Dictyostelium discoideum и у D. minutum - формы, у которой релейная система передачи отсутствует. У D. munutum уровень сигнала, исходящего из каждого центра агрегации, сильно ослабевает, и в результате формируются очень мелкие плазмодии и плодовые тела.
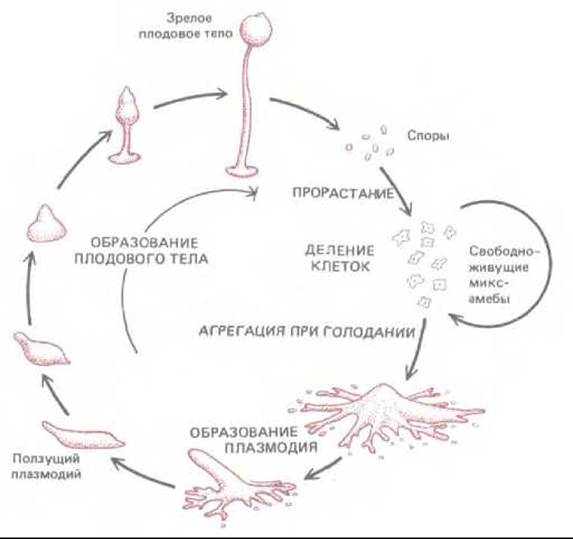
Рис. 14-60. Жизненный цикл Dictyostelium discoideum. При голодании свободноживущие миксамебы агрегируют с образованием подвижного плазмодия, который затем образует плодовое тело. При благоприятных условиях высвобождающиеся из плодового тела споры прорастают и вновь превращаются в амеб.
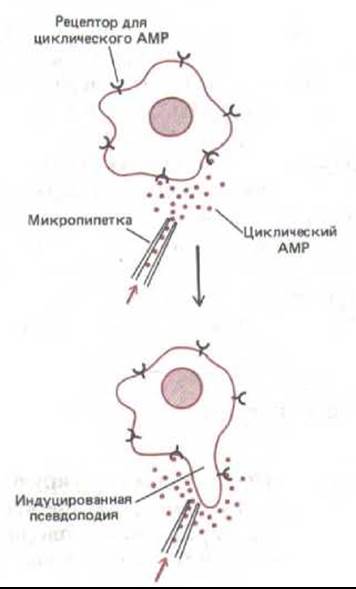
Рис. 14-61. Нанесение небольшого количества циклического AMP на любую точку поверхности голодающей клетки (амебы) Dictyostelium тотчас же вызывает образование псевдоподии в этой точке. Такой механизм позволяет амебе двигаться по направлению к источнику сАМР. Чтобы воздействовать на клетку, циклический AMP должен связаться со специфическими рецепторами на ее поверхности.
14.3.3. Межклеточная адгезия у слизевиков зависит от специфических гликопротеинов клеточной поверхности [30]
Помимо активации сигнальной системы циклического AMP голодание миксамеб Dictyosteliun вызывает экспрессию сотен новых генов, и некоторые из них кодируют молекулы межклеточной адгезии, участвующие в агрегации клеток. Полагают, например, что один из связывающих углеводы белков (т.е. лектинов, см. разд. 6.3.1) - дискоидин-1-выделяется голодающими клетками для обеспечения примитивных форм контактной ориентировки. Связываясь с поверхностью миксамебы и с субстратом, по которому она мигрирует, он мог бы способствовать образованию потоков миксамеб, движущихся к центрам агрегации, во многом подобно тому, как фибронектин направляет миграцию клеток во время гаструляции. В самом деле, связывание клетки с дискоидином-1 зависит от того же трипептида RGD, который содержится в фибронектине и многих других адгезивных белках (разд. 14.2.13).
Различные вновь синтезируемые белки способствуют процессу межклеточной адгезии, позволяя мигрирующим миксамебам плотно слипаться друг с другом и формировать многоклеточный организм. В первые 8 ч голодания клетки слипаются с помощью Са2+-зависимого механизма с участием адгезивной молекулы, называемой контактным сайтом В. Через 8 ч вступает в действие другая адгезионная система, где слипание клеток осуществляется Са2+-независимым механизмом с участием молекулы межклеточной адгезии, называемой контактным сайтом А. Контактные сайты А и В были выделены и идентифицированы как интегральные гликопротеины плазматической мембраны с помощью остроумного иммунологического метода, представленного на рис. 14-63. Позднее этот метод был использован для идентификации молекул межклеточной адгезии также и у позвоночных.
Каким образом гликопротеины клеточной поверхности, такие как контактные сайты А и В, связывают клетки друг с другом? На рис. 1464 представлены три возможных механизма: 1) молекулы одной клетки могут связываться с такими же молекулами соседних клеток (так называемое гомофильное связывание); 2) молекулы одной клетки могут связываться с иного рода молекулами соседних клеток (гетерофильное связывание); и 3) рецепторы клеточной поверхности соседних клеток могут связываться друг с другом, секретируя мультивалентные линкерные молекулы. Как выяснилось, у животных действуют все эти три механизма.
Полагают, что контактный сайт А обеспечивает слипание клеток путем гомофильного механизма, так как после присоединения белка к синтетическим агрегатам эти агрегаты связываются только с клетками, вырабатывающими контактный сайт А, и это связывание блокируется, если клетки предварительно обработаны антителами к контактному сайту А. Секвенирование ДНК показывает, что контактный сайт А - это лишь один раз пронизывающий мембрану белок, по-видимому, не родственный ни одному из до сих пор известных белков межклеточной адгезии (см. ниже).
14.3.4. Диссоциированные клетки позвоночных могут вновь ассоциироваться в организованную ткань благодаря селективной межклеточной адгезии
Привлекательность использования таких микроорганизмов, как Dictyo-stelium, при изучении агрегации клеток состоит в том, что этот процесс нормально протекает в культуральной чашке.
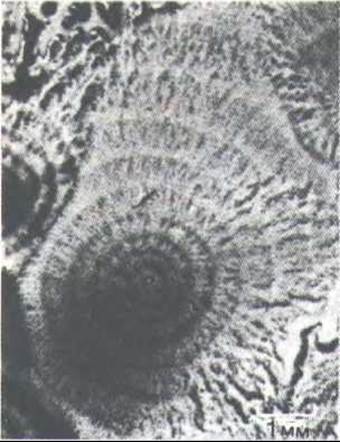
Рис. 14-62. «Волны» голодающих амеб Dictyostelium, движущихся к центру агрегации. При таком малом увеличении отдельные амебы не видны. (Световая микрофотография; с любезного разрешения Günter Gerisch.)

Рис. 14-63. Иммунологический метод идентификации белков плазматической мембраны, участвующих в межклеточной адгезии. На этапе 1 получают антитела (обычно кроличьи) к исследуемым клеткам или к их изолированным плазматическим мембранам. На этапе 2 выделяют и тестируют моновалентные фрагменты, чтобы получить препарат антитела, блокирующий межклеточную адгезию. (Используются моновалентные фрагменты, полученные с помощью протеаз - см. разд. 18.2.4), так как они не сшивают клетки и, таким образом, не вызывают «ложной» адгезии.
Для выявления молекул клеточной поверхности, участвующих в межклеточной адгезии, белки плазматической мембраны солюбилизируют, отделяют друг от друга и каждую фракцию испытывают на способность нейтрализовать действие фрагментов антител, блокирующее агрегацию клеток (этапы 3 и 4). Затем фракции, проявившие такую способность, очищают и вновь тестируют до тех пор, пока не будет получен чистый белок (этот процесс на схеме не показан). Другой Иммунологический подход состоит в получении большого числа моноклональных антител (разд. 4.5.4) к антигенам клеточной поверхности и их скрининге для выявления тех, которые будут блокировать межклеточную адгезию. Оба иммунологических метода основаны на важном общем наблюдении: простое нанесение на клеточную поверхность антител само по себе не препятствует нормальной клеточной адгезии; адгезия блокируется только тогда, когда мишенями для связывания антител служат специфические молекулы клеточной поверхности, участвующие в адгезии.
К сожалению, такая возможность изучать процессы клеточного узнавания в ходе развития многоклеточных животных представляется редко. Обычно мы можем в лучшем случае диссоциировать клетки формирующейся ткани, а затем испытывать их способность вновь объединяться in vitro. В отличие от тканей взрослого организма, которые трудно разделить на отдельные клетки, эмбриональные ткани позвоночных легко диссоциируют при воздействии малых концентраций прогеолигического фермента трипсина, иногда в сочетании с удалением внеклеточного кальция с помощью подходящего хелатора (например, ЭДТА). Эти воздействия нарушают межбелковые взаимодействия (многие из которых зависят от Са2+, см. разд. 14.3.7), удерживающие клетки вместе. Поразительно то, что такие диссоциированные клетки часто вновь объединяются in vitro в структуры, напоминающие исходную ткань. Таким образом, структура ткани не является только результатом процесса развития, а активно поддерживается и стабилизируется системой взаимного сродства клеток друг к другу и к внеклеточному матриксу. Поэтому можно надеяться, что изучение реагрегации диссоциированных клеток в культуре поможет выяснить роль адгезии между клетками и между клетками и матриксом в создании и поддержании организации тканей.
В этом смысле поучительны эксперименты на культивируемых клетках эпидермиса (эпителия кожи). В этой ткани решающую роль в удерживании вместе клеток, называемых кератиноцитами, в многослойном пласте на базальной мембране играют Са2+-зависимые адгезионные системы. Кератиноциты в базальном слое кожи - относительно недифференцированные клетки, они быстро пролиферируют и поставляют новые клетки в верхние слои, где клеточные деления прекращаются и происходит окончательная дифференцировка (разд. 17.4.2). Помещенные на подходящий субстрат в культуре, диссоциированные кератиноциты будут точно так же делиться и дифференцироваться. Однако если в культуре поддерживать концентрацию Са2+ ниже нормы, то Са2+-зависимые адгезионные системы не смогут действовать и кератиноциты будут расти в виде монослоя, где перемещаны как делящиеся, так и дифференцирующиеся клетки. Если затем повысить концентрацию Са2+, то пространственная организация клеток вскоре изменится; монослой преобразуется в многослойный эпителий, где пролиферирующие клетки образуют базальный слой, прилегающий к субстрату, а дифференцирующиеся клетки выделяются в верхние слои, так же как и в нормальной коже. Это позволяет предполагать, что послойное расположение кератиноцитов в зависимости от состояния их дифференцировки поддерживается Са2+-зависимыми механизмами межклеточной адгезии (см. рис. 14-68).
14.3.5. Реагрегация диссоциированных клеток позвоночных зависит от тканеспецифических систем узнавания [32]
При нормальном развитии большинства тканей не встречается сортировка случайно перемешанных клеток разных типов (разд. 16.4). Тем не менее, если диссоциированные эмбриональные клетки из двух разных тканей позвоночного, например из печени и сетчатки, перемешать, то эти агрегаты из перемешанных клеток будут постепенно рассортировываться в соответствии с тканевой принадлежностью клеток. Такой тест, по-видимому, выявляет тканеспецифические системы межклеточного узнавания, которые удерживают вместе клетки в развивающейся ткани. Подобные системы узнавания можно продемонстрировать и другим способом. Как показано на рис. 14-65, диссоциированные клетки легче слипаются с агрегатами своей собственной ткани, чем с агрегатами других тканей. Таким образом, два разных теста - определение степени сродства клеток в опытах с длительной инкубацией (рассортировка клеток) и оценка тенденции клеток присоединяться к уже имеющимся агрегатам - дают сходный результат.
Какова молекулярная основа такой избирательной межклеточной адгезии у позвоночных? По-видимому, здесь, как и у слизевиков, ответственны два разных механизма межклеточной адгезии, один из которых Са2+-независимый, а другой - Са2+-зависимый, и в каждом из них участвует особое семейство гомологичных гликопротеинов клеточной поверхности.

Рис. 14-64. Три возможных способа взаимодействия между молекулами клеточной поверхности в процессе межклеточной адгезии.

Рис. 14-65. Тканеспецифическая адгезивность диссоциированных эмбриональных клеток позвоночных по данным теста со связыванием радиоактивных клеток. Адгезивность можно оценить, определив число меченых клеток, связавшихся с клеточными агрегатами за тот или иной промежуток времени. Склонность к адгезии выше между клетками одного типа. В часто используемой модификации этого теста клетки метят флуоресцентным или радиоактивным маркером и исследуют их связывание с монослоем немеченых клеток в культуре.
14.3.6. У позвоночных в Са2+-независимой межклеточной адгезии участвуют гликопротеины плазматической мембраны из суперсемейства иммуноглобулииов; таковы, например, молекулы адгезии нервных клеток (N-CAM)
Для идентификации некоторых гликопротеинов клеточной поверхности, участвующих в межклеточной адгезии у позвоночных, был использован иммунологический метод, представленный на рис. 14-63. В одном из наиболее изученных примеров были получены фрагменты моновалентного антитела к клеткам сетчатки куриного эмбриона. Затем были отобраны антитела, ингибирующие реагрегацию этих клеток in vitro. Мембранные белки клеток сетчатки были затем фракционированы и испытаны на способность нейтрализовать блокирующую активность антител. Таким путем был идентифицирован крупный (около 1000 аминокислотных остатков) трансмембранный гликопротеин, названный молекулой адгезии нервных клеток (N-CAM). N-CAM экспрессируется на поверхности нервных и глиальных клеток (разд. 19.1.6), «склеивая» их при участии Са2+-независимого механизма. Если такие мембранные белки очистить и ввести в синтетические фосфолипидные пузырьки, то эти пузырьки будут склеиваться друг с другом, а также с клетками, имеющими N-CAM на своей поверхности; однако склеивание блокируется, если клетки предварительно обработать моновалентными антителами к N-CAM. Это указывает на то, что N-CAM связывает клетки друг с другом с помощью гомофильного взаимодействия, непосредственно соединяющего две молекулы N-CAM(CM. рис. 14-64).
Антитела к N-CAM нарушают нормальный ход развития сетчатки в тканевой культуре, а при введении в развивающийся глаз цыпленка препятствуют нормальному росту аксонов нервных клеток сетчатки. Как мы увидим позже (разд. 19.7.8), это позволяет предполагать, что N-CAM играет важную роль в развитии центральной нервной системы, способствуя межклеточной адгезии. Кроме того, клетки нервного гребня, формирующие периферическую нервную систему, находясь в составе нервной трубки, имеют большое количество N-CAM на своей поверхности и теряют его при миграции. Но когда они агрегируют, образуя ганглии, N-CAM появляется вновь (см. рис. 14-56), что указывает на важную роль N-CAM в построении ганглия. N-CAM экспрессируется также во время критических стадий в развитии многих ненервных тканей, где, как полагают, эти молекулы способствуют удержанию вместе специфических клеток.
Существует несколько форм N-CAM, каждая из которых кодируется отдельной мРНК. Разные мРНК образуются при альтернативных вариантах сплайсинга РНК-транскрипта одного и того же крупного гена. У большинства форм N-CAM большая внеклеточная часть полипептидной цепи (около 680 аминокислотных остатков) идентична и организована в виде пяти доменов, гомологичных доменам иммуноглобулинов, характерным для молекул антител (разд. 18.3.3). Таким образом, N-CAM принадлежит к тому же древнему суперсемейству «белков узнавания», что и антитела (разд. 18.6.20). Разные формы N-CAM различаются главным образом сегментами, связанными с мембраной, и цитоплазматическими доменами и поэтому могут по-разному взаимодействовать с цитоскелетом; в самом деле, одна из форм не пронизывает липидный бислой и соединена с плазматической мембраной только ковалентной связью с фосфатидилинозитолом (разд. 8.6.13) (рис. 14-66), в то время как другая секретируется и встраивается во внеклеточный матрикс. Каковы функциональные различия всех этих форм, не известно.
У позвоночных находят все больше гликопротеинов клеточной поверхности, осуществляющих Са2+-независимую межклеточную адгезию, которые принадлежат к суперсемейству иммуноглобулинов. Однако не все поверхностные белки, участвующие в такой адгезии, относятся к этому суперсемейству; например, те, которые функционируют только в присутствии внеклеточных ионов Са2+, принадлежат к другому семейству.
14.3.7. Кадгерины - семейство гомологичных гликопротеинов клеточной поверхности - осуществляют у позвоночных Са2+-зависимую межклеточную адгезию [34]
Иммунологические методы, представленные на рис. 14-63, сыграли также решающую роль в открытии трех родственных гликопротеинов клеточной поверхности, называемых кадгеринами, которые участвуют в Са2+-зависимой межклеточной адгезии у позвоночных. Е-кадгерин имеется на поверхности многих эпителиальных клеток (и в клетках зародышей млекопитающих до имплантации), N-кадгеринка поверхности нервных клеток, клеток сердца и хрусталика, а Р-кадгерин — на. клетках плаценты и эпидермиса; как и N-CAM, все они иногда встречаются и в других тканях в процессе развития. Эти три кадгерина являются гомологичными трансмембранными гликопротеинами, лишь однократно проходящими через мембрану (каждый из них состоит примерно из 700 аминокислотных остатков), и в этом отношении они сходны с N-CAM. Однако в отсутствие Са2+ конформация кадгеринов сильно изменяется и поэтому они быстро расщепляются протеолитическими ферментами. Поскольку некоторые клетки, например эндотелиальные, проявляют Са2+-зависимую адгезию, но при этом не экспрессируют ни одного из трех известных кадгеринов, можно ожидать, что будут открыты новые представители семейства кадгеринов.
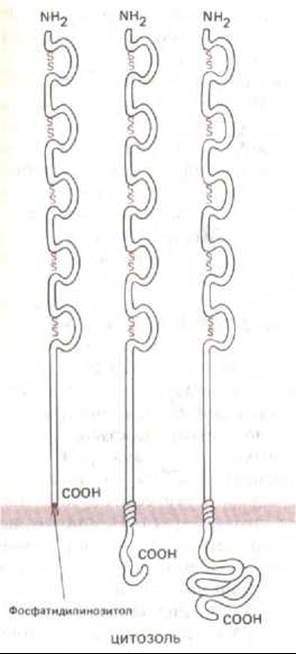
Рис. 14-66. Схематическое изображение трех форм N-CAM. Во всех трех случаях внеклеточная часть полипептидной цепи одинакова и организована в виде пяти доменов, сходных с доменами иммуноглобулинов. Каждый такой домен представляет собой петлю, концы которой связаны дисульфидными мостиками. (По данным В. A. Cunningham et al. Science 236: 799-800, 1987. Copyright 1987 by the AAAS.)
Лучше всех охарактеризован Е-кадгерин, называемый также молекулой адгезии печеночных клеток (L-CAM) или увоморулином. Большая внеклеточная часть его полипептидной цепи образует три гомологичных домена, по всей видимости не родственных доменам иммуноглобулинов. Вероятно, он играет важную роль в скреплении клеток различных эпителиев. Например, Са2+-зависимая реагрегация диссоциированных эпителиальных клеток печени блокируется антителами к Е-кадгерину. В зрелых эпителиальных тканях Е-кадгерин обычно концентрируется в адгезионных поясах, где он, как полагают, служит трансмембранным линкером, связывающим кортикальные актиновые цитоскелеты клеток, удерживая их вместе (разд. 14.1.3). Он также участвует в компактизации бластомеров в раннем зародыше мыши (разд. 16.2.4). Во время компактизации вначале рыхло расположенные бластомеры прижимаются друг к другу, плотно упаковываются и связываются межклеточными соединениями. Антитела к Е-кадгерину блокируют компактизацию бластомеров, тогда как антитела, реагирующие со многими другими поверхностными молекулами этих клеток, не оказывают такого действия.
Кажется вероятным, что кадгерины играют ключевую роль и на более поздних стадиях развития позвоночных, так как их появление и исчезновение коррелирует с важными морфогенетическими событиями, при которых ткани отграничиваются друг от друга. Например, по мере формирования нервной трубки и отделения ее от покровной эктодермы (разд. 16.1.9) в клетках развивающегося нервного эпителия исчезает Е-кадгерин и появляется N-кадгерин (а также и N-CAM) (рис. 14-67). Когда клетки нервного гребня мигрируют из нервной трубки, они теряют N- кадгерин (как и N-CAM, см. выше), но вновь начинают вырабатывать его позднее, при формировании нервного ганглия (см. рис. 14-56).
Биологическое значение поразительной зависимости белков межклеточной адгезии из семейства кадгеринов от концентрации ионов кальция не известно. Например, еще нет никаких данных о том, что для контроля межклеточной адгезии в процессе развития осуществляется регуляция внеклеточной концентрации кальция.
14.3.8. Молекулы клеточной поверхности, участвующие в адгезии между клетками и между клетками и матриксом, можно рассматривать как элементы морфогенетического кода [35]
Цитофизиологические, морфологические и биохимические исследования указывают на то, что клетка даже одного определенного типа использует много различных молекулярных механизмов прикрепления к другим клеткам и к внеклеточному матриксу. Некоторые из этих механизмов связаны со специализированными межклеточными соединениями, а другие - нет (рис. 14-68). Поскольку отдельная клетка использует большое число адгезивных систем, почти у каждого типа клеток найдется хотя бы одна система межклеточной адгезии, общая с любым другим типом, и поэтому все клетки будут обладать некоторым сродством Друг к другу. Обычно клетки разных тканей (и даже от весьма далеких видов) способны образовывать друг с другом десмосомы, щелевые контакты и адгезионные соединения. Это позволяет предполагать, что участвующие в таких соединениях белки высококонсервативны (идет ли речь о разных тканях или видах). Однако точно так же, как каждая клетка многоклеточного животного содержит определенный набор поверхностных рецепторов, дающий ей возможность специфическим образом реагировать на комплементарный набор растворимых сигнальных молекул (гормонов или локальных медиаторов), так и каждая клетка в ткани обладает определенной комбинацией (или концентрацией) рецепторов, позволяющих ей связываться определенным специфическим образом с другими клетками или с внеклеточным матриксом.
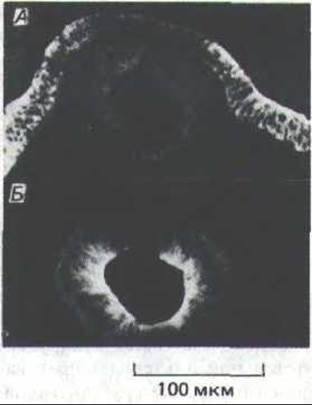
Рис. 14-67. Иммунофлуоресцентные микрофотографии поперечного среза куриного эмбриона: развивающаяся нервная трубка помечена антителами к Е-кадгерину (А) и к N-кадгерину (5). Обратите внимание, что клетки лежащей выше эктодермы содержат только Е-кадгерин, а клетки нервной трубки утратили Е-кадгерин, но в них появился N-кадгерин. (С любезного разрешения Kohei Hatta и Masatoshi Takeichi.)

Рис. 14-68. Обобщенная схема адгезионных механизмов, используемых типичными эпителиальными клетками для прикрепления друг к другу и к внеклеточному матриксу (базальной мембране). Слева представлены механизмы с участием специализированных областей, видимых при электронной микроскопии обычных препаратов и (или) препаратов, полученных методом замораживания-скалывания. Справа иные механизмы. В некоторых случаях в соединении клеток между собой или с матриксом при помощи тех и других механизмов участвуют одни и те же гликопротеины клеточной поверхности. Как указывалось в тексте, все специализированные адгезионные механизмы, за исключением щелевых контактов, являются Са2+-зависимыми; из остальных адгезионных механизмов лишь некоторые зависимы от Са2+
В отличие от рецепторов для растворимых веществ, которые связывают свои специфические лиганды с высоким сродством, рецепторы, связывающие молекулы клеточной поверхности или внеклеточного матрикса, осуществляют это с относительно низким сродством. Поэтому действие этих рецепторов основано на многократном увеличении силы связывания за счет одновременного соединения многих рецепторов со многими лигандами соседней клетки или внеклеточного матрикса. Поскольку у каждых двух клеток имеется некоторый спектр специфических рецепторов адгезии для других клеток и для матрикса, а также их концентраций и распределения по клеточной поверхности, то это и будет определять суммарное сродство, с которым клетки связываются друг с другом и с матриксом. Можно полагать, что именно этот спектр и есть тот «морфогенетический код», который определяет, как клетки будут организованы в ткани. Поскольку животные клетки даже близко родственных типов правильно рассортировываются in vitro, они должны быть способны определять относительно малые различия в адгезивных свойствах и использовать эти различия для установления лишь наиболее адгезивных из многих возможных контактов с другими клетками и матриксом. Наблюдения над подвижными клетками в культуре позволяют предполагать, как бы это могло осуществляться.
14.3.9. Высокоподвижные клетки служат чувствительными детекторами малых различий в адгезивности [36]
Клетки, участвующие в морфогенетических процессах у зародыша, часто очень подвижны. Если такие клетки диссоциировать и поместить в культуральную чашку, то вначале они будут по всем направлениям выпускать микрошипы и ламеллоподии, а затем активно расползаться по поверхности чашки. Эта подвижность часто совпадает с появлением различий между клетками и, следовательно, с периодом, когда важную роль должны будут играть процессы клеточного узнавания. Например, в зародыше Xenopus клетки внезапно становятся очень подвижными на стадии перехода к средней бластуле, когда начинается транскрипция генов (разд. 16.1.2).
Интенсивное изучение клеточной подвижности проводилось на культурах фибробластов, нейтрофилов и регенерирующих нейронов. Его результаты, суммированные в гл. И, указывают на то, что подвижные клетки являются чрезвычайно чувствительными детекторами малых различий в адгезивности. Микрошипы и ламеллоподии, выпускаемые во всех направлениях, по-видимому, участвуют в процессе «перетягивания каната», в результате которого клетка поляризуется и уверенно движется в направлении наиболее адгезивной части субстрата, даже если различия в адгезивности очень малы (разд. 11.6.3). Фибробласты, например, будут неуклонно двигаться вверх по малому градиенту адгезивности, создавшемуся на поверхности культуральной чашки. Изучение хемотаксиса у нейтрофилов позволяет предполагать, что подвижная клетка способна выявлять различия в адгезивности по обеим сторонам клетки всего лишь в 1%. Подобным же образом клетки в тканях могли бы с высокой чувствительностью расшифровывать «морфогенетический код» на клеточных поверхностях, уверенно двигаясь для установления тесного контакта с теми "из соседних клеток, к которым они наиболее адгезивны.
14.3.10. Временные контакты могут инициировать тканеспецифическую межклеточную адгезию, которая затем стабилизируется контактами соединительного комплекса [37]
Какие из многочисленных типов межклеточных соединений, описанных в начале этой главы, могли бы осуществляться при миграции клеток и их взаимном узнавании при формировании тканей и органов? Чтобы выяснить это, можно использовать электронную микроскопию при изучении контактов между соседними клетками во время их передвижения в развивающемся зародыше или в зрелых тканях при репарации повреждений. Такие исследования показывают, что эти контакты, как правило, не приводят к формированию организованных межклеточных соединений. Тем не менее контактирующие мембраны часто тесно прижимаются друг к другу и располагаются параллельно, разделенные щелью в 10-20 нм. Именно на такое расстояние (около 13 нм) выступает из плазматической мембраны гемагглютинин вируса гриппа - первый гликопротеин плазматической мембраны, у которого была установлена трехмерная структура (разд. 8.6.12). Гликопротеины двух соседних плазматических мембран могут взаимодействовать друг с другом через щель в 10-20 нм, осуществляя адгезию. Такой тип временного контакта может быть оптимальным для клеточной локомоции-достаточно тесный для сцепления, но не настолько плотный, чтобы клетка не могла передвигаться.
Поскольку контакты соединительного комплекса между подвижными эмбриональными клетками не видны (за исключением, возможно, небольших щелевых контактов), формирование межклеточных соединений может быть важным механизмом иммобилизации клеток внутри организованной ткани, когда она уже сформировалась. Разумная гипотеза состоит в том, что временная адгезия белков клеточной поверхности приводит к тканеспецифической межклеточной адгезии, которая затем стабилизируется в результате образования межклеточных соединений. Поскольку многие из трансмембранных гликопротеинов, участвующих в этом процессе, способны диффундировать в плоскости плазматической мембраны, они могут накапливаться в местах межклеточного контакта и, таким образом, использоваться как для временной адгезии, так и для формирования специализированных соединительных структур. Так, некоторые белки межклеточной адгезии, например Е-кадгерины (разд. 14.3.7), могут способствовать инициации межклеточной адгезии, а позднее становиться составной частью межклеточных соединений.
Чтобы расшифровать правила узнавания и связывания, используемые в морфогенезе сложных тканей, идеальной была бы возможность инактивировать различные типы белков-рецепторов межклеточной адгезии и адгезии между клетками и матриксом индивидуально и в различных комбинациях. По мере того как возрастает число охарактеризованных моноклональных антител и белковых фрагментов, каждый из которых блокирует один-единственный тип молекулы межклеточной адгезии или рецептора матрикса, и по мере того как гены, кодирующие эти белки клеточной поверхности, становятся доступными для использования in vitro и в трансгенных животных, эта мечта биологов развития становится реальностью.
Заключение
Диссоциированные и перемешанные клетки разных эмбриональных тканей позвоночных вновь ассоциируют предпочтительно с клетками той же ткани. Первоначальные трудности при изучении молекулярных механизмов, лежащих в основе нормальной организации клеток в сложные ткани у высших животных, стимулировали переход к изучению более простых систем. Свободноживущие миксамебы клеточного слизевика Dictyostelium discoideum при голодании агрегируют с образованием многоклеточных плодовых тел. Их межклеточная адгезия осуществляется по меньшей мере двумя гликопротеинами клеточной поверхности: один действует в раннем развитии и зависит от концентрации внеклеточного кальция, а другой - в более поздней стадии и не требует присутствия кальция. Процесс тканеспецифического узнавания у позвоночных, возможно, тоже осуществляется гликопротеинами клеточной поверхности по меньшей мере двух семейств: члены одного-Са2+-зависимые (кадгерины), другого-Сa2+-независимые (представленные N-CAM и другими членами суперсемейства иммуноглобулинов). Оба семейства молекул межклеточной адгезии, по-видимому, играют важную роль в управлении морфогенезом позвоночных. Поскольку клетки даже одного типа используют различные молекулярные механизмы слипания друг с другом (и с внеклеточным матриксом), специфичность межклеточной адгезии, наблюдаемая в эмбриональном развитии, должна быть суммарным результатом сродства большого числа разных адгезионных систем. Проявляемая подвижными клетками способность определять малые различия в адгезивности позволяет представить себе, каким образом специфические комбинации, концентрации и распределение молекул межклеточной адгезии и рецепторов для матрикса, имеющиеся у клеток каждого типа могли бы использоваться в качестве необходимого «морфогенетического кода».
Литература
Цитированная
1. Bock G., Clark S., eds. Junctional Complexes of Epithelial Cells. Ciba Symposium 125, New York, Wiley, 1987.
Farquhar M. G., Palade G. E. Junctional complexes in various epithelia. J. Cell Biol., 17, 375-412, 1963.
Gilula N. B. Junctions between cells. In: Cell Communication (R. P. Cox, ed), pp. 1-29. New York, Wiley, 1974.
Goodenough D. A., Revel J. P. A fine structural analysis of intercellular junctions in the mouse liver. J. Cell Biol., 45, 272-290, 1970.
Staehelin L.A., Hull В. Е. Junctions between living cells. Sci. Am., 238(5), 141 152, 1978.
2. Diamond J. M. The epithelial junction: bridge, gate and fence. Physiologist, 20, 10-18, 1977.
Madara J. L. Tight junction dynamics: is paracellular transport regulated? Cell, 53, 497-498, 1988.
Madara J. L., Dharmsathaphorn K. Occluding junction structure-function relationships in cultured epithelial monolayer. J. Cell Biol., 101, 2124-2133, 1985.
Simons K., Fuller S. D. Cell sufrace polarity in epithelia. Annu. Rev. Cell Biol., 1, 243-288, 1985. van Meer G., Gumbiner В., Simons K. The tight junction does not allow lipid molecules to diffuse from one epithelial cell to the next. Nature, 322, 639-641, 1986.
3. Burridge K., Fath K., Kelly Т., Nuckolls G., Turner C. Focal adhesions: transmem-brane junctions between the extracellular matrix and the cytoskeleton. Annu. Rev. Cell Biol., 4, 487-526, 1988.
Geiger В., Volk Т., Volberg T. Molecular heterogeneity of adherens junctions. J. Cell Biol., 101, 1523-1531, 1985.
4. Franks W. W., Cowin P., Schmelz M., Kuppell H.-P. The desmosomal plaque and the cytoskeleton. In: Junctional Complexes of Epithelial Cells.
Ciba Foundation Symposium 125 (G. Bock, S. Clark, eds.), pp. 26-48, New York, Wiley, 1987. Garrod D. R. Desmosomes, cell adhesion molecules and the adhesive properties of cells in tussues. J. Cell Sci. Suppl. 4, 221-237, 1986.
Jones J. C. R., Yokoo K. M., Goldman R. D. Further analysis of pemphigus autoanti-bodies and their use in studies on the heterogeneity, structure, and function of desmosomes. J. Cell Biol., 102, 1109-1117, 1986.
Steinberg M. S. et al. On the molecular organization, diversity and functions of desmosomal proteins. In: Junctional Complexes of Epithelial Cells. Ciba Foundation Symposium 125 (G. Bock, S. Clark, eds.), pp. 3-25. New York, Wiley, 1987.
5. Bennett M., Spray D., eds. Gap Junctions. Cold Spring Harbor, NY, Cold Spring Harbor Laboratory, 1985.
Furshpan E. J., Potter D. D. Low-resistance junctions between cells in embryos and tissue culture. Curr. Top. Dev. Biol., 3, 95-127, 1968. Giluda N. В., Reeves O. R., Steinbach A. Metabolic coupling, ionic coupling and cell contacts. Nature, 235, 262-265, 1972.
Hooper M. L., Subak-Sharpe J. H. Metabolic cooperation between cells. Int. Rev. Cytol., 69, 45-104, 1981.
Loewenstein W.R. The cell-to-cell channel of gap junctions. Cell, 48, 725-726, 1987. Neyton J., Trautmann A. Single-channel currents of an intercellular junction. Nature, 317, 331-335, 1985.
Pitts J.D., FinbowM.E. The gap junction. J. Cell Sci., Suppl. 4, 239-266, 1986.
Young J. D.-E., Cohn Z. A., Gilula N. B. Functional assembly of gap junction conductance in lipid bilayers: demonstration that the major 27 kd protein forms the Junctional channel. Cell, 48, 733-743, 1987.
6. Caspar D. L. D., Goodenough D., Makowski L., Phillips W. C. Gap junction structures. I. Correlated electron microscopy and X-ray diffraction.
J. Cell Biol., 74, 605-628, 1977.
Gilula N. B. Topology of gap junction protein and channel function. In: Junctional Complexes of Epithelial Cells. Ciba Foundation Symposium
125 (G. Bock, S. Clark, eds.), pp. 128-139, New York, Wiley, 1987.
Paul D. L. Molecular cloning of cDNA for rat liver gap junction protein. J. Cell Biol., 103, 123-134, 1986.
Unwin P. N. Т., Zampighi G. Structure of the junction between communicating cells. Nature, 283, 545-549, 1980.
7. Caveney S. The role of gap junctions in development. Annu. Rev. Physiol., 47, 318-335, 1985.
Warner A. E. The role of gap junction in amphibian development. J. Embryol. Exp. Morphol. Suppl. 89, 365-380, 1985.
Warner A. E., Guthrie S.C., GilulaN.B. Antibodies to gap-junctional protein selectively disrupt junctional communication in the early amphibian embryo. Nature, 311, 127-131, 1984.
8. Rose В., Loewenstein W. R. Permeability of cell junction depends on local cytoplas-mic calcium activity. Nature, 254, 250-252, 1975.
Saez S. C. et. al. Cyclic AMP increases junctional conductance and stimulates phosphorylation of the 27-kDa principal gap junction polypeptide. Proc. Natl. Acad. Sci. USA, 83, 2473-2477, 1986.
Spray D. C., Bennett M. V. L. Physiology and pharmacology of gap junctions. Annu. Rev. Physiol., 47, 218-303, 1985.
Turin L., Warner A. E. Intracellular pH in early Xenopus embryo: its effect on current flow between blastomeres. J. Physiol. (Lond.), 300, 489504, 1980.
9. Hay E.D., ed. Cell Biology of Extracellular Matrix. New York, Plenum, 1981. McDonald J. A. Extracellular matrix assembly. Annu. Rev. Cell Biol., 4, 183-208, 1988.
Piez K. A., Reddi A. H., eds. Extracellular Matrix Biochemistry. New York, Elsevier, 1984.
10. Evered D., Whelan J., eds. Functions of the Proteoglycans, Ciba Foundation Symposium 124. New York, Wiley, 1986.
Hascall V. C., Hascall G. K. Proteoglycans. In: Cell Biology of Extracellular Matrix (E.D. Hay, ed.), pp. 39-63. New York, Plenum, 1981. Wight T. N.. Meeham R. P., eds. Biology of Proteoglycans. San Diego, CA, Academic Press, 1987.
11. Laurent T.C., Eraser J. R. E. The properties and turnover of hyaluronan. In: Functions of the Proteoglycans. Ciba Foundation Symposium 124 (D. Evered, J. Whelan, eds.), pp. 9-29. New York, Wiley, 1986.
Toole B. P. Glycosaminoglycans in Morphogenesis. In: Cell Biology of Extracellular Matrix (E.D. Hay, ed.), pp. 259-294. New York, Plenum, 1981.
12. Dorfman A. Proteoglycan biosynthesis. In: Cell Biology of Extracellular Matrix (E.D. Hay, ed.), pp. 115-138. New York, Plenum, 1981.
Hassell J. R., Kimura J. H., Hascall V. C. Proteoglycan core protein families. Annu. Rev. Biochem., 55, 539-567, 1986.
Heinegärd D., Paulsson M. Structure and metabolism of proteoglycans. In: Extracellular Matrix Biochemistry (K. A. Piez, A. H. Reddi, eds.), pp. 277-328. New York, Elsevier, 1984.
Ruoslahti E. Structure and biology of proteoglycans. Annu. Rev. Cell Biol., 4, 229-255, 1988.
13. FranssonL.-A. Structure and function of cell-associated proteoglycans. Trends Biochem. Sci., 12, 406-411, 1987.
Höök M., Kjjellen L., Johansson S., Robinson J. Cell-surface glycosaminoglycans. Annu. Rev. Biochem., 53, 847-869, 1984.
Rees D. A. Polysaccharide Shapes, Outline Studies in Biology, pp. 62-73. London, Chapman and Hall, 1977.
Scott J. E. Proteoglycan-collagen interactions. In: Functions of the Proteoglycans. Ciba Foundation Symposium 124 (D. Evered, J. Whelan, eds.), pp. 104-124. New York, Wiley, 1986.
14. BurgesonR.E. New collagens, new concepts. Annu. Rev. Cell Biol., 4, 551-577, 1988.
Linsenmayer T. F. Collagen. In: Cell Biology of Extracellular Matrix (E. D. Hay, ed.), pp. 5-37. New York, Plenum, 1981.
Martin G. R., Timpl R., Muller P. K., Ktihn K. The genetically distinct collagens. Trends Biochem. Sci., 10, 285-287, 1985.
15. Fleischmajer R., Olsen B.R., Ktihn K., eds. Biology, Chemistry, and Pathology of Collagen. Ann. N.Y. Acad. Sci., Vol. 460, 1985.
OlsenB. R. Collagen Biosynthesis. In: Cell Biology of Extracellular Matrix (E.D. Hay, ed.), pp. 139-177. New York, Plenum, 1981.
Woolley D. E. Mammalian collagenases. In: Extracellular Matrix Biochemistry (K.A. Piez, A.H. Reddi, eds.), pp. 119-157. New York, Elsevier, 1984.
16. Eyre D.R., Paz M.A., Gallop P.M. Cross-linking in collagen and elastin. Annu. Rev. Biochem., 53, 717-748, 1984.
Piez K. A. Molecular and aggregate structures of the collagens. In: Extracellular Matrix Biochemistry (K.A. Piez, A.H. Reddi, eds.), pp. 1-39. New York, Elsevier, 1984.
17. Prockop D.J., Kivirikko K.I. Heritable diseases of collagen. New Engl. J. Med., 311, 376-386, 1984.
Trelstad R. L., Silver F. H. Matrix assembly. In: Cell Biology of Extracellular Matrix (E. D. Hey, ed.), pp. 179 215. New York, Plenum, 1981.
18. Stopak D., Harris A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol., 90, 383-398, 1982.
19. Yurchenco P.O., Furthmayr H. Self-assembly of basement membrane collagen, Biochemistry, 23, 1839-1850, 1984.
Yurchenco P. D., Ruben G. C. Basement membrane structure in situ: evidence for lateral associations in the type IV collagen network. J. Cell Biol., 105, 2559-2568, 1987.
20. Cleary E. G., Gibson M. A. Elastin-associated microfibrils and microfibrillar proteins. Int. Rev. Connect. Tissue Res., 10, 97-209, 1983.
Gosline J. M., Rosenbloom J. Elastin. In: Extracellular Matrix Biochemistry (K.A. Piez, A.H. Reddi, eds.), pp. 191 227. New York, Elsevier, 1984.
Ross R., Bornstein P. Elastic fibers in the body. Sci. Am., 224(6), 44 52, 1971.
21. Dufour S., Duband J.-L., Kornblihtt A. R., ThieryJ.P. The role of fibronectins in embryonic cell migrations. Trends Genet., 4, 198-203, 1988. Hynes R.O. Molecular biology of fibronectin. Annu. Rev. Cell Biol., 1, 67-90, 1985. Hynes R.O. Fibronectins. Sci. Am., 254(6), 42-51, 1986. Hynes R. O., Yamada K. M. Fibronectins: multifunctional modular proteins. J. Cell Biol., 95, 369-377, 1982.
Ruoslahti E., Pierschbacher M. D. New perspectives in cell adhesion: RGD and integrins. Science, 238, 491-497, 1987.
22. Humphries M. J., Akiyama S. K., Komoriya A., Olden K., Yamada K. M. Neurite extension of chicken peripheral nervous system neeurons on fibronectin: relative importance of specific adhesion sites in the central cell-binding domain and the alternatively spliced type III connecting segment. J. Cell Biol., 106, 1289-1297, 1988.
Tamkun J. W., Schwarzbauer J. E., Hynes R. 0. A single rat fibronectin gene generates three different mRNAs by alternative splicing of a complex exon. Proc. Natl. Acad. Sci. USA, 81, 5140-5144, 1984.
23. Farquhar M. G. The glomerular basement membrane: a selective macromolecular filter. In: Cell Biology of Extracellular Matrix (E.D. Hay, ed.), pp. 335-378. New York, Plenum, 1981.
Martin G. R., Timpl R. Laminin and other basement membrane components. Annu. Rev. Cell Biol., 3, 57-85, 1987.
Sasaki M., Kato S., Kohno K., Martin G. R., Yamada Y. Sequence of the cDNA encoding the laminin Bl chain reveals a multidomain protein contaning cysteine-rich repeats. Proc. Natl. Acad. Sci. USA, 84, 935 939, 1987.
24. Reist N.E., Magill C., McMahan U.J. Agrin-like molecules at synaptic sites in normal denervated and damaged skeletal muscles. J. Cell Biol., 105, 2457-2469, 1987.
25. Anderson D. C., Springer T.A. Leukocyte adhesion deficiency: an inherited defect in the Mac-1, LFA-1 and PI50,95 glycoprotein. Annu. Rev. Med., 38, 175-194, 1987.
Buck C.A., Horwitz A.F. Cell surface receptors for extracellular matrix molecules. Annu. Rev. Cell Biol., 3, 179-205, 1987.
Hynes R.O. Integrins: a family of cell surface receptors. Cell, 48, 549-554, 1987. Ruoslahti E. Fibronectin and its receptors. Annu. Rev. Biochem., 57, 375-414, 1988.
26. Bornstein P., Duksin D., Balian G., Davidson J. M., Crouch E. Organization of extracellular proteins on the connective tissue cell surface: relevance to cell-matrix interactions in vitro and in vivo. Ann. N. Y. Acad. Sci., 312, 93-105, 1978.
Burridge K., Path K., Kelly Т., Nuckolls u., Turner C. Focal adhesion: transmem-brane junctions between the extracellular matrix and cytoskeleton. Annu. Rev. Cell Biol., 4, 487-526, 1988.
Horwitz A., Duggan K., Buck C., Beckerle M. C., Burridge K. Interaction of plasma membrane fibronectin receptor with talin-a transmembrane linkage. Nature, 320, 531-533, 1986.
Hyens R. Structural relationships between fibronectin and cytoplasmic cytoskeletal networks. In: Cytoskeletal Elements and Plasma Membrane Organization (G. Poste, G. L. Nicolson, eds.) Vol 7, pp. 100-137. Amsterdam, Elsevier, 1981.
Watt F. T. The extracellular matrix and cell shape. Trends Biochem. Sci., 11, 482-485, 1986.
27. Le Douarin N.. Smith J. Development of the peripheral nervous system from the neural crest. Annu. Rev. Cell Biol., 4, 375-404, 1988.
McClay D. R., Ettensohn C.A. Cell adhesion and morphogenesis. Annu. Rev. Cell Biol., 3, 319-346, 1987.
28. Loomis W. F. Dictyostelium discoideum. A Developmental System. New York, Academic Press, 1975.
29. Banner J. T. Chemical signals of social amoebae. Sci. Am., 248 (4), 114 120, 1983. Gerisch G. Cyclic AMP and other signals controlling cell development and differentiation in Dictyostelium. Annu. Rev. Biochem., 56, 853 879, 1987.
30. Gerisch G. Interrelation of cell adhesion and differentiation in Dictyostelium discoideum. J. Cell Sci., Suppl. 4, 201-219, 1986.
Gerisch G. Univalent antibody fragments as tools for the analysis in Dictyostelium. Curr. Top. Dev. Biol., 14, 243-270, 1980.
31. Hennings H., Holbrook K.A. Calcium regulation of cell-cell contact and differentiation of epidermal cells in culture. An ultrastructural study. Exp. Cell Res., 143, 127-142, 1983.
32. Moscona A.A., Hausman R.E. Biological and biochemical studies on embryonic cell-cell recognition. In: Cell and Tissue Interactions. Society of General Physiologists Series (J. W. Lash, M. M. Burger, eds.), Vol. 32, pp. 173-185. New York, Raven, 1977.
Roth S., Weston J. The measurement of intercellular adhesion. Proc. Natl. Acad. Sci. USA, 58, 974 980, 1967.
33. Cunningham B. A. et al. Neural cell adhesion molecule: structure, immunoglo-bulin-like domains, cell surface modulation, and alternative RNA splicing. Science, 236, 799-806, 1987.
Edelman G. M. Cell-adhesion molecules: a molecular basis for animal form. Sci. Am., 250(4), 118-129, 1984.
Edelman G. M. Cell adhesion molecules in the regulation of animal form and tissue pattern. Annu. Rev. Cell Biol., 2 81-116, 1986.
Rutishauser U., Goridis C. N-CAM: the molecule and its genetics. Trends Genet., 2, 72-76, 1986.
Williams A. F., Barclay A. N. The immunoglobulin superfamily - domains for cell surface recognition. Annu. Rev. Immunol., 6, 381-406, 1988.
34. Takeichi M. The cadherins: cell-cell adhesion molecules controlling animal morphogenesis. Development, 102, 639-655, 1988.
35. Ekblom P., Vestweber D., Kemler R. Cell-matrix interactions and cell adhesion during development. Annu. Rev. Cell Biol., 2, 27 48, 1986.
Garrod D. R. Desmosomes, cell adhesion molecules and the adhesive properties of cells in tissues. J. Cell Sci. Suppl. 4, 221-237, 1986.
Jessel Т. М. Adhesion molecules and the hierarchy of neural development. Neuron, 1, 3-13, 1988.
Steinberg M. S. The adhesive specification of tissue self-organization. In: Morphogenesis and Pattern Formation (T. G. Connelly et al., eds.), pp. 179-203. New York, Raven, 1981.
36. Devereotes P., Zigmond S. H. Chemotaxis in eukaryotic cells. Annu. Rev. Cell Biol., 4, 649-686, 1988.
37. TrinkausJ.P. Cells into Organs, 2nd ed., pp. 69-178, Englewood Cliffs, NJ, Prentice-Hall, 1984.