Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Клеточные механизмы развития
Дрозофила и молекулярная генетика формирования пространственной организации
Вся классическая генетика основана на предположении о том, что строение любого организма контролируется его генами. Роль ДНК в обеспечении наследственности известна уже более ста лет, однако механизмы генетического контроля, которые отвечают за образование нормальной структуры тела взрослых животных, до сих пор остаются неразгаданными. Однако в последние годы этот пробел в наших знаниях начал заполняться. Новые открытия были сделаны главным образом при изучении развития плодовой мушки-дрозофилы. Опыты на дрозофиле привели к открытию класса контролирующих развитие генов, специфическая функция которых состоит в формировании пространственной организации тела. Сочетание подходов классической и молекулярной генетики помогло установить функции этих генов. Далее мы покажем, что общая стратегия формирования пространственной организации тела у позвоночных близка к таковой у дрозофилы, и более того, у позвоночных имеются близкие аналоги генов, контролирующих этот процесс у дрозофилы.
Первые представления о существовании такой генетической системы сформировались под влиянием открытия мутаций, вызывающих причудливые нарушения плана строения тела взрослой дрозофилы. Например, мутация Antennapedia приводит к тому, что на голове вместо антенн растут ноги (рис. 16-53); в результате мутации bithorax вместо придатков, именуемых жужжальцами, появляется дополнительная пара крыльев. Такие мутации, превращающие те или иные части тела в структуры, которые в норме должны находиться в других местах, были названы гомеозисными; нормальные гены, подверженные таким мутациям, называют гомеозисными селекторными генами. Открытие гомеозисных мутантов подтолкнуло к проведению весьма искусных экспериментов, показавших, что тело нормальной мухи формируется наподобие лоскутного одеяла, в каждом из лоскутов-участков которого экспрессируется разный набор гомеозисных селекторных генов. Продукты этих генов служат молекулярными адресами, в первом приближении обеспечивающими клетки позиционными значениями. Гомеозисная мутация, таким образом, нарушает нормальное обеспечение информацией всех клеток данного участка: клетки дезинформируются в отношении своего местоположения и из них формируются структуры. которые в норме располагаются в иных участках тела.

Рис. 16-53. Голова нормальной взрослой дрозофилы (А) и дрозофилы, несущей гомеозисную мутацию Antennapedia. Б. Крайняя форма такой мутации; обычно в структуры ноги превращается только часть антенны. (Рисунок мутанта Antennapedia выполнен по фотографии, предоставленной Peter Lawrence.)
Гомеозисные селекторные гены являются лишь одной из частей сложной генетической системы, ответственной за создание нормальной мозаичной структуры тела насекомого. В этом разделе мы опишем систему в целом и вкратце рассмотрим некоторые из ее молекулярных механизмов. Воспользуемся для этого концепцией формирования пространственной организации, которая обсуждалась в предыдущем разделе. Мы увидим, что эта система состоит из трех классов генов, контролирующих становление пространственной организации:
1) вначале действуют гены полярности яйца, продукты которых определяют пространственные координаты эмбриона, устанавливая градиент морфогена в яйце;
2) гены сегментации интерпретируют позиционную информацию, обеспечиваемую первичными градиентами морфогенов: эти гены размечают зародыш на серию сегментов - основных модулей, из которых состоит тело у всех насекомых;
3) гены сегментации посредством своих продуктов влияют на экспрессию гомеозисных селекторных генов, которые создают различия между сегментами; в результате сочетания активности гомеозисных селекторных генов и генов сегментации клетки каждого сегмента посредством импринтинга запоминают определенные позиционные значения, которые обусловливают их дальнейшее поведение. И, наконец, внутри каждого сегментированного отдела тела возникают межклеточные коммуникации, определяющие самые мелкие детали взрослого организма. В этом клетки руководствуются, по всей вероятности, правилом интеркаляции.
16.5.1. Тело насекомого формируется путем видоизменения основного плана строения, предусматривающего наличие повторяющихся сегментов [45]
Развитие дрозофилы от яйца до взрослой особи представлено на рис. 16-54. Период эмбрионального развития начинается с момента оплодотворения и занимает примерно сутки, в конце которых зародыш вылупляется из яйца и превращается в личинку. Развитие личинки протекает в три стадии, каждую из которых называют возрастом с соответствующим порядковым номером; возраст заканчивается линькой, когда сбрасывается старая кутикула и образуется новая, более просторная. В конце третьего возраста личинка окукливается. Внутри куколки происходит существенная перестройка всех структур и через 9 дней после оплодотворения появляется взрослая муха, или имаго.
Тело мухи состоит из головы, трех грудных (торакальных) сегментов, обозначаемых Т1-Т3, и девяти брюшных (абдоминальных) сегментов, обозначаемых А1-А9. Каждый сегмент характеризуется неким общим планом строения, обладая при этом отдельными только ему присущими чертами. Сегмент Т1, например, снабжен парой ног, Т2 - парой ног и парой крыльев, Т3 - парой ног и парой жужжальцев — небольших булавовидных балансёров, необходимых для обеспечения полета (они образовались в результате эволюции второй пары крыльев, существовавших у более примитивных насекомых). Такая квазиповторяющаяся сегментация более выражена у личинки, у которой сегменты выглядят более унифицированными; на более ранних стадиях (у зародышей) можно видеть, что зачатки головы и участки, формирующие рост взрослого насекомого, также выглядят сегментированными (рис. 16-55). Границы сегментов в данном случае носят несколько условный характер, и на этот счет имеются особые соглашения. При обсуждении характера экспрессии генов мы увидим, что в целом принято говорить о существовании 14 парасегментов (обозначаемых Р1-Р14); это составляет половину числа традиционно определяемых сегментов (рис. 16-56). И, наконец, на обоих концах тела животного расположены высокоспециализированные структуры, не имеющие сегментарного происхождения.
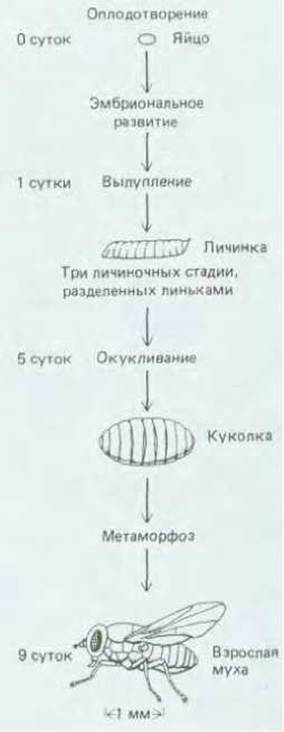
Рис. 16-54. Схема развития дрозофилы от яйца до взрослой мухи.
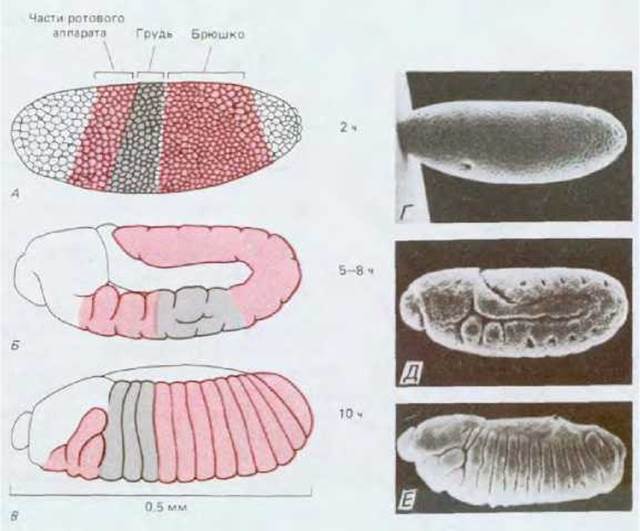
Рис. 16-55. Возникновение сегментов тела дрозофилы в процессе эмбрионального развития. Представлено на рисунках (вид сбоку) (А-В) и на соответствующих микрофотографиях, полученных с помощью сканирующего электронного микроскопа (Г-Е). А, Г - после двухчасового развития эмбрион находится на стадии синцитиальной бластодермы (см. рис. 16-57). Сегментации не наблюдается, хотя уже можно нарисовать (окрашенные участки) карту презумптивных зачатков с расположением будущих сегментов. Б, Д - после 5-8 ч развития эмбрион находится на стадии удлинения зародышевой полоски: произошла гаструляция, начинают появляться сегменты и сегментированная ось тела удлиняется, изгибаясь на хвостовом конце и как-будто принимая форму яйцевой оболочки. В, Е - после 10 ч развития зародыша ось тела сокращается и вновь выпрямляется, все сегменты четко определены; структуры головы, видимые на этой стадии на поверхности личинки, начинают погружаться вглубь последней с тем, чтобы появиться вновь только после окукливания. (Г, Д - с любезного разрешения Rudi Turner, Anthony Mahowald; E - c любезного разрешения Jane Petschek.)

Рис. 16-56. Сегменты личинки дрозофилы и их соответствие участкам бластодермы. Обратите внимание, что концевые области бластодермы соответствуют несегментированным структурам, которые формируют в основном внутренние части личинки, а также сегментированные зачатки ротового аппарата взрослой мухи. Сегментацию у дрозофилы можно описать, используя термины «сегменты» или «парасегменты»; их взаимосвязь указана в нижней части рисунка. До сих пор не установлено точное число сегментов брюшка: наличие восьми доказано, однако, вероятно, имеется и девятый. Мn-мандибула; Мх-максилла; La-губа
Общий план строения всего тела, где представлены два специализированных конца и набор модулируемых повторений основной единицы, возникает в результате процессов, которые происходят в яйце и раннем эмбрионе в первые часы после оплодотворения.
16.5.2. Развитие дрозофилы начинается с образования синцития [46]
Длина яйца дрозофилы составляет около 400 мкм, а диаметр около 160 мкм; яйцо обладает ярко выраженной полярностью. Как и у других насекомых, развитие яйца в данном случае происходит достаточно необычно: в результате последовательных делений ядра, не сопровождающихся делением цитоплазмы, возникает синцитий. Ранние деления ядер синхронны и происходят в быстром темпе - через каждые 8 мин. В результате первых 9 делений возникает группа ядер, большая часть которых мигрирует из центра яйца к поверхности, где и формируется монослой, именуемый синцитиальной бластодермой. После следующих 4 делений ядер плазматические мембраны прорастают внутрь от поверхности яйцеклетки и окружают каждое из ядер. Так синцитиальная бластодерма превращается в клеточную бластодерму, которая содержит около 5000 отдельных клеток (рис. 16-57). Небольшая группа ядер, расположенных на самом заднем конце яйца, образует клетки на несколько циклов деления раньше. Эти полярные клетки представляют собой первичные половые клетки, которые положат начало поколениям яйцеклеток или спермиев. Как и в процессе деления у амфибий, высокая скорость репликации ДНК тормозит транскрипцию, так что до стадии клеточной бластодермы развитие в основном (хотя и не полностью) зависит от запасов материнской мРНК и белка, накапливающихся в яйцеклетке до оплодотворения. После образования клеток их деления приобретают более привычный характер, становятся асинхронными, скорость деления замедляется и резко повышается скорость транскрипции.
Зародыш дрозофилы на стадии клеточной бластодермы соответствует полой бластуле амфибий или морских ежей; отличие же состоит в том, что бластула амфибий и морских ежей заполнена жидкостью, а в центре зародыша на этой стадии у насекомых располагается желток. Гаструляция начинается после образования клеток. Хотя у насекомых геометрия этого процесса носит крайне специфические черты, общий результат сходен: благодаря координированным движениям клеток вдоль оси эмбриона возникает кишечная трубка из энтодермальных клеток; трубка окружена мезодермой, которая занимает пространство между этой трубкой и наружным листком эктодермы. В ходе гаструляции длинная ось эмбриона сначала вытягивается («удлинение зародышевой полоски») и затем вновь укорачивается («сокращение зародышевой полоски»); в результате удлинения ось тела изгибается в соответствии с упаковкой эмбриона под яйцевой оболочкой (рис. 16-55).
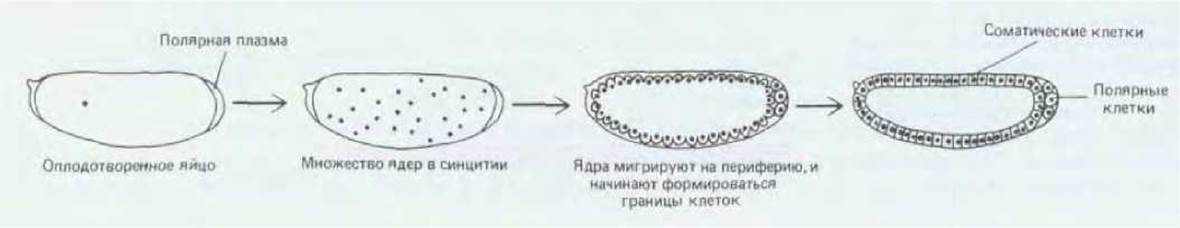
Рис. 16-57. Развитие яйца дрозофилы от момента оплодотворения до стадии клеточной бластодермы. [Н. А. Schneiderman, in Insect Development (P. A. Lawrence, ed.), pp. 3-34, Oxford, U.K., Blackwell, 1976.]
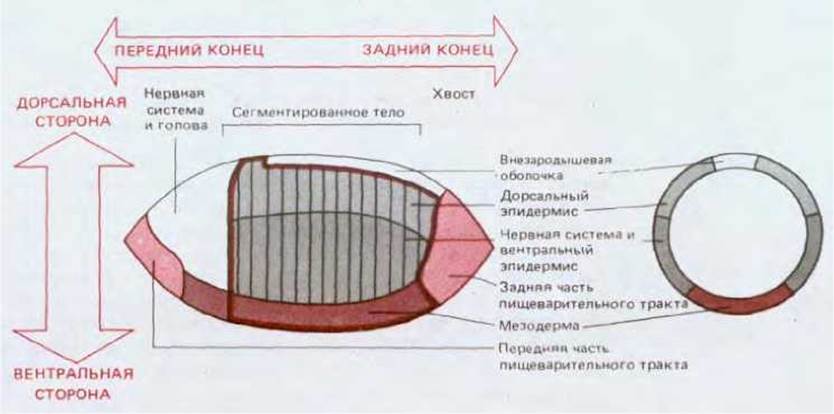
Рис. 16-58. Карта презумптивных зачатков эмбриона дрозофилы на стадии клеточной бластодермы (вид сбоку и поперечный разрез), раскрывающая связь между дифференцировкой важнейших типов тканей в дорсовентральном направлении и расположением сегментов вдоль переднезадней оси. Утолщенная линия окружает участок, где формируются сегментированные структуры. В процессе гаструляции клетки, расположенные вдоль вентральной срединной линии, инвагинируют, образуя мезодерму, а клетки, которые позже сформируют пищеварительный тракт, инвагинируют вблизи обоих концов эмбриона. (V. Hartestein, G. M. Technau, J. A. Campos-Ortega, Wilhelm Roux Archiv Dev. Biol., 194, 213-216, 1985.)
Наблюдая за поведением клеток в ходе сложных гаструляционных движений, можно нарисовать карту презумптивных зачатков для монослоя клеток, расположенных на поверхности бластодермы (рис. 16-58). Карта презумптивных зачатков выглядит наиболее просто на поперечных срезах через среднюю часть эмбриона; здесь будущая мезодерма расположена вентрально, а будущая эктодерма находится по обе стороны от нее. В данном случае как и у позвоночных вдоль всего тела проходит вытянутое скопление нервных клеток, возникающих из части эктодермы. В развитии насекомых мы находим этапы, соответствующие не только гаструляции и нейруляции, но и образованию сомитов: по завершении гаструляции на поверхности эмбриона наблюдаются бороздки и выступы, отмечающие подразделение тела на парасегменты вдоль переднезадней оси (рис. 16-55). Более точные тесты показывают, что основные черты такой сегментарной структуры определяются уже на стадии клеточной бластодермы до начала гаструляции.
16.5.3. План строения эмбриона контролируется в двух прямоугольных системах координат [47]
Для упрощения ориентации на бластодерме принято пользоваться двумя координатами - условными широтой и долготой. Было также показано, что, согласно генетическим тестам, формирование пространственной организации происходит за счет двух механизмов, один из которых определяет организацию по дорсовентральной оси, а другой - по переднезадней. Дорсовентральная ось контролируется группой, состоящей примерно из 20 генов: мутации любого из них приводят к развитию эмбрионов, которые как бы «дорсализованы», т. е. лишены вентральных структур, или «вентрализованы», т. е. лишены дорсальных структур. Другая группа, состоящая примерно из 50 генов, куда входят гены сегментации и гомеозисные селекторные гены, уже упоминавшиеся ранее, контролирует пространственную организацию вдоль переднезадней оси. Мутации этих генов приводят к развитию эмбрионов, у которых либо отсутствуют какие-либо элементы вдоль переднезадней оси, либо эти элементы дуплицированы. Хотя к настоящему времени многие гены из обеих групп клонированы и даже определены их белковые продукты, тем не менее мы ограничимся рассмотрением пространственной организации зародыша только вдоль переднезадней оси.
16.5.4. Переднезадняя полярность эмбриона контролируется сигналами с обоих концов яйца дрозофилы [48]
Исходная полярность яйцеклетки контролируется распределением веществ, запасенных до оплодотворения в период нахождения ооцитов в яичнике (рис. 16-39). Если на переднем конце яйцеклетки дрозофилы проделать маленькое отверстие с тем, чтобы вытекло небольшое количество цитоплазмы, расположенной в самой передней части клетки, то эмбрионы теряют способность формировать структуры головы. Более того, если вместо утраченной цитоплазмы переднего конца инъецировать цитоплазму заднего конца из другой яйцеклетки, то в передней половине яйцеклетки-реципиента возникнет второй набор брюшных сегментов с обратной полярностью (рис. 16-59).
Были идентифицированы мутации, приводящие к подобным нарушениям структуры передней или задней частей эмбриона. Гены полярности яйца, которые были обнаружены с помощью таких мутантов, являются первыми элементами иерархической генетической системы, участвующей в формировании пространственной организации вдоль переднезадней оси. Гены полярности яйца относятся к числу генов, транскрибируемых в материнском геноме в ходе оогенеза; их запасенные продукты начинают действовать вскоре после оплодотворения. По этой причине фенотип эмбриона определяется аллелями матери, а не сочетанием отцовских и материнских аллелей, представленных в самом эмбрионе. Гены, экспрессируемые таким образом, называют генами материнского эффекта.
У матерей-гомозигот по мутации полярности яйца bicoid образуются эмбрионы без головы и торакальных (грудных) структур и за счет этого абдоминальные (брюшные) структуры занимают необычно большую часть всего тела; в свою очередь мутация полярности яйца oskar приводит к образованию зародышей, полностью лишенных абдоминальных сегментов. (Несегментированные структуры обоих концов тела находятся на особом положении: они не затрагиваются этими мутациями, но могут исчезнуть вследствие мутаций torso и некоторых других.)
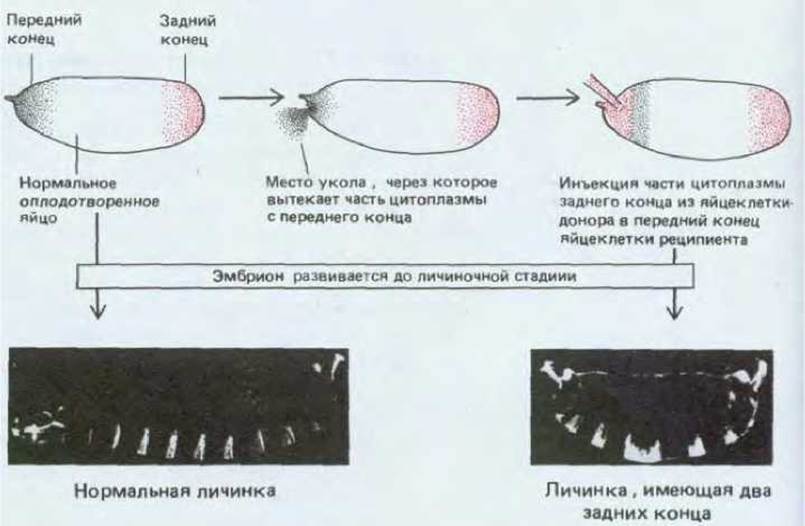
Рис. 16-59. Локализованные детерминанты на концах яйца дрозофилы определяют его переднезаднюю полярность. Если на переднем конце яйца удалить небольшой участок цитоплазмы и заменить его цитоплазмой с заднего конца, то возникает аномальная личинка, имеющая два задних конца (фото справа); на фото слева представлена нормальная личинка. Личинки сфотографированы в темном поле. [H.J. Frohnhofer, R. Lehmann, С. Nusslein-Volhard, J. Embryol. Exp. Morphol, 97 (suppl.): 169-179, 1986.]
Мутации bicoid и oskar приводят к отсутствию соответствующих генных продуктов. Эти мутации можно устранить посредством инъекции мутантным эмбрионам нормальной цитоплазмы. Мутанты bicoid развиваются сравнительно нормально после инъекции цитоплазмы переднего конца нормальных эмбрионов в передний конец мутантного яйца, а мутант oskar нормализуется вследствие инъекции цитоплазмы заднего конца нормального эмбриона в будущий брюшной отдел мутанта. В обоих случаях нормальный генный продукт локализован на одном из концов яйца и действует как источник определенного сигнала, контролируя возникновение позиционных значений вдоль переднезадней оси.
Молекулярно-генетические эксперименты позволили прояснить ситуацию. С помощью гибридизации in situ клонированных кДНК-зондов bicoid было показано, что мРНК, соответствующая гену bicoid, концентрируется на переднем конце яйца. Исходно эта мРНК синтезируется в яичнике питающими клетками, связанными с ооцитами (см. разд. 16.4.1, рис. 16-39). По мере перемещения bicoid-мРНК по цитоплазматическим мостикам в ооцит она прикрепляется к некоторым компонентам цитоплазмы (вероятно, к элементам цитоскелета) на переднем конце ооцита. Трансляция начинается только после откладки яйца. В результате возникает градиент концентрации белка bicoid с максимумом на переднем конце эмбриона. Градиент концентрации можно изменить генетически, создав мутанты, несущие множественные копии нормального гена bicoid: с увеличением дозы гена у матери увеличивается концентрация белка в яйце. Соответственно происходит смешение сегментов эмбриона по направлению к заднему концу, даже несмотря на то, что их расположение определяется позиционной информацией, возникающей под действием концентрации белка bicoid в данном участке (рис. 16-60). Эти соображения позволяют отнести данный белок к морфогенам (см. разд. 16.4.2).

Рис. 16-60. Градиент белка bicoid в яйцеклетке дрозофилы и его влияние на структуру сегментов. Градиент обнаруживается при обработке антителами против белка bicoid; характер сегментации выявляется при окрашивании антителами к продукту гена группы pair-rule, именуемого even- skipped (см. разд. 16.5.5). Сравниваются три эмбриона: не имеющий гена bicoid, имеющий одну копию этого гена и имеющий 4 копии. В отсутствие гена bicoid сегменты на переднем конце не формируются; с увеличением дозы гена они формируются все дальше от переднего конца зародыша, как если бы их расположение определялось концентрацией белка bicoid в данном участке. Изменение этой концентрации, как следует из интенсивности окраски, может быть представлено в виде графика. Несмотря на значительные различия в расположении зачатков сегментов, которые обнаруживаются между эмбрионами с одной и с четырьмя копиями гена, и те, и другие образуют вполне нормальные личинки и взрослых особей. Механизмы такой регуляции обсуждаются в разд. 16.4.9.
16.5.5. Действие трех классов генов сегментации приводит к подразделению эмбриона на сегменты [49]
Продукты генов полярности яйца обеспечивают появление универсальных градуальных сигналов, определяющих возникновение системы отдельных сегментов. Этот процесс зависит от действия генов сегментации, образующих группу примерно из 20 генов. Мутации этих генов способны изменять число сегментов или их основные внутренние свойства, не затрагивая общую полярность яйца. Гены сегментации по сравнению с генами полярности яйца действуют на более поздних стадиях. С учетом действия этих генов фенотип эмбриона будет полностью или частично определяться генотипом эмбриона, а не только матери. Таким образом, эти гены следует отнести к группе генов эффекта зиготы.
Большинство мутаций генов сегментации летальны; их эффект не проявляется у взрослых мух, поскольку мутанты погибают, не достигнув продвинутых стадий развития. Однако такие летальные мутации могут распространяться в рецессивном состоянии (как это обычно и бывает). Следовательно, жизнеспособными оказываются гетерозиготы, обладающие двумя копиями гена: одной нормальной и другой мутантной. При скрещивании гетерозиготных родителей четвертую часть потомства составляют гомозиготы, несущие две копии мутантного гена. Такие потомки погибают преждевременно на поздних эмбриональных или ранних личиночных стадиях, но они живут достаточно долго, чтобы мог проявиться измененный фенотип. Почти все гены сегментации были обнаружены в результате воздействия на мух мутагенами и последующего изучения десятков тысяч погибающих личинок, которые были получены в результате скрещивания мутантных форм.
Гены сегментации подразделяют на три класса (рис. 16-61). Первыми в действие вступают по меньшей мере три gap-гена, действие продуктов которых приводит к появлению наиболее грубого подразделения эмбриона. Мутации любого gap-гена сопровождаются исчезновением обширных участков последовательных сегментов, а мутации различных gap-генов приводят к появлению различных, но частично перекрывающихся дефектов. Например, личинка мутантная по гену Krüppel лишена 8 сегментов от Т1 до А5 включительно (соответственно парасегменты Р3 -Р10).

Рис. 16-61. Фенотипическое проявление мутаций, затрагивающих три типа генов сегментации. В каждом случае участки, выделенные цветом у нормальных личинок (слева), у мутанта делетированы или заменены зеркальными повторами не затронутых участков. Доминантные мутации принято обозначать прописными буквами, а рецессивные - строчными. Несколько мутаций, затрагивающих строение тела дрозофилы, относят к доминантным вследствие их выраженного влияния на фенотип гетерозигот, хотя по основной характеристике (летальному эффекту) они рецессивны, т.е. проявляются только у гомозигот. (С. Nüsslein-Volhard, Е. Wieschaus, Nature, 287, 795-801, 1980; с небольшими изменениями.)
Следующими генами сегментации, вступающими в действие, являются 8 генов pair-rule. Мутации этих генов вызывают серию делеций, повреждающих чередующиеся сегменты, что приводит к сохранению только половины сегментов. Такая парно-сегментарная периодичность характерна для всех мутантов по генам pair-rule, но они отличаются по локализации мутаций в границах сегментов или парасегментов. Например, один из мутантов pair-rule, именуемый even-skipped, теряет все четные парасегменты, а другой - fushi tarazu (ftz) - теряет все нечетные парасегменты. Мутация этого же класса, названная hairy, приводит к исчезновению серии участков одинаковой ширины, которые не совпадают с парасегментами. Наконец, существует около 10 генов полярности сегментов. Мутации этих генов приводят к утрате части сегмента и ее замещению зеркальной копией всего сегмента либо его части. Например, у мутантов gooseberry задняя половина каждого сегмента, т. е. передняя половина каждого парасегмента, заменяется почти зеркально перевернутой передней половиной соответствующего сегмента (см. рис. 16-61).
Анализ фенотипа различных мутантов по генам сегментации приводит к предположению, что гены сегментации формируют координированную систему, которая делит развивающийся эмбрион на все более мелкие домены, различающиеся по характеру генной экспрессии. И здесь молекулярная генетика также позволяет изучать механизмы, лежащие в основе действия этой системы.
16.5.6. Локализованная экспрессия генов сегментации регулируется иерархической системой позиционных сигналов [44, 50]
Несколько генов из каждой группы генов сегментации было клонировано и соответствующие зонды использованы для локализации транскриптов в нормальных эмбрионах по методу гибридизации in situ (см. разд. 4.6.11). Мы уже обсуждали ранее, как этот метод был использован для демонстрации того, что транскрипты гена bicoid являются источником позиционного сигнала: транскрипты локализуются на одном из концов яйца, хотя эффекты мутации гена распространяются на большую часть эмбриона. Подобным образом было показано, что некоторые гены сегментации (а именно gap-гены) в свою очередь прямо или косвенно участвуют в формировании позиционных сигналов, которые позволяют контролировать характер развития в ближайшем окружении. Например, мутанты, дефектные по gap-гену Krüppel, обладают выраженной аномалией, распространяющейся через участок, где были выявлены транскрипты данного гена в нормальном эмбрионе, а также на несколько сегментов за его пределами (рис. 16-62). Ген Krüppel был секвенирован и оказался гомологичен (равно, как и другой gap-гeн-hunchback) семейству генов, о которых известно, что у позвоночных они кодируют ДНК-связывающие регуляторные белки, включая фактор транскрипции TFIIIA у Xenopus (см. разд. 9.1.9). Возникает соблазн предположить по аналогии с bicoid, что белок Krüppel в роли диффундирующего морфогена распространяется из участка транскрипции Krüppel, хотя наблюдаемое распространение белка не столь обширно, как требуется в соответствии с этой гипотезой.

Рис. 16-62. Пространственные домены, в которых действует дар-ген Krüppel, картированный на бластодерме дрозофилы. А. На рисунке показано, как дефект, вызванный отсутствием функционального продукта Krüppel, простирается за пределы участка, в котором в норме локализованы транскрипты Krüppel. Б. Нормальное распределение транскриптов Krüppel согласно результатам гибридизации in situ на стадии бластодермы. В. Нормальное распределение белка Krüppel, выявляемое с помощью окрашивания антителами на этой же стадии. На других стадиях белок может быть распространен более широко. Фенотип мутанта, у которого отсутствует функциональный продукт Krüppel, указан на рис. 16-61, А. (Б - из Н. Jackele, D. Tautz, R. Schuh, E. Seifert, E. Lehmann, Nature, 324, 668-670, 1986; В - из U. Gaul, E. Seifert, R. Shuh, H. Jackle, Cell, 50, 639-647, 1987, copyright Cell Press.)

Рис. 16-63. При гибридизации in situ радиоактивного ДНК-зонда для гена ftz с бластодермой дрозофилы среди продуктов транскрипции данного гена обнаруживается семь полос, что соответствует проявлению дефектов у мутантов по ftz. На радиоавтографе полосы экспрессии ftz выявляются на продольном срезе в виде черных точек, образованных зернами серебра. (С любезного разрешения Philip Ingham.)
Некоторые гены группы pair-rule участвуют в передаче сигналов на более короткие расстояния, оказывая воздействие на клетки, соседствующие с участками транскрипции этих генов; другие гены, напротив, оказывают воздействие на развитие только в тех участках, где они транскрибируются. Например, транскрипты нормального гена ftz на стадии бластодермы проявляются в виде семи кольцевых полосок, наподобие полос у зебры (рис. 16-63), отмечающих ширину и расположение зачатков четных парасегментов, которые утрачиваются у мутантов ftz.
Подводя итоги этих наблюдений, можно предположить, что продукты генов полярности яйца обеспечивают эмбрионы универсальными позиционными сигналами, вынуждающими экспрессироваться определенные gap-гены в определенных местах. В свою очередь продукты gap-генов представляют как бы второй ярус позиционных сигналов, действующих более локализованно и используемых для регуляции более тонких деталей пространственной организации эмбриона, и оказывающих в свою очередь влияние на экспрессию еще одной группы генов, куда входят и гены группы pair-rule. Таким образом, универсальные градиенты, создаваемые генами полярности яйца, принимают участие в формировании более мелких деталей пространственной организации путем постепенного подразделения по принципу иерархии последовательных позиционных контролей. Это весьма надежная стратегия: поскольку позиционные сигналы не определяют подробных деталей, отдельные ядра, отвечающие на них, не должны реагировать с высокой точностью на минимальное изменение величины таких сигналов.
16.5.7. Продукты одного гена сегментации контролируют экспрессию другого [44, 50, 51]
Согласно представленной выше схеме, иерархия позиционных сигналов должна соответствовать иерархии регулярных взаимодействий между генами, управляющими формированием пространственной организации. Это положение можно проверить при изучении влияния мутации одного гена на экспрессию другого. Оказалось, что гены, участвующие в процессе формирования пространственной организации вдоль переднезадней оси, формируют иерархическую пирамиду в пяти основных ярусах, причем продукты генов каждого яруса регулируют экспрессию генов нижележащих ярусов. На вершине этой пирамиды находятся гены полярности яйца, за ними gap-гены, затем гены pair-rule, затем гены полярности сегментов и, наконец, гомеозисные селекторные гены.


Рис. 16-64. А. Характер транскрипции четырех из восьми известных генов группы pair-rule и одного гена полярности сегмента engrailed в бластодерме дрозофилы. Хотя каждый из генов группы pair-rule сам по себе определяет только простое чередование с шагом в два сегмента, деятельность всего набора генов pair-rule в сочетании приводит к определению соседствующих и перекрывающихся структур и может вызывать значительно более тонкое и сложное разбиение всей бластодермы на полосы шириной всего в одну клетку, в которых и экспрессируется ген engrailed. Б. Проявление экспрессии гена engrailed у пятичасового эмбриона (стадия удлинения зародышевой полоски), десятичасового эмбриона и у взрослой мухи, крылья которой на этом препарате были удалены. Данная картина экспрессии выявляется с помощью антител против белка engrailed (для пятичасового) или (для двух других образцов) путем создания линии мух, несущих регуляторные последовательности гена engrailed, связанные с кодирующей последовательностью гена фермента- репортера, чье присутствие легко выявляется гистохимически по образованию окрашенного продукта в процессе реакции, катализируемой этим ферментом. Обратите внимание, что распределение белка engrailed после его появления сохраняется в течение всей жизни животного. (А - по М. Akam, Development, 101, 1-22, 1987; Б - с любезного разрешения Тот Kornberg.)
Можно получить мутантные эмбрионы, лишенные нормальных продуктов гена Krüppel, и определить методом гибридизации in situ экспрессию нормального гена ftz, используя клонированный зонд комплементарный последнему. Характерные полоски ftz не образуются именно в тех участках бластодермы, которые затронуты мутацией Krüppel. Следовательно, продукт гена Krüppel прямо или косвенно регулирует экспрессию гена ftz. Вместе с тем, у мутантов ftz распределение нормального продукта Krüppel не нарушено: подукт ftz не регулирует экспрессию гена Krüppel.
Иногда наблюдается взаимодействие между генами одного яруса иерархической пирамиды; в отличие от взаимодействия генов Krüppel и ftz некоторые из этих взаимодействий могут иметь реципрокный (т. е. перекрестный) характер. Например, gap-гены Krüppel и hunchback взаимно ингибируют друг друга, что не позволяет экспрессироваться их продуктам в ядрах эмбриона одновременно. Поэтому в норме они экспрессируются в соседних участках бластодермы с четкой границей между областью экспрессии гена hunchback, расположенной спереди, и областью экспрессии гена Krüppel, расположенной сзади. Но в отсутствие одного из продуктов этой пары генов область другого продукта расширяется за пределы обычной демаркационной линии. Явление взаимного ингибирования, проявляемое этими двумя генами, которое вынуждает ядро каждой из клеток совершать выбор между тем или иным направлением специализации, может быть использовано для объяснения того, каким образом в ответ на непрерывный градиент морфогена возникает набор строго определенных неперекрывающихся областей экспрессии.
Вероятно, регулярная периодическая картина экспрессии генов pair-rule устанавливается сходным образом. Здесь градуальные позиционные сигналы, определяемые экспрессией генов дар, задают примерное направление развития, а взаимодействие генов pair-rule (например, генов hairy и runt) приводит к более строгой и точной детализации. Таким образом, области экспрессии различных генов группы pair-rule формируют точно воспроизводимое распределение взаимных исключений и перекрываний в каждом из двусегментных модулей бластодермы нормального эмбриона (рис. 16-64). Различные полоски клеток бластодермы, опоясывающих зародыш, характеризуются различной комбинацией экспрессии генов pair-rule, которая, будучи организована по принципу иерархии, спускается до минимально возможного уровня детализации - до ширины одиночной клетки, что соответствует примерно 1/4 ширины будущего сегмента или парасегмента.
16.5.8. Гены полярности яйца, gap-гены и pair-rule-гены создают временную пространственную организацию; гены полярности сегментов и гомеозисные селекторные гены обеспечивают постоянную запись [44, 52]
События, описанные в предыдущем разделе, происходят в течение первых нескольких часов после оплодотворения. Gap-гены и гены pair-rule активируются один за другим и кодируемые ими мРНК (наблюдаемые с помощью гибридизации in situ) создают усредненную и сильно огрубленную (по сравнению с конечным результатом) картину. Вновь синтезируемые продукты сами регулируют экспрессию генов до тех пор, пока вследствие реализации серии взаимных приспособлений, исходное распределение генных продуктов не выявляется в виде четко определенной системы повторяющихся полос. Но и эта система нестабильна и носит временный характер. По мере развития эмбриона от стадии гаструлы и далее регулярное посегментное расположение продуктов генов групп дар и pair-rule исчезает. Но их действие привело к возникновению временного набора позиционных значений, т. е. молекулярных адресов клеток бластодермы, которые будут поддерживать сегментарную организацию личинки и взрослого животного. Эти позиционные значения записаны с помощью сохраняющейся активации генов полярности сегментов и гомеозисных селекторных генов.
16.5.9. Гены полярности сегментов контролируют основные подразделения каждого из парасегментов [44, 53]
В отдельных участках всех парасегментов наблюдается сходная картина экспрессии генов полярности сегментов. Хорошим примером тому является ген engrailed. Присутствие его мРНК можно продемонстрировать с помощью гибридизации in situ на стадии клеточной бластодермы, где эта мРНК формирует серию из 14 полос шириной в одну клетку, расположенных в самых передних частях будущих парасегментов. Появление этих полос тесно связано с экспрессией полос, соответствующих генам pair-rule (см. рис. 16-64); наблюдая за нарушениями распределения полос engrailed у мутантов pair-rule, можно сформулировать правила включения генов engrailed. По всей вероятности, ключевую роль здесь выполняет одно из двух специфических сочетаний продуктов генов pair-rule: в четных парасегментах ген engrailed проявляется только после экспрессии генов ftz и odd-paired, а в нечетных - после экспрессии сочетания even-skipped и paired. Иные сочетания продуктов генов pair-rule активируют или подавляют другие гены полярности сегментов: транскрипция гена wingless включается в полосах шириной в одну клетку, которые расположены в наиболее близких к хвостовому концу областях парасегментов. Таким образом, каждый будущий парасегмент уже на стадии клеточной бластодермы подразделен по крайней мере на три различных области. Химические различия будут сохраняться и поддерживаться постоянной транскрипцией по меньшей мере некоторых генов полярности сегментов и после того, как продукты генов pair-rule в основном исчезнут (см. рис. 16-61, Б). Некоторые из экспрессируемых таким образом генов полярности сегментов (включая, например, wingless) создают продукты, которые в последующем развитии действуют в качестве локальных морфогенов внутри сегментов, регулируя более тонкие детали внутренней пространственной организации парасегмента и его рост.
Продукты генов pair-rule не только регулируют активность генов полярности сегментов, но также взаимодействуют с продуктами генов дар (и, очевидно, генами полярности яйца) и вызывают точно локализованную дифференциальную активацию генов, формирующих пятый и последний ярус иерархической пирамиды - гомеозисных селекторных генов, в результате деятельности которых и сохраняются постоянные различия между разными парасегментами. Далее мы более детально рассмотрим проявление активности этих селекторных генов и тщательно обсудим их роль в обеспечении механизмов клеточной памяти.
16.5.10. Гомеозисные селекторные гены комплекса bithorax и комплекса Antennapedia обусловливают возникновение различий между парасегментами [54]
У дрозофилы изучено множество различных гомеозисных мутаций и каждая из них приводит к замене одной части тела другой; например, вместо глаз возникают крылья, вместо антенн-ноги и т.д. (см. рис. 16-53). Особенно важные наборы мутаций могут возникать в пределах двух кластеров генов, известных как комплекс bithorax и комплекс Antennapedia. Каждый из комплексов содержит несколько генов, обладающих различными функциями: гены комплекса bithorax контролируют возникновение различий между абдоминальными и торакальными сегментами тела, а гены комплекса Antennapedia контролируют возникновение различий между торакальными сегментами и сегментами головы. Гены этих двух комплексов именуются гомеозисными селекторными генами, поскольку они осуществляют выбор между состояниями детерминации, соответствующими различным, но гомологичным, или гомеоморфологичным, структурам. Каждый гомеозисный селекторный ген ограничен в своем действии специфическим доменом, или областью тела, которая трансформируется в результате мутации данного гена. Обычно такие домены обладают четко очерченными границами, которые приблизительно соответствуют половине «сегмента», не совпадающего с границами сегмента, но совпадающими с границами парасегмента (рис. 16-56).
Гомеозисные селекторные гены идентифицированы, как было показано в разд. 16.5, благодаря открытию мутантных взрослых мух; многие мутации этой группы являются рецессивными леталями. Такие мутации приводят к гибели особи практически сразу же после вылупления. Таким образом, как и в случае рецессивных летальных мутаций генов сегментации (см. разд. 16.5.5), эффект этих генов никогда не проявляется у взрослых мух, но может наблюдаться у эмбрионов или ранних личинок. Следовательно, анализ этих ранних стадий позволяет получить наиболее четкую и в некоторых отношениях наиболее полную картину, дающую представление о роли гомеозисных селекторных генов.

Рис. 16-65. Нормальный эмбрион дрозофилы (А) и мутантный эмбрион (Б), у которого утрачена большая часть генов комплекса bithorax. У мутантов все парасегменты, расположенные сзади от Р5, сходны с Р5. [С любезного разрешения Gary Struhl; A - перепечатано (с разрешения) из Nature, 293, 36-41, Copyright 1981, Macmillan Journals Limited.]
Личинки, дефектные по всем генам комплекса bithorax, обладают относительно простым строением: голова и передняя часть груди до парасегмента Р4 нормальны, но все остальные 10 парасегментов приобретают свойства парасегмента Р4. Частичные делеции в комплексе bithorax приводят не к столь серьезным трансформациям: например, Р5 и все остальные парасегменты, расположенные впереди, могут выглядеть нормальными, а парасегменты, расположенные от Р5 сзади, превращаются в Р5 (рис. 16-65). Эти наблюдения, а также аналогичные находки в отношении комплекса Antennapedia иллюстрируют существенную роль гомеозисных селекторных генов в определении различий между параcегментами: при отсутствии этих последних генов такой дифференцировки парасегментов не происходит.
16.5.11. Гомеозисные селекторные гены кодируют систему молекулярных адресов [44, 55]
Как и гены сегментации, гомеозисные селекторные гены впервые активируются на стадии бластодермы. Поскольку вся ДНК комплексов Antennapedia и bithorax была клонирована, в настоящее время с помощью гибридизации in situ и имеющихся ДНК-зондов можно выявить последовательность транскрипции всех гомеозисных селекторных генов. Выводы из этих исследований удивительны: на первый взгляд каждый гомеозисный селекторный ген экспрессируется нормально только в тех участках, которые развиваются аномально, т. е. как будто они находятся не на своем месте, когда этот ген мутирует или отсутствует. Это кажущееся отсутствие логики позволяет рассматривать продукты селекторных генов как молекулярные адреса. Каждый парасегмент обладает собственным набором таких адресов, и если адреса изменены, то парасегмент ведет себя таким образом, как если бы он находился в другом месте. Активация гомеозисных селекторных генов контролируется генами сегментации, и поэтому характер экспрессии гомеозисных селекторных генов совпадает с границами парасегментов, определяемых продуктами генов pair-rule и полярности сегментов. Таким образом, сочетание продукта определенного гомеозисного селекторного гена (или набора таких продуктов) с определенными продуктами генов полярности сегментов надежно определяет единственный адрес, которым обладают только клетки одного из участков данного сегмента.
16.5.12. Продукты гомеозисных селекторных генов участвуют в регуляции экспрессии этих генов [56]
Как и в случае генов сегментации, характер экспрессии гомеозисных селекторных генов с момента появления транскриптов в бластодерме претерпевает сложные настройки и с определенного момента в пределах каждого парасегмента приобретает свои строго определенные черты; окончательный характер экспрессии устанавливается только после завершения гаструляции. На рис. 16-66, А указывается характер экспрессии на стадии удлинения зародышевой полоски, т. е. примерно через 5 ч после оплодотворения (см. рис. 16-55).
Этот характер частично изменяется в результате взаимодействия нескольких гомеозисных селекторных генов. Если гомеозисные селекторные гены расположены по порядку, начиная с генов, экспрессирующихся на головном конце, и кончая генами хвостового конца, то, следовательно, каждый ген этой серии репрессируется продуктами последующих ее членов. Таким образом, в отсутствие продуктов последующих генов любой данный ген в этой серии будет характеризоваться высоким уровнем экспрессии как в своем обычном домене, так и в парасегментах, расположенных позади этого домена. Такое расположение генов, соответствующее их пространственной экспрессии и контролируемое взаимосвязями, отражено последовательностью, в которой они расположены вдоль хромосомы в каждом из двух комплексов генов (рис. 16-66, Б). Этот вопрос обсуждается в разд. 10.3.19.

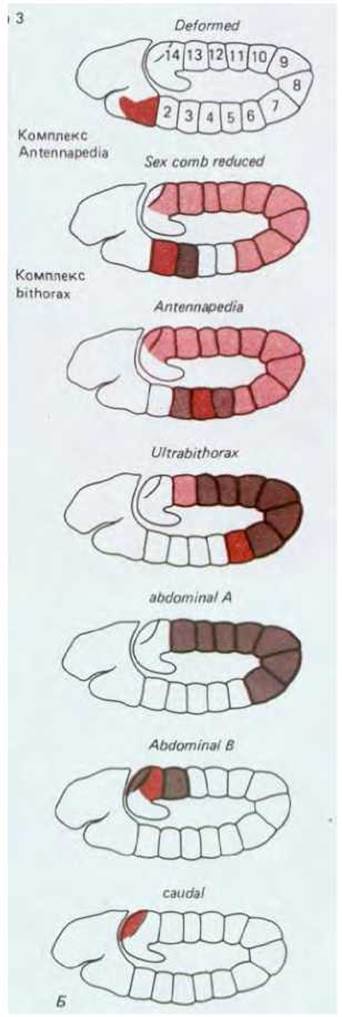
Рис. 16-66. А. Характер экспрессии генов в комплексах Antennapedia и bithorax в зависимости от их хромосомной локализации. Обратите внимание, что последовательность генов в каждом из хромосомных комплексов соответствует пространственной последовательности, с которой экспрессируются эти гены. Б. Характер транскрипции гомеозисных селекторных генов через 5 ч после оплодотворения. Все эти гены, за исключением гена caudal, расположены в комплексах Antennapedia и bithorax, и все они на этой стадии экспрессируются, по-видимому, в доменах парасегментов. Большинство этих генов активно экспрессируется по меньшей мере в одном парасегменте (выделены наиболее темным цветом) и на менее высоком уровне в некоторых соседних парасегментах: там, где присутствие транскрипта необходимо для проявления нормального фенотипа (более светлый цвет) и там, где транскрипты не нужны (самый светлый цвет). (Б - из М. Akam, Development, 101, 1-22, 2987; с изменениями.)
16.5.13. Взрослая муха развивается из набора имагинальных дисков, которые запомнили позиционную информацию [57]
Характер экспрессии гомеозисных селекторных генов устанавливается в эмбрионе дрозофилы и определяет строение не только личинки, но и взрослой мухи. Для того чтобы в полной мере оценить роль этих генов, необходимо иметь представление о том, каким образом в конце концов развивается взрослая особь, или имаго.

Рис. 16-67. Имагинальные диски у личинки дрозофилы (изображены схематично) и образующиеся из них структуры взрослого организма. Из трех пар дисков ноги показана только одна. [J. W. Fristom et al. Problems in Biology: RNA in Development (E. W. Hanley, ed.), p. 382, Salt Lake Sity, University of Utah Press, 1969.]
Взрослая муха формируется главным образом за счет недифференцированных так называемых имагинальных клеток, собранных в группы, которые расположены по бокам в каждом из сегментов тела личинки. Источником имагинальных клеток является эмбриональный эпителий, который покрывает все тело. Эти клетки сохраняют связь с эпидермисом и в основном участвуют в формировании эпидермальных структур взрослого организма. Имагинальные клетки, из которых возникнет голова, грудь и гениталии, организованы в Имагинальные диски, а имагинальные клетки брюшка собраны в кластеры, именуемые абдоминальными гистобластныши гнездами. Подробно были исследованы в основном клетки дисков. Всего известно 19 дисков, один из которых расположен на средней линии тела, а остальные 18 лежат попарно по бокам личинки (рис. 16-67). Диски представляют собой эпителиальные мешки в виде смятых и расплющенных шариков; в процессе метаморфоза они выпрямляются и дифференцируются. Из одной пары дисков возникают глаза и антенны, из другой - крылья и часть груди, из третьей - первая пара ног и т. д. Внешне клетки разных имагинальных дисков различить невозможно, и в процессе дифференцировки из них возникает сходный набор дифференцированных клеточных типов. Однако результаты экспериментов по трансплантации дисков показывают, что фактически они регионально детерминированы и неэквивалентны.
Если имагинальный диск пересадить в пределах личинки с одного участка на другой и позволить ей развиваться до начала метаморфоза, то трансплантированный диск независимо от нового местоположения будет дифференцироваться автономно в структуру, соответствующую его происхождению. Отсюда следует, что клетки имагинальных дисков в процессе дифференцировки руководствуются памятью о своем исходном местоположении. При использовании более сложных методов трансплантации, когда клетки имагинальных дисков до дифференцировки пролиферируют в течение более длительного времени, можно показать, что состояние клеточной памяти наследуется (за некоторыми исключениями из этого общего правила) в течение неопределенно большого числа клеточных поколений (рис. 16-68).
Гомеозисные селекторные гены являются существенным компонентом механизмов клеточной памяти. Если их элиминировать из клеток имагинального диска на любой стадии длительного периода, приводящего к дифференцировке в процессе метаморфоза, то клетки начинают дифференцироваться в другие структуры, как если бы они принадлежали иным сегментам тела. Это явление можно продемонстрировать с помощью метода митотической рекомбинации, индуцированной рентгеновскими лучами. Этот подход можно рассматривать как аналог генетической хирургии отдельных клеток, используемой для получения на любой стадии развития клонов мутантных клеток с определенным генотипом. Именно эти вопросы будут обсуждаться в следующем разделе.
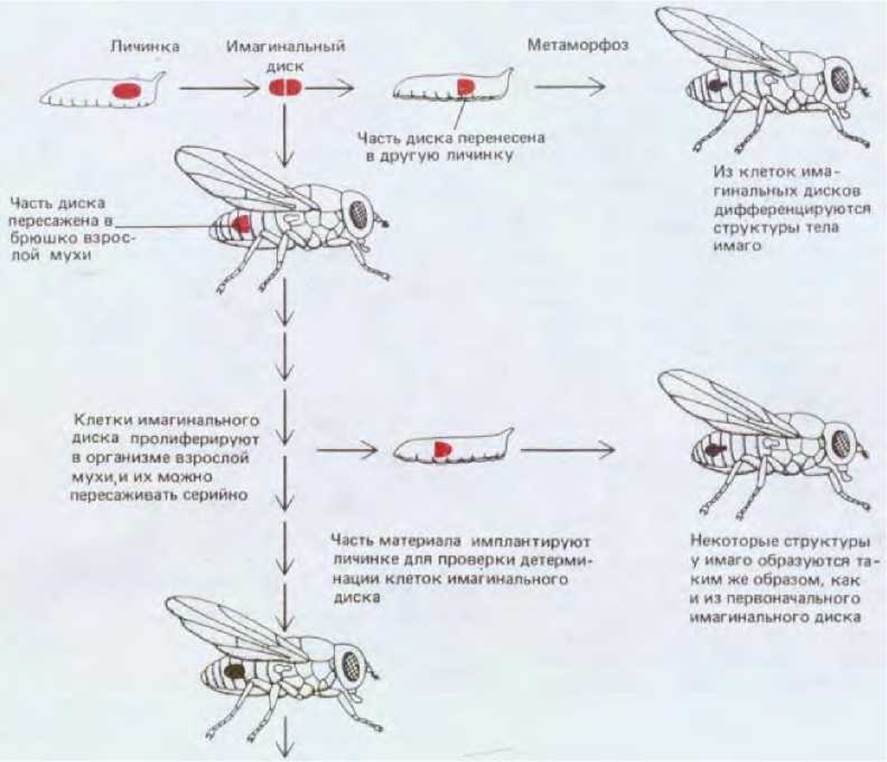
Рис. 16-68. Эксперименты по определению состояния детерминации клеток имагинальных дисков. Метод состоит в имплантации клеток личинкам накануне метаморфоза; клетки дифференцируются, образуя определенные структуры взрослого организма, которые после метаморфоза располагаются в полости тела мухи-реципиента и не интегрированы с ее организмом. Клетки можно тестировать сразу же после извлечения дисков или после имплантации в брюшко взрослой мухи, которое является в этом случае естественной культуральной камерой. Гормональные условия в организме взрослых мух позволяют клеткам, которые, таким образом, не претерпели метаморфоз, размножаться без дифференцировки (до проведения теста на клеточную детерминацию). В обоих случаях клетки после имплантации в личинку, как правило, дифференцируются и образуют структуры, соответствующие назначению исходного диска.
16.5.14. Гомеозисные селекторные гены играют важную роль в запоминании позиционной информации клетками имагинальных дисков [58]
Нормальная соматическая клетка содержит два гомологичных набора хромосом. Один из гомологов каждой пары происходит от отца, другой от матери. В норме обмен ДНК за счет кроссинговера между гомологичными хромосомами отцовского и материнского происхождения имеет место только в мейозе при формировании половых клеток. Но иногда кроссинговер происходит в процессе деления обычных соматических клеток. Хотя в норме митотическая рекомбинация - событие довольно редкое, его можно вызвать у насекомых облучением рентгеновскими лучами (вероятно, это побочный результат воздействия излучения на хромосомы). Как указано на рис. 16-69, если материнские и отцовские хромосомы несут различные аллели гена, то клетка является гетерозиготной. Вследствие единичного акта митотической рекомбинации можно получить две гомозиготные дочерние клетки, отличающиеся генетически как от родительских клеток, так и друг от друга: одна наследует две копии отцовского, другая - две копии материнского аллеля. Далее каждая из дочерних клеток воспроизводится обычным образом, создавая пару гомозиготных клонов, которые расположены в окружении гетерозиготных тканей (рис. 16-70). Если, например, все клетки организма исходно гетерозиготны по мутации, которая вызывает желтую пигментацию вместо нормальной коричневой, но эта мутация рецессивна (так что гетерозиготные клетки обладают коричневым фенотипом), то в результате митотической рекомбинации может возникнуть клон гомозиготных желтых клеток на коричневом фоне.
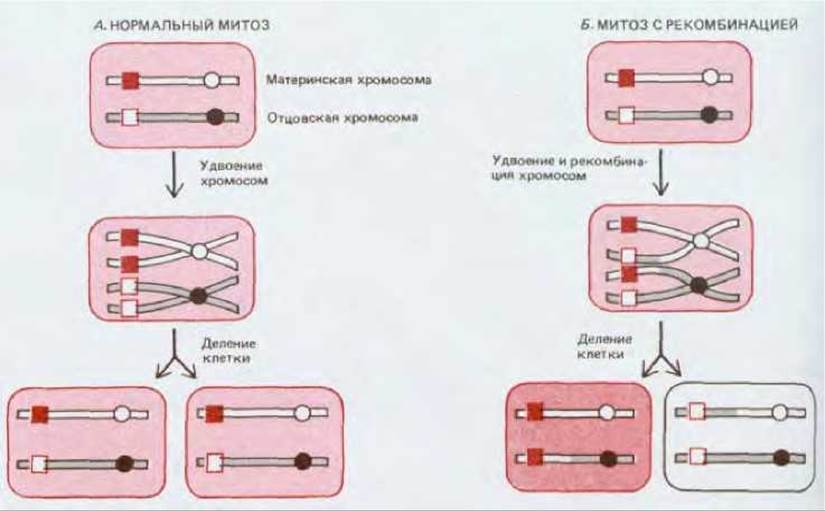
Рис. 16-69. Нормальный митоз (А) и митоз, сопровождающийся рекомбинацией (Б). На схеме указана судьба одиночной пары гомологичных хромосом, одна из которых отцовского происхождения (выделена цветом с центромерой в виде черного кружка), а другая материнского (с центромерой в виде белого кружка). Эти хромосомы содержат ген пигментации (либо иной маркерный ген) с аллелем А дикого типа (белый квадрат на отцовской хромосоме) и рецессивным мутантным аллелем а (красный квадрат на материнской хромосоме). Гомозиготная А/А и гетерозиготная А/а клетки обладают нормальным фенотипом, а гомозиготные а/а клетки - измененным фенотипом. Рекомбинация за счет обмена ДНК между отцовской и материнской хромосомами приводит к образованию пары дочерних клеток, одна из которых является гомозиготой А/А (нормальный фенотип), а другая - гомозиготой а/а (мутантный фенотип). Митотическая рекомбинация - редкое случайное событие.
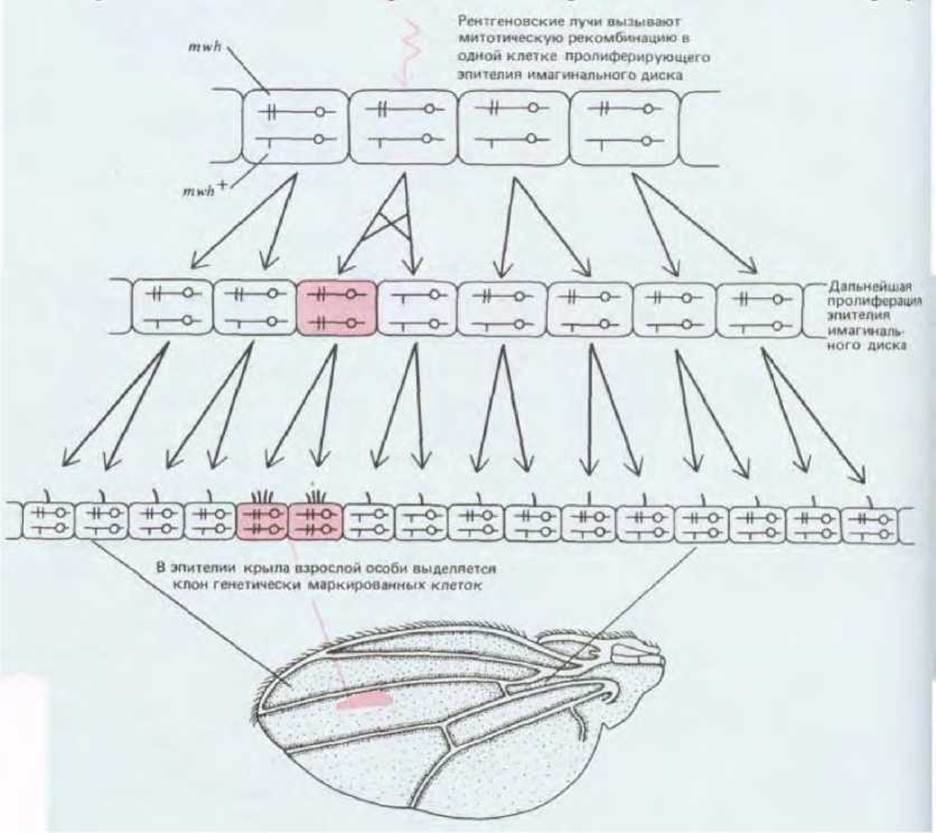
Рис. 16-70. Митотическую рекомбинацию можно использовать для создания в крыле дрозофилы клона генетически маркированных мутантных клеток. Чем раньше происходит рекомбинация, тем больше будет возможный клон.
Конечно же, невозможно проконтролировать в каких именно клетках произойдет митотическая рекомбинация, равно как и невозможно предугадать точно участок хромосомы, в котором произойдет кроссинговер. Однако здесь экспериментаторы могут довольно четко контролировать время таких событий (облучая клетки в строго определенное время) и, что еще важнее, исходный генотип. Во-первых, можно скрещивать гомозигот, у которых мутация интересующего гомеозисного селекторного гена связана с маркерной мутацией (например, мутацией, вызывающей аномальную пигментацию). В данном случае маркер позволит, выявлять гомозиготные клоны, полученные в результате митотической рекомбинации, по их аномальной окраске. Такие маркированные клоны можно с уверенностью считать гомозиготными по интересующей нас мутации.
Основные эффекты мутаций гомеозисных селекторных генов в своем большинстве рецессивны: только у гомозиготных мутантных организмов проявляется гомеозисная трансформация. Используя описанную митотическую рекомбинацию, можно создать клон клеток, меченных в имагинальном диске по гомеозисному гену, и наблюдать их поведение на гетерозиготном, фенотипически нормальном фоне. Именно так было показано, что меченые клетки (и только они) способны к гомеозисной трансформации (чем доказывается их расположение в пределах участка действия гомеозисного селекторного гена); на основе этого можно сделать вывод, что в раннем развитии имело место рекомбинационное событие. Например, можно подвергнуть действию рентгеновских лучей двухдневную личинку, гетерозиготную по мутации, которая нарушает функцию гена Ultrabithorax (Ubx) из комплекса bithorax. В результате в данных имагинальных дисках будут получены изолированные клоны гомозиготных клеток Ubx /Ubx. Если эти клоны расположены на диске жужжальца, то в жужжальце возникнут скопления ткани дикого типа. Такие наблюдения показывают, что в каждой из клеток память о позиционной информации определяется постоянной активностью нормального гомеозисного селекторного гена и что эта память в каждой из клеток проявляется автономно.
16.5.15. Гомеозисные селекторные гены и гены полярности сегментов определяют компартменты тела [59]
Запоминаемые различия, контролируемые гомеозисными селекторными генами, дискретны: экспрессия генов в клетках соседних парасегментов характеризуется четкими различиями. Это же справедливо по крайней мере в отношении одного гена полярности сегментов - engrailed (см. рис. 16-64, Б), дифференциальная экспрессия которого соответствует четкому различию между клетками задней и передней части парасегмента (что соответствует клеткам передней и задней части сегмента). Таким образом, благодаря дифференциальной экспрессии этих двух классов генов, тело делится с образованием серии отдельных участков, клетки которых характеризуются различным состоянием детерминации.
На границе двух таких участков клетки не смешиваются, как если бы селективное слипание клеток, обладающих одинаковым молекулярным адресом, позволяло им отделяться от клеток, несущих другой адрес. Так, например, если в результате генетической рекомбинации в крыле появляется клон маркированных, но все же нормальных клеток, то этот клон располагается лишь по одну сторону четко определенной границы, разделяющей два парасегмента, образующих крыло. Подразделения тела (в крыле или любом ином органе), образующиеся таким образом, называют компартментами (рис. 16-71). Хотя границы компартментов, как правило, не соответствуют границам нормальных органов, они совпадают с границами доменов, в пределах которых действуют гомеозисные селекторные гены, и это можно наблюдать по экспрессии гена engrailed (см. рис. 16-71, Б). У соответствующих мутантов ткань по одну из сторон границы компартмента трансформирована; с другой стороны располагается нормальная ткань (рис. 16-72).
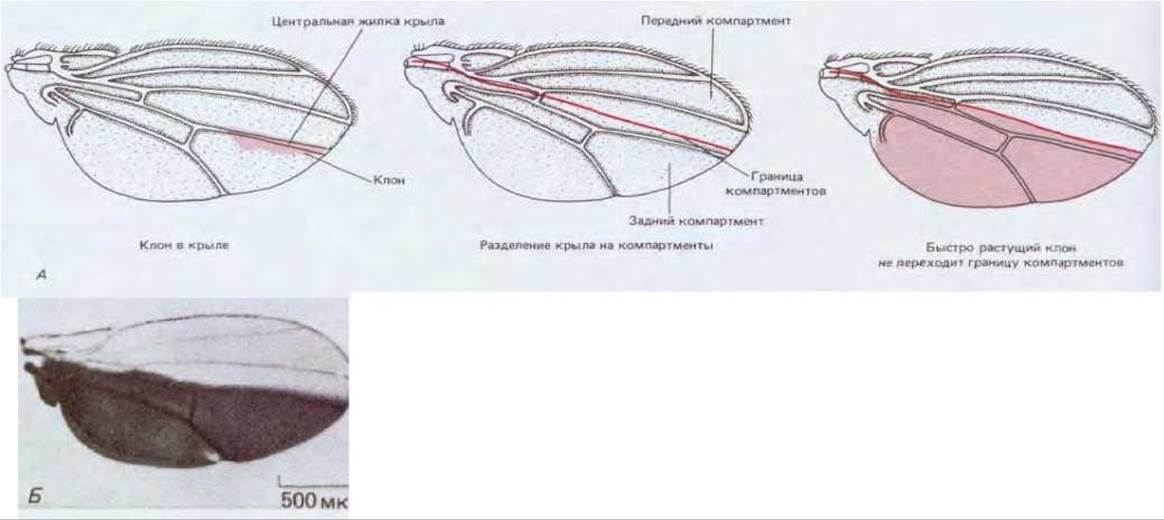
Рис. 16-71. А. Форма маркированных клонов в крыле дрозофилы указывает на существование границы компартментов. У такой границы край каждого пятна получается прямым. Даже если маркированный клон генетически изменен, что позволяет ему расти быстрее остального крыла и стать очень большим, он все равно не переходит границы компартментов (крайний рисунок справа). Обратите внимание, что эта граница не совпадает с центральной жилкой крыла. Б. Характер экспрессии гена engrailed в крыле, выявляемый тем же методом, что и на рис. 16-64, Б. Границы компартмента совпадают с границами экспрессии гена engrailed. (А -по F.H.C. Crick, P.A.Lawrence, Science, 189, 340-347, 1975; Б - с любезного разрешения Тот Kornberg.)
Границы компартментов по определению являются границами двух популяций клеток, различающихся по состоянию своей детерминации, которые не могут смешиваться. Хотя в норме состояние детерминации необратимо, тем не менее каждый из компартментов должен быть самоподдерживающейся единицей. Он не способен использовать клетки соседнего компартмента или делиться с соседом своим собственным избытком клеток. Однако он способен регулировать свою внутреннюю организацию за счет усовершенствований, которые не нарушают этих ограничений. Каждый из компартментов обладает собственной детализованной внутренней структурой, возникающей в имагинальном диске в результате межклеточных взаимодействий на относительно поздних стадиях развития. Молекулярная основа этих местных механизмов формирования пространственной организации до сих пор не изучена, хотя, как упоминалось в разд. 16.5.9, не исключено, что в них принимает участие продукт гена полярности сегмента wingless. Можно показать, однако, что постоянные межклеточные взаимодействия определяют не только пространственную организацию, но и рост частей имагинальных дисков: данная система подчиняется правилу интеркаляции (см. разд. 16.4.9). В процессе регуляции роста и формирования пространственной организации каждый из компартментов ведет себя как более или менее независимое целостное образование. Это было показано в экспериментах, где митотическую рекомбинацию использовали для создания меченых клонов клеток с генотипом, позволяющим пролиферировать им быстрее других клонов имагинального диска. В процессе роста эти клоны занимают непропорционально большую часть компартмента, в пределах которого они расположены, но тем не менее они не способны нарушать границы компартментов; они не могут увеличить размеры компартмента или изменить его пространственную организацию (см. рис. 16-71).
16.5.16. Саморегуляция гомеозисных селекторных геноввносит вклад в механизмы клеточной памяти [60]
Совершив экскурс в будущее, т. е. рассмотрев более поздние стадии развития дрозофилы, вернемся в прошлое, чтобы с молекулярной точки зрения обсудить важные свойства гомеозисных селекторных генов. И прежде всего следует обсудить, каким образом эти механизмы обеспечивают каждую из клеток памятью о том, в каком из сегментов она находится. Один из способов достижения такого эффекта состоит в выработке механизма, действующего по принципу положительной обратной связи, где продукт гена стимулирует свою собственную транскрипцию (см. разд. 16.2.10). Существуют данные о том, что гомеозисные селекторные гены действительно обладают таким самоподдерживающим свойством. Например, клетки в культуре можно трансфицировать искусственно созданным вектором-плазмидой, которая содержит либо последовательность гомеозисного селекторного гена, кодирующую белок и соединенную с каким-либо иным сильным промотором, либо регуляторную последовательность того же гена, соединенную с последовательностью другого гена, кодирующего другой белок (например, фермент, выявление которого не вызывает трудностей). В первом случае можно обеспечить на необходимом уровне синтез белка, кодируемою гомеозисным селекторным геном, а во втором - проверить насколько эффективна регуляторная функция данного белка (это определяется по синтезу фермента-репортера в клетках, трансфицированных одновременно плазмидами обоих типов). В таких опытах было показано, что белок Ultrabithorax может оказывать влияние по типу обратной связи на регуляторную последовательность Ultrabithorax, стимулируя экспрессию соответствующего гена (рис. 16-73). Более того, он также способен воздействовать на регуляторную последовательность Antennapedia, контролируя синтез соответствующего белка, а белок ftz, возможно, стимулирует как Ultrabithorax, так и Antennapedia. Конечно же, условия, создаваемые в клеточной культуре как в модели, не соответствуют условиям, возникающим в зародыше, тем не менее эти наблюдения показывают, что гомеозисные селекторные гены и их родичи могут не только стимулировать или ингибировать друг друга, но и стимулировать самих себя.

Рис. 16-72. Жужжальце мутанта bithorax (5); для сравнения приведена фотография нормального крыла и нормального жужжальца (А). Передний компартмент мутантного жужжальца превратился в передний компартмент крыла. (А - с любезного разрешения Peter Lawrence, Б - из F. H.C. Crick, P. A. Lawrence, Science, 189, 340 347, 1975. Copyright, 1975 by the American Association for the Advancement of Science.)
Вероятно, такая положительная обратная связь важна для исходной установки состояния активации гена, но для поддержания этого состояния в течение длительного времени могут использоваться другие механизмы. Тем не менее сейчас мы начинаем понимать, каким образом продукты гомеозисных селекторных генов могут использоваться одновременно в качестве молекулярных адресов, памятных записей и инструментов для регуляции активности других генов.
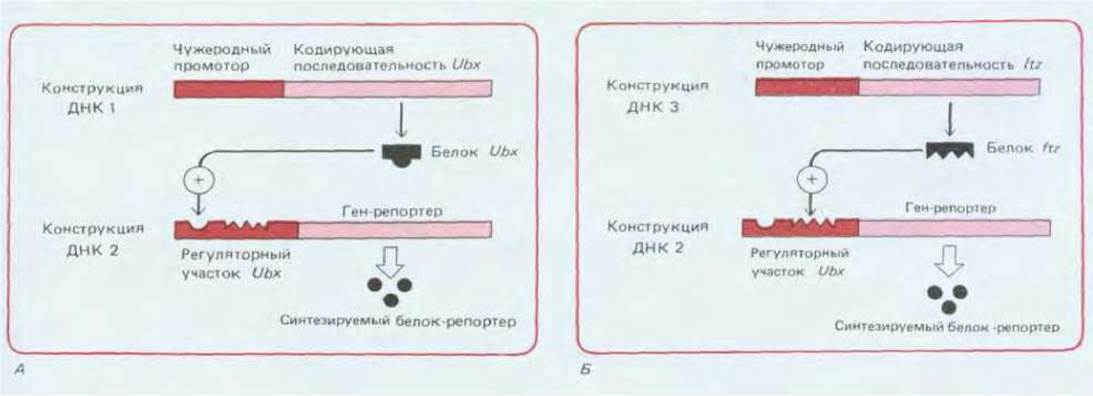
Рис. 16-73. Эксперименты, в которых были использованы клетки, трансфицированные искусственно созданными плазмидами с встроенными генами Ultrabithorax (Ubx) и fushi tarazu (ftz), показывают, что белки ftz (Б) и Ubx (А) могут влиять на регуляторную область гена Ubx, стимулируя его экспрессию. Самостимуляция Ubx (A) создает положительную обратную связь, которая обеспечивает самоподдерживающуюся экспрессию Ubx in vivo. Аналогичный эффект наблюдается для гена Antennapedia. На данном рисунке ситуация, однако, значительно упрощена. В реальном эмбрионе существует, по-видимому, множество регуляторных белков, которые объединяются и/или конкурируют, осуществляя контроль экспрессии этих генов.

Рис. 16-74. Мутантный эмбрион, дефектный по гену extra sex combs (esc), полученный от матери, у которой также отсутствует этот ген. Все сегменты трансформированы и напоминают последний брюшной сегмент (сравните с рис. 16-65). У этого мутанта характер экспрессии гомеозисных селекторных генов (сначала почти нормальный) становится нестабильным и вследствие этого вскоре наблюдается включение всех данных генов вдоль всей оси тела. (G. Struhl, Nature, 293, 36-41, 1981.)
16.5.17. Экспрессия гомеозисных селекторных генов регулируется по принципу дифференциального сплайсинга, а также за счет контроля транскрипции [56, 61]
В широком смысле система гомеозисных селекторных генов, вероятно, обладает простой рациональной организацией и функцией. Однако в деталях существует много сложностей. Например, взаимодействия продуктов гомеозисных селекторных генов с другими генами как такового, по-видимому, недостаточно для стабилизации исходного характера экспрессии. Необходим дополнительный набор генов, и при их инактивации в результате мутации гомеозисные селекторные гены включаются независимо во всех клетках эмбриона (рис. 16-74). Постоянные отличия парасегментов друг от друга в своей основе могут быть связаны с наследуемыми изменениями регуляторных участков гомеозисных селекторных генов, которые каким-то образом подверглись импринтингу на уровне строения хроматина (см. разд. 10.3.10). Более того, несмотря на то, что комплекс bithorax определяет характер девяти парасегментов, он содержит всего 3 гена: Ultrabithorax, abdominal-A и abdominal-B. Эти гены, как и гены комплекса Antennapedia, необычайно велики. Для них характерно наличие очень сложных регуляторных последовательностей. Поэтому с каждого гена образуется набор различным образом сплайсированных транскриптов. Например, ген Ultrabithorax содержит примерно 75 000 пар нуклеотидов, и соответствующие ему транскрипты в зависимости от стадии развития и расположения данной клетки в эмбрионе сплайсируются по-разному. Мутации, локализованные в разных участках в пределах гена, могут воздействовать на разные парасегменты или на какие-либо части парасегментов. Так, например, мутации, локализованные в одном из участков гена Ultrabithorax, превращают переднюю половину жужжальца в переднюю половину крыла (см. рис. 16-72), а мутации другого участка превращают заднюю часть жужжальца в заднюю часть крыла. Эти мутации расположены в разных местах и затрагивают разные участки тела, поэтому одно время полагали, что они соответствуют разным генам; в результате они получили разные названия - bithorax и postbithorax. К настоящему времени выяснилось, что многие мутации гомеозисных селекторных генов, которые влияют на отдельные парасегменты либо части парасегментов, не являются мутациями различных генов, а могут быть отнесены к различным участкам одного и того же большого сложного гена (см. разд. 10.3.19).
16.5.18. Многие гены, контролирующие становление пространственной организации, содержат консервативные последовательности гомеобокса, кодирующего часть ДНК-связывающего белка [62]
Поразительным результатом клонирования гомеозисных селекторных генов было открытие последовательности примерно из 180 пар нуклеотидов, названной гомеобоксом; она с небольшими вариациями содержится практически во всех генах данного типа, а также в некоторых других генах. Например, ген группы pair-rule (ftz) содержит последовательность нуклеотидов, на 77% идентичную гомеобоксу Antennapedia, а совпадение последовательности аминокислот, которые кодируются этими генами, еще больше и достигает 83%. У дрозофилы минимум 16 генов содержат гомеобокс, хотя пределы гомологии варьируют достаточно широко, и почти все гомеобокс - содержащие гены являются ключевыми среди примерно 50 генов, контролирующих пространственную организацию вдоль переднезадней оси тела. Сюда относятся гены полярности яйца (bicoid), pair-rule-гены (ftz, even-skipped, paired), гены полярности сегментов (gooseberry, engrailed), практически все гомеозисные селекторные гены из комплексов Antennapedia и bithorax. Существует как минимум один ген (zerknüllt), участвующий в формировании пространственной организации по дорсовентральной оси, содержащий гомеобокс. Из этих наблюдений следует, что наличие гомеобокса - один из характерных признаков генов, контролирующих становление пространственной организации.
Гены, содержащие гомеобокс, как правило, кодируют белки, локализованные в клеточных ядрах, что предполагает их прямое участие в контроле экспрессии генов. Кроме того, последовательность аминокислот, образующая гомеобокс, вероятно, позволяет белкам дрозофилы, которые ее содержат, связываться со специфическими участками ДНК, функционирующими как энхансеры и сайленсеры (разд. 10.2.7) генной экспрессии, в том числе экспрессии других содержащих гомеобокс генов.
Существование специфических регуляторных последовательностей в ДНК, узнаваемых белками, которые содержат домен, соответствующий гомеобоксу, позволяет предположить, что и они являются характерной чертой генов, содержащих гомеобокс и участвующих в формировании пространственной организации. Нетрудно представить, как такие гены с крайне незначительными различиями в регуляторных последовательностях и последовательностях, кодирующих белки, могут объединиться и образовать сложную сеть, в которой продукты одного гена контролируют экспрессию другого; подобный механизм обсуждался, когда мы рассматривали формирование пространственной организации вдоль переднезадней оси эмбриона дрозофилы. В такой системе механизмы клеточной памяти и детерминацию можно достаточно просто объяснить саморегуляцией экспрессии генов, сходной с саморегуляцией, которая была описана для генов Ultrabithorax (см. рис. 16-73).
16.5.19. В эволюции гомеобокс обладает высокой степенью консерватизма [62, 63]
Удивительная гомология генов, содержащих гомеобокс, дает возможность предполагать, что они возникли за счет собственной дупликации и дивергенции. Возникновение генов путем тандемной дупликации и дивергенции следует также из кластерного расположения многих этих генов в геноме дрозофилы. Комплекс Antennapedia, например, включает гены ftz, bicoid, zerknüllt, а также набор гомеозисных селекторных генов. Формирование кластеров генов, содержащих гомеобокс, может быть отражением их истории и не является физиологической необходимостью; у мух, у которых вследствие генетических перестроек ген Ultrabithorax выщеплен из комплекса bithorax, не обнаруживается никаких аномалий в строении тела.
Представляется вероятным, что по мере усложнения строения тела к геному добавляются серии измененных генов, содержащих гомеобокс. Мутанты дрозофилы, у которых отсутствуют те или иные наборы генов, содержащих гомеобокс, характеризуются фенотипическими признаками, свойственными, возможно, структурам предкового организма. Например, удалив определенные гомеозисные селекторные гены, можно получить животное с характерным расположением множества идентичных сегментов наподобие многоножки; если бы удалось пройти по пути эволюции еще на шаг назад, удалив гены полярности сегментов и гены pair-rule, то можно было бы получить гипотетического предка, организованного наподобие нематод без сегментации, но с сохранением различив между головой и хвостом. Исходя из такой последовательности событий, ген полярности яйца bicoid, вероятно, можно считать предковым представителем семейства генов, содержащих гомеобокс. Конечно, это пока всего лишь плод нашего воображения, но не исключено участие такого предкового гомеобокссодержащего гена в формировании пространственной организации тела, так как именно эту функцию выполняют практически все его потомки у дрозофилы.
Открытие гомеобокса ставит перед нами вопросы более широкого эволюционного значения. Гомеобокс-содержащие гены обнаружены не только у насекомых и других членистоногих, но и у нематоды С. elegans, у кольчатых червей (пиявок и дождевых червей), у морских ежей, примитивных хордовых и у позвоночных (включая лягушек, кур, мышей и человека). Гомеобоксная последовательность обладает удивительной степенью консерватизма на уровне структуры белка; один из белков, соответствующих гомеобокссодержащему гену Xenopus, обладает последовательностью, 59 из 60 аминокислот которой идентичны гомеодомену в белке Antennapedia дрозофилы; и это несмотря на 500 млн. лет независимой эволюции. Такая высокая степень консерватизма позволяет предполагать, что механизмы, контролирующие основной план строения тела у насекомых и позвоночных, могут иметь фундаментальное сходство.
16.5.20. Механизмы региональной клеточной детерминации у позвоночных и насекомых могут быть сходными [63, 64]
Описывая строение раннего зародыша дрозофилы (разд. 16.5.2), мы отмечали сходство с позвоночными. Животные и того, и другого класса в своем развитии проходят через стадию гаструляции, обеспечивающую появление различных зародышевых листков; тело представителей обоих классов подразделяется на сегменты, располагающиеся более или менее перпендикулярно по отношению к закладкам зародышевых листков. Сомиты эмбриона позвоночных и сегменты эмбрионов дрозофилы внешне сходны, но анализ их поведения показывает, что они обладают различными позиционными значениями, которые и определяют их (сомитов) дальнейшую дифференцировку. Как и в случае имагинальных дисков дрозофилы, такую позиционную детерминацию можно продемонстрировать в экспериментах по трансплантации. Так, например, у ранних куриных эмбрионов вновь формирующиеся сомиты можно пересадить на другое место. На этой стадии грудные и шейные сомиты внешне практически неразличимы, хотя грудные сомиты после пересадки в область шеи дадут начало грудным позвонкам с ребрами, а сомиты шеи после пересадки в область груди дают начало характерным шейным позвонкам. На этом сходство не заканчивается. Известно, что каждый сегмент тела насекомых делится на передний и задний компартменты, отличающиеся друг от друга по экспрессии генов engrailed. Так же резко различаются по своей химической природе передние и задние половины сомитов куриного зародыша (рис. 16-75), что проявляется в свойствах клеточной поверхности, регистрируемых с помощью некоторых лектинов, а также в их влиянии на направление роста нервных волокон.
После открытия гомеобокса появилась возможность проверить, не являются ли такие аналогии отражением распределения определенных молекул. К настоящему времени было показано, что последовательность нуклеотидов некоторых из гомеобокс-содержащих генов позвоночных гомологичны соответствующим генам дрозофилы и эта гомология простирается за пределы гомеобокса; с помощью метода гибридизации in situ было показано, что эти гены позвоночных экспрессируются в строго определенных участках эмбриона позвоночных (рис. 16-76). Эти данные позволяют считать, что молекулярные механизмы формирования пространственной организации у позвоночных и насекомых в своей основе очень схожи, однако оценить масштабы сходства до сих пор не представляется возможным. Например, у позвоночных пространственная организация обеспечивается в основном межклеточными взаимодействиями на стадиях дробления. Здесь нет аналога процессам, которые происходят в синцитиальном зародыше насекомых. Более того, многие специалисты по филогенезу полагают, что сегментированность тела у этих групп животных возникла в процессе эволюции независимо. К сожалению, приходится отметить, что у позвоночных не зарегистрировано ничего даже отдаленно напоминающего гомеозисные мутации, сходные с таковыми у дрозофилы. И если это так, то возникают сомнения, что исследования дрозофилы помогут внести существенный вклад в выявление общей взаимосвязи между генами и пространственной организацией тела у всех организмов.
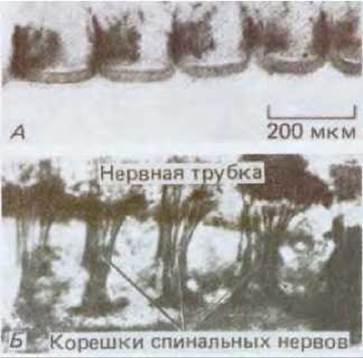
Рис. 16-75. А. Ряд сомитов (передний конец тела находится слева, задний - справа) двухдневного куриного эмбриона, окрашенных антителами, распознающими клетки нервного гребня: последние мигрируют только через переднюю половину каждого из сомитов, поскольку клетки, составляющие эту переднюю половину, существенно отличаются от клеток задней половины (в первом случае условия для миграции клеток благоприятны, во втором - нет). Б. Участок более взрослого куриного эмбриона, окрашенный для выявления корешков спинальных нервов в тех местах, где они проходят через сомиты. Подобно клеткам нервного гребня, нервные корешки мигрируют только через переднюю половину сомита. Результаты экспериментов по пересадке тканей показывают, что такое сегментарное строение периферической нервной системы определяется исходными различиями между передними и задними клетками сомита в отношении детерминации (это напоминает характер экспрессии гена engrailed у дрозофилы). (А - из М. Rickman, J.W. Fawsett, R.J. Keynes, J. Embryol. Exp. Morphol., 90, 437-455, 1985; Б - с любезного разрешения Claudio Stern.)
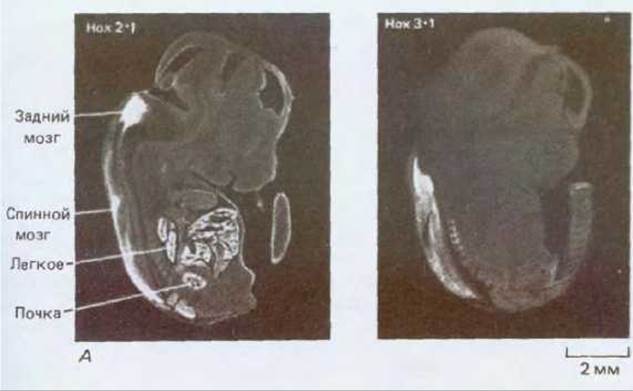
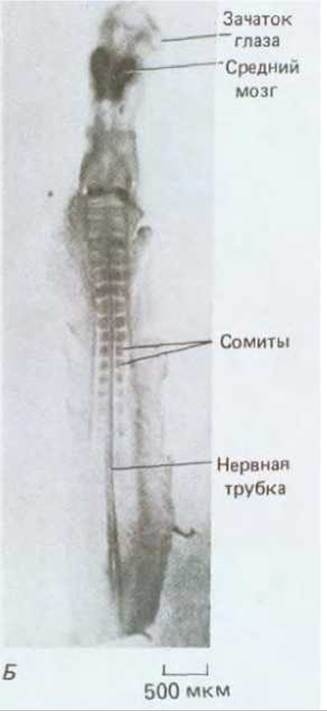
Рис. 16-76. А. Характер экспрессии двух гомеобокс-содержащих генов мыши, Нох 2.1 и Нох 3.1, выявляемый по методу гибридизации in situ в соседних продольных срезах через весь 13,5-дневный эмбрион мыши. Высокая концентрация транскриптов соответствует высокой концентрации зерен серебра на радиоавтографах. Два этих гена экспрессируются в различных, частично перекрывающихся участках вдоль переднезадней оси в головном и спинном мозге, а также в некоторых других тканях. Б. Характер экспрессии гомеобокссодержащего гена курицы (куриного а), обладающего особенно близкой гомологией с геном engrailed дрозофилы. В данном случае были использованы антитела, демонстрирующие распределение в двухдневном курином эмбрионе белка, кодируемого этим геном. В отличие от своего аналога у дрозофилы, который образует серию сегментных полос, белок en у курицы локализуется в виде отдельного скопления в среднем и заднем мозге. (А - из P. W.H. Holland, B.L. M. Hogan, Development, 102, 159-174, 1988; Б - с любезного разрешения Tom Kornberg.)
Заключение
Тело дрозофилы, как и тело других насекомых, состоит из набора повторяющихся модифицированных базовых модулей (сегментов) со специализированными несегментированными структурами на переднем и заднем концах тела. Любое крупное подразделение каждого из сегментов определяется экспрессией особого набора контролирующих генов, уточняющих молекулярные адреса этих подразделений. Пространственная организация начинает формироваться с возникновения асимметрии яйцеклетки. Здесь можно различить две группы генов с материнским эффектом, которые также называют генами полярности яйца. Одна группа этих генов отвечает за дорсовентральное распределение зародышевых листков и основных видов тканей, а другая - за переднезаднее (от головы к хвосту) расположение сегментов. Примером гена этого последнего класса служит ген bicoid, мРНК которого концентрируется на переднем конце яйца. Поскольку зародыш на начальных этапах развития представляет собой синцитий, продукт гена bicoid способен легко диффундировать через цитозоль по всему эмбриону, создавая градиент морфогена, определяющий общую организацию передней половины эмбриона. Этот градиент запускает упорядоченную экспрессию иерархически организованной структуры генов, образованной генами групп gap и pairrule, генами полярности сегментов и гомеозисными селекторными генами. Эти последние гены под влиянием гена bicoid и взаимодействия между собой начинают экспрессироваться в отдельных участках эмбриона, что постепенно приводит к разделению тела на повторяющиеся сегменты и их части.
Экспрессия генов группы gap и pair-rule носит временный характер, но она накладывает отпечаток на экспрессию генов полярности сегментов и гомеозисных селекторных генов; экспрессия этих последних генов сохраняется, подвергаясь некоторым уточнениям в процессе дальнейшего развития и обеспечивает клетки позиционной информацией. Механизм клеточной памяти частично обеспечивается положительной обратной связью (предполагающей, что белковые продукты гомеозисных селекторных генов стимулируют транскрипцию собственных генов) и частично наследуемыми изменениями структуры хроматина. Необходимость некоторых форм запоминания позиционных значений можно продемонстрировать в экспериментах на клетках имагинальных дисков, из которых возникают наружные структуры тела взрослого организма; эти клетки сохраняют память о своих исходных назначениях в течение неопределенного числа клеточных делений. Такое поведение определяется постоянным присутствием гомеозисных селекторных генов в каждой отдельной клетке любого имагинального диска. Границы компартментов, которые, по всей вероятности, поддерживаются благодаря избирательному слипанию отдельных клеток, делят клетки, характеризуемые различным состоянием дифференцировки, согласно экспрессии этих генов.
В геноме гомеозисные селекторные гены сгруппированы в два класса: комплекс Antennapedia и комплекс bithorax. Все они содержат гомеобоксную последовательность, которая кодирует высококонсервативную последовательность примерно из 60 аминокислот. Эта нуклеотидная последовательность присутствует и в некоторых генах полярности яйца, генах группы pair-rule, генах полярности сегментов, что свидетельству об общности эволюционного происхождения этих генов из гена-пpeдшесвенника, который принимал участие в регуляции формирования пространственной организации. Гены, содержащие гомеобокс, обнаружены у различных животных, в том числе у круглых червей и млекопитающих. позволяет предположить, что становление пространственной организации у этих животных основано на молекулярных механизмах, сход с молекулярными механизмами, действующими у дрозофилы.