Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Клеточные механизмы развития
Органогенез: координированная сборка сложных тканей
Формирование пространственной организации до сих пор рассматривалось нами с точки зрения изменения свойств клеток и при этом гор меньше внимания уделялось их положению; мы следили за нарастанием этих изменений в отдельной ткани, в частности, у дрозофилы мы рассматривали эпидермис, а в конечностях позвоночных - соединительную ткань скелета. Однако на самом деле вследствие сложных движений в эмбриогенезе все органы представляют собой сложное сочетание различных тканей, образованных клетками, которые происходят из разных источников и руководствуются различными правилами. Клеточные движения позволяют собрать все эти компоненты воедино. В этом последнем разделе мы рассмотрим, каким образом позиционная информация управляет клеточными движениями и координирует построение сложных органов, каковыми являются конечности.
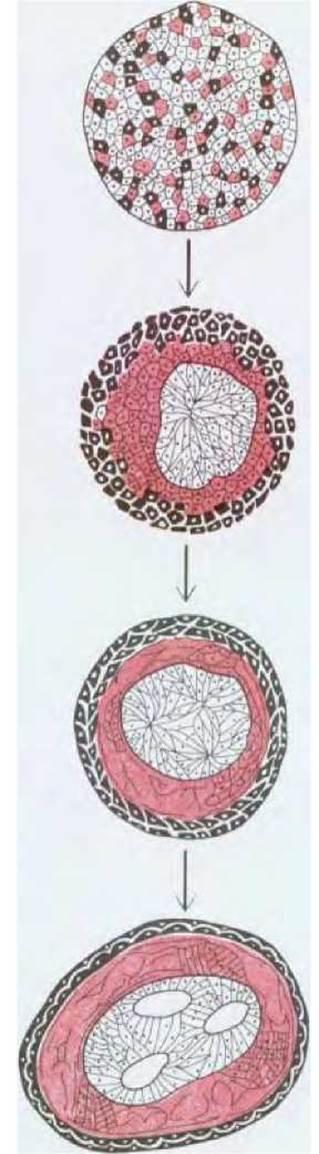
Рис. 16-77. Клетки различных участков раннего эмбриона амфибий сортируются в соответствии со своим происхождением. В классическом эксперименте, который схематически представлен на этом рисунке, клетки мезодермы, нервной пластинки и эпидермиса были дезагрегированы. После пересортировки клетки формируют структуру, похожую на нормальный эмбрион с «нервной трубкой» внутри, эпидермисом снаружи и мезодермой между ними. (P. L. Townes, J. Holtfreter, J. Exp. Zool., 128, 53-120, 1955; с небольшими изменениями.)
16.6.1. Избирательное слипание стабилизирует клеточные структуры, образованные по-разному детерминированными клетками [65, 66]
В процессе развития животного клетки движутся, пролиферируют и приходят в контакт друг с другом, вследствие чего потомки этих клеток перемешиваются. У химерных зародышей мыши, например, перемешаны клетки двух исходных морул, вследствие чего во взрослом организме хаотически перемешаны клетки двух генотипов (см. разд. 16.2.5). Но если нарушение расположения клеток происходит после их детерминации, то могут наблюдаться нарушения в пространственном распределении клеток, характеризующихся различными состояниями. Приобретение клетками свойств, определяемых их положением, предупреждает возможность случайного перемешивания клеток. Феномен компартментов у дрозофилы (см. рис. 16.5.15) демонстрирует один из способов достижения этого. Вероятно, детерминированные клетки остаются в соответствующих компартментах за счет селективного слипания с клетками, обладающими таким же состоянием детерминации. Клетки, экспрессирующие одинаковые молекулярные адреса, по всей вероятности, слипаются между собой сильнее, чем клетки с иными молекулярными адресами. Очевидно, позиционная информация, записанная в результате активации таких генов, как engrailed и Ultrabithorax, проявляется посредством определенного выбора молекул адгезии клеточной поверхности.
У ранних эмбрионов амфибий стабилизирующие эффекты межклеточной адгезии в отношении организации структуры, обеспечивающей взаимное расположение различных клеточных типов, вероятно, настолько сильны, что способны восстанавливать нормальное расположение даже после искусственной диссоциации клеток, приводящей к образованию бесформенной неупорядоченной массы клеток. Клетки мезодермы, нейральной пластинки и клетки эпидермиса способны, сортируясь из такой смеси, формировать структуры с эпидермисом снаружи, мезодермой под эпидермисом и структурой, напоминающей нервную трубку, внутри (рис. 16-77). Исследования, проведенные на курином и мышином эмбрионах, дают основания полагать, что такое поведение определяется, по крайней мере частично, семейством Са2+-зависимых гликопротеинов (кадгеринов), обеспечивающих клеточную адгезию (см. разд. 14.3.7). Эти и другие Са2+-зависимые молекулы клеточной адгезии, такие, как N-CAM (см. разд. 14.3.6), дифференциально экспрессируются в различных тканях раннего эмбриона и антитела против этих молекул нарушают нормальную селективную адгезию клеток одного типа.
16.6.2. Пространственные структуры, образуемые молекулами клеточной адгезии, регулируют характер морфогенетических движений [66, 67]
Изменение характера экспрессии различных кадгеринов тесно коррелирует с изменением ассоциации клеток в процессе гаструляции, нейруляции и формирования сомитов (рис. 16-78); такие изменения в раннем эмбриогенезе могут регулироваться и по крайней мере частично зависеть от распределения кадгеринов. В частности, кадгерины, вероятно, играют важную роль в контроле образования и рассасывания эпителиальных слоев и клеточных кластеров. Следовательно, движения, участвующие в построении раннего зародыша, определяются характером химических различий между клетками, расположенными в разных местах.
Это же общее положение иллюстрируется многочисленными иными примерами. Эпителий имагинального диска дрозофилы в процессе образования крыла взрослого организма должен выпрямиться, вытянуться и уложиться определенным образом. Хотя этот процесс во многом остается загадочным, он, вероятно, определяется локализованной экспрессией специфических молекул адгезии клеточных поверхностей, которые к настоящему времени начинают идентифицировать с помощью моноклональных антител. Распределение таких позиционно специфических молекул клеточной поверхности тесно коррелирует с характером укладки диска в процессе метаморфоза (рис. 16-79); некоторые из этих молекул, как было показано, относятся к семейству поверхностных рецепторов клетки, именуемых интегринами (разд. 14.2.17). В отличие от кадгеринов интегрины опосредуют присоединение клеток к компонентам внеклеточного матрикса. Ранее было показано, что такие взаимодействия клеток с матриксом выполняют важную роль в процессе гаструляции (см. разд. 16.1.5). Молекулы межклеточной адгезии и молекулы адгезии клеточной поверхности и матрикса можно рассматривать как два вида ключевых приспособлений для трансляции определенной структуры позиционной информации в пространственную организацию морфогенетических движений.
16.6.3. У позвоночных первичным носителем позиционной информации является мезодерма [68]
Совершенно очевидно, что позиционная информация, которой обладают клетки, может проявляться по-разному. Это особенно хорошо иллюстрируется на примере развития сложных органов. Конечность позвоночных образуется клетками шести различных типов, формирующими соединительную ткань (кости, сухожилия и т. д.), эпидермис, мышцы, выстилку кровеносных сосудов, аксоны нервных клеток и их глиальные оболочки, пигментные клетки и кроветворную ткань костного мозга. И хотя все эти компоненты обладают собственной, хорошо определенной структурой, они вносят разный вклад в формирование конечности как таковой. У мух, размеры которых невелики, поверхность тела по отношению к объему очень велика, и эпидермис, образуемый эктодермой, играет доминирующую роль как в образовании экзоскелета, обеспечивающего механическую опору, так и в координации процессов формирования пространственной организации. У позвоночных, которые значительно крупнее насекомых, роли зародышевых листков изменены. Опорный каркас тела образуется соединительными тканями (главным образом за счет мезодермы); далее мы увидим, что эти ткани играют также координирующую роль в формировании пространственной организации во время органогенеза. И действительно, эксперименты на амфибиях в начале этого столетия показали, что мезодерма играет важнейшую роль в закладке пространственной организации уже на самых ранних стадиях становления общего плана строения тела.
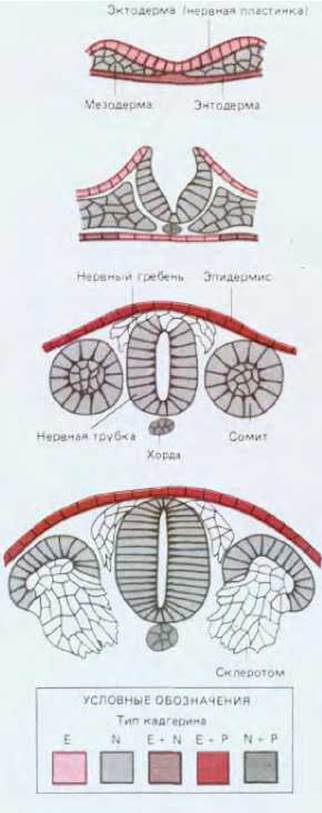
Рис. 16-79. Имагинальный диск дрозофилы, обработанный моноклональными антителами, которые распознают позиционно-специфический антиген PS2. Четкая граница окрашенного участка соответствует краю будущего крыла, где дорсальный и вентральный эпителий крыла встречаются, образуя складку. Прерывистой линией отмечена граница компартментов вдоль переднезадней оси. (V.C. Wilcox, D.L. Bower, R.J. Smith, Cell, 25, 159-164, 1981.)

Рис. 16-78. Изменение характера экспрессии трех кадгеринов на нескольких последовательных стадиях раннего развития куриного или мышиного эмбрионов, показанное на поперечных срезах через развивающуюся нервную трубку и сомиты. Кадгерины, расположенные определенным образом, могут содействовать регуляции морфогенетических движений, участвующих в образовании нервной трубки, хорды, сомитов, нервного гребня и склеротомов. (М. Та-keichi, Trends in Genetics, 8, 213-217, 1987.)
Как уже упоминалось (см. разд. 16.1.7-16.1.9), нервная система позвоночных формируется из эктодермы под индуцирующим воздействием подстилающей ее мезодермы. Если кусочек мезодермы, расположенный непосредственно под областью будущей нервной трубки одного гаструлирующего зародыша амфибии, пересадить под эктодерму на брюшной стороне другого зародыша, то эктодерма в этом участке начнет утолщаться и сворачиваться, образуя в этом необычном месте отрезок нервной трубки. При этом особенности данного отрезка будут зависеть от происхождения мезодермы. Если мезодерма была взята из переднего участка, то из эктодермы образуется часть головного мозга; мезодерма из заднего участка вызовет образование участка спинного мозга. Это позволяет предположить, что клетки эктодермы приобретают определенные позиционные значения в зависимости от позиционных значений лежащих непосредственно под ними клеток мезодермы.
Регуляция формирования пространственной организации со стороны подстилающей соединительной ткани наблюдается при развитии многих органов позвоночных. Так, кожа и кишка со всеми их железами, придатками и локальной спецификацией приобретают характерное для них строение вследствие определенных взаимодействий, в которых компоненты соединительной ткани обеспечивают соответствующие участки эпителия соответствующей позиционной информацией. Хорошим примером тому являются эксперименты на коже, покрывающей конечности.
16.6.4. Характер и распределение производных эпидермиса контролируется дермой [66, 69]
Кожа состоит из двух слоев - эпидермиса (представляющего собой эпителий, образованный эктодермой) и дермы (являющейся соединительной тканью, образованной фибробластами, происходящими в основном из мезодермы). Из эпидермиса формируются кератинизированные придатки кожи (волосы, перья, чешуи и когти), а также многие железы. Для разных участков тела характерны различные виды кератинизированных производных: на спине, крыльях и верхних частях ног, например у курицы, располагаются ряды перьев (рис. 16-80), а на нижних частях ног - ряды чешуй. Более того, в зависимости от положения в пределах каждого ряда перья и чешуи могут различаться по форме и цвету. Если у куриного эмбриона взять эпидермис с ноги, где он позже образует чешуи, и объединить с дермой спины, где он в норме образует перья, то из него вместо чешуи в дальнейшем будут формироваться перья, (рис. 16-81); обратная комбинация приводит к противоположному результату. Вообще дерма контролирует не только тип производных эпидермиса, но и их точное местоположение. Здесь мы вновь встречаемся с проявлением неэквивалентности (см. разд. 16.4.6): дерма разных участков тела внешне одинакова, но различается по своей способности индуцировать определенную дифференцировку лежащего над ней эпидермиса.

Рис. 16-80. Расположение перьевых зачатков на спине куриного эмбриона после 9 сут инкубации. Обратите внимание, что зачатки в каждом ряду разделены одинаковыми промежутками. (С любезного разрешения A. Mauger, P. Sengel.)
Молекулярные механизмы, посредством которых соединительная ткань контролирует дифференцировку эпителия, неясны, но некоторый успех достигнут в идентификации молекул, контролирующих морфогенетические движения клеток, которые дают начало волосам, перьям или железам. И здесь также решающее значение имеют межклеточные типы адгезии, равно как и адгезия клеток с матриксом. В соединительнотканном компоненте данной структуры механические воздействия, оказываемые на коллаген, секретируемый фибробластами, приводят к агрегации последних в участках образования различных придатков. В то же время в соединительной ткани и лежащем над ней эпителии наблюдаются изменения характера экспрессии молекул клеточной адгезии, таких, как N-CAM и Е-кадгерин, которые, по всей вероятности, регулируют форму клеток и их взаимную упаковку (см. разд. 14.3.6 и 14.3.7). На границе между эпителием и соединительной тканью происходит синтез и разложение различных компонентов базальной пластинки (см. разд. 14.2.15), в том числе ламинина, протеогликанов и коллагена; при этом локализация как синтеза, так и разрушения строго контролируются, что способствует осуществлению регуляции процессов разрастания эпителия и формирования складчатости.

Рис. 16-81. Схема опытов, в которых было показано, что тип производных кожи определяется дермой.
16.6.5. Соединительную ткань конечности позвоночных заселяют многие типы мигрирующих клеток [11, 70]
Соединительная ткань пронизывает все тело позвоночных. В конечности соединительная ткань формирует кости и хрящи, сухожилия и связки, кожу, оболочку мышц, внешние слои стенок кровеносных сосудов и оболочки нервов и промежуточную ткань, связывающую воедино все эти компоненты. Эти формы соединительной ткани образованы фибробластами и близкородственными клетками, которые погружены в обогащенный коллагеном внеклеточный матрикс, секретируемый ими. И все эти разнообразные клетки развиваются из мезенхимы недифференцированной зародышевой ткани, заполняющей зачаток эмбриональной конечности; ее происхождение можно проследить вплоть до мезодермы боковой пластинки, соседствующей с сомитами ранних эмбрионов (см. рис. 16-15). Кроме покрывающего конечность эпидермиса, все остальные компоненты конечности являются производными популяции мигрирующих клеток, не являющихся производными боковой пластинки. Прежде чем достигнуть места назначения и принять участие в формировании структуры взрослого животного, эти клетки должны совершить длительное путешествие по эмбриональной соединительной ткани.
Такая миграция была продемонстрирована в опытах с пересадкой куриным зародышам эмбриональных клеток перепела. Хотя перепел во многом напоминает курицу, его клетки легко отличить на гистологических препаратах, так как они содержат крупную, сильно окрашивающуюся глыбку гетерохроматина, связанного с ядрышком. Такой ядрышковый маркер позволяет легко опознать пересаженные клетки, куда бы они ни попали внутри эмбриона. Если у куриного зародыша еще до закладки крыльев заместить ткань определенной группы сомитов такой же тканью от перепела, то все мышечные клетки крыльев (и только они) будут происходить от перепела (рис. 16-82). Очевидно, будущие мышечные клетки мигрируют в область закладки крыла и остаются здесь внешне неотличимыми от других клеток, но уже детерминированными, пока не наступит время их дифференцировки.
Еще одним важным примером мигрирующих клеток являются клетки, происходящие из нервного гребня - участка, расположенного вблизи нервной трубки (рис. 16-83) (см. разд. 16.11.9). Способность этих клеток мигрировать была доказана сходным образом после замены нервного гребня у цыпленка нервным гребнем перепела; идентификация клеток нервного гребня перепела проводилась по ядрышковому маркеру. Как и глиальные клетки, которые образуют оболочку аксонов нервных клеток, пигментные клетки конечности происходят из клеток нервного гребня. Чувствительные и вегетативные аксоны конечностей являются выростами нейронов, возникших из клеток нервного гребня. (Аксоны, обеспечивающие произвольные движения, напротив, являются выростами двигательных нейронов спинного мозга).
16.6.6. Пространственная организация соединительной ткани конечности не зависит от заселяющих эту ткань клеток [71]
Если у раннего зародыша до начала образования почки конечности разрушить ткань сомитов или нервного гребня и/или нервной трубки, то можно легко получить конечности, лишенные определенных классов мигрирующих клеток или нервных волокон. В общем такие конечности во многих отношениях вполне нормальны. Можно, например, получить конечности, не содержащие мышечных клеток, но в них имеются нормальный скелет, кожа и чувствительные нервы; даже сухожилия развиваются нормально, хотя затем, в отсутствие тянущих их мышц, постепенно дегенерируют. Точно так же в конечности, лишенной нервов и всех производных клеток нервного гребня, развивается нормальный скелет, кожа и мышцы, однако затем мышцы, лишенные нервной стимуляции, постепенно дегенерируют. Внутренние структуры конечности в отсутствие всего эпидермального покрова не будут развиваться нормально, однако частичное удаление довольно значительных участков эпидермиса не нарушает нормального развития.
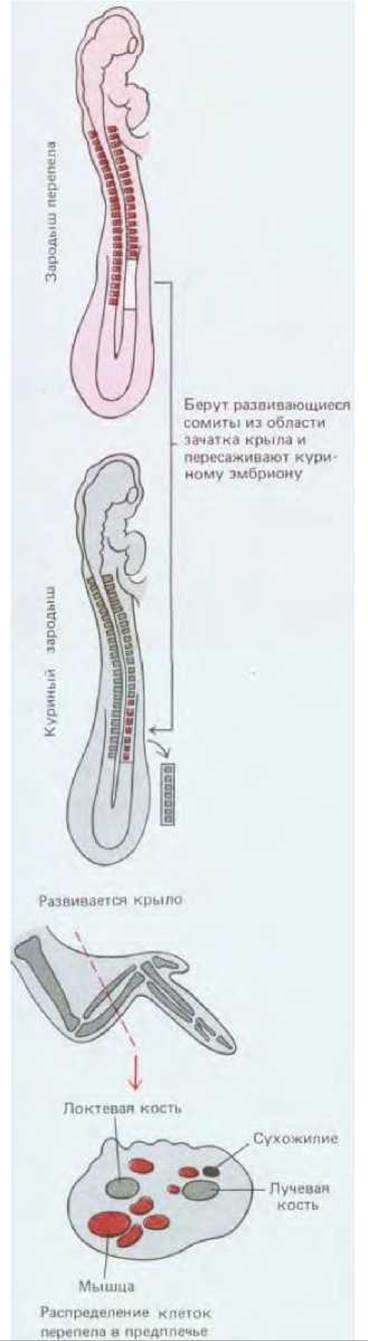
Рис. 16-82. Если у куриного эмбриона после двух суток инкубации заменить клетки сомитов такими же клетками перепела и спустя неделю приготовить гистологические препараты из области крыла, то окажется, что мышечные клетки крыла образовались из трансплантированных сомитов перепела.

Рис. 16-83. Главные пути миграции клеток нервного гребня у куриного эмбриона (схематический поперечный разрез средней части тела). Из клеток, мигрирующих непосредственно под эктодермой (поверхностный путь), образуются пигментные клетки кожи; клетки, движущиеся по глубинному пути через сомиты, дают начало сенсорным и симпатическим ганглиям, и частично надпочечникам (см. также рис. 14-55).
Таким образом, пространственная организация соединительной ткани практически не зависит от других компонентов конечности. Более того, эти другие компоненты конечности обладают собственной, пространственной организацией, становление которой в значительной степени определяется соединительной тканью. Мы уже обсуждали, как это происходит, на примере эпидермиса (см. рис. 16-81); с помощью аналогичных экспериментов по трансплантации ткани можно показать, что это же справедливо в отношении популяций мигрирующих клеток, таких, как мышечные клетки, аксоны нервных клеток и пигментные клетки. Клетки всех этих типов в основном формируют структуру, сообразуясь с конечностью хозяина, независимо от того, из какого участка эмбриона они происходят. Если соединительная ткань как таковая является чем-то вроде центрального источника и хранилища позиционной информации конечности позвоночных, то каким образом она оказывает свое организующее влияние на мигрирующие клетки?
16.6.7. Соединительная ткань определяет пути перемещения и конечный адрес мигрирующих клеток [11, 72]
В принципе существует пять основных способов, посредством которых соединительная ткань контролирует популяции клеток, заселяющих ее. Она может определять:
1) пути, по которым клетки перемещаются;
2) участки, куда прибывают мигрирующие клетки;
3) масштабы пролиферации;
4) способ дифференцировки;
5) вероятность выживания.
Значение каждого из этих способов контроля варьирует в зависимости от типа мигрирующих клеток, но ни один из них не изучен достаточно полно. В самом деле, практически ничего не известно о молекулярных основах системы позиционных значений соединительной ткани, на которой базируется ее пространственная организация. В настоящее время для выявления позиционно зависимых различий в распределении поверхностных молекул клетки только начинают применять моноклональные антитела.
Однако некоторые общие принципы клеточной миграции начинают проясняться. Поведение всех мигрирующих клеток определяется механизмами клеточной адгезии и узнавания, рассмотренными в гл. 14; эти механизмы служат основными предпосылками нормального органогенеза. В частности, клетки в процессе миграции должны входить в тесный контакт с внеклеточным матриксом или поверхностью других клеток. Фибронектин - это тот внеклеточный матрикс, который, по всей вероятности, является важнейшим (хотя и не единственным) компонентом субстрата для многих мигрирующих клеток; антитела и пептиды, блокирующие фибронектиновые рецепторы клеточной поверхности, способны влиять на миграцию клеток нервного гребня во многих участках эмбриона; так, например, они блокируют миграцию клеток в процессе гаструляции (см. разд. 16.1.5). Общность некоторых механизмов, участвующих в обеспечении перемещения мигрирующих клеток к местам назначения, становится более понятной в результате исследований мутантных мышей, несущих мутации Steel или dominant-spotting. У таких мутантов пигментные, кроветворные и первичные половые клетки не способны достигнуть места своего назначения соответственно в коже, костном мозге и гонадах. Мутация dominant-spotting приводит к дефекту собственно мигрирующих клеток; мутанты Steel обладают дефектами соединительной ткани, в которой поселяются мигрирующие клетки.
Мы только начинаем постигать механизм, посредством которых соединительная ткань конечностей регулирует миграцию клеток по специфическим путям или, иными словами, направляет их по определенным адресам, однако можно с определенностью утверждать, что такое направление определяется позиционной информацией, которая заложена в клетках соединительной ткани. Так, например, поверхность клеток с иными позиционными значениями может обладать иными свойствами или секретировать иные компоненты внеклеточного матрикса. Перемещаясь по соединительной ткани, клетка постоянно образует выросты, анализируя ими ближайшее окружение и оценивая слабо выраженные сигналы, в отношении которых эти клетки обладают особой чувствительностью за счет специфического отбора поверхностных белков-рецепторов. Внутри клетки эти рецепторные белки соединены с цитоскелетом, обеспечивающим ее перемещение. Образованные в разных участках выступы клеточной поверхности как бы находятся в постоянном состоянии «перетягивания каната», что приводит к перемещению клетки в направлении наиболее прочного соединения с поверхностью субстрата (см. разд. 11.6.4), пока клетка не достигнет участка, где силы адгезии уравновешены или столь велики, что клетка не в состоянии отделиться от поверхности. В этом перемещении важную роль играет хемотаксис, а также взаимодействие мигрирующих клеток (см. разд. 14.3); эти процессы могут приводить либо к остановке и скапливанию клеток в одном участке, либо к их широкому распространению за счет взаимного отталкивания.
16.6.8. При исследовании развития нервной системы возникает ряд особых проблем [73]
Обсуждение миграции клеток привело нас к теме, которая в целом до сих пор не рассматривалась. Это - развитие нервной системы. Процесс этот представляется одним из наиболее загадочных. Фундаментальные вопросы биологии развития, рассмотренные в этой главе, можно суммировать следующим образом: как в организме возникают различные типы клеток и как эти клетки попадают в соответствующие для них места. Нервная система ставит перед ними еще одну проблему: каким образом между клетками образуются правильные соединения? Большую часть клеток других типов можно рассматривать как точечные объекты, каждый из которых занимает определенное положение и обладает определенными внутренними свойствами. Однако нейрон по своей сути не является точечным объектом: он необычайно увеличен за счет длинного аксона и дендритов, связывающих его с другими клетками. Если эти связи ошибочны, то работа нервной системы будет нарушена. Процессы возникновения различных типов нейронов и упаковки их клеточных тел в регулярную структуру можно объяснить, основываясь на тех же принципах, что и в случае остальных клеток. Но упорядоченный рост аксонов и дендритов и образование правильной системы синапсов представляют собой явления иного порядка. Передний конец растущего аксона или дендрита ползет примерно так же, как и мигрирующая клетка: его можно назвать мигрирующим органом неподвижной клетки. Факторы, контролирующие его движение, в некотором смысле такие же, что и факторы, контролирующие движение клеток; это - специфические типы адгезии и т. д. Но в процессе изучения взаимосвязи аксонов с другими клетками, их взаимодействия с иными нервными окончаниями и способности образовывать синапсы перед нами возникают новые проблемы, требующие иного подхода. Поэтому мы откладываем обзор строения нервной системы (движущей силы развития) до гл. 19.
Заключение
Позиционные значения, приобретаемые клетками в процессе пространственной организации зародыша, выражаются адгезионными свойствами их поверхности, а также их внутренним химизмом. Клетки одного mum стремятся взаимодействовать между собой и отделяются от иных, отличающихся от них клеток; таким образом происходит стабилизация пространственной организации и обеспечивается способность клеток к спонтанной сортировке при их искусственном смешивании. Изменение характера адгезионных свойств лежит в основе морфогенетических процессов, таких, как гаструляция, нейруляция и формирование сомитов. Поскольку характер позиционных значений данного класса клеток проявляется через изменение свойств клеточной поверхности, он может управлять миграцией других популяций эмбриональных клеток в процессе сборки сложных тканей или органов. Вероятно, у позвоночных клетки соединительной ткани являются первичными носителями позиционной информации. Клетки соединительной ткани дермального слоя кожи способны контролировать региональную специализацию эпидермиса, формирующего перья и чешуи. Сходным образом клетки соединительной ткани конечности контролируют и координируют образование структур, формируемых популяциями мигрирующих клеток, к числу которых относятся мышечные клетки (производные сомитов), аксоны нервных клеток (от центральной нервной системы и периферических ганглиев) и пигментные клетки (производные нервного гребня). Несмотря на то что к настоящему времени идентифицированы многие молекулы клеточной адгезии общего назначения, а также показано, что некоторые из них выполняют в этих процессах центральную роль, молекулярные механизмы, направляющие миграцию клеток по определенным маршрутам к строго определенным местам назначения в конечностях, до сих пор неизвестны.
Литература
Общая
Browder L. Developmental Biology, 2nd ed. Philadelphia, Saunders, 1984. Gilbert S.F. Developmental Biology, 2nd ed. Sunderland, MA, Sinauer, 1988. Molecular Biology of Development. Cold Spring Harbor Symp. 50, 1985. Slack J. M. W. From Egg to Embryo: Determinative Events in Early Development.
Cambridge, U.K., Cambridge University Press, 1983. Spemann H. Embryonic Development and Induction. New Haven, Yale University Press, 1938. (Reprinted, New York, Garland, 1988.)
Walbot V. Holder N. Developmental Biology. New York, Random House, 1987.
Weiss P. A. Principles of Development. New York, Holt, 1939.
Цитированная
1. Browder L. W. ed. Developmental Biology: A Comprehensive Synthesis. Vol. 2: The Cellular Basis of Morphogenesis. New York, Plenum, 1986.
Gerhart J., et al. Amphibian early development. Bioscience, 36, 541-549, 1986.
Slack J. M. W., ed. Early Amphibian Development. J. Embryol. Exp. Morphol., Suppl., 89, 1985.
Trinkaus J. P. Cells into Organs: The Forces that Shape the Embryo, 2nd ed., Englewood Cliffs, NJ, Prentice Hall, 1984.
2. Gerhart J. C. Mechanisms regulating pattern formation in the amphibian egg and early embryo. In Biological Regulation and Development (R. F. Goldberger, ed.), Vol. 2, pp. 133-316, New York, Plenum, 1980.
Gerhart J., Ubbels G., Black S., Hara K., Kirschner M. A reinvestigation of the role of the grey crescent in axis formation of Xenopus laevis. Nature, 292, 511-516, 1981.
Vincent J. P., Oster G. F., Gerhart J. C. Kinematics of gray crescent formation in Xenopus eggs: the displacement of subcortical cytoplasm relative to the egg surface. Dev. Biol. 113, 484-500, 1986.
3. Gilbert S. F. Developmental Biology, 2nd ed., pp. 73-111, Sunderland, MA, Sinauer, 1988.
Kirschner M., Newport J. Gerhart J. The timing of early developmental events in Xenopus. Trends Genet., 1, 41-47, 1985.
Wilson E.B. The Cell in Development and Heredity, 3rd ed., pp. 980-1034. New York, Macmillan, 1925. (Reprinted, New York, Garland, 1987.)
4. Furshpan E. J., Potter D. D. Low-resistance junctions between cells in embryos and tissue culture. Curr. Top. Dev. Biol., 3, 95-128, 1968.
Kalt M. R., The relationship between cleavage and blastocoel formation in Xenopus laevis. II. Electron microscopic observations. J. Embryol. Exp. Morphol., 26, 51-66, 1971.
Warner A. The role of gap junctions in amphibian development. J. Embryol. Exp. Morphol., Suppl., 81, 365-380, 1985.
5. Fink R. D., McClay D. R. Three cell recognition changes accompany the ingression of sea urchin primary mesenchyme cells. Dev. Biol., 107, 66
74, 1985.
Gustafson Т., Wolpert L. Cellular movement and contact in sea urchin morphogenesis. Biol. Rev., 42, 442-498, 1967.
Hardin J. D., Cheng L. Y. The mechanisms and mechanics of archenteron elongation during sea urchin gastrulation. Dev. Biol., 115, 490-501, 1986. McClay D.R., Wesel G.M. The surface of the sea urchin embryo at gastrulation: a molecular mosaic. Trends Genet., 1, 12-20, 1985.
Wilt F. H. Determination and morphogenesis in the sea urchin embryo. Development, 100, 559-575, 1987.
6. Ettensohn C.A. Mechanisms of epithelial invagination. Q. Rev. Biol., 60, 289-307, 1985.
McClay D. R., Ettensohn C. A. Cell adhesion in morphogenesis. Annu. Rev. Cell. Biol., 3, 319-345, 1987.
Odell G. M., Oster G., Alberch P., Bernside B. The mechanical basis of morphogenesis. I. Epithelial folding and invagination. Dev. Biol., 85, 446462, 1981.
7. Gerhart J., Keller R. Region-specific cell activities in amphibian gastrulation. Annu. Rev. Cell. Biol., 2, 201-229, 1986.
8. Spemann H., Mangold H. Induction of embryonic primordia by implantation of organizers from different species. Roux's Archiv., 100, 599-638, 1924. (English translation in Foundations of Experimental Embryology, 2nd ed. [B. H. Willier, J. M. Oppenheimer, eds.] New York, Hafner, 1974.)
9. Balinsky B.L Introduction to Embryology, 5th ed., Philadelphia, Saunders, 1981.
Longman J. Medical Embryology, 5th ed. Baltimore, Williams & Wilkins, 1985.
Romer A. S., Parsons T. S. The Vertebrate Body, 6th ed. Philadelphia, Saunders, 1986.
10. Kitchin L. C. The effects of notochordectomy in Amblystotna mexicanum. J. Exp. Zool, 112, 393-411, 1949.
Smith J. С., Watt F. W. Biochemical specificity of Xenopus notochord. Differentiation, 29, 109-115, 1985.
11. Le Douarin N. The Neural Crest. Cambridge U.K., Cambridge University Press, 1982.
Newgreen D. F., Erickson C. A. The migration of neural crest cells. Int. Rev. Cytol, 103, 89-145, 1986.
12. Bumside B. Microtubules and microfilaments in amphibian neurulation. Am. Zool,
13. 989-1006, 1973. Gordon R. A review of the theories of vertebrate neurulation and their relationship to the mechanics of neural tube birth defects. J. Embryol. Exp. Morphol., Suppl., 89, 229-255, 1985.
Karfunkel P. The mechanisms of neural tube formation. Int. Rev. Cytol., 38, 245-271, 1974.
13. Blackhaw S.E., Warner A. E. Low resistance junctions between mesoderm cells during development of trunk muscles. J. Physiol., 255, 209-230, 1976.
Keynes R. J., Stern C. D. Mechanisms of vertebrate segmentation. Development, 103, 413-429, 1988.
14. Slack J.M. W. From Egg to Embryo: Determinative Events in Early Development. Cambridge, U.K., Cambridge University Press, 1983.
15. DiBerardino M.A. Orr N.H., McKinnel R.G. Feeding tadpoles cloned from Ram erythrocyte nuclei. Proc. Nat. Acad. Sci. USA., 83, 8231-8234, 1986.
Gurdon J. B. The Control of Gene Expression in Animal Development. Cambridge, Harvard University Press, 1974.
Gurdon J. B. Transplanted nuclei and cell differentiation. Sci. Am., 219(6), 24-35, 1968.
McKinnel R. G. Cloning-Nuclear Transplantation in Amphibia. Minneapolis, University of Minnesota Press, 1978.
16. Davidson E.H. Gene Activity in Early Development, 3rd ed., pp. 411-524, Orlando, FL, Academic Press, 1986.
Jeffery W.R. Spatial distribution of mRNA in the cytoskeletal framework of Ascidian eggs. Dev. Biol., 103, 482-492, 1984.
Satoh N. Towards a molecular understanding of differentiation mechanisms in Ascidian embryos. Bioessays, 7, 51-56, 1987.
Wilson E.B. The Cell in Development and Heredity, 3rd ed., pp. 1035-1121, New York, Macmillan, 1928. (Reprinted, New York: Garland. 1987.)
17. Gurdon J. B. Embryonic induction-molecular prospects. Development, 99, 285-306, 1987.
Kimelman D., Kirschner M. Synergistic induction of mesoderm by FGF and TGF-beta and the identification of an mRNA coding for FGF in the early Xenopus embryo. Cell, 51, 869-877, 1987.
Rosa F., et al. Mesoderm induction in amphibians: the role of TGF-beta2-like factors. Science, 239, 783-785, 1988.
Slack J. M. W, Darlington B. G., Heath J. K., Godsave S. F. Mesoderm induction in early Xenopus embryos by heparin-binding growth factors. Nature, 326, 197-200, 1987.
Weeks D. L., Melton D. A. A maternal mRNA localized to the vegetal hemisphere in Xenopus eggs codes for a growth factor related to TGF-beta. Cell, 51, 861-867, 1987.
18. Austin C.R., Short R. V., eds. Embryonic and Fetal Development, 2nd ed. Reproduction in Mammals, Ser., Book 2, Cambridge, U. K., Cambridge University Press, 1982.
Hogan В., Constantini F., Lacy E. Manipulating the Mouse Embryo: A Laboratory Manual. Cold Spring Harbor, NY, Cold Spring Harbor Laboratory, 1986.
Rugh R. The Mouse: Its Reproduction and Development. Minneapolis, Burgess, 1968.
19. Gardner R.L. Clonal analysis of early mammalian development. Philos. Trans. R. Soc. Lond. (Biol.), 312, 163-178, 1985.
McLaren A. Mammalian Chimeras. Cambridge, U. K., Cambridge University Press, 1976.
20. Johnson M. H., Chisholm J. C., Fleming T. P., Houliston E. A role for cytoplasmic determinants in the development of the mouse early embryo? J. Embryol. Exp. Morphol., Suppl. 97, 97-121, 1986.
Kelly S. J. Studies of the developmental potential of 4-/and 8-cell stage mouse blastomeres. J. Exp. Zool., 200, 365-376, 1977.
Tarkowski A. K. Experiments on the development of isolated blastomeres of mouse eggs. Nature, 184, 1286-1287, 1959.
21. Illmensee K., Stevens L.C. Teratomas and chimeras. Sci. Am., 240(4), 120-132, 1979.
Papaioannou V. E., Gardner R. L., McBurney M. W., Babinet C., Evans M. J. Participation of cultured teratocarcinoma cells in mouse embryogenesis. J. Embryol. Exp. Morphol., 44, 93-1.04, 1978.
Robertson Е. J. Pluripotential stem cell lines as a route into the mouse germ line. Trends Genet., 2, 9-13, 1986.
22. Weiss P. A. Principles of Development, pp. 289-437, New York, Holt, 1939.
23. SpemannH. Über die Determination der ersten Organanlagen des Amphibienembryo I-VI Arch. Entw. Mech. Org., 43, 448-555, 1918.
24. Hardeman E. C., Chiu C.-P., Minty A., Blau H. M. The pattern of actin expression in human fibroblast x mouse muscle heterokaryons suggests that human muscle regulatory factors are produced. Cell, 47, 123-130, 1986.
25. Barton S. C., Surani M. A. H., Norris M. L. Role of paternal and maternal genomes in mouse development. Nature, 311, 374-376, 1984.
Monk M. Memories of mother and father. Nature, 328, 203-204, 1987.
Reik W. Collick A., Norris M. L., Barton S. C., Surani M. A. Genomic imprinting determines methylation of parental alleles in transgenic mice. Nature, 328, 248-251, 1987.
Sapienza C., Peterson A. C., Rossant J., Balling R. Degree of methylation of transgenes in dependent on gamete of origin. Nature, 328, 251-254, 1987.
Swain J. L., Stewart T. A., Leder P. Parental legacy determines methylation and expression of an autosomal transgene: a molecular mechanism for parental imprinting. Cell, 50, 719-727, 1987.
26. Kimmel С. В., Varga R. M. Cell lineage and developmental potential of cells in the zebra fish embryo. TIG, 4, 68-74, 1988.
Gardner R. L., Lawrence P. eds., Single Cell Marking and Cell Lineage. Philos.
Trans. R. Soc. Lond. (Biol.), 312, 1985. Price J. Retroviruses and the study of cell lineage. Development, 101, 409-419, 1987.
Wolfram S. Cellular automata as models of complexity. Nature, 311, 419-424, 1984.
27. Edgar L. G., McGhee J. D. DNA synthesis and the control of embryonic gene expression in C. elegans. Cell, 53, 589-599, 1988.
Wilkins-A.S. Genetic Analysis of Animal Development. New York, Wiley, 1986. Wood W. В., et al. The Nematode Caenorhabditis elegans. Cold
Spring Harbor, NY, Cold Spring Harbor Laboratory, 1988.
28. Kenyon C. Cell lineage and the control of Caenorhabditis elegans development. Philos. Trans. R. Soc. Lond. (Biol.), 312, 21-38, 1985.
Sulston J. E., Horvitz H. R. Post-embryonic cell lineage of the nematode, Caenorhabditis elegans. Dev. Biol, 56, 110-156, 1977.
Sulston J. E., Schierenberg E., White J. C., Thompson J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev. Biol., 100, 64-119, 1983.
29. Ambros V., Horvitz H. R. The lin-14 locus of Caenorhabditis elegans controls the time of expression of specific post-embryonic developmental events. Genes Dev., 1, 398-414, 1987.
Chalfle M., Horvitz H. R., Sulston J. E. Mutations that lead to reiteration of the cell lineages of C. elegans. Cell, 24, 59-69, 1981. Ellis H. M., Horvitz H. R. Genetic control of programmed cell death in the nematode C. elegans. Cell, 44, 817-829, 1986.
Sternberg P. W., Horvitz H. R. The genetic control of cell lineage during nematode development. Annu. Rev. Genet, 18, 489-524, 1984.
30. Cooke J. Properties of the primary organization field in the embryo of Xenopus laevis. IV. Pattern formation and the regulation following early inhibition of mitosis. J. Embryol. Exp. Morphol., 30, 49-62, 1973.
Satoh N. Towards a molecular understanding of differentiation mechanisms in Ascidian embryos. Bioessays, 7, 51-56, 1987.
Stephens L., Hardin J., Keller R., Wilt F. The effects of aphidicolin on morphogenesis and differentiation in, the sea urchin embryo. Dev. Biol., 118, 64-69, 1986.
31. Kimble J.E. Strategies for control of pattern formation in Caenorhabditis elegans. Philos. Trans. R. Soc. Lond. (Biol.), 295, 539-551, 1981. Priess J.R., Schnable H., Schnabel R. The glr-1 locus and cellular interactions in early C. elegans embryos. Cell, 51, 601-611, 1987.
Sternberg P. W., Horvitz H. R. Pattern formation during vulval development in C. elegans. Cell, 44, 761-772, 1986.
Sulston J. E., White J. G. Regulation and cell autonomy during postembryonic development Caenorhabditis elegans. Dev. Biol., 78, 577-597, 1980.
32. Artavanis-Tsakonas S. The molecular biology of the Notch locus and the fine-tuning of differentiation in Drosophila. Trends Genet, 4, 95-100, 1988.
Ferguson E. L., Sternberg P. W., Horvitz H. R. A genetic pathway for the specification of the vulval cell lineages of Caenorhabditis elegans. Nature, 326, 259-267, 1987.
Greenwald I. The lin-12 locus of Caenorhabditis elegans. Bioessays, 6, 70-73, 1987.
33. Hughes S. M., Lillien L. E., RaffM. C., Rohrer H., Sendtner M. Ciliary neurotrophic factor induces type-2 astrocyte differentiation in culture. Nature, 335, 70-73, 1988.
RaffM. C., Abney E.R., Fok-Seang J. Reconstitution of a developmental clock in vitro: a critical role for astrocytes in the timing of oligodendrocyte differentiation. Cell, 42, 61-69, 1985.
Raff M. C., Miller R., Noble M. A glial progenitor cell that develops in vitro into an astrocyte or an aligodendrocyte depending on the culture medium. Nature, 303, 390-396, 1983.
Richardson W.D., Pringle N. Mosley M., Westermark В., Dubois-Dalcq M. A role for platelet-derived growth factor in normal gliogenesis in the central nervous system. Cell, 53, 309-319, 1988.
Temple S., Raff M. C. Clonal analysis of oligodendrocyte development in culture:evidence for a developmental clock that counts cell divisions. Cell, 44, 773-779, 1986.
34. Malacinski G. M., Bryant S. V., eds. Pattern formation: A Primer in Developmental Biology. New York, Macmillan, 1984.
Meinhardt H. Models of Biological Pattern Formation. New York, Academic Press, 1982.
Theories of Biological Pattern Formation. Philos. Trans. R. Soc. Lond. (Biol.), 295, 425-617, 1981.
35. Bode P. M., Bode H. R. Patterning in Hydra. In Pattern Formation: A Primer in Developmental Biology (G. Malacinski, S.V. Bryant, eds.), pp. 213-241, New York, Macmillan, 1984.
Jqffe L. F. The role of ionic currents in establishing developmental pattern. Philos. Trans. R. Soc. Lond. (Biol.), 295, 553-566, 1981.
Lenhoff H.M., Lenhoff S.G. Trembleys polyps. Sci. Am., 258 (4), 86-91, 1988. Lohs-Schardin M. Dicophalic - a Drosophila mutant affecting polarity in follicle organization and embryonic patterning. Wilhelm Roux's Arch. 191, 28-36, 1982.
Robinson K. R., Cone R. Polarization of fucoid eggs by a calcium ionophore gradient. Science, 207, 77-78, 1980.
36. Wolpert L. Positional information and pattern formation. Curr. Top. Dev. Biol., 6, 183-224, 1971.
37. Lewis J., Slack J. M. W., Wolpert L. Threshold in development. J. Theor. Biol., 65, 579-590, 1977.
38. Crick F.H.C. Diffusion in embryogenesis. Nature, 225, 420-422, 1970.
39. Sounders J. W. Jr., Gasseling M. Т., Cairns J. M. The differentiation of prospective thigh mesoderm grafted beneath the apical ectodermal ridge of the wing bud in the chick embryo. Dev. Biol., 1, 281-301, 1959.
40. Bryant S. V., Gardiner D. M., Muneoka K. Limb development and regeneration. Am. Zool., 27, 675-696, 1987.
Butler E. G. Regeneration of the urodele forelimb after reversal of its proximodistal axis: J. Morphol., 96, 265-282, 1955.
Goss R.J. Principles of Regeneration. New York, Academic Press, 1969. Wallace H. Vertebrate Limb Regeneration. New York, Wiley, 1981.
41. Fallon J. F., et al, eds. Limb Development and Regeneration, Parts A and B. Prog. Clin. Biol. Res., 110, 1983.
Wolpert L. Pattern formation in biological development. Sci. Am. 239(4), 154-164, 1978.
42. Maden M. Retinoids and the control of pattern limb development and regeneratioa Trends Genet., 1, 103-107, 1985.
Thaller C., Eichele G. Identification and spatial distribution of retinoids in the developing chick limb bud. Nature, 327, 625-628, 1987.
Tickle C. The number of polarizing region cells required to specify, additional digits in developing chick wing. Nature, 289, 295-298, 1981.
Tickle C., SummerbellD., WolpertL. Positional signalling and specification of digits in chick limb morphogenesis. Nature, 254, 199-202, 1975.
43. Bohn H. Tissue interactions in the regenerating cockroach leg. In Insect Development (P. A. Lawrence, ed.), Royal Entomological Society of London Symposium No. 8, pp. 170-185, Oxford, U. K., .Blackwell, 1976.
Bryant P. J., Bryant S. V., French V. Biological regeneration and pattern formation. Sci. Am., 237(1),66-81, 1977.
Bryant P. J., Simpson P. Intrinsic and extrinsic control of growth in developing organs. Q. Rev. Biol., 59, 387-415, 1984.
Lewis J. Simpler rules for epimorphic regeneration: the polar-coordinate model without polar coordinates. J. Theor. Biol., 88, 371-392, 1981.
44. Akam M. The molecular basis for metameric pattern in the Drosophila embryo, Development, 101, 1-22, 1987.
Garcia-Bellido A., Lawrence P. A., Morata G. Compartments in animal development. Sci. Am., 241(1), 102-111, 1979. Ingham P. W. The molecular genetics of embryonic pattern formation in Drosophila. Nature, 335, 25-34, 1988.
Scott M. P., O'Farrell P. H. Spatial programming of gene expression in early Drosophila embryogenesis. Annu. Rev. Cell Biol., 2, 49-80, 1986.
45. Martinez-Arias A., Lawrence P. A. Parasegments and compartments in the Drosophila embryo. Nature, 313, 639-642, 1985.
46. Foe V.E., Alberts B.M. Studies of nuclear and cytoplasmic behavior during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis. J. Cell Sci., 61, 31-70, 1983.
Sander K. Morphogenetic movements in insect embryogenesis. In Insect Development (P. A. Lawrence, ed.), Royal Entomological Society of London Symposium 8, pp. 35-52. Oxford, U.K., Blackwell, 1976.
Technau G. M. A single cell approach to problems of cell lineage and commitment during embryogenesis of Drosophila melanogaster. Development, 100, 1-12, 1987.
47. Anderson K. V. Dorsal-ventral embryonic pattern genes of Drosophila. Trends Genet., 3, 91-97, 1987.
48. Driever W., Nusslein-Volhard C. The bicoid protein determines position in the Drosophila embryo in a concentration-dependent manner. Cell, 54, 95-104, 1988.
Driever W. Nüsslein-Volhard C. A gradient of bicoid protein in Drosophila embryos. Cell, 54, 83-93, 1988.
Lawrence P. A. Background to bicoid. Cell, 54, 1-2, 1988.
Nüsslein-Volhard C., Frohnhöfer H.G., Lehmann R. Determination of anteroposterior polarity in Drosophila. Science, 238, 1675-1681, 1987.
Sander K. Embryonic pattern formation in insects: basic concepts and their experimental foundations. In Pattern Formation: A Primer in Developmental Biology (G. Malacinski, S. V. Bryant, eds), pp. 245-268, New York, Macmillan, 1984.
49. Nüsslein-Volhard C., Wieshaus E. Mutations affecting segment number and polarity in Drosophila., Nature, 287, 795-801, 1980.
50. Gaul U., Jäckle H. How to fill a gap in the Drosophila embryo. Trends Genet. 3, 127-131, 1987.
Gaul U., Jäckle H. Pole region-dependent repression of the Drosophila gap gene Kruppel by maternal gene products. Cell, 51, 549-555, 1987.
Hafen E., Küroiwa A., Gehring W.J. Spatial distribution of the transcripts from the segmentation gene fushi tarazu during Drosophila embryonic development. Cell, 37, 833-841, 1984.
51. Jäckle H., Tautz D., Schuh R., Seifert E., Lehmann R. Cross-regulatory interactions among the gap genes of Drosophila. Nature, 324, 668-670, 1986.
52. Ish-Horowicz D., Howard K. R., Pinchin S. M., Ingham P. W. Molecular and genetic analysis of the hairy locus in Drosophila. Cold Spring Harbor Symp., 50, 135-144, 1985.
Weir M. P., Kornberg T. Patterns of engrailed and fushi tarazu transcripts reveal novel intermediate stages in Drosophila segmentation. Nature, 318, 433-439, 1985.
53. DiNardo S., Sher E., Heemskerk-Jongens J., Kastis J. A., O'Farrell P. H. Two-tiered regulation of spatially patterned engrailed gene expression during Drosophila embryogenesis. Nature, 332, 604-609, 1988.
Ingham P. W., Baker N. E., Martinez-Arias A. The products offtz and eve genes act as a positive and negative regulators of engrailed and wingless expression in the Drosophila blastoderm. Nature, 331, 73-75, 1988.
Martinez-Arias A., Baker N. E., Ingham P. W. Role of segment polarity genes in the definition and maintenance of cell states in the Drosophila embryo. Development, 103, 157-170, 1988.
Rijsewijk F., et al. The Drosophila homolog of the mouse mammary oncogene int-1 is identical to the segment polarity gene wingless. Cell, 50, 649-657, 1987.
54. Lewis E. B. A gene complex controlling segmentation in Drosophila. Nature, 276, 565-570, 1978. Morata G., Lawrence P. A. Homeotic genes, compartments and cell determination in Drosophila. Nature, 265, 211-216, 1977.
Struhl G. A homeotic mutation transforming leg to antenna in Drosophila. Nature, 292, 635-637, 1981.
Wakimoto В. Т., Kaufman Т. С. Analysis of larval segmentation in lethal genotypes associated with Antennapedia gene complex in Drosophila melanogaster. Dev. Biol., 81, 51-64, 1981.
55. Akam M. E. Segments, lineage boundaries and the domains of expression of homeotic genes. Philos. Trans. R. Soc. Lond. (Biol.), 312, 179-187, 1985.
Harding K., Wedeen C., McGinnis W., Levine M. Spatially regulated expression of homeotic genes in Drosophila. Science, 229, 1236-1242, 1985.
56. Akam M. The molecular basis for metameric pattern in the Drosophila embryo. Development, 101, 1-22, 1987.
Lawrence P. A., Morata G. The elements of the bithorax complex. Cell, 35, 595-601, 1983.
Struhl G., White R. A. Regulation of the Ultrabithorax gene of Drosophila by other bithorax complex genes. Cell, 43, 507-519, 1985
57. Ashburner М., Wright Т. F., eds. The Genetics and Biology of Drosophila. vol 2C, London, U.K., Academic Press, 1978.
Gehring W., Nothiger R., The imaginal discs of Drosophila. In Developmental Systems: Insects (S. Counce, C.H. Waddington, eds.), vol. 2, pp. 211-290, New York, Academic Pess, 1973.
Hadorn E. Transdetermination in cells. Sci. Am., 219(5), 110-120, 1968.
58. Nöthiger R. Clonal analysis in imaginal discs. In Insect Development (P. A. Law rence, ed.) Royal Entomological Society of London Symposium No. pp. 109-117, Oxford, U.K., Blackwell, 1976.
Stern C. Genetic Mosaics and Other Essays. Cambridge, Harvard University Press, 1968.
Struhl C. Genes controlling segment specification in the Drosophila thorax. Proc Natl. Acad. Sci. USA, 79, 7380-7384, 1982.
59. Crick F. H. C., Lawrence P. A. Compartments and polyclones in insect development Science, 189, 340-347, 1975.
Garcia-Bellido A., Lawrence P. A., Morata G. Compartments in animal development. Sci. Am., 241(1), 102-111, 1979.
Kornberg Т., Siden I., O'Farrell P., Simon M. The engrailed locus of Drosophila: in situ localization of transcripts reveals compartment-specific expression. Cell, 40
45-53, 1985. Simpson P., Morata G. Differential mitotic rates and patterns of growth in compartments in the Drosophila wing. Dev. Biol., 85, 299308, 1981.
60. Desplan G., Theis J. O'Farrell P.H. The sequence specificity of homeodomain-DNA interaction. Cell, 54, 1081-1090, 1988.
Hiromi Y., Gehring W.J. Regulation and function of the Drosophila segmentation gene fushi tarazu. Cell, 50, 963-974, 1987.
RobertsonM. A genetic switch in Drosophila morphogenesis. Nature, 327, 556-557, 1987.
61. Bender W., et al. Molecular genetics of the bithorax complex in Drosophila melanogaster. Science, 221, 23-29, 1983.
Peifer M., Karch F., Bender W. The bithorax complex: control of segmental identity, Genes Dev., 1, 891-898, 1987.
Struhl G., Akam M. Altered distributions of Ultrabithorax transcripts in extra sex combs mutant embryos of Drosophila. EMBO J., 4, 3259-3264, 1985.
62. Desplan C., Theis J. O'Farrell P. H. The sequence specificity of homeodomain-DNA interaction. Cell, 54, 1081-1090, 1988.
Gehring W.J. Homeo boxes in the study of development. Science, 236, 1245-1252, 1987.
Scott M. P., Carroll S. B. The segmentation and homeotic gene network in early Drosophila development. Cell, 51, 689-698, 1987.
63. Beeman R. W. A homeotic gene cluster in the red flour beetle. Nature, 327, 247-249, 1987.
McGinnis W., Garber R. L., Wirz J., Kuroiwa A., Gehring W.J. A homologous protein-coding sequence in Drosophila homeotic genes and its conservation in other metazoans. Cell, 37, 403-408, 1984.
Müller M. M., Carrasco A. E., De Robertis E. M. A homeo-boxcontaining gene expressed during oogenesis in Xenopus. Cell, 39, 157-162, 1984.
64. Dressier G. R., Gruss P. Do multigene families regulate vertebrate development? Trends Genet., 4, 214-219, 1988.
Hogan В., Holland P., Schofield P. How is the mouse segmented? Trends Genet, 1,1 67-74, 1985. HollandP. W. H., Hogan B. L. M. Expression of homeotic genes during mouse development; a review. Genes Dev., 2, 773-782, 1988.
Kieny M., Mauger A., Sengel P. Early regionalization of the somitic mesoderm as studied by the development of the axial skeleton of the chick embryo. Dev. BioL 28, 142-161, 1972.
Keynes R.J., Stern C.D. Mechanisms of vertebrate segmentation. Development, 103, 413-429, 1988.
65. Gardner R.L. Cell mingling during mammalian embryogenesis. J. Cell Sci., Suppl 4, 337-356, 1986.
Steinberg M.S. Does differential adhesion govern self-assembly processes in histogenesis? Equilibrium configurations and the emergence of a hierarchy among populations of embryonic cells. J. Exp. Zool., 173, 395-434, 1970.
Townes P.L., Holtfreter J. Directed movements and selective adhesion of embryonic amphibian cells. J. Exp. Zool., 128, 53-120, 1955.
66. Edelman G. M. Cell adhesion molecules in the regulation of animal form and tissue pattern. Annu. Rev. Cell Biol, 2, 81-116, 1986.
McClay D. R., Ettensohn C. A. Cell adhesion in morphogenesis. Annu. Rev. Cell Biol., 3, 319-345, 1987. Takeichi M. The cadherins: cell-cell adhesion molecules controlling animal morphogenesis. Development, 102, 639-655, 1988.
67. Bagaert Т., Brown N.. Wilcox M. The Drosophila PS2 antigen is an invertebrate integrin that, like the fibronectin receptor, becomes localized to muscle attachments. Cell, 51, 929-940, 1987.
Duband J. L., et al. Adhesion molecules during somitogenesis in the avian embryo. J. Cell Biol., 104, 1361-1374, 1987.
Leptin M., Wilcox M. The Drosophila position-specific antigens: clues to their morphogenetic role. Bioessays, 5, 204-207, 1986.
Nose A., Nagafuchi A., Takeichi M. Expressed recombinant cadherins mediate cell sorting in model systems. Cell, 54, 993-1001, 1988.
68. Spemann H. Embryonic Development and Induction, pp. 260-296, New Haven, Yale University Press, 1938 (Reprinted, New York, Garland, 1988.)
Wessells N. K., Tissue Interactions and Development. Menlo Park, CA, Benjamin-Cummings, 1977.
69. Bernfield M., Banerjee S. D., Koda J. E., Rapraeger A. C. Remodelling of the basement membrane as a mechanism of morphogenetic tissue interaction. In The Role of the Extracellular Matrix in Development (R. L. Trelstad, ed.), pp. 545-572, Symp. Soc. Dev. Biol., 42, New York, Liss, 1984.
Ekblom P. W., Vestweder D., Kemler R. Cell-matrix interactions and cell adhesion during development. Annu. Rev. Cell Biol., 2, 27-47, 1986. Harris A. K., Stopak D., Warner P. Generation of spatially periodic patterns by a mechanical instability: a mechanical alternative to the Turing model. J. Embryol. Exp. Morphol., 80, 1-20, 1984.
Sengel P. Morphogenesis of Skin. Cambridge, U. K., Cambridge University Press, 1976.
70. Chevallier A., Kieny M., Mauger A. Limb-somite relationship: origin of the limb musculature. J. Embryol. Exp. Morphol., 41, 245-258, 1977. Christ В., Jacob H. J., Jacob M. Experimental analysis of the origin of the wing musculature in avian embryos. Anat. Embryol., 150, 171-186, 1977.
Stopak D., Harris A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol., 90, 383-398, 1982.
71. Bryant S. V., Gardiner D. M., Muneoka K. Limb development and regeneration. Am. Zool., 27, 675-696, 1987.
Chevallier A. Role of the somitic mesoderm in the development of the thorax in bird embryos. II. Origin of thoracic and appendicular musculature. J. Embryol. Exp. Morphol., 49, 73-88, 1979.
Kieny M., Chevallier A. Autonomy of tendon development in the embryonic chick wing. J. Embryol. Exp. Morphol., 49, 153-165, 1979.
Martin P., Lewis J. Normal development of the skeleton in chick limb buds devoid of dorsal ectoderm. Dev. Biol., 118, 233-246, 1986.
72. Bronner-Fraser M. An antibody to a receptor for fibronectin and laminin perturbs cranial neural crest development in vivo. Dev. Biol., 117, 528-536, 1986.
Chabot В., Stephenson D. A., Chapman V.M. Besmer P., Bernstein A. The protooncogene c-kit encoding a transmembrane tyrosine kinase receptor maps to the mouse W locus. Nature, 335, 88-89, 1988.
Dufour S., Duband J. L., Konblihtt A. R., Thiery J. P. The role of fibronectins in embryonic cell migration. Trends Genet., 4, 198-203, 1988.
Mackie E. J., et al. The distribution of tenascin coinsides with pathways of neural cell migration. Development, 102, 237-250, 1988.
Weston J. Phenotypic diversification in neural crest-derived cells: the time and stability of commitment during early development. Curr. Top. Dev. Biol., 20, 195-210, 1986.
Wylie C. C., Stott D., Donovan P. J. Primordial germ cell migration. Developmental Biology: A Comprehensive Synthesis. Vol. 2: The Cellular Basis of Morphogenesis (L.W. Browder, ed.), pp. 433-448, New York, Plenum, 1986.
73. Purves D., Lichtman J. W., Principles of Neural Development. Sunderland, MA, Sinauer, 1985.