Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Иммунная система
Функциональные свойства антител
Позвоночные животные быстро погибают от инфекции, если они неспособны вырабатывать антитела. Антитела защищают нас от инфекций, инактивируя вирусы или бактериальные токсины и мобилизуя систему комплемента и различные типы лейкоцитов, которые убивают внедрившиеся микроорганизмы и более крупных паразитов. Синтезируемые исключительно В-лимфоцитами, антитела вырабатываются в миллионах разновидностей, каждая со своей аминокислотной последовательностью и своим участком для связывания антигена. В совокупности называемые иммуноглобулинами (сокращенно Ig), они составляют один из главных белковых компонентов крови - по весу примерно 20% суммарного белка плазмы. В этом разделе мы рассмотрим пять классов антител, имеющихся у высших позвоночных, каждый из которых осуществляет после связывания антигена характерный биологический ответ.
18.2.1. Антиген-специфические рецепторы на В-клетках - это молекулы антител [12]
Как и предсказывает теория клональной селекции, все молекулы антител, производимые какой-то одной В-клеткой, имеют одинаковый антиген-связывающий участок. Первые антитела, синтезированные вновь образовавшейся клеткой, не секретируются; вместо этого они встраиваются в плазматическую мембрану, где служат рецепторами для антигена. Каждая В-клетка имеет на своей плазматической мембране приблизительно 105 таких молекул.
Когда антиген присоединяется к молекулам антител на поверхности виргильной В-клетки или В-клетки памяти, это обычно инициирует сложную цепь событий, приводящую к клеточной пролиферации и созреванию клеток памяти или активных (секретирующих антитела) клеток. Активные клетки вырабатывают большие количества растворимых (не связанных с мембраной) антител с тем же антиген-связывающим участком, что и у антител на клеточной поверхности, и выделяют эти антитела в кровь. Активные В-клетки могут начать секретировать антитела, будучи еще малыми лимфоцитами, но конечная стадия этого пути дифференцировки - большая плазматическая клетка (см. рис. 18-4, В), которая выделяет антитела со скоростью около 2000 молекул в секунду. По-видимому, плазматические клетки используют для производства антител столь значительную часть мощности своего белок-синтезирующего аппарата, что не способны к дальнейшему росту и делению и через несколько дней погибают.
18.2.2. Можно стимулировать выработку антител В-клетками в культуральной чашке [13]
В 60-х годах были достигнуты успехи, открывшие новые пути изучения В-клеток. Первым из них была разработка метода локального гемолиза,
который позволил идентифицировать и подсчитывать индивидуальные активные В-клетки, вырабатывающие антитела к определенному антигену. В простейшем варианте этого метода берут лимфоциты (обычно из селезенки) у животного, иммунизированного бараньими эритроцитами (БЭ). Их помещают затем в агар вместе с избытком БЭ. В результате на чашке получается «газон» из иммобилизованных БЭ с вкраплением лимфоцитов. В этих условиях клетки не могут передвигаться, но любые выделяемые В-клеткой антитела будут диффундировать и покрывать поверхность всех БЭ, находящихся поблизости. Такие покрытые антителами эритроциты можно лизировать, добавив комплемент (разд. 18.5). Таким образом, присутствие каждой выделяющей антитела клетки обнаруживается по прозрачному пятну («бляшке») в темном слое БЭ. Аналогичный метод можно использовать для подсчета клеток, вырабатывающих антитела к другим антигенам, таким как белки или полисахариды, если присоединить эти антигены к поверхности бараньих эритроцитов.
Вторым важным успехом было установление того факта, что можно заставить В-клетки вырабатывать антитела, приводя их в контакт с антигеном в культуре, где можно контролировать взаимодействия клеток и условия среды. В результате удалось выяснить, что для стимуляции секреции антител В-лимфоцитами под действием большинства антигенов необходимы еще Т-лимфоциты и специализированные антиген-представляющие клетки; происходящие при этом межклеточные взаимодействия будут описаны позже (разд. 18.6.12).
18.2.3. Антитела имеют два идентичных антиген-связывающих участка [11]
Простейшие молекулы антител имеют форму буквы Y с двумя идентичными антиген-связывающими участками - по одному на конце каждой из двух «ветвей» (рис. 18-12). Поскольку таких участков два, эти антитела называют бивалентными. Такие антитела могут сшивать молекулы антигена в обширную сеть, если каждая молекула антигена имеет три или большее число антигенных детерминант (рис. 18-13). Достигнув определенных размеров, такая сеть выпадает из раствора. Тенденция больших иммунных комплексов к осаждению (преципитации) удобна для выявления антител и антигенов. Эффективность реакций связывания и сшивания антигена значительно возрастает благодаря гибкому нармирному участку антитела: он позволяет изменять расстояние между двумя антиген-связывающими участками (рис. 18-14).
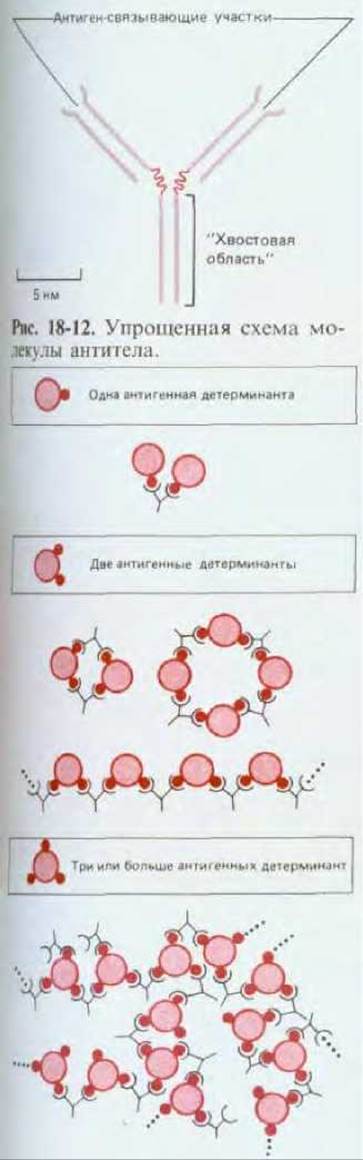
Рис. 18-13. Поскольку антитела имеют два идентичных антиген-связывающих участка, они могут сшивать антигены. Типы образующихся комплексов антиген-антитело зависят от числа антигенных детерминант у антигена. Здесь показано связывание антитела одного вида (моноклонального антитела) с антигенами, имеющими одну, две или три одинаковые антигенные детерминанты. Антигены с двумя детерминантами могут образовывать с антителами небольшие циклические комплексы или линейные цепи, а антигены с тремя или большим числом детерминант могут формировать обширные трехмерные сети, легко выпадающие в осадок.

Рис. 18-14. Шарнирный участок молекулы антитела повышает эффективность связывания молекул антигена и сшивания их друг с другом
Защитное действие антител объясняется не просто их способностью связывать антиген. Они выполняют и целый ряд других функций, в которых участвует «хвост» Y-образной молекулы. Эта область молекулы определяет, что произойдет с антигеном, когда он будет связан. Благодаря особенностям биосинтеза иммуноглобулинов антитела с одинаковыми антиген-связывающими участками могут иметь весьма разные «хвостовые» области (разд. 18.4.7), каждая из которых придает антителам особые функциональные свойства, например способность активировать комплемент (разд. 18.5.1) или присоединяться к фагоцитирующим клеткам (разд. 18.2.5).
18.2.4. Молекула антитела состоит из двух идентичных легких цепей и двух идентичных тяжелых цепей [14]
Основную структурную единицу в молекуле антитела образуют четыре полипептидные цепи - две идентичные легкие (L-цепи, каждая примерно из 220 аминокислот) и две идентичные тяжелые (Н-цепи, каждая примерно из 440 аминокислот). Все четыре цепи соединены между собой нековалентными и ковалентными (дисульфидными) связями. Молекула состоит из двух одинаковых половинок, имеющих идентичные антиген-связывающие участки; связывающая антиген поверхность обычно образуется при участии одной L- и одной Н-цепи (рис. 18-15).
Протеолитические ферменты папаин и пепсин расщепляют молекулы антител на различные характерные фрагменты. Папаин дает два отдельных идентичных Fab-фрагмента (Fab - сокращение слов fragment antigen binding), каждый из которых обладает одним антиген-связывающим участком, и один Fc-фрагмент (Fc означает «кристаллизующийся фрагмент», от crystallizable). Пепсин дает один крупный F(аb')2-фрагмент, состоящий из двух ковалентно связанных F(ab')-фрагментов (каждый из которых немного больше, чем Fab-фрагмент), и много мелких фрагментов (рис. 18-16). Поскольку F(ab')-фрагменты бивалентны, они в отличие от моновалентных Fab-фрагментов сохраняют способность сшивать антигены и образовывать преципитаты. Ни один из этих фрагментов не обладает другими биологическими свойствами нативных молекул антител, так как не содержит «хвостовой» (Fc) области, ответственной за эти свойства.
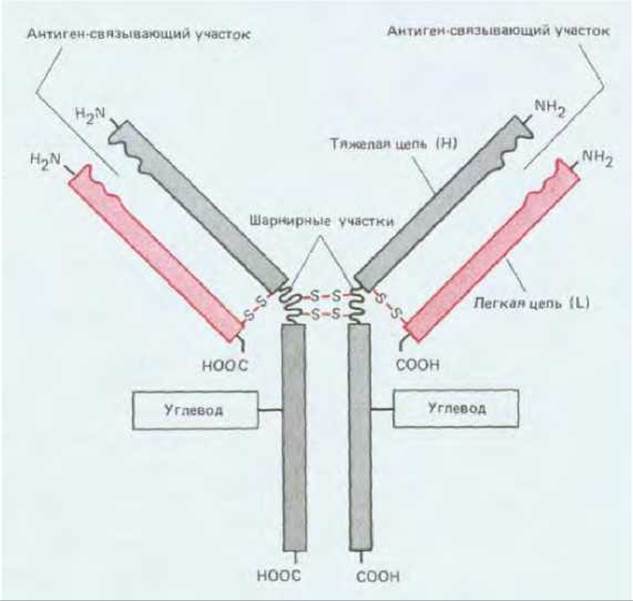
Рис. 18-15. Типичная молекула антитела состоит из двух идентичных тяжелых (Н) и двух идентичных легких (L) цепей. Обратите внимание, что антиген-связывающие участки формируются за счет комплекса N-концевых областей L-и Н- цепей, а «хвостовую» и шарнирную области образуют только Н-цепи. Каждая Н-цепь содержит одну или несколько олигосахаридных (углеводных) цепочек, функция которых не известна.
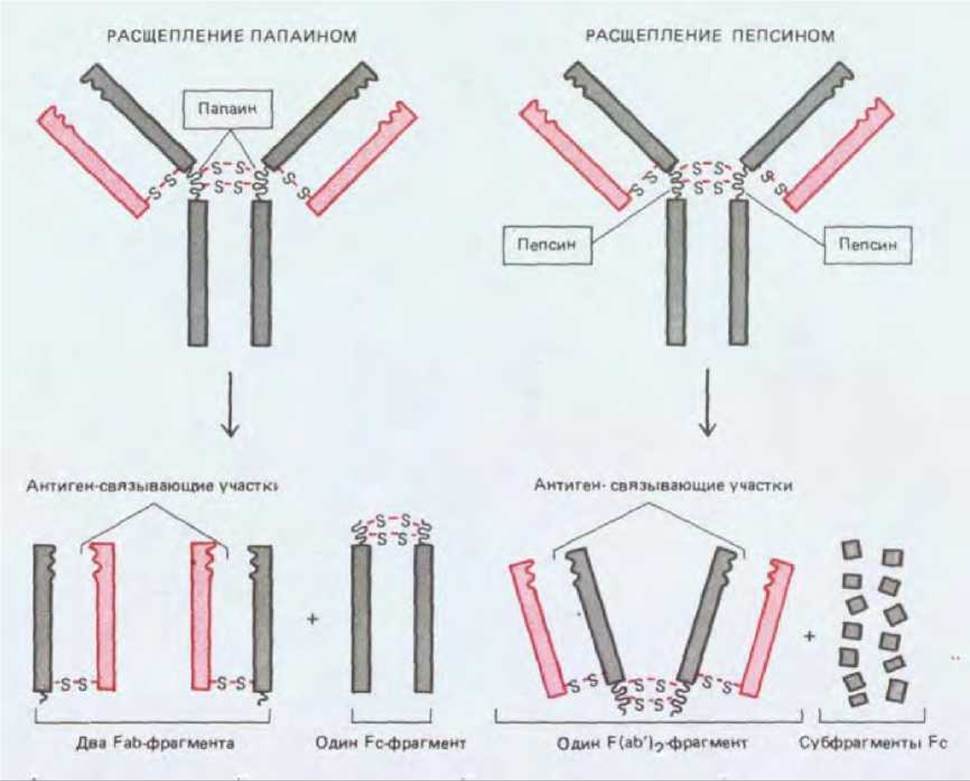
Рис. 18-16. Фрагменты, образующиеся при расщеплении молекул антител протеолитическими ферментами папаином и пепсином.
18.2.5. Существуют пять классов Н-цепей, каждый со своими особыми биологическими свойствами [11, 15]
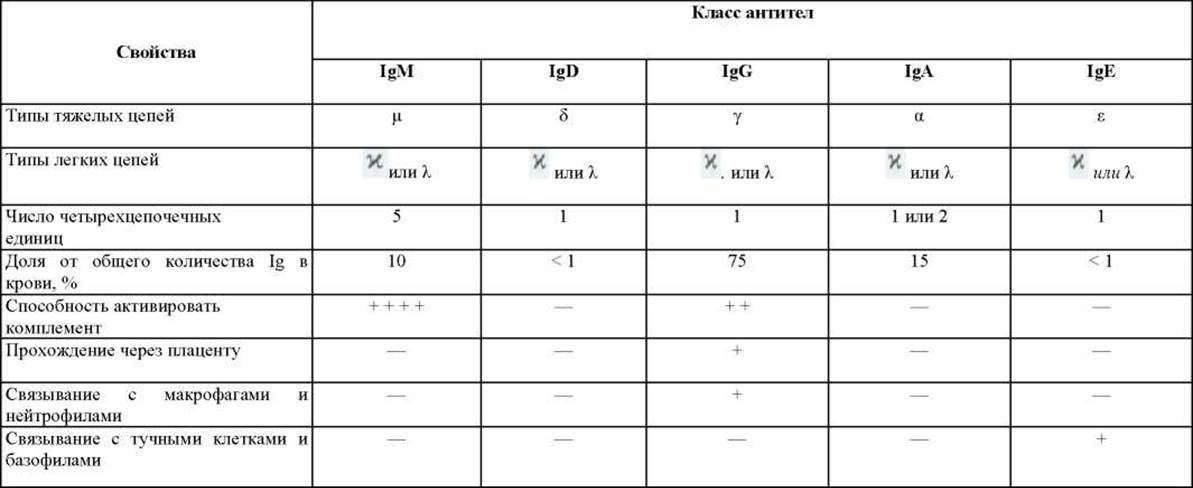
У высших позвоночных существуют пять классов антител - IgA, IgD, IgE, IgG и IgM, каждый со своим классом Н-цепей а, δ, ε, у и μ, соответственно. Молекулы IgA содержат а -цепи, молекулы IgG- у-цепи и т.д. (табл. 18-1). Кроме того, имеется ряд подклассов иммуноглобулинов IgG и IgA; например, у человека существует четыре подкласса IgG (IgG1, IgG2, IgG3 и IgG4), содержащих тяжелые цепи у1, у2, у3 и у4 соответственно. Разные Н-цепи придают шарнирным участкам и «хвостовым» областям антител различную конформацию и определяют характерные свойства каждого класса и подкласса (см. табл. 18-1).
IgM-это всегда первые антитела, продуцируемые развивающимися В-клетками, хотя многие В-клетки со временем переключаются на выработку антител других классов (разд. 18.4.7). Непосредственный предшественник В-клетки, так называемая пре-В-клетка, вначале вырабатывает только μ-цепи и накапливает их. Позднее в клетке начинают синтезироваться и легкие цепи; они соединяются с μ-цепями, образуя с ними четырехцепочечные молекулы IgM (каждая с двумя ц -цепями и двумя легкими цепями), которые встраиваются в плазматическую мембрану. Таким образом, клетка приобретает поверхностные рецепторы, с помощью которых она может связать антиген, и с этого момента ее называют виргильным В-лимфоцитом. Многие из виргильных В-клеток вскоре начинают вырабатывать также и поверхностные молекулы IgD, имеющие тот же антиген-связывающий участок, что и молекулы IgM.
Таблица 18-1. Свойства основных классов антител, образующихся у человека
IgM - не только первый класс антител, появляющихся на поверхности развивающихся В-клеток; это также основной класс антител, выделяeмых в кровь на ранних стадиях первичного иммунного ответа. В секретаруемой форме IgM состоит из пяти четырехцепочечных единиц, так что в общей сложности IgM имеет 10 антиген-связывающих участков Каждый пентамер содержит полипептидную цепь еще одного типа, называемую J-цепью (joining chain). J-цепь синтезируется клетками. выделяющими IgM, и ковалентно встраивается между двумя смежными Fc-областями, где она замыкает кольцевую структуру олигомера и препятствует дальнейшей полимеризации (рис. 18-17).
Присоединение антигена к Fab-областям секретируемой пентамерной молекулы IgM индуцирует связывание Fc-областей с первым компонентом системы комплемента и его активацию. Если при этом антиген расположен на поверхности внедряющегося микроорганизма, то в результате активации система комплемента осуществляет биохимическую атаку, приводящую к гибели микроорганизма (разд. 18.5). Молекулы IgD в отличие от IgM редко секретируются активными В-клетками, и у них не известно никаких функций, кроме роли рецепторов для антигена.
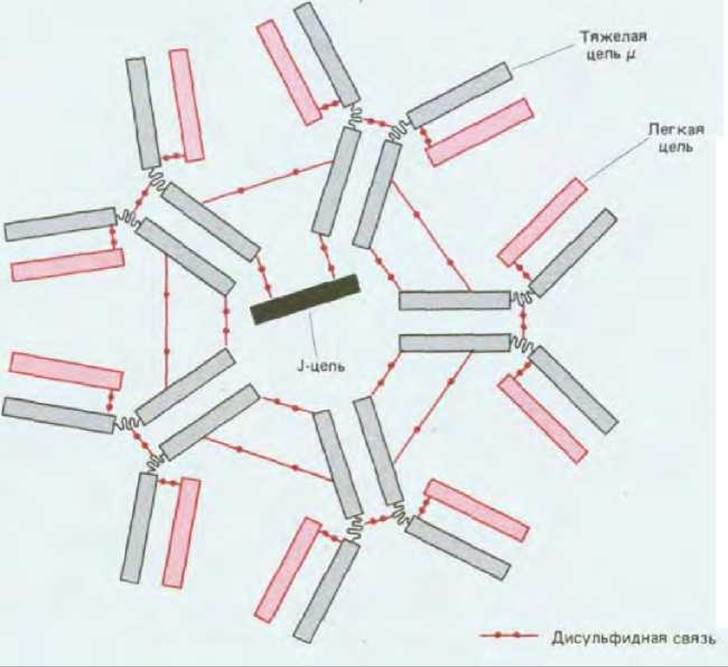
Рис. 18-17. Пентамерная молекула IgM. Пять субъединиц соединены дисульфидными связями. Единственная J-цепь (мол. масса ~15 000), связанная дисульфидными мостиками с двумя тяжелыми μ-цепями, замыкает кольцевую структуру и предотвращает дальнейшую полимеризацию. J-цепь гомологична одиночному домену Ig (разд. 18.3.3).
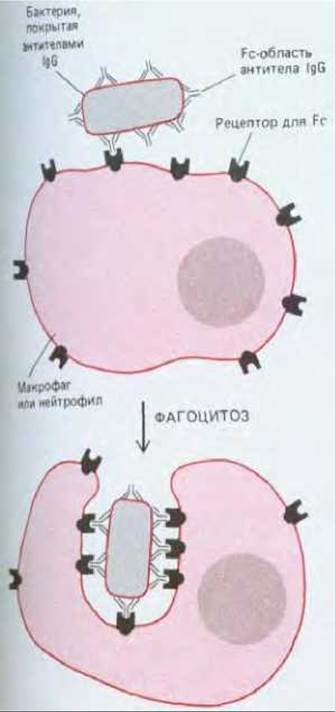
Рис. 18-18. Бактерия, покрытая антителами IgG, эффективно фрагоцитируется макрофагом или нейтрофилом с поверхностными рецепторами, способными связывать Fc- область молекулы IgG. Связывание покрытой антителами бактерии с этими Fc-рецепторами активирует процесс фагоцитоза (разд. 6.5.14).
Основной класс иммуноглобулинов, находящихся в крови, составляют IgG, производимые в больших количествах при вторичном иммунном ответе. Помимо активации системы комплемента Fc-область молекул IgG связывается со специфическими рецепторами макрофагов и нейтрофилов. В большой мере благодаря таким Fc-рецепторам эти фагоцитирующие клетки могут связывать, поглощать и разрушать внедрившиеся микроорганизмы, покрытые IgG-антителами, которые были выработаны в ответ на инфекцию (рис. 18-18). Различные типы лейкоцитов, несущие Fc-рецепторы, могут убивать также и покрытые IgG чужеродные эукариотические клетки, не фагоцитируя их. Этот процесс, называемый антителозависимой клеточной цитотоксичностью, могут осуществлять макрофаги, нейтрофилы и эозинофилы (см. ниже), а также клетки-киллеры (К-клетки). Киллеры - это лимфоцитоподобные клетки, специализированные, по-видимому, для убивания аномальных клеток собственного организма (разд. 18.6.4).
Молекулы IgG-единственные антитела, которые могут переходить от матери к плоду через плаценту. Клетки плаценты, соприкасающиеся с материнской кровью, имеют Fc-рецепторы, связывающие молекулы IgG, что обеспечивает их переход в кровеносную систему плода. Антитела сначала поглощаются путем эндоцитоза при участии рецепторов, а затем транспортируются в пузырьках через клетку и выводятся путем экзоцитоза в кровь плода (процесс, называемый трансцитозом, см. разд. 6.5.11). Антитела других классов не связываются с этими рецепторами и поэтому не могут проходить через плаценту.
IgA-основной класс антител в секретах (молоке, слюне, слезах, секретах дыхательных путей и кишечного тракта). Он представлен главным образом четырехцепочечными мономерами (подобно IgG) или же димерами, содержащими одну J-цепь и одну цепь, называемую секреторным компонентом (рис. 18-19). В составе секретов IgA представляет собой димер. Он транспортируется из внеклеточной жидкости в секретируемую жидкость таким же способом, как молекулы IgG-из материнской крови в кровь плода, т. е. путем трансцитоза. В данном случае в транспорте участвуют Fc-рецепторы особого типа, которые имеются на базальной поверхности эпителиальных клеток, выстилающих кишечник, бронхи или протоки молочных, слюнных или слезных желез. Здесь Fc-рецепторы связывают димеры IgA из внеклеточной жидкости (рис. 18-20).
Fc-область молекул IgE связывается с Fc-рецепторами еще одного типа, обладающими необычно высоким сродством к ней (Ка ~1010 л/моль). Эти рецепторы имеются на поверхности тучных клеток в тканях и базофилов в крови (разд. 17.5.1), а связанные ими молекулы IgE в свою очередь служат рецепторами для антигена. Присоединение антигена приводит к выделению клетками биологически активных аминов (в особенности гистамина, а у некоторых видов - серотонина) (рис. 18-21). Эти амины вызывают расширение кровеносных сосудов и увеличивают проницаемость их стенок; они в большой мере ответственны за клинические проявления таких аллергических реакций, как сенная лихорадка, астма и крапивница. Как полагают, при обычных обстоятельствах эти изменения кровеносных сосудов делают область воспаления более доступной для лейкоцитов, антител и компонентов комплемента. Тучные клетки секретируют также факторы, привлекающие и активирующие особый класс лейкоцитов - эозинофилы (разд. 17.5.1), которые могут убивать различного рода паразитов, особенно если те покрыты IgG-антителами.

Рис. 18-19. Строение димерной молекулы антител IgA, содержащихся в секретах (сильно упрощенная схема). В дополнение к двум мономерам IgA, которые связаны одним дисульфидным мостиком между тяжелыми а-цепями, комплекс содержит также J-цепь и добавочную полипептидную цепь с мол. массой 70000 дальтон, называемую секреторным компонентом. Как полагают, эта цепь защищает молекулы IgA от переваривания протеолитическими ферментами секретов.

Рис. 18-20. Механизм переноса димерной молекулы IgA через эпителиальную клетку. IgA связывается на базальной поверхности эпителиальной клетки со специализированным трансмембранным белком - Fc-рецептором. Комплексы рецептор-lgA поглощаются путем эндоцитоза при участии этого рецептора, переносятся в пузырьках через цитоплазму эпителиальной клетки и секретируются в проток железы на противоположной стороне клетки путем экзоцитоза. Здесь часть Fc-рецептора, связанная с димером IgA (секреторный компонент), отщепляется от трансмембранного «хвоста», высвобождая таким образом антитело в виде комплекса в проток. Во внеклеточную жидкость секреторных органов попадают димеры IgA из двух источников: одни вырабатываются в этих же органах плазматическими клетками, секретирующими IgA, а другие образуются в селезенке и лимфатических узлах, откуда переходят в кровяное русло и затем просачиваются из капилляров в разных тканях.
18.2.6. Антитела могут иметь или ϰ-, или λ,-цепи, но не те и другие
В дополнение к пяти классам Н-цепей у высших позвоночных в антителах имеются два типа L-цепей - ϰ и λ, каждый из которых может сочетаться с любой Н-цепью. Отдельная молекула антитела всегда состоит из двух идентичных L-цепей и двух идентичных Н-цепей; поэтому ее два антиген-связывающих участка всегда совершенно одинаковы. Такая симметрия имеет решающее значение для сшивающей функции секретируемых антител. Поэтому молекула Ig может иметь L-цепи ϰ и λ, но не ту и другую одновременно. Каких-либо различий в биологической функции этих двух типов L-цепей пока не установлено.

Рис. 18-21. Тучные клетки (и базофилы) пассивно приобретают поверхностные рецепторы, связывающие антиген. Антитела IgE, выделяемые активными В-лимфоцитами, попадают в ткани и связываются Fc-рецепторами на поверхности тучных клеток, специфически узнающими Fc-область этих антител. Поэтому отдельные тучные клетки (и базофилы) в отличие от В-клеток имеют на своей поверхности антитела с целым рядом различных антиген-связывающих участков. Когда молекула антигена присоединяется к этим мембраносвязанным антителам IgE и тем самым сшивает соседние молекулы IgE, она активирует тучную клетку и та высвобождает гистамин путем экзоцитоза.
18.2.7. Сила взаимодействия антигена с антителом зависит как от сродства, так и от числа связывающих участков [16]
Связывание антигена с антителом, так же как и субстрата с ферментом, обратимо. Оно определяется суммой многих относительно слабых нековалентных взаимодействий, включая гидрофобные и водородные связи, вандерваальсовы силы и ионные взаимодействия. Эти слабые взаимодействия эффективны только в том случае, если молекулы антигена и антитела настолько комплементарны друг другу, что некоторые атомы антигена входят в соответствующие углубления на поверхности антитела. Комплементарные антигену области четырехцепочечной молекулы антитела - это ее два идентичных антиген-связывающих участка; соответствующая область антигена - его антигенная детерминанта (рис. 18-22). Большинство антигенных макромолекул имеют много различных детерминант; если две из них или большее число (как в некоторых полимерах) одинаковы, антиген называют мультивалентным (рис. 18-23).
Обратимую реакцию между антигеном с одной антигенной детерминантой (Аг) и одним антиген-связывающим участком (Ат) можно представить следующим образом:
![]()
Точка равновесия зависит как от концентраций Ат и Аг, так и от силы их взаимодействия. Очевидно, что с увеличением концентрации Аг все большая доля Ат будет ассоциирована с Аг. Силу взаимодействия обычно выражают константой сродства (Kа) (см. рис. 3-7):
Ка = [АгАт]/[Аг][Ат]
(выражения в квадратных скобках означают концентрацию каждого из компонентов в состоянии равновесия).
Константу сродства, которую иногда называют константой ассоциации, можно определить, измерив концентрацию свободного Аг, необходимую для заполнения половины антиген-связывающих участков антитела. Когда половина участков заполнена, [АгАт] = [Ат] и К = 1/[Аг]. Таким образом, константа сродства антитела к антигену равна величине, обратной концентрации антигена, дающей половину максимального связывания. Обычные значения варьируют в широких пределах - от 5-104 до 1011 л/моль. Константа сродства, при которой молекулу иммуноглобулина перестают рассматривать как антитело к данному антигену, несколько произвольна, однако антитело с Ка ниже 104 вряд ли будет биологически эффективным; кроме того, маловероятно, что В-клетки с рецепторами, имеющими столь слабое сродство к антигену, будут им активироваться.
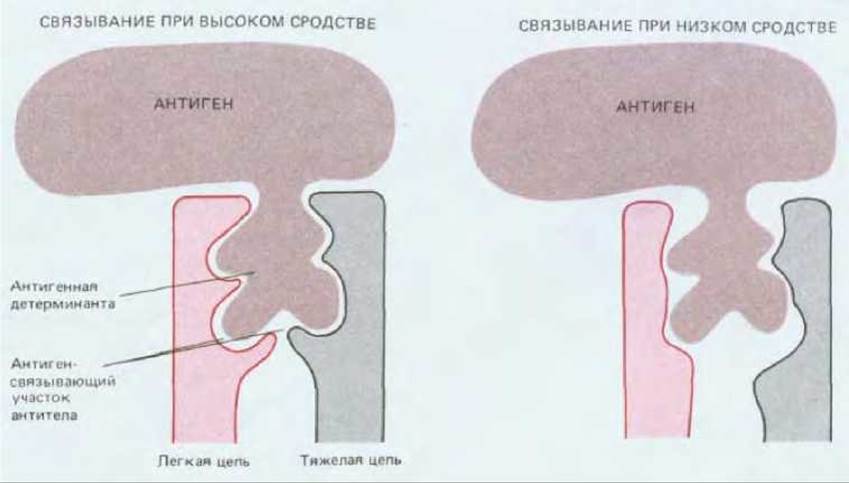
Рис. 18-22. Сильно упрощенная схема связывания антигенной детерминанты макромолекулы с антиген-связывающими участками двух различных антител - с высоким и с низким сродством к данному антигену. Антигенная детерминанта удерживается в связывающем участке различными слабыми нековалентными взаимодействиями. Обратите внимание на то, что в образование этого участка обычно вносят вклад как легкая, так и тяжелая цепи молекулы антитела.
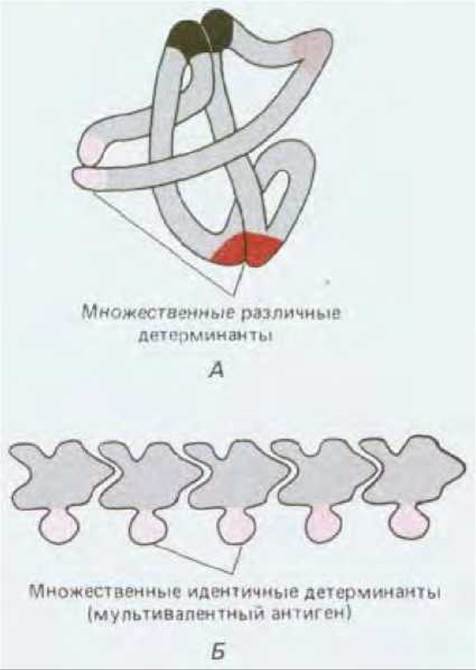
Рис. 18-23. Молекулы с множественными антигенными детерминантами. А. Глобулярный белок, имеющий ряд различных антигенных детерминант. Обратите внимание, что разные области полипептидной цепи могут в свернутой структуре сближаться друг с другом, образуя единую детерминанту на поверхности белка. Б. Полимерная структура с повторяющимися идентичными антигенными детерминантами; такую молекулу называют мультивалентным антигеном.
Сродство антитела отражает силу взаимодействия антигенной детерминанты с отдельным антиген-связывающим участком, каким бы ни было число таких участков. В отличие от этого общая авидность антитела по отношению к мультивалентному антигену (такому, как полимер с повторяющимися субъединицами) характеризует суммарную силу взаимодействия всех связывающих участков антитела, вместе взятых. Когда мультивалентный антиген взаимодействует более чем с одним антиген-связывающим участком антитела, сила связывания резко возрастает: для того чтобы антиген и антитело могли диссоциировать, все их связи друг с другом должны быть разорваны одновременно. Поэтому типичная молекула IgG при вовлечении в реакцию обоих антиген-связывающих участков будет связываться с мультивалентным антигеном по меньшей мере в 1000 раз сильнее, чем в случае, когда вовлечен лишь один участок.
По той же причине, если сродство отдельных антиген-связывающих участков IgG и IgM одинаково, молекула IgM (имеющая 10 таких участков) проявит несравненно большую авидность к мультивалентному антигену, чем молекула IgG (имеющая 2 участка). Различие в авидности, часто 10000-кратное или больше, весьма важно, так как антитела, образующиеся на ранних стадиях иммунного ответа, обычно обладаю: значительно меньшим сродством к антигену, чем те, которые вырабатываются позже. (Повышение среднего сродства продуцируемых антител с течением времени после иммунизации называется созреванием сродства - см. разд. 18.4.4.) Благодаря своей высокой общей авидности антитела IgM (основной класс Ig, вырабатываемых в начале иммунного ответа) могут эффективно функционировать даже при низком сродстве отдельных связывающих участков.
Заключение
Молекула антитела представляет собой белок, имеющий форму буквы Y с двумя идентичными антиген-связывающими участками на концах боковых ветвей (Fab-областей) и с участками для связывания с компонентами комплемента и/или различными рецепторами клеточной поверхности на «стебельке» (на Fc-области). Антитела защищают позвоночных от инфекций, инактивируя вирусы или бактериальные токсины и мобилизуя комплемент и различные клетки, которые убивают и поглощают внедрившиеся микроорганизмы.
Каждый клон В-клеток вырабатывает молекулы антител с уникальным антиген-связывающим участком. Вначале молекулы встраиваются в плазматическую мембрану клетки, где они служат рецепторами дм антигена. Когда к таким рецепторам присоединяется антиген, В-клетки активируются (обычно с помощью Т-клеток), начинают размножаться и созревают либо в клетки памяти, либо в активные клетки, выделяющие антитела с таким же антиген-связывающим участком, как и у антител встроенных в мембрану.
Каждая молекула антитела составлена из двух идентичных тяжелых (Н) цепей и двух идентичных легких (L) цепей. Как правило, част как Н~, так и L-цепей образуют антиген-связывающие участки. Существуют пять классов антител (IgA, IgD, IgE, IgG и IgM), имеющие соответственно различные Н-цепи (а, δ, ε, у и μ,). Н-цепи образуют также Fc-областъ антитела, от которой зависит, какие другие белки будут связываться с антителом, что в свою очередь определяет биологические свойства данного класса антител. С любым классом Н-цепей могут сочетаться L-цепи любого типа (ϰ или X). Тип L-цепи, по-видимому, не влияет на свойства антител.