Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Половые клетки и оплодотворение
Оплодотворение
После своего выхода из гонады как яйцеклетка, так и спермий обречены на гибель в считанные часы, если они не отыщут друг друга и не сольются в процессе оплодотворения. Оплодотворение спасает эти клетки от гибели: яйцеклетка активируется и приступает к осуществлению программы развития, а ядра двух гамет сливаются, формируя таким образом геном нового организма. Большая часть того, что нам известно об оплодотворении, - это результат исследований на морских беспозвоночных, в особенности на морских ежах (рис. 15-40). У подобных организмов оплодотворение осуществляется в морской воде, куда выводятся огромные количества сперматозоидов и яиц. Такой процесс наружного оплодотворения гораздо более доступен для изучения, чем внутреннее оплодотворение у млекопитающих, осуществляющееся в половых путях самки. В связи с этим наше обсуждение оплодотворения будет относиться главным образом к морским ежам. Несмотря на огромную эволюционную дистанцию, которая отделяет млекопитающих от морских ежей, клеточные и молекулярные механизмы, лежащие в основе процесса их оплодотворения, по-видимому, весьма сходны.

Рис. 15-40. Фотография двух видов морских ежей, обычно используемых при изучении оплодотворения. Наверху показан Strongylocentrotus purpuratus, внизу Strongylocentrotus franciscanus. Фотографии почти в натуральную величину. (С любезного разрешения Victor Vacquier.)
15.4.1. Контакт со студенистой оболочкой яйца инициирует у спермии морского ежа акросомальную реакцию [19]
У самки типичного морского ежа в организме содержится 107 яиц, а у самца - 1012 спермиев, что дает возможность получать гаметы морского ежа в очень больших количествах в виде чистых популяций, где все клетки находятся на одинаковой стадии развития. При смешении гамет различные этапы взаимодействия спермиев с яйцеклетками протекают синхронно с точностью до секунд. Процесс оплодотворения начинается в тот момент, когда головка спермия приходит в соприкосновение со студенистой оболочкой (рис. 15-24) яйцеклетки. Такой контакт инициирует у спермия акросомальную реакцию. В этой реакции содержимое акросомы выводится в окружающее пространство. У морских ежей и многих других морских беспозвоночных высвобождение содержимого акросомы сопровождается образованием длинного содержащего актин акросомального отростка, который вытягивается из переднего конца спермия. Как показано на рис. 15-41, кончик этого отростка покрывается компонентами бывшей мембраны акросомы, а также содержимым акросомы, включающим: 1) гидролитические ферменты, с помощью которых спермий проходит через студенистую оболочку яйцеклетки и достигает вителлинового слоя; 2) специфические белки, обеспечивающие связывание верхушки отростка с вителлиновым слоем (см. ниже), и 3) гидролитические ферменты, благодаря которым акросомальный отросток прокладывает себе путь сквозь этот слой к плазматической мембране яйцеклетки. При контакте мембрана на кончике акросомального отростка сливается с мембраной яйцеклетки, что позволяет ядру сперматозоида войти в яйцеклетку (рис. 15-41).
У спермиев морского ежа акросомальную реакцию вызывает полисахаридный компонент (полимер сульфатированной фруктозы) студенистой оболочки яйца: если выделить это вещество из яиц и добавить его к сперматозоидам, оно за несколько секунд инициирует обычную акросомальную реакцию. Полисахарид студенистой оболочки связывается с гликопротеиновым рецептором плазматической мембраны спермия, вызывая ее деполяризацию; по-видимому, в результате такой деполяризации в мембране открываются каналы для Са2+, что позволяет ионам Са2+ войти в спермий. В то же время полисахарид студенистой оболочки активирует протонные насосы плазматической мембраны спермия; эти насосы обеспечивают отток из клетки ионов Н+ в обмен на Na+. Обусловленное этим повышение рН в головке спермия и увеличение концентрации цитозольного Са2+ инициируют акросомальную реакцию. Было высказано предположение, что при повышении внутриклеточного рН неполяризованный актин в цитоплазме спермия отделяется от особых белков, в норме связывающих актин и блокирующих его полимеризацию (см. разд. 11.2.12); это приводит к формированию акросомального отростка в результате «взрывной» полимеризации актина.

Рис. 15-41. На этой схеме показаны подробности акросомальной реакции у морского ежа. При соприкосновении спермия со студенистой оболочкой яйца содержимое акросомы высвобождается путем экзоцитоза (1), после чего следует бурная полимеризация актина, в результате которой образуется длинный акросомальный отросток, проникающий в студенистую оболочку (2). Вышедшие из акросомы белки (показаны черными точками) прилипают к поверхности акросомального отростка и служат как для связывания спермия с вителлиновым слоем, так и для разрушения этого слоя (3). Когда бывшая акросома (мембрана которой образует теперь верхушку акросомального отростка) приходит в контакт с плазматической мембраной яйца (3), две мембраны сливаются, происходит распад актиновых нитей и спермий проникает в яйцо (4). Как спермий находит яйцеклетку для оплодотворения после того, как гаметы выходят в морскую воду? Яйца морского ежа выделяют пептид, называемый резактом, который является видоспецифическим хемоаттрактантом для спермиев морского ежа. Резакт связывается на поверхности спермия с трансмембранным рецептором, который, как обнаружено, представляет собой фермент гуанилатциклазу. Этот фермент катализирует синтез циклического GMP в сперматозоиде.
Однако удлинение акросомального отростка связано не только с полимеризацией актина. Приток ряда ионов (Са2+, Na+ и Сl-) повышает количество осмотически активных молекул в головке спермия, что приводит к притоку в спермий воды. Вызванное этим резкое повышение гидростатического давления, вероятно, способствует удлинению акросомального отростка.
15.4.2. Связывание спермия с яйцеклеткой осуществляется при помощи видоспецифических макромолекул [20]
Видоспецифичность оплодотворения особенно важна для обитающих в воде животных, яйцеклетки и спермии которых выводятся в водную среду; ведь в этих условиях возможно их слияние с яйцеклетками и спермиями других видов. У морских ежей такая специфичность проявляется в связывании спермия с вителлиновым слоем, лежащим под студенистой оболочкой: иногда спермии претерпевают акросомальную реакцию при контакте с яйцеклеткой животного другого вида, однако спермии не могут связываться с такими яйцеклетками и, следовательно, не могут оплодотворять их.
Из спермы морского ежа было выделено вещество, которое считают ответственным за видоспецифическое связывание сперматозоидов с вителлиновым слоем. Это белок, получивший название байндина, содержится в акросоме. После своего высвобождения в акросомальной реакции он покрывает поверхность акросомального отростка и способствует прикреплению спермия к яйцу. У каждого вида морских ежей вырабатывается свой особый тип байндина, и молекулы этого байндина связываются с вителлиновым слоем яиц морского ежа только того же вида. Оказалось, что вителлиновый слой одного из видов морских ежей содержит видоспецифический гликопротеин, который выступает в роли рецептора байндина в процессе связывания. Есть данные о том, что байндин действует подобно лектину, узнающему специфические углеводные детерминанты в молекулах гликопротеинов (рис. 15-42). Предполагается, что, поскольку байндин способен инициировать слияние искусственных липидных пузырьков in vitro, он может быть катализатором слияния плазматических мембран акросомального отростка и яйцеклетки после того, как эти мембраны пришли в соприкосновение (разд. 6.5.16).
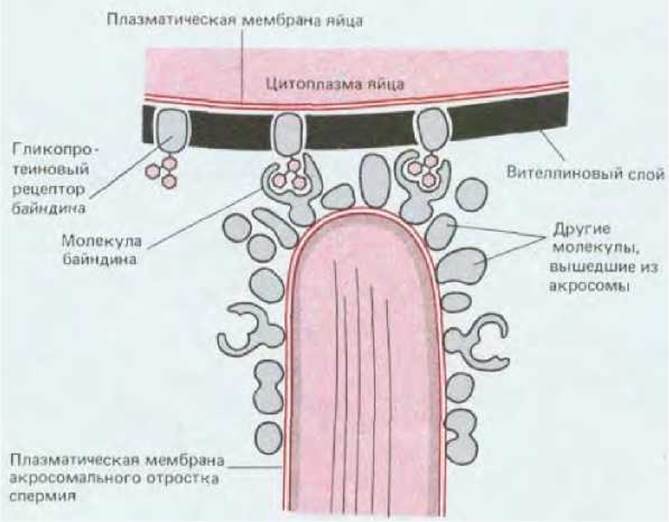
Рис. 15-42. Молекулы байндина, покрывающие поверхность акросомального отростка сперматозоида морского ежа (схематизировано). Как полагают, эти молекулы связываются специфической сахаридной цепью рецепторной молекулы, находящейся в вителлиновом слое яйца.
15.4.3. Активация яйцеклетки опосредуется изменениями внутриклеточных концентраций ионов [21]
Как только активированный спермий морского ежа прикрепляется к яйцу, акросомальный отросток быстро прокладывает себе путь через вителлиновый слой. Мембрана на верхушке отростка сливается с плазматической мембраной на кончике микроворсинки (рис. 15-43). Соседние микроворсинки быстро удлиняются и группируются вокруг спермия; затем, по мере того как микроворсинки постепенно растворяются, спермий головкой вперед затягивается в яйцо.
Сперматозоид запускает программу развития, заложенную в яйце. Перед оплодотворением яйцеклетка метаболически неактивна: она не синтезирует ДНК, а РНК и белки образуются в ней очень медленно. Яйцеклетка, вышедшая из яичника и лишенная теперь поддержки окружавших ее клеток, погибает в считанные часы, если не будет спасена спермием. Связывание спермия с поверхностью яйцеклетки индуцирует повышение ее метаболической активности, синтез ДНК и последующее дробление. Однако сам спермий служит лишь устройством для запуска уже заложенной в яйцеклетке программы. Сам он для этого не столь нужен: яйцеклетку можно активировать с помощью множества неспецифических химических или физических воздействий. Например, для яйца лягушки эффективным стимулом может быть укол иглой. (Развитие яйцеклетки, активированной в отсутствие спермия, называется партеногенезом; ряд организмов, в том числе некоторые позвоночные, обычно размножаются путем партеногенеза.) Начальные стадии активации яйцеклетки не могут зависеть от образования каких-либо новых белков, так как они протекают совершенно нормально в присутствии ядов, ингибирующих белковый синтез.
У морских ежей все ранние стадии активации яйца связаны с изменением концентраций содержащихся в нем ионов. Уже в первые секунды или минуты после внесения спермы в суспензию яйцеклеток в них происходят три различных сдвига: 1) увеличение проницаемости плазматической мембраны для Na+ вызывает деполяризацию мембраны в течение нескольких секунд; 2) массовое высвобождение ионов Са2+ из внутриклеточного хранилища кальция (разд. 11.6.3) ведет к заметному повышению их концентрации в цитозоле в течение примерно 10 с; 3) не более чем через 60 с начинается выведение ионов Н+, сопряженное с поглощением ионов Na+, что приводит к значительному повышению внутриклеточного рН (рис. 15-44). Как будет описано ниже, эти ионные сдвиги обусловливают два физиологических эффекта: во-первых, благодаря им яйцо становится недоступным для проникновения других спермиев и, во-вторых, с их помощью осуществляются первые этапы в развертывании программы развития.

Рис. 15-43. Один из моментов в процессе оплодотворения яйца морского ежа спермием (электронная микрофотография). Мембрана на верхушке акросомального отростка слилась с плазматической мембраной яйца на кончике одной из микроворсинок его поверхности. Неоплодотворенное яйцо морского ежа покрыто более чем 100 000 микроворсинками. (С любезного разрешения Frank Collins.)

Рис. 15-44. Два ионных сдвига, ответственные за активацию яйца морского ежа после оплодотворения. Примерно через 10 с после оплодотворения начинается высвобождение ионов Са2+ из внутриклеточных хранилищ в цитозоль; их концентрация через 2,5 мин возвращается к уровню, несколько превышающему тот, который свойствен неоплодотворенному яйцу. Приблизительно через 60 с включается механизм выведения ионов Н+, сопряженного с притоком Na+, что ведет уже к длительному повышению внутриклеточного рН.
15.4.4. Деполяризация плазматической мембраны яйца обеспечивает быструю блокаду полиспермии [22]
Хотя к яйцеклетке может прикрепиться большое число сперматозоидов, только один из них обычно сливается с ее плазматической мембраной и вносит в клетку свое ядро. Если с яйцеклеткой сольются два или несколько спермиев (это называют полиспермией), то будут формироваться добавочные митотические веретена, что приведет к аномальному расхождению хромосом при дроблении; в таких случаях образуются недиплоидные клетки и развитие вскоре прекращается. Это означает, что яйцеклетки, окруженные большим количеством сперматозоидов, после оплодотворения одним из них должны каким-то образом быстро создать препятствие для проникновения дополнительных спермиев. Механизм такой быстрой блокады полиспермии не у всех одинаков.
У рыб в оболочках яиц имеется узкий канал, называемый микропиле, через который спермии могут проходить лишь один за другим; прохождение одного спермия стимулирует яйцо, вследствие чего содержимое кортикальных гранул высвобождается и закупоривает отверстие, преграждая вход другим спермиям. Однако у большинства организмов яйцеклетки не имеют микропиле и могут сливаться со спермием в любом участке своей поверхности. У яйцеклеток некоторых животных (таких, как морские ежи и амфибии) полиспермию предотвращает быстрая деполяризация плазматической мембраны после слияния с первым сперматозоидом. Мембранный потенциал яйца морского ежа составляет примерно — 60 мВ. Через несколько секунд после контакта со спермием мембранный потенциал резко падает и меняет знак, доходя приблизительно до +20 мВ, а затем спустя примерно минуту начинает постепенно возвращаться к исходному уровню (рис. 15-45). Если предотвратить деполяризацию мембраны (в основном обусловленную притоком ионов Na+ в яйцеклетку после контакта со спермием), проводя оплодотворение в среде с низкой концентрацией Na+, то частота случаев полиспермии возрастает. Кроме того, если неоплодотворенную яйцеклетку искусственно деполяризовать, пропуская через нее ток с помощью микроэлектродов, то сперматозоиды будут способны прикрепляться к яйцеклетке, но не смогут сливаться с ней; если же теперь реполяризовать мембрану, прикрепившиеся спермии сольются с яйцеклеткой и проникнут в нее. Хотя молекулярный механизм этого явления неизвестен, кажется вероятным, что деполяризация мембраны, обычно происходящая при оплодотворении, изменяет конформацию какого-то важного белка плазматической мембраны яйца таким образом, что мембрана спермия уже не может слиться с нею.
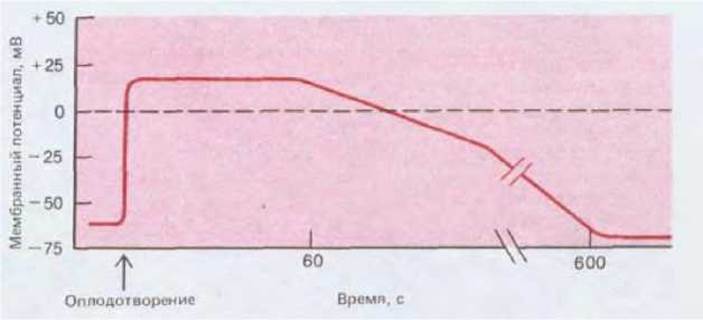
Рис. 15-45. Изменение мембранного потенциала яйца морского ежа после оплодотворения. Быстрая деполяризация каким-то образом препятствует слиянию с яйцеклеткой других спермиев, что обеспечивает быструю блокаду полиспермии.
Мембранный потенциал яйцеклетки через несколько минут после оплодотворения возвращается к норме; поэтому нужен еще какой-то механизм, препятствующий полиспермии в течение более длительного времени. В большинстве яйцеклеток (в том числе и в яйцеклетке млекопитающих) этот барьер создают вещества, которые освобождаются из кортикальных гранул, расположенных сразу под плазматической мембраной яйцеклетки.
15.4.5. За позднюю блокаду полиспермии ответственна кортикальная реакция [23]
Кортикальные гранулы яйца морского ежа сливаются с плазматической мембраной и высвобождают свое содержимое через 10-50 с после контакта яйца со спермием. Кортикальная реакция запускается сильным повышением концентрации свободных ионов Са2+ в цитозоле. У активированного яйца морского ежа менее чем через минуту после присоединения спермия концентрация Са2+ увеличивается примерно в сто раз, а затем спустя одну-две минуты снова снижается до обычного уровня (рис. 15-46). Роль ионов Са2+ в запуске кортикальной реакции можно прямо продемонстрировать в опыте с изолированными плазматическими мембранами яиц морского ежа; к внутренней поверхности таких мембран еще прикреплены кортикальные гранулы и если добавить к этому препарату небольшое количество Са2+, то через несколько секунд происходит экзоцитоз.
В яйцах морского ежа кортикальная реакция приводит по меньшей мере к двум независимым последствиям: 1) протеолитические ферменты, вышедшие из кортикальных гранул, быстро разрушают рецепторы байндина вителлинового слоя, ответственные за связывание спермиев, и 2) освобождаемое содержимое кортикальных гранул вызывает отделение вителлинового слоя, ранее примыкающего к плазматической мембране, от поверхности яйца, и в то же время благодаря ферментам образуются поперечные сшивки между белками этого слоя, что делает его более жестким. В результате указанных событий формируется оболочка оплодотворения, с которой спермии не могут связаться и через которую они не могут проникнуть (рис. 15-47).
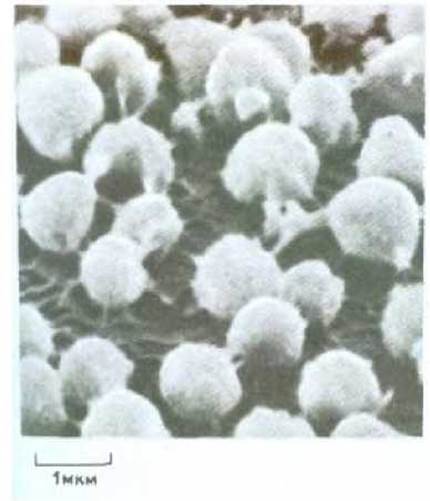
Рис. 15-46. Кортикальные гранулы, прикрепленные к изолированной мембране неоплодотворенной яйцеклетки морского ежа (микрофотография, полученная с помощью сканирующего электронного микроскопа). При добавлении к такому препарату ионов Са2+ кортикальные гранулы сливаются с плазматической мембраной и высвобождают свое содержимое путем экзоцитоза. Поскольку в каждой клетке имеется около 15 000 кортикальных гранул, в результате кортикальной реакции поверхность яйца менее чем за минуту увеличивается более чем вдвое; часть дополнительного мембранного материала идет на удлинение микроворсинок на поверхности всего яйца, тогда как остальная часть поступает в окаймленные ямки и пузырьки (V. D. Vacquier, Dev. Biol., 43, 62-74, 1975.)
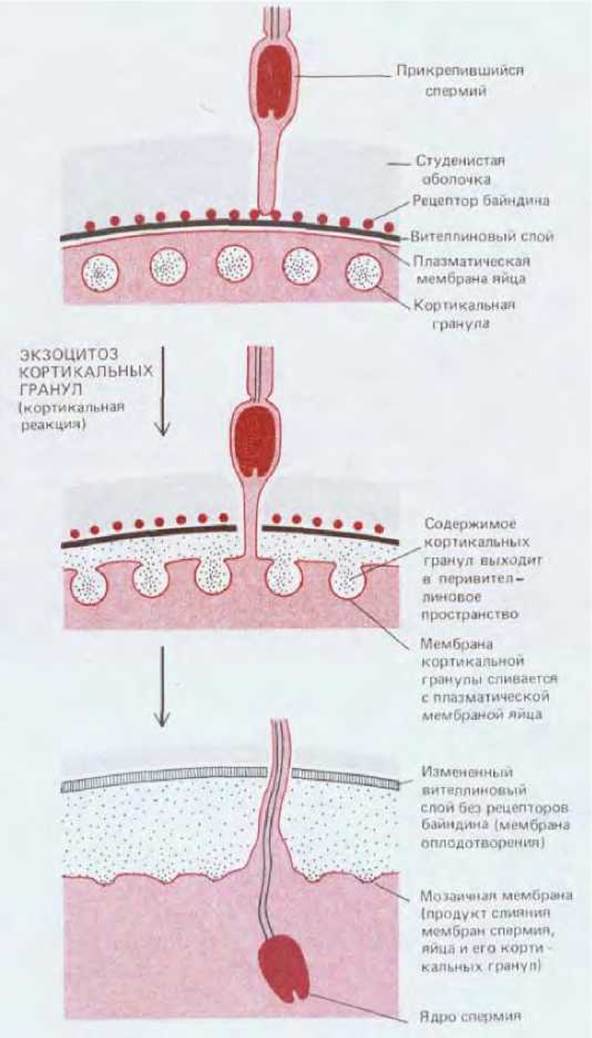
Рис. 15-47. Эта схема показывает, каким образом кортикальная реакция яйца морского ежа предотвращает проникновение в него дополнительных спермиев. Высвобождаемое содержимое кортикальных гранул вызывает расширение щели под вителлиновым слоем и изменяет этот слой так, что в нем исчезают рецепторы байндина и он превращается в «оболочку оплодотворения», через которую не могут проникнуть спермии. Такое «затвердение» вителлинового слоя происходит в основном благодаря образованию ковалентных сшивок между тирозиновыми боковыми цепями белков, вследствие чего формируется обширная нерастворимая белковая сетка.
15.4.6. Активация яйцеклетки осуществляется с помощью инозитолфосфолипидного механизма клеточной сигнализации [24]
Деполяризация мембраны представляет собой первое обнаруживаемое изменение после оплодотворения, но, судя по всему, она нужна лишь для предотвращения полиспермии. Искусственная деполяризация мембраны не приводит к активации яйцеклетки; и наоборот, устранение деполяризации мембраны во время оплодотворения не подавляет активацию.
Есть много убедительных данных в пользу того, что программу развития яйцеклетки запускает кратковременное повышение концентрации Са2+ в цитозоле (которое распространяется от места внедрения спермия по всей яйцеклетке в виде кольцевой волны - см. рис. 4-35). Концентрацию Са2+ в цитозоле можно искусственно повысить либо путем прямой инъекции этих ионов в яйцеклетку, либо с помощью ионофоров, переносящих Са2+, таких, например, как А23187 (см. разд. 6.4.19). Таким способом удается активировать яйцеклетки всех до сих пор исследованных животных, в том числе млекопитающих. Если же, напротив, предотвратить повышение концентрации Са2+, введя связывающее кальций вещество ЭГТА, активации при оплодотворении не происходит. Ионы Са2+ действуют в клетке по меньшей мере одним способом - они присоединяются к Са2+-связывающему белку кальмодулину, который в свою очередь активирует много разнообразных белков клетки (разд. 12.4.3). Кальмодулин был найден в больших количествах во всех исследованных яйцеклетках.
Как оплодотворение приводит к повышению концентрации ионов Са2+ в цитозоле яйцеклетки? В гл. 12 мы говорили о том, что внеклеточные лиганды, связываясь с рецепторными белками клеточной поверхности, вызывают гидролиз фосфатидилтозитол-бисфосфата (Р1Р2 в плазматической мембране, в результате чего образуется инозитолтрифосфат (InsP3) и диацилглицерол; InsP3 в свою очередь инициирует высвобождение Са2+ из внутриклеточных хранилищ (разд. 12.3.9) в цитозоль, а диацилглицерол активирует протеинкиназу С (разд. 12.3.10). Эксперименты на морских ежах подтверждают предположение о том, что указанный механизм ответствен и за повышение концентрации ионов Са2+ в цитозоле при оплодотворении. Концентрация InsP3 возрастает через несколько секунд после оплодотворения и сразу после этого повышается концентрация ионов Са2+ в цитозоле; если в неоплодотворенное яйцо ввести путем инъекции InsP3, то концентрация Са2+ в цитозоле повышается и яйцеклетка активируется. Как и ожидалось, активация спермия связана с G-белком, который активирует специфическую фосфолипазу С, катализирующую гидролиз (см. разд. 12.3.9). Непонятно, однако, связывается ли спермий с рецептором плазматической мембраны яйцеклетки,
функционально сопряженным с фосфолипазой С посредством G-белка, или при слиянии с яйцеклеткой он вводит в нее активатор G-белка.
Поскольку концентрация ионов Са2+ в цитозоле после оплодотворения повышается лишь ненадолго (примерно на 1 мин), ясно, что это не может непосредственно приводить к событиям, происходящим на более поздних стадиях активации яйцеклетки. У морских ежей к таким событиям относятся повышение интенсивности синтеза белков, начинающееся через 8 мин после оплодотворения, и инициация синтеза ДНК спустя примерно 30 мин. Имеется большое число данных, указывающих на то, что активация протеинкиназы С играет важную роль на поздних стадиях активации, причем наиболее существенным в этот период является повышение внутриклеточного рН.
15.4.7. У некоторых организмов поздние биосинтетические процессы, связанные с активацией яйцеклетки, индуцируются повышением внутриклеточного рН [25]
У морских ежей активация протеинкиназы С диацилглицеролом приводит к активации (преимущественно посредством фосфорилирования) Na+ — Н+-ионообменника плазматической мембраны яйцеклетки. Этот мембранный транспортный белок использует энергию, запасенную в виде трансмембранного градиента ионов Na+, для откачивания ионов Н+ из клетки (см. разд. 6.4.10). Отток ионов Н+ приводит к тому, что величина рН внутри клетки возрастает с 6,6 до 7,2 и при дальнейшем развитии зиготы поддерживается на этом уровне (см. рис. 15-47). Считается, что необычно низкое значение внутриклеточного рН в неоплодотворенных яйцах морского ежа несет основную ответственность за поддержание яйцеклетки в метаболически неактивном состоянии; более того, имеются убедительные свидетельства того, что именно повышение рН после оплодотворения индуцирует в оплодотворенных яйцах морского ежа позднюю биосинтетическую активность. Во-первых, если повысить рН в неоплодотворенных яйцах, инкубируя их в среде, содержащей аммиак (рис. 15-48), то процессы синтеза белков и репликации ДНК заметно усиливаются даже без повышения внутриклеточной концентрации свободных ионов Са2+. Во-вторых, если сразу после оплодотворения поместить яйца в морскую воду, не содержащую ионов Са2+ (так что не будет градиента Na+ для откачивания ионов Н+), внутриклеточный уровень рН не повышается и поздние события, связанные с активацией яйца, не наступают. Такие яйца еще можно спасти, добавив к среде аммиак: тогда рН в клетке возрастает и даже при отсутствии внеклеточного Na+ индуцируется синтез белков и ДНК.

Рис. 15-48. Повышение внутриклеточного рН при инкубации клеток (например, яйцеклеток) в среде с аммиаком. Аммиак диффундирует через плазматическую мембрану и взаимодействует в цитозоле с ионами Н+, образуя NH+4, в результате чего внутриклеточная концентрация ионов Н+ падает и рН возрастает.
Для заметного усиления белкового синтеза в оплодотворенных яйцах не нужен синтез новой РНК, поскольку этот феномен имеет место и в присутствии антибиотика актиномицина D, ингибирующего синтез РНК. Полагают, что в обычных условиях синтез белков усиливается в результате по меньшей мере двух независимых изменений: 1) ранее запасенные в яйце молекулы мРНК становятся доступными для синтеза белков; 2) происходит активация рибосом, что позволяет им быстрее транслировать мРНК. В отличие от этого ускорение белкового синтеза в неоплодотворенных яйцах, обработанных аммиаком, является следствием одной лишь усиленной мобилизации существующих молекул мРНК. Если мобилизация мРНК - по всей вероятности, результат повышения внутриклеточного рН, то движение рибосом вдоль цепей мРНК, по-видимому, ускоряется под влиянием какого-то другого фактора. Детали механизмов, лежащих в основе двух указанных типов активации, пока неясны.
Оплодотворение представляет собой в высшей степени уникальный феномен, однако в нем участвуют те же механизмы передачи клеточных сигналов, которые контролируют внутриклеточные процессы в соматических клетках (см. гл. 12). Последовательность некоторых событий активации яиц морского ежа после оплодотворения приведена в табл. 15-1.
Таблица 15-1. Последовательность событий после оплодотворения яиц морского ежа
|
Событие |
Время после оплодотворения |
Внутриклеточное промежуточное звено |
|
1. Деполяризация плазматической мембраны |
<5с |
Индуцированное спермием повышение проницаемости плазматической мембраны для ионов Na+ (и до некоторой степени для Са2+) |
|
2. Гидролиз фосфатидилинозитол-бисфосфата |
< 10 с |
Активация фосфолипазы С |
|
3. Повышение внутриклеточной концентрации свободных ионов Са2+ |
10-40 с |
Индуцированное InsP3 высвобождение связанных ионов Са2+ из внутриклеточных хранилищ |
|
4. Экзоцитоз кортикальных гранул |
10-50 с |
Повышение внутриклеточной концентрации Са2+ |
|
5. Повышение внутриклеточного значения рН |
60 с |
Активация Na+ - Н+ -ионообменника протеинкиназой С |
|
6. Усиление синтеза белков |
8 мин |
Повышение внутриклеточного рН |
|
7. Слияние ядер спермия и яйца |
30 мин |
|
|
8. Начало репликации ДНК |
30-45 мин |
Повышение внутриклеточного рН |
15.4.8. В слиянии пронуклеусов спермиев и яиц морского ежа участвуют центриоли, вносимые спермием [26]
Оплодотворенную яйцеклетку называют зиготой. У большинства видов, включая морских ежей, оплодотворение завершается лишь после того, как сольются гаплоидные ядра (называемые пронуклеусами) двух гамет. Поскольку размеры яйцеклетки велики, пронуклеусам яйца и спермия приходится преодолевать значительные расстояния, прежде чем они сольются друг с другом. В связи с этим не вызывает удивления тот факт, что такое передвижение определяется структурой цитоскелета.
Спермий морского ежа вносит в зиготу не только свою ДНК - он отдает еще и две центриоли. Центриолям спермия в процессе оплодотворения принадлежит исключительно важная роль, так как яйцеклетка утрачивает свои центриоли при последнем делении мейоза. Центриоли спермия становятся центром, от которого расходятся лучи микротрубочек (такая структура называется сперматической звездой), по-видимому, направляющих пронуклеус самца к пронуклеусу самки: если с помощью колхицина вызвать деполимеризацию микротрубочек, движение пронуклеусов прекращается. Когда два сблизившихся пронуклеуса приходят в соприкосновение, их мембраны сливаются и формируется диплоидное ядро зиготы. Две центриоли спермия вместе со сперматическими звездами делятся, образуя два полюса митотического веретена для первого деления дробления.
15.4.9. Яйцеклетки млекопитающих могут быть оплодотворены in vitro [27]
Изучать яйцеклетки млекопитающих неизмеримо труднее, чем яйца морских ежей. В распоряжении исследователя имеются миллионы яиц морского ежа, тогда как при работе с яйцеклетками млекопитающих ему приходится довольствоваться лишь десятками или сотнями их. Тем не менее сейчас есть возможность оплодотворять эти яйцеклетки in vitro. (Хотя мы будем по-прежнему пользоваться термином «яйцеклетка», следует помнить, что в отношении млекопитающих речь идет об оплодотворенном ооците второго порядка - см. разд. 15.3.7.) Этот путь приносит реальную пользу: оплодотворенные яйцеклетки млекопитающих, пересаженные в матку, могут развиться в нормальных особей; благодаря такой методике многие бесплодные женщины получили возможность рожать нормальных детей. Оплодотворение яйцеклеток млекопитающих in vitro позволяет также изучать некоторые его механизмы.
Такие исследования показали, что хотя в общих чертах последовательности событий при оплодотворении млекопитающих и морских ежей сходны, отдельные этапы процессов могут существенно отличаться.
Некоторые различия касаются спермиев. Сперматозоиды млекопитающих не способны оплодотворить яйцеклетку, пока они не подвергнутся процессу, называемому капацитацией, который индуцируется выделениями женского полового тракта. Механизм капацитации не ясен; возможно, она связана с изменениями в липидном и гликопротеиновом составах плазматической мембраны спермия, а также с повышением уровня его метаболизма и увеличением подвижности. Капацитированный спермий мыши проникает через толстый слой фолликулярных клеток и специфически связывается одним из главных гликопротеинов zona pellucida - защитной оболочки, равноценной вителлиновому слою морского ежа (см. разд. 15.3.2). По крайней мере у нескольких видов один и тот же гликопротеин яйцеклетки, по-видимому, инициирует у спермия акросомальную реакцию. Например, у мыши zona pellucida состоит лишь из гликопротеинов, которые синтезируются растущими ооцитами и образуют самоорганизующуюся трехмерную структуру из связанных между собой волокон (см. рис. 15-23). Один из этих гликопротеинов, называемый ZP3, отвечает за связывание со спермием и за инициацию акросомальной реакции. Полагают, что при связывании с zona pellucida сперматозоид распознает специфическую углеводородную последовательность гликопротеина ZP3. Молекулы, участвующие в процессе распознавания, локализованы в плазматической мембране спермия, тогда как у морских ежей они располагаются в мембране акросомы. Zona pellucida, как и вителлиновый слой яиц морского ежа, служит барьером для межвидового оплодотворения; устранение ее часто приводит к исчезновению такого барьера. Например, яйцеклетки хомячка, у которых с помощью специфических ферментов удалена zona pellucida, могут быть оплодотворены сперматозоидами человека. Не удивительно, что такие гибриды («humsters») не развиваются.
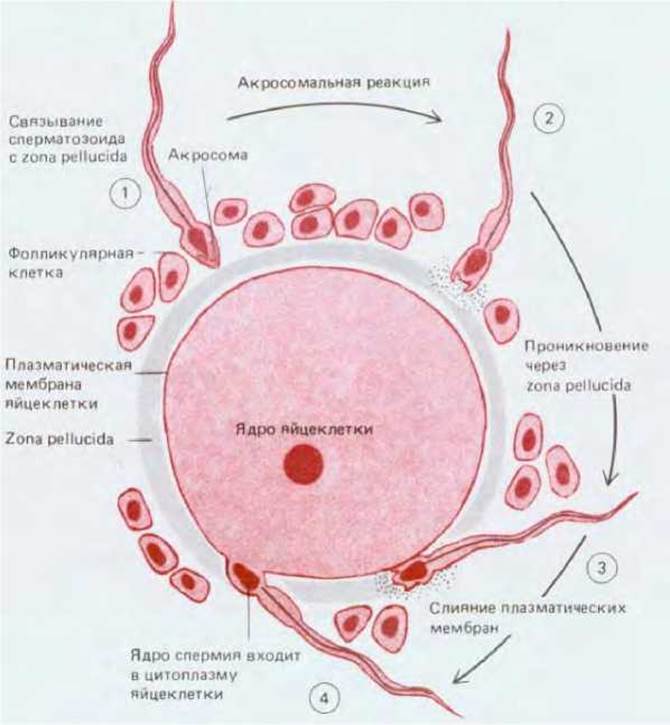
Рис. 15-49. Ход акросомальной реакции при оплодотворении яйцеклетки млекопитающего. Полагают, что у мышей и за связывание спермия, и за индукцию акросомальной реакции ответствен один и тот же гликопротеин zona pellucida. Обратите внимание на то, что спермий млекопитающего подходит к плазматической мембране яйцеклетке по касательной, так что слияние мембран происходит не на верхушке головки сперматозоида, а на ее боковой поверхности. У мышей диаметр zona pellucida состовляет 7 мкм, и спермий проходит это расстояние со скоростью примерно 1 мкм/мин.
При акросомальной реакции спермин млекопитающих высвобождают протеазы и гиалуронидазу, которые играют важную роль в проникновении спермия через zona pellucida. Однако здесь не формируется акросомальный отросток, сходный с тем, который образуется у морского ежа; у спермиев большинства млекопитающих с яйцеклеткой раньше всего сливается экваториальная (расположенная за акросомой) область плазматической мембраны, а не мембрана акросомы (рис. 15-49). Лишь относительно небольшое число спермиев млекопитающих обычно оказывается в состоянии добраться до претерпевшей овуляцию яйцеклетки (менее 200 из 3 ∙ 108 сперматозоидов человека, выделяющихся при коитусе, достигают места оплодотворения), поэтому необходимость в быстрой блокаде полиспермии несущественна: у млекопитающих не происходит быстрой деполяризации плазматической мембраны, сопровождающей оплодотворение и предотвращающей полиспермию у морских ежей и амфибий. С другой стороны, ферменты, высвобождающиеся при кортикальной реакции яйцеклеток млекопитающих, изменяют структуру яйцевой оболочки, обеспечивая медленную блокаду полиспермии. Например, в мышиных яйцеклетках фермент так видоизменяет гликопротеин ZP3, что он перестает связывать спермии или индуцировать у них акросомальную реакцию. В яйцеклетках некоторых млекопитающих в результате кортикальной реакции перестраивается не zona pellucida, а плазматическая мембрана, вследствие чего предотвращается слияние с яйцеклеткой дополнительных спермиев.
Другой характерной особенностью оплодотворения у млекопитающих является то, что центриоли присутствуют в яйцеклетках, а в спермиях их нет. Кроме того, в оплодотворенных яйцеклетках млекопитающих не происходит непосредственного слияния двух пронуклеусов: они сближаются, однако их хромосомы не соединяются до тех пор, пока мембрана каждого из пронуклеусов не будет разрушена при подготовке к первому делению дробления. Большая часть других ранних событий при оплодотворении яиц морского ежа, приведенных в табл. 15-1 (таких, как активация с помощью фосфатидилинозитол-бисфосфата и повышение концентрации ионов Са2+ в цитозоле), осуществляется и в яйцеклетках млекопитающих. Следующие за этим изменения представляют собой часть процесса эмбриогенеза, в ходе которого зигота развивается в новый организм. Эмбриогенез, возможно, представляет собой самое поразительное явление во всей биологии; этот процесс - предмет следующей главы.
Заключение
Оплодотворение начинается с того момента, когда головка спермия приходит в соприкосновение с защитной оболочкой, окружающей яйцеклетку. Такой контакт индуцирует у спермия акросомальную реакцию, содержимое акросомы высвобождается, и некоторые из выделившихся белков облегчают прохождение спермия через плазматическую мембрану яйцеклетки, что делает возможным слияние с ней плазматической мембраны спермия. В результате оплодотворения благодаря гидролизу фосфатидилинозитол-бисфосфата, содержащегося в плазматической мембране яйцеклетки, инициируются бурные изменения в самой яйцеклетке. При активации яйцеклетки ее поверхность изменяется так, что становится невозможным слияние с ней дополнительных спермиев; один вид блокады полиспермии является следствием кортикальной реакции, при которой содержимое кортикальных гранул высвобождается, перестраивая яйцевую оболочку. Кроме того, внутри яйцеклетки также происходят определенные изменения, в результате чего после соединения пронуклеусов двух гамет, зигота становится способной к развертыванию программы развития.
Литература
Общая
Austin С. R., Short R. V., eds. Reproduction in Mammals: I. Germ Cells and Fertilization, 2nd ed., Cambridge, U.K., Cambridge University Press, 1982.
Browder L., Developmental Biology, 2nd ed., Chapters 5, 6 and 8, Philadelphia, Saunders, 1980.
Epel D. The program of fertilization, Sci. Am., 237 (11), 128-138, 1977.
Karp G., Berrill N. J. Development, 2nd ed., Chapters 4 and 5, New York, McGraw-Hill, 1981. Longo FJ. Fertilization, London, Chapman & Hall, 1987.
Цитированная
1. Crow J. F. The importance of recombination. In: The Evolution of Sex: An Examination of Current Ideas (R. E. Michod, B. R. Levin, eds.), pp. 56-73, Sunderland, MA, Sinauer, 1988.
Maynard Smith J. Evolution of Sex, Cambridge, U. K., Cambridge University Press, 1978.
Williams G.C. Sex and Evolution, Princeton, NJ: Princeton University Press, 1975.
2. Ayala F., Kiger J. Modern Genetics, 2nd ed., Menlo Park, CA: Benjamin-Cummings, 1984. Ferris S. D., Whitt G. S. Loss of duplicate gene expression after polyploidization, Nature, 265, 258-260, 1977.
Fincham J.R.S. Genetics, Boston: Jones and Bartlett, 1983.
3. Lewis J., Wolpert L. Diploidy, evolution and sex, J. Theor. Biol., 78, 425-438, 1979.
Spofford J.B. Heterosis and the evolution of duplications. Am. Nat., 103, 407-432, 1969.
4. Evans C. W., Dickinson H. G., eds. Controlling Events in Meiosis, Symp. Soc. Exp. Biol., Vol. 38, Cambridge, U.K., The Company of Biologists, 1984.
Whitehouse H. L. Towards an Understanding of the Mechanism of Heredity, 3rd ed., London, St. Martins, 1973.
Wolfe S. L Biology of the Cell, 2nd ed., pp. 432-470. Belmont, CA: Wadsworth, 1981.
5. John В., Lewis K. R. The Meiotic Mechanism. Oxford Biology Readers (J. J. Head, ed.), Oxford, Eng., Oxford University Press, 1976.
Jones G. H. The control of chiasma distribution. In Controlling Events in Meiosis (C. W. Evans, H.G. Dickinson, eds.), Symp. Soc. Exp. Biol., Vol. 38, pp. 293-320,
Cambridge, U.K. The Company of Biologists, 1984. Orr-Weaver T.L., Szostak J. W. Fungal recombination, Microbiol. Rev., 49, 33-58, 1985.
6. Heyting C., Dettmers R. J., Dietrich A. J., Redeker E. J. Two major components of synaptonemal complexes are specific for meiotic prophase nuclei, Chromosoma, 96, 325-332, 1988.
Moses M.J. Synaptonemal complexes, Annu. Rev. Genet., 2, 363-412, 1968.
Smithies O., Powers P. A. Gene conversions and their relationship to homologous pairing. Phil. Trans. R. Soc. Lond. (Biol.), 312, 291-302, 1986. von Wettstein D., Rasmussen S. W., Holm P. B. The synaptonemal complexes in genetic segregation, Annu. Rev. Genet., 18, 331-413, 1984.
7. Carpenter А. Т. С. Gene conversion, recombination nodules, and the initiation of meiotic synapsis, Bioessaays, 6, 232-236, 1987.
Carpenter A. T. C. Recombination nodules and synaptonemal complexes in recombination-defective females of Drosophila melanogaster, Chromosoma, 75, 236-259, 1979.
8. Buckle V., Mondello C., Darling S., Craig I. W., Goodfellow P. N. Homologous expressed genes in the human sex chromosome pairing region, Nature, 317, 739-741, 1985.
Chandley A.C. Meiosis in man. Trends Genet., 4, 79-84, 1988. Solari A.J. The behavior of the XY pair in mammals, Int. Rev. Cytol., 38, 273-317, 1974.
9. Austin C. R., Short R. V., eds. Reproduction in Mammals: I. Germ Cells and Fertilization, Cambridge, U. K., Cambridge University Press, 1982.
10. Browder L. Developmental Biology, p. 173-231, Philadelphia, Saunders, 1980. Karp G., Berrill N. J. Development, 2nd ed., pp. 116-138, New York, McGraw-Hill, 1981.
11. BrowderL.W., ed. Oogenesis, New York, Plenum, 1985.
Davidson E.H. Gene Activity in Early Development, 3rd ed., pp. 305-407. Orlando, FJ, Academic, 1986.
Metz C.B., Monroy A., eds. Biology of Fertilization, Vol. 1: Model Systems and Oogenesis, Orlando FL, Academic, 1985.
12. Bornslaeger E.A., Mattei P., Schultz R.M. Involvement of cAMP-dependent protein kinase and protein phosphorylation in regulation of mouse oocyte maturation. Dev. Biol., 114, 453-462, 1986.
Mailer J.L. Regulation of amphibian oocyte maturation. Cell Differ., 16, 211-221, 1985.
Masui Y., Clarke H.J. Oocyte maturation, Int. Rev. Cytol., 57, 185-282, 1979.
Sadler S. E., Mailer J. L. Inhibition of Xenopus oocyte adenylate cyclase by progesterone: a novel mechanism of action. Adv. Cyc. Nuc. Prot. Phosphor. Res., 19, 179-194, 1985.
13. Cyert M.S., Kirschner M. W. Regulation of MPF activity in vitro, Cell, 53, 185-195, 1988.
Ford С. С. Maturation promoting factor and cell cycle regulation, J. Embryol, Exp. Morphol., Suppl, 89, 271-284, 1985.
Kirschner M., Newport J., Gerhart J. The timing of early developmental events in Xenopus. Trends Genet, 1, 41-47, 1985.
Lohka M. J., Hayes M. K., Mailer J. L. Purification of maturation-promoting factor, an intracellular regulator of early mitotic events. Proc. Natl. Acad. Sci. USA, 85, 3009-3013, 1988.
Mailer J.L. Regulation of amphibian oocyte maturation. Cell Differ., 16, 211-221, 1985.
14. Peters H., McNatty K. P. The Ovary: A Correlation of Structure and Function in Mammals, pp. 11-22, 60-84, Berkeley: University of California
Press, 1980.
Richards J. S. Hormonal control of ovarian follicular development, Recent Prog. Horm. Res., 35, 343-373, 1979.
15. Bellve A.R., O'Brien D.A. The mammalian spermatozoon: structure and temporal assembly. In Mechanism and Control of Animal Fertilization (J. F. Hartmann, ed.), pp. 56-137, New York, Academic, 1983.
Fawcett D. W. The mammalian spermatozoon, Dev. Biol. 44, 394-436, 1975.
Fawcett D. W., Bedford J. M., eds. The Spermatozoon, Baltimore, Urban & Schwarzenberg, 1979.
16. Browder L. Developmental Biology, pp. 146-172, Philadelphia, Saunders, 1980.
Clermont Y. Kinetics of spermatogenesis in mammals: seminiferous epithelium cycle and spermatogonial renewal, Physiol. Rev., 52, 198-236, 1972.
Karp G., Berrill N. J. Development, 2nd ed., pp. 100-116, New York, McGraw-Hill, 1981.
Metz С. В., Monroy A., eds. Biology of Fertilization, Vol. 2, Biology of the Sperm, Orlando, FL, Academic, 1985.
17. Lindsley D.L., Tokuyasu К. Т. Spermatogenesis. In: The Genetics and Biology of Drosophila (M. Ashburner, T. R. F. Wright, eds.), Vol. 2, pp.
225-294, New York, Academic, 1980.
Willison K., Ashworth A. Mammalian spermatogenic gene expression, Trends Genet, —351-355, 1987.
18. Epel D. Fertilization. Endeavour (New Series), 4, 26-31, 1980.
Hendrick J. L., ed. The Molecular and Cellular Biology of Fertilization, New York, Plenum, 1986.
Longo F.J. Fertilization, London, Chapman & Hall, 1987.
Metz С. В., Monroy A., eds. Biology of Fertilization, Vol. 3, The Fertilization Response of the Egg. Orlando FL, Academic, 1985.
19. Shapiro B.M. The existential decision of a sperm. Cell, 49, 293-294, 1987.
Shapiro B. M., Schackmann R. W., Tombes R. M., Kazazoglou T. Coupled ionic and enzymatic regulation of sperm behavior. Curr.. Top. Cell Regul, 26, 97-113,1985.
Tilney L. G., Inoue S. Acrosomal reaction of the Thyone sperm. III. The relationship between action assembly and water influx during the extension of the acrosomal process, J. Cell Biol., 100, 1273-1283, 1985.
Trimmer J. S., Vacquier V. D. Activation of sea urchin gametes, Annu. Rev. Cell Biol., 2, 1-26, 1986.
20. Gao В., Klein L. E., Britten R. J., Davidson E. H. Sequence of mRNA coding for bindin, a species-specific sea urchin sperm protein required for fertilization, Proc. Natl. Acad. Sci. USA, 83, 8634-8638, 1986.
Glabe C. G. Interaction of the sperm adhesive protein bindin, with phospholipid vesicles. II. Bindin induces the fusion of mixed-phase vesicles that contain phosphatidylcholine and phosphatidylserine in vitro, J. Cell Biol., 100, 800-806, 1985.
Rossignol D.R., Earles B.J., Decker G. L., Lennarz W.J. Characterization of the sperm receptor on the surface of eggs of Strongylocentrotus purpuratus. Dev. Biol., 104, 308-321, 1984.
Vacguier V.D., Moy G. W. Isolation of bindin: the protein responsible for adhesion of sperm to sea urchin eggs. Proc. Natl. Acad. Sci. USA, 74, 2456-2460, 1977.
21. Shatten G., Husler D. Timing the early events during sea urchin fertilization, Dev. Biol., 100, 244-248, 1983.
Trimmer J. S., Vacquier V. D. Activation of sea urchin gametes, Annu. Rev. Cell Biol., 2, 1-26, 1986.
Whitaker M. J., Steinhardt R. A. Ionic signalling in the sea urchin egg at fertilization. In: Biology of Fertilization (C.B. Metz, A. Monroy, eds.), Vol. 3, pp. 168-222, Orlando FL, Academic, 1985.
22. Jaffe L. A., Cross N. L. Electrical regulation of sperm-egg fusion, Annu. Rev. Physiol., 48, 191-200, 1986.
23. Kay E. S., Shapiro В. М. The formation of the fertilization membrane of the sea urchin egg. In: Biology of Fertilization (С. В. Metz, A. Monroy, eds.), Vol. 3, pp. 45-81, Orlando FL, Academic, 1985.
Schuel H. Functions of egg cortical granules. In: Biology of Fertilization (С. В. Metz, A. Monroy, eds.), Vol. 3, pp. 1-44, Orlando FL, Academic, 1985.
24. Eisen A., Reynolds G. T. Source and sinks for the calcium released during fertilization of single sea urchin eggs, J. Cell Biol., 100, 1522-1527, 1985.
Turner P. R., Jaffe L. A., Fein A. Regulation of cortical vesicle exocytosis in sea urchin eggs in inositol 1,4,5-triphosphate and GTP-binding protein. J. Cell Biol., 102, 70-78, 1986.
Whitaker M., Irvine R.F. Inositol 1,4,5-triphosphate microinjection activates sea urchin eggs. Nature, 312, 636-639, 1984.
25. Dube F., Schmidt Т., Johnson C. H., Epel D. The hierarchy of requirements for an elevated intracellular pH during early development of sea urchin embryos. Cell, 40, 657-666, 1985.
Winkler M. Translational regulation in sea urchin eggs: a complex interaction of biochemical and physiological regulatory mechanisms, Bioessays, 8, 157-161, 1988.
26. Schatten H., Schatten G., Mazia D., Balczon R., Simerly C. Behavior of centrosomes during fertilization and cell division in mouse oocytes and in sea urchin eggs. Proc. Nat. Acad. Sci. USA, 83, 105-109, 1986.
27. Clegg E.D. Mechanisms of mammalian sperm capacitation. In: Mechanism and Control of Animal Fertilization (J. F. Hartmann, ed.), pp. 178212, New York, Academic, 1983.
Grobstein C. External human fertilization, Sci. Am., 240(6), 57-67, 1979. Wassarman P. M. Early events in mammalian fertilization, Annu. Rev. Cell Biol., 3, 109-142, 1987.
Wassarman P.M. Zona pellucida glycoproteins, Annu. Rev. Biochem., 57, 415-442, 1988.