Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Клеточные механизмы развития
Программы развития индивидуальных клеток: анализ генеалогии клеток на примере нематод
Клетки, обладая памятью подобно компьютерам, способны реализовать сложные программы развития; в результате реализации таких программ из множества клеток, каждая из которых действует по своей собственной программе, контролируемой в процессе развития, возникает сложное тело взрослого животного. Некоторые типы поведения клеток в процессе развития достаточно автономны, а другие определяются сигналами, идущими от окружающих клеток. Таким образом, клетки эмбриона можно уподобить сети компьютеров, действующих параллельно и обменивающихся информацией. Каждая клетка обладает одинаковым геномом, т.е. содержит одну и ту же программу, но эта программа может существовать во множестве вариантов, направляющих развитие по разным путям в зависимости от сигналов, воспринимаемых клеткой из окружающей среды.
Клеточная память играет чрезвычайно важную роль, и именно по этой причине поведение клеток в определенное время зависит от того выбора, что был сделан ее предками в предыдущих циклах деления. Таким образом, для полного понимания всей программы развития необходимо знать, как осуществлялись клеточные деления, т.е. необходимо знать генеалогию индивидуальных клеток эмбриона. В этом и состоит сущность генеалогического анализа, проведение которого, особенно на примере крупных и сложно организованных животных (например, позвоночных), представляет собой довольно трудную задачу. Если на ранних стадиях развития специфически пометить отдельные клетки, то на более поздних стадиях можно идентифицировать сами клетки или их потомки. Один из способов мечения заключается в микроинъекции специфических молекул, за которыми легко следить (например, флуоресцирующие красители или фермент пероксидазу хрена; см. разд. 19.1.5), в клетки ранних эмбрионов (рис. 16-29). Кроме того, отдельные клетки эмбриона можно пометить генетически, например, создавая условия для их инфекции специально выбранным ретро-вирусом (см. разд. 17.5.4) или подвергая эмбрионы действию ионизирующего излучения, вызывающего случайные соматические мутации (см. разд. 16.5.13). Эти методы генеалогического анализа весьма трудоемки и каждый из экспериментов дает лишь небольшую информацию о потомках эмбриональных клеток. Ситуация осложняется еще и тем, что у позвоночных и многих других организмов наследственность подвержена случайной изменчивости даже у генетически идентичных животных.
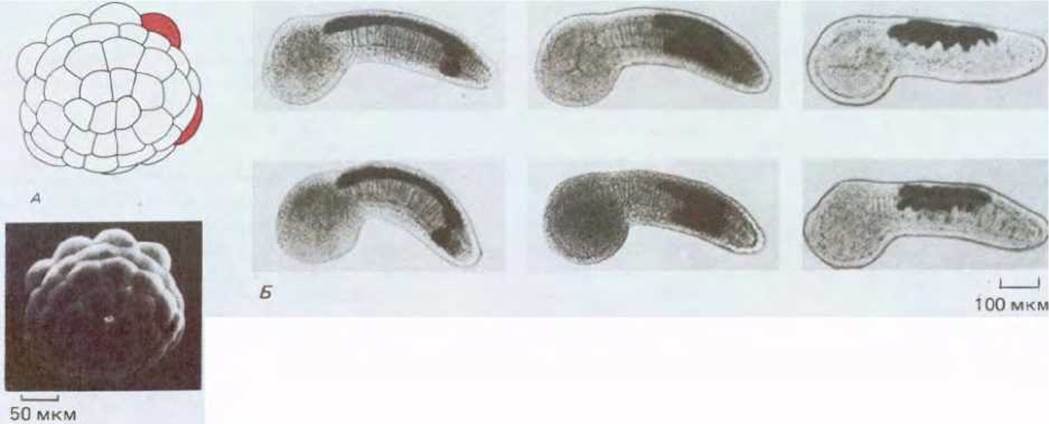
Рис. 16-29. Прослеживание клеточной родословной у асцидии Halocynthia roretzi. А. Эмбрион на стадии 64 клеток. На этой стадии в один из бластомеров инъецируют в качестве метки пероксидазу хрена. В результате становится возможным идентифицировать потомки этого бластомера, подобно тому, как это сделано на рисунке под фотографией. Б. Личинки, развивающиеся из 6 таких эмбрионов, были подвергнуты специальной обработке для выявления фермента (показано черным цветом) в клетках - потомках инъецированных бластомеров. У двух личинок, изображенных слева (вверху и внизу), предковым бластомером, в который вводилась метка, был верхний из показанных красным цветом на рис. А, у двух личинок, изображенных посередине, нижний из этих бластомеров; для двух личинок, изображенных справа, предковый бластомер на рис. А не виден. У данного вида в процессе развития из одних и тех же бластомеров всегда возникают определенные части зародыша (см. фотографии). (Н. Nishida, Dev. Biol., 121, 526-541, 1987.)
Однако у представителей некоторых низших типов, в том числе у моллюсков, кольчатых и круглых червей, деление и перемещение клеток в высшей степени упорядочены и у всех особей осуществляются одинаково. Столь полная воспроизводимость результатов была использована при изучении крошечной прозрачной нематоды Caenorhabditis elegans. Это животное характеризуется простым и практически неизменным строением, и его развитие можно проследить клетка за клеткой на всем пути от яйца до взрослого организма. Здесь можно вычертить полную генеалогию каждой клетки. На этом фоне удается очень точно отметить эффекты мутаций и иных экспериментальных воздействий. Такой метод позволяет связать определенные гены с конкретными этапами в реализации программ, контролирующих развитие клеток. Однако мы увидим, что изучение внутренней логики программы отнюдь не простая задача, даже в таких благоприятных условиях; ее сложность во многом обусловлена наличием межклеточных взаимодействий. Мы закончим этот раздел примером, иллюстрирующим применение экспериментов в культуре для непосредственного анализа небольших фрагментов программы, контролирующей развитие отдельных клеток млекопитающих.
16.3.1. В анатомическом и генетическом отношениях нематода Caenorhabditis elegans устроена очень просто [27]
Длина взрослой особи С. elegans около 1 мм. Тело червя состоит приблизительно из 1000 соматических клеток и 1000-2000 половых клеток (рис. 16-30). С помощью электронной микроскопии серийных срезов удалось полностью, клетка за клеткой, реконструировать анатомию животного. Общий план строения этого примитивного червя в основных чертах такой же, как и у большинства высших животных. Удлиненное тело обладает билатеральной симметрией и состоит из обычных тканей (нервы, мышцы, кишечник, кожа), организованных обычным способом (рот и мозг на переднем конце тела, анальное отверстие на заднем). Наружная стенка тела состоит из двух слоев - защитной гиподермы («кожи») и подстилающего ее мышечного слоя. Простая трубка, образованная клетками энтодермы, формирует кишечник. Между кишечником и стенкой тела расположена вторая трубка (гонада), построенная из соматических клеток и содержащая половые клетки. Взрослые особи С. elegans представлены двумя формами - гермафродитами и самцами. Для простоты гермафродитов можно рассматривать как самок, образующих ограниченное количество спермы: самка может воспроизводиться либо путем самооплодотворения своей собственной спермой, либо путем перекрестного оплодотворения гермафродита самцом при спаривании. При самооплодотворении в основном возникают гомозиготные потомки, что превращает С. elegans в исключительно удачный объект для проведения генетических исследований.
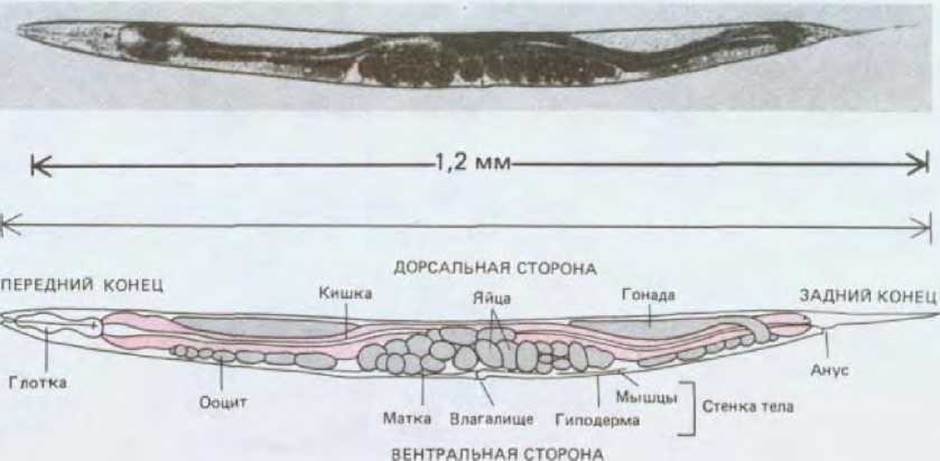
Рис. 16-30. Взрослая гермафродитная особь Caenorhabditis elegans (вид сбоку). (J. Е. Sulston, H. R. Horvitz, Dev. Biol., 56, 110-156, 1977.)
Сравнительной простоте анатомии С. elegans соответствует такая же простота генетического аппарата. В 6 парах гомологичных хромосом содержится, по-видимому, всего лишь около 3000 жизненно важных генов. Гаплоидный геном содержит 80 х 106 пар нуклеотидов, что примерно в 17 раз больше, чем у Е. coli и в 38 раз меньше, чем у человека. В настоящее время с помощью мутационного анализа идентифицировано примерно 800 генов. Среди них гены, влияющие на такие признаки, как форма и поведение червей, гены, кодирующие такие известные белки, как миозин, и гены, контролирующие характер и направление развития. Кроме того, получена библиотека генома в виде большого набора перекрывающихся фрагментов ДНК (см. разд. 5.6.3).
16.3.2. Для развития нематод характерно удивительное постоянство [28]
Развитие С. elegans начинается с одной клетки - оплодотворенного яйца, которое последовательно делится; на стадии 558 клеток под яйцевой оболочкой формируется маленький червячок. После вылупления клеточные деления продолжаются, что приводит к дальнейшему росту и половому созреванию червя, который проходит 4 последовательные личиночные стадии, разделенные линьками. В результате последней линьки образуется взрослая особь - червь-гермафродит, начинающий откладывать собственные яйца. Полный цикл развития от яйца до яйца занимает около 3 суток.
Тело червя прозрачно, поэтому здесь можно прижизненно наблюдать деление, миграцию и дифференцировку клеток (рис. 16-31), а также описать генеалогические отношения и поведение всех клеток, начиная со стадии одноклеточного яйца и кончая взрослым животным. Эти исследования показали, что соматические структуры животного образуются по одной неизменной генеалогической схеме. Каждое из множества клеточных делений происходит в строго определенное время. Это означает, что каждая клетка-предшественница и все ее потомки делятся у всех особей одинаково (за несколькими исключениями). Вот почему, зная положение данной клетки на родословном древе, можно предсказать ее судьбу (рис. 16-32). В отличие от этого, деление клеток зародышевой линии не запрограммировано столь жестко: после вылупления червя из яйца две клетки-предшественницы первичных половых клеток претерпевают несколько делений, давая начало большому числу потомков, судьба которых определяется положением, занимаемым ими в гонаде.
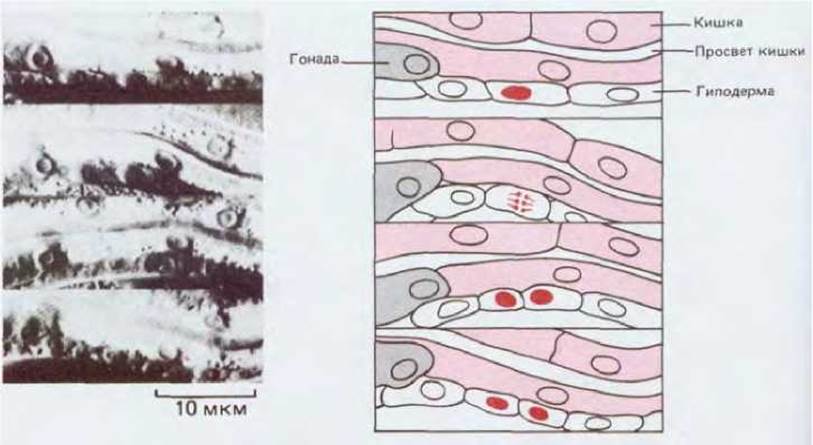
Рис. 16-31. Участок средневентральной области живой личинки С. elegans, сфотографированный последовательно четыре раза с интервалом в несколько минут. Видна делящаяся клетка гиподермы. (С любезного разрешения John Sulston, Judith Kimble.)
Полное описание генеалогии С. elegans приближает нас к ответу на фундаментальный вопрос. Нематоды, как и большинство животных, состоят из относительно большого числа клеток, которые можно отнести всего лишь к нескольким типам. Зная, что клетки имеют разное происхождение, легко поддаться соблазну и объяснять различия между ними происхождением от разных клонов; иными словами, все клетки данного типа могут быть потомками одной клетки - «основательницы» и предназначаться для развития по определенному пути. Однако генеалогический анализ показывает, что хотя на ранних стадиях развития отдельные клетки детерминируются в качестве предшественников определенного типа клеток, тем не менее это правило в общем не соблюдается ни для нематод, ни для других животных. Таким образом, у С. elegans (кроме клеток кишечника и половых клеток) клетки каждого из дифференцированных типов, например клетки гиподермы, нервные, мышечные и клетки гонад, происходят не от одной, а от нескольких клеток-«основательниц», которые возникли в независимых ветвях генеалогического древа (см. рис. 16-32). Следовательно, клетки, обладающие сходными признаками, не обязательно должны быть близкородственными. Напротив (хотя и редко), близкородственными могут оказаться клетки, различающиеся по множеству признаков; так, у С. elegans некоторые нейроны являются сестринскими по отношению к мышечным клеткам.
Следовательно, наша задача состоит в том, чтобы понять внутренние правила, действующие в каждой из ветвей генеалогического древа, в соответствии с которыми возникает серия клеточных типов, представленных определенным числом клеток.
16.3.3. Гены, контролирующие развитие, детализируют программу, управляющую клеточной генеалогией нематод [29]
В процессе развития клетка, подобно компьютеру, совершает выбор различных возможностей: делиться или не делиться, превратиться в нейрон или в мышечную клетку, стать предшественницей той или этой ветви генеалогического древа. Чтобы понять механизм такого выбора необходимо идентифицировать соответствующие гены. Мутации в этих генах обусловливают нарушение развития, но это не единственный вид мутаций, приводящих к подобным последствиям. Так, некоторые мутации жизненно важных генов могут «укоротить» родословное древо, вызвав преждевременную гибель эмбриона. Мутации в генах, определяющих синтез специализированных белков, приводят к тому, что при внешне нормальном строении тела некоторые типы дифференцированных клеток будут функционировать аномально. В отличие от всех вышеперечисленных случаев мутации генов, затрагивающих выбор программ развития, приводят к нарушению общего плана строения тела: в результате нормальные дифференцированные клетки будут располагаться в организме аномально. Нарушение генеалогического древа может выражаться и в появлении аномального количества определенных клеток. Все перечисленные типы мутаций позволяют идентифицировать гены, контролирующие развитие (рис. 16-33).
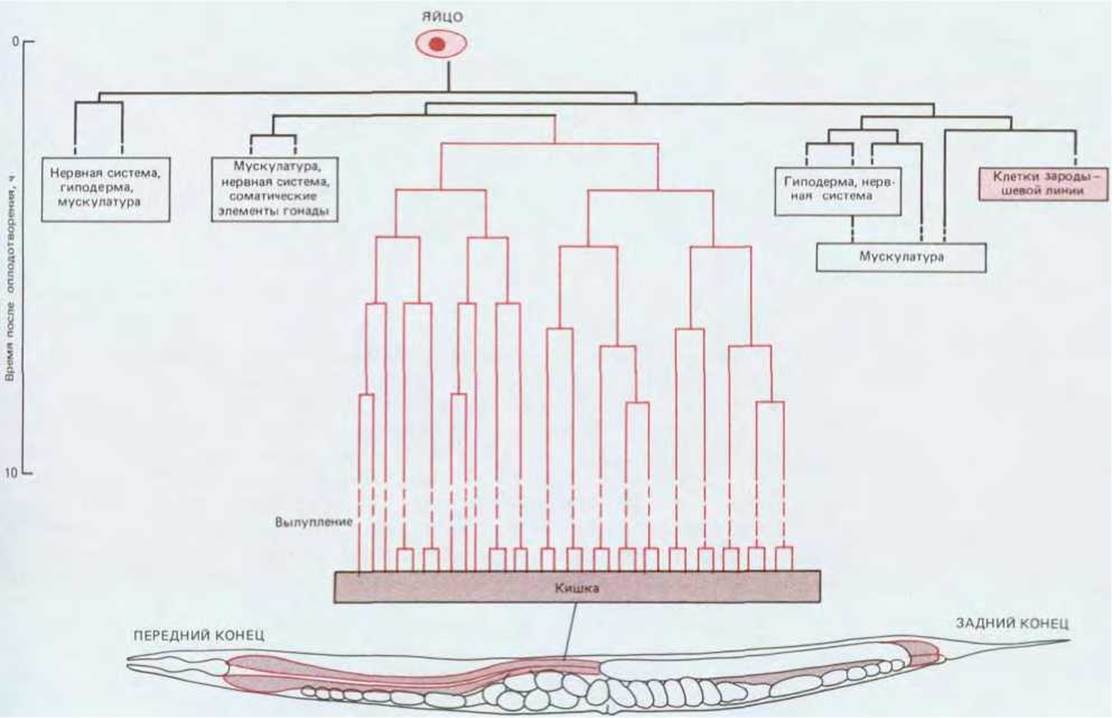
Рис. 16-32. Родословная клеток, формирующих кишечник С. elegans. Яйцо (вверху) изображено в том же масштабе, что и взрослая особь (внизу). Следует отметить, что клетки кишечника образуют только один клон (как и клетки зародышевой линии), тогда как в большинстве других тканей клетки могут давать начало нескольким клонам.
Мутации некоторых контролирующих генов приводят к замене одного типа клеток другим на последних этапах реализации программы развития. В данных случаях происходит изменение выбора, сделанного на более ранних стадиях, так что одна ветвь древа полностью замещается другой. Как показано на рис. 16-34, определенный тип развития может воспроизводиться с высокой частотой на нескольких независимых ветвях родословного древа. Такой феномен предполагает существование некой стандартной схемы, реализуемой в различных условиях. В целом возникает ощущение, что каждая из ветвей генеалогического древа контролируется сложной комбинацией генов, многие из которых задействованы и в контроле других ветвей.
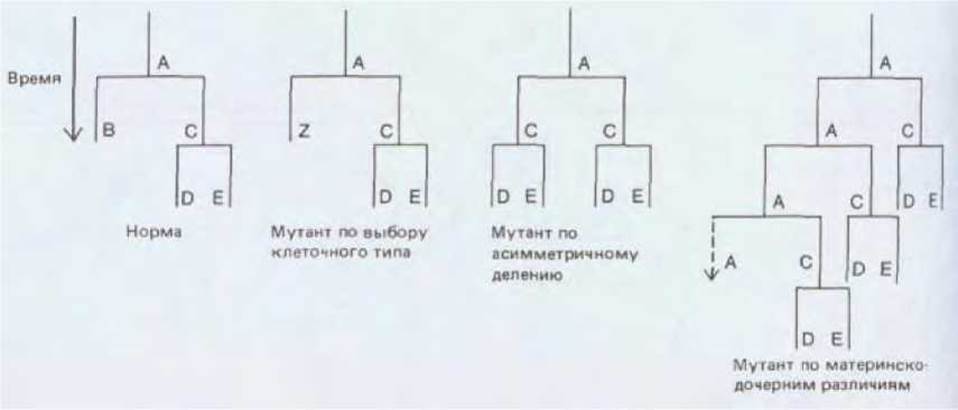
Рис. 16-33. Простой фрагмент родословной клеток и некоторые типы вариаций, которые могут происходить вследствие мутаций генов, контролирующих развитие. Анализ мутантных фенотипов позволяет определить в чем состояла нормальная функция мутировавших генов. Буквенные обозначения указывают внутреннее состояние клетки.
Системным программистам хорошо известно, что даже небольшие изменения программы могут существенно повлиять на результаты ее реализации. Точно также мутация одного контролирующего гена приводит к грубому искажению родословного древа. Это положение хорошо иллюстрируется так называемыми гетерохромными мутациями, в результате которых некоторые наборы клеток ведут себя согласно правилам, действующим на ином этапе нормального развития. Например, дочерняя клетка может вести себя подобно материнской или еще более ранним предшественницам, а ее потомки воспроизводят свойственный им фенотип и т. д. Таким образом, фрагмент генеалогического древа воспроизводится несколько раз и развитие всего организма нарушается. Для объяснения этого феномена на рис. 16-35 представлены эффекты серии мутаций гена lin-14. Вместо того чтобы следовать нормальной схеме клеточной дифференцировки, характеризующей последовательную смену 1-го, 2-го, 3-го и 4-го личиночных возрастов с последующим торможением делений, многие клетки мутантов по lin-14 воспроизводят схему, характерную для 1-го личиночного возраста, проходя по 5-6 циклов линьки и продолжая производить кутикулу незрелого типа. Другие мутации этого гена имеют обратный эффект, вынуждая клетки достигать зрелого состояния преждевременно, что сопровождается утратой промежуточных стадий. В результате животное достигает дефинитивной стадии, обладая аномально малым количеством клеток. Такое преждевременное развитие реализуется у мутантов, характеризуемых дефицитом нормальной активности lin-14; задержки развития наблюдаются у мутантов с аномально высоким уровнем активности данного гена. Таким образом, эффект продукта гена lin-14 состоит как бы в поддержании клеток в «молодом» состоянии и, по всей вероятности, нормальное развитие подразумевает постепенное ограничение синтеза этого продукта по мере взросления животных.

Рис. 16-34. Родословные схемы, показывающие, каким образом мутации генов, контролирующих развитие (в данном случае гена lin-22), могут приводить к одинаковым заменам одного варианта родословной на другой в нескольких различных ветвях родословного древа. Показаны линии потомков для каждой из 6 клеток-предшественниц гиподермы личинки С. elegans; расположение этих клеток указано вверху на рисунке, изображающем молодую личинку. Крестиками отмечены случаи запрограммированной гибели клеток, что представляет собой довольно обычное явление при нормальном развитии С. elegans и других видов. (Y. R. Horvitz et al., Cold Spring Harbor Symp. Quant. Biol., 48, 453 463, 1983.)
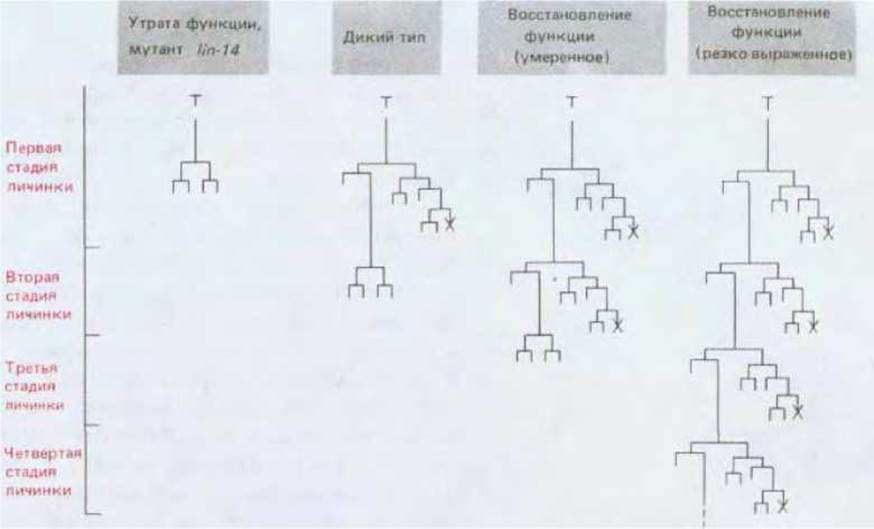
Рис. 16-35. Гетерохронные мутации гена lin-14 у С. elegans и их воздействие на одну из затрагиваемых ими родословных. Мутация с потерей функции (рецессивная) этого гена приводит к тому, что клетки начинают делиться и дифференцироваться так же, как у личинок на поздних стадиях развития; мутации с восстановлением функции (доминантные) этого гена обладают обратным эффектом. Крестиками отмечены случаи запрограммированной гибели клеток. (V. Ambros, H. R. Horvitz, Science, 226, 409-416, 1984.)
16.3.4. Программа дифференцировки согласована с программой клеточных делений [30]
Изучая гетерохронные мутации, исследователи столкнулись с еще одной сложной проблемой. Дело в том, что в процессе развития под контролем генома происходит уточнение программы деления клеток, а также программы клеточной дифференцировки и оба эти проявления клеточного поведения должны быть синхронизированы. У гетерохронных мутантов нарушено и деление, и дифференцировка. Это наводит на мысль о регуляции обоих процессов одним механизмом, поврежденным вследствие мутации.
Можно предположить, что роль такого механизма играет клеточный цикл. Однако факты не подтвержают это предположение: дифференцировка ранних эмбриональных клеток следует установленной схеме и при искусственном ограничении клеточных делений под влиянием химических веществ, ингибирующих цитокинез или синтез ДНК. Клеточные деления не следует уподоблять периоду колебаний маятника биохимических часов, определяющих темп развития; скорее ситуация обратная и именно биохимические часы контролируют темп клеточных делений и продолжительность клеточного цикла у множества видов животных. Изменение химического состояния клетки одновременно влияет на принятие решений о делении клеток, а также на время и направление дифференцировки. Молекулярные механизмы контроля клеточных делений в эмбриогенезе практически не изучены и представляют собой одну из центральных проблем современной биологии развития. Генеалогические мутанты нематод могут сыграть ключевую роль в решении этой проблемы.
16.3.5. Автономное поведение клеток и межклеточные взаимодействия взаимосвязаны и определяют характер развития [31]
Процессы развития плохо поддаются объяснению в отсутствие данных о степени автономности поведения отдельных клеток и вкладе межклеточных взаимодействий. Наблюдая последствия удаления клеток у нематод, можно оценить важность обмена сигналами между клетками. Для этого лазерный луч фокусируют в пятнышко диаметром 0,5 мкм (средний диаметр ядра С. elegans составляет около 2 мкм) и повторяющимися импульсами разрушают ядро какой-либо клетки. Клетка с разрушенным ядром погибает, а окружающие ее соседние клетки продолжают развиваться. Напрашивается вывод: большая часть клеток нематод в течение длительного периода своего жизненного цикла следует собственным программам развития и не зависит от сигналов соседних клеток.
И тем не менее межклеточные сигналы играют в развитии С. elegans и других животных очень важную роль. Хороший пример тому представляет развитие влагалища, или вульвы, - отверстия в гиподерме (коже) у гермафродитов для откладки яиц. Вульва располагается на брюшной стороне тела и сформирована из 22 клеток, возникших из трех клеток-предшественниц гиподермы по особой родословной. Одна из клеток гонады, так называемая якорная клетка, прикрепляет, или «заякоривает», расположенную над ней гонаду (матку) к развивающейся вульве для формирования пути выхода яиц из матки в окружающую среду. Результаты опытов с разрушением этой клетки лазерным лучом показывают, что именно она индуцирует развитие вульвы из трех ближайших клеток гиподермы. После уничтожения якорной клетки из этих клеток вместо вульвы возникает участок обычной гиподермы. Таким образом, якорная клетка индуцирует дифференцировку вульвы у С. elegans подобно тому, как вегетативные бластомеры индуцируют дифференцировку мезодермы у ранних эмбрионов Xenopus. Для этой индукции достаточно единственной якорной клетки: нормальное развитие вульвы происходит даже при уничтожении всех клеток гонады, за исключением якорной клетки (см. рис. 16-36, А).
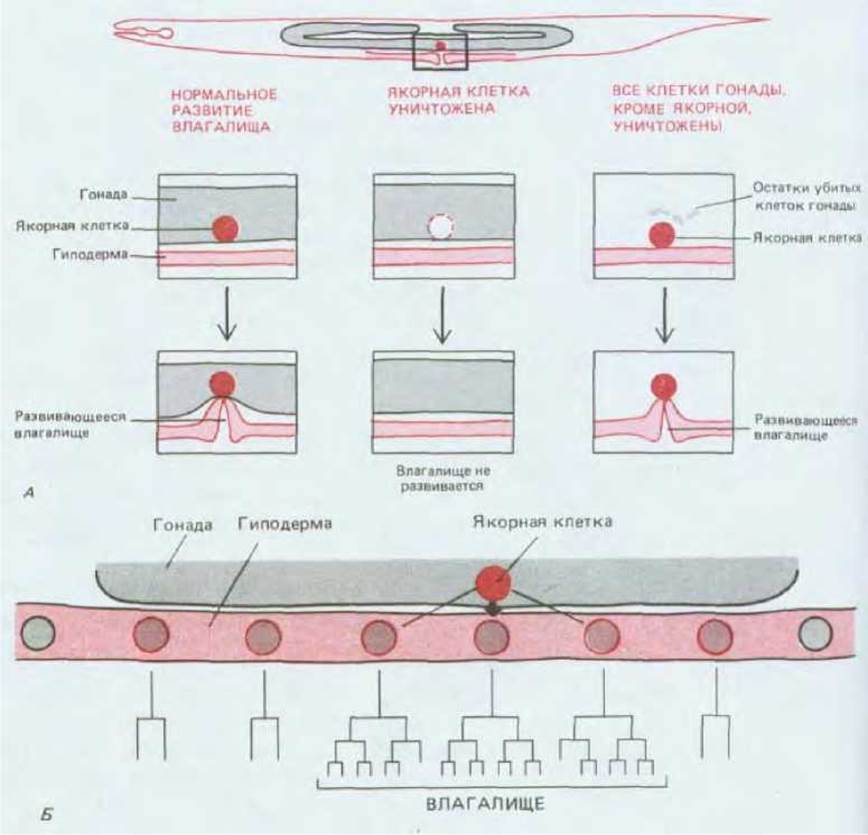
Рис. 16-36. А. Схема экспериментов, в которых было показано, что для развития вульвы необходимо индуктивное влияние якорной клетки. Б. Увеличенное изображение шести клеток группы эквивалентности вульвы (показаны в цвете) в вентральной гиподерме и нормальная родословная их потомков, приведенная внизу. Все эти 6 клеток (и только они) способны реагировать на индуцирующее воздействие вульвы, но в норме на это воздействие реагируют только 3 из них.
Индуцирующий сигнал якорной клетки обеспечивает пространственно согласованное с расположением гонады развитие вульвы, но эта система обладает определенным запасом гибкости. Три клетки гиподермы, в норме участвующие в формировании вульвы, соседствуют с тремя другими клетками, которые также способны выполнить эту задачу, если они попадают под влияние якорной клетки. При уничтожении лазерным лучом клеток-предшественниц вульвы эти соседние клетки сворачивают с пути своего нормального развития, вероятно, в связи с изменением местоположения, и вместо гиподермы формируют вульву. Другие клетки не способны реагировать на индуцирующий сигнал и не могут участвовать в формировании вульвы ни при каких обстоятельствах. Мы можем ввести понятие группы эквивалентности, примером которой на модели С. elegans (рис. 16-36, Б) могут служить три нормальные клетки-предшественницы вульвы и три соседние клетки, которые индуцируются сходным образом, поскольку эти клетки функционально взаимозаменяемы. Все участники группы эквивалентности отличаются от окружающих клеток тем, что они характеризуются иной предысторией развития. Именно это обстоятельство обеспечивает таким клеткам уникальную возможность реагировать на индуцирующий сигнал. Клетки этой группы приобретают различия под воздействием индуцирующего сигнала. Здесь мы имеем дело с особым примером того, как клеточная программа развития зависит от взаимодействия клеточной памяти (автономного свойства клеток) и сигналов, поступающих от других клеток (внешний контроль).
16.3.6. Эксперименты позволяют уточнить роль генов, контролирующих развитие [32]
Эксперименты, описанные в предыдущем разделе, помогают интерпретировать данные генетических исследований. Мутации любого из 5 различных генов могут приводить к образованию фенотипа multivulva, где все 6 клеток группы эквивалентности вступают на путь развития вульвы и вместо 22 клеток вульвы возникают 48 клеток и, как результат, несколько вульв. У этих мутантов все 6 клеток ведут себя, как если бы они застыли в состоянии активации якорной клеткой и разрушение последней не изменяет ход развития вульвы. В данном случае, вероятно, мутации затрагивают гены, которые в норме действуют в клетках группы эквивалентности вульвы, определяя их ответ на сигнал якорной клетки. Мутации другого небольшого набора генов приводят к образованию иного, противоположного фенотипа (vulvaless). И здесь, по всей вероятности, меняется способность клеток группы эквивалентности реагировать на индукцию.
Мутации гена lin-12 (вызывающего образование нескольких вульв) оказывают плейотропное действие: они могут обусловливать либо отсутствие, либо удвоение якорной клетки, меняя таким образом распределение индуцирующего сигнала и правила, согласно которым клетки группы эквивалентности вульвы реагируют на сигнал. Мутации гена lin-12 воздействуют и на иные группы эквивалентности, что наводит на мысль о некоем общем значении гена lin-12 в межклеточных взаимодействиях, посредством которых клетки какой-либо одной группы эквивалентности направляются по различным путям развития. Была определена последовательность нуклеотидов гена lin-12 и оказалось, что белок, кодируемый этим геном обладает гомологией с семейством белков, которые, как полагают, принимают участие в межклеточном общении у позвоночных и насекомых (см. разд. 12.3.12). К этому семейству относятся фактор роста эпидермиса у млекопитающих (ФРЭ), некоторые поверхностные рецепторы клеток млекопитающих, такие, как рецептор липопротеинов низкой плотности (ЛНП) (см. разд. 6.5.8), и продукт гена Notch, содействующий выбору пути развития эктодермы у дрозофилы: дифференцировка нервной ткани или дифференцировка эпидермиса. Такие находки дают основание полагать, что молекулярные уроки, усвоенные при изучении развития нематод, могут найти применение при изучении развития многих других видов.
16.3.7. Программу развития индивидуальных клеток млекопитающих можно анализировать в клеточной культуре: дифференцировка глиальных элементов зрительного нерва крысы [33]
Самый прямой способ отличить автономное поведение клетки от ее поведения под контролем межклеточных взаимодействий состоит в изучении того, как перемещение клеток в другой участок тела или их выделение с целью искусственного изменения среды обитания сказывается на их поведении. Эти вопросы трудно поддаются изучению у С. elegans, поскольку разрушение клеток лазерным лучом не позволяет решить эту задачу. Отсутствие информации о межклеточных взаимодействиях в процессе развития этой нематоды осложняет изучение базовых программ клеточного контроля, даже несмотря на хорошо изученную родословную всех клеток и характеристику многих мутантов по генам, контролирующим развитие. Среду, в которой находится клетка, проще изменять в культуре. Здесь появляется возможность непосредственного анализа как программ, контролирующих поведение клетки, так и межклеточных взаимодействий, управляющих клеточными делениями и дифференцировкой в процессе развития некоторых частей тела позвоночных.
Зрительный нерв является одним из простейших элементов центральной нервной системы млекопитающих и широко известен, как модельная система для таких исследований. Он содержит длинные аксоны нервных клеток сетчатки, направляющихся от глаза к мозгу. Структурную и функциональную опору аксонов в нервах обеспечивают три типа глиальных клеток (см. разд. 19.1.6): олигодендроциты и два типа астроцитов, известных просто как астроциты типов 1 и 2 (рис. 16-37). Все три типа глиальных клеток различают с помощью антител; с помощью такого же метода различают глиальные клетки и клетки-предшественницы. При исследовании клеток, выделенных из зрительного нерва на различных стадиях развития и помещенных в культуру, было показано, что три типа глиальных клеток (которые в норме делятся редко, если вообще делятся) возникают в различное время и происходят из двух ветвей генеалогического древа. Астроциты типа 1 возникают до рождения из клеток-предшественниц одного типа, а олигодендроциты и астроциты типа 2 образуются после рождения из другого типа клеток- предшественниц, именуемых «клетки-предшественницы 02А».

Рис. 16-37. Зрительный нерв крысы содержит аксоны нейронов сетчатки (указана только одна такая клетка) и 3 типа глиальных клеток. Астроциты типа 1 обеспечивают структурную опору нерва, выполняя роль, аналогичную роли клеток соединительной ткани в конечности. Олигодендроциты и астроциты типа 2 вместе участвуют в образовании оболочки вокруг каждого аксона: олигодендроциты обворачиваются вокруг аксона, формируя изолирующий миелиновый слой (см. разд. 19.2.11), а астроциты типа 2 выпускают тонкие отростки, контактирующие с аксонами в местах, где миелиновая оболочка прерывается, образуя перехват Ранвье. Нервный импульс по мере прохождения по аксону распространяется от одного перехвата Ранвье к другому (см. разд. 19.2.4).
Олигодендроциты в норме возникают в момент рождения, астроциты типа 2 через неделю после рождения.
После выяснения родословной этих клеток и времени их появления усилия исследователей были сконцентрированы на вопросе о том, какими правилами руководствуются клетки в своем поведении. Например, что вынуждает дифференцироваться клетки-предшественницы 02А и почему, если они дифференцируются в одно время, то становятся олигодендроцитами, а если в другое, то астроцитами типа 2? В какой степени эти события управляются неким собственным автономным часовым механизмом клетки и в какой степени дифференцировка зависит от поступления в определенное время внешних сигналов?
Если из эмбрионального зрительного нерва выделить клетки-предшественницы 02 А и культивировать в отсутствие астроцитов типа 1, которые в норме являются соседями клеток 02А, то клетки 02А прекращают делиться и досрочно начинают дифференцироваться; при помещении в эту же культуру астроцитов типа 1 клетки 02А прекращают деление, и их дифференцировка задерживается до срока, соответствующего in vivo дню рождения. Оказалось, что действие астроцитов типа 1 связано с секретируемым ими фактором роста. Полагают, что этот фактор роста соответствует тромбоцитарному фактору роста (ТФР, или PDGF-platelet-derived growth factor; см. разд. 13.3.4). Присутствие такого фактора приводит к предотвращению преждевременной дифференцировки клеток-предшественниц 02А; однако повышение концентрации этого фактора не затягивает дифференцировку по сравнению с нормой. Вероятно, клетки-предшественниц 02А эмбрионального зрительного нерва еще раньше принимают определенную программу развития, согласно которой по истечении определенного времени или через определенное число клеточных делений клетки теряют чувствительность к фактору роста и дифференцируются независимо от его наличия. Отдельные клетки-предшественницы 02А принимают такую программу в разное время и первые из них в норме начинают дифференцироваться в момент рождения.
Чем же определяется конкретное направление дифференцировки клетки в олигодендроцит или в астроцит типа 2? Клетки 02А в культуре, развиваясь в условиях бессывороточной среды, дифференцируются только в олигодендроциты: для них это конститутивный путь развития или в терминах информатики развитие «по умолчанию». В противоположность этому, дифференцировка астроцитов типа 2 выглядит, как индуцируемыш путь развития: клетки начинают такую дифференцировку под действием специфического белка, который можно выделить из зрительного нерва крысы. В значительных количествах этот белок синтезируется со второй недели развития, т.е. именно тогда, когда начинается дифференцировка астроцитов типа 2. Оказалось, что этот белок идентичен фактору роста нервов (ФРН, или CNTF-ciliary neurotrophic factor). Это позволяет предположить, что время синтеза ФРН определяет время дифференцировки астроцитов типа 2 в развивающемся нерве. До сих пор неясно, какие именно клетки синтезируют ФРН in vivo и какие факторы контролируют точное время начала его синтеза, однако известно, что в культуре этот фактор могут синтезировать астроциты типа 1.
Данные этих исследований еще раз подтверждают предположение о том, что развитие клеток представляет собой результат взаимодействия автономных процессов и поведения, контролируемого сигналами окружающей среды. Здесь были показаны преимущества метода культуры клеток для изучения молекулярных основ этих процессов. Можно попытаться суммировать эти находки в схеме потока информации, которая, в терминах информатики, представляет собой внутреннюю программу клеток-предшественниц 02А, т.е. набор правил, согласно которым клетки прочитывают сигналы окружающей среды и выбирают время и место дифференцировки (рис. 16-38). Такая информация о поведении отдельных клеток особенно важна, если мы действительно пытаемся разобраться в закономерностях эмбрионального развития. Мы пока не в состоянии дать ответ на фундаментальный вопрос, каким образом возникает пространственное распределение множества клеток во всем организме, но к этой проблеме мы вернемся в следующем разделе.

Рис. 16-38. Схема, в которой упрощенная модель программы межклеточного контроля представлена в виде программы компьютера. Вероятно, эта программа участвует в регуляции клеточных делений и дифференцировки у клеток-предшественниц олигодендроцитов и астроцитов типа 2 (02А) в развивающемся зрительном нерве млекопитающих. Широкие стрелки изображают «вход-выход» данных, т. е. внеклеточные сигналы принимаемые или испускаемые клеткой. Неполные или предполагаемые участки этой схемы указаны прерывистыми линиями; соответствующая широкая стрелка, указывающая налево, демонстрирует возможность обратной связи от клеток-предшественниц 02А, которая могла бы содействовать регулировке сигналов, поступающих от клеток-предшественниц астроцитов типа 1. Считают, что клетки-предшественницы 02А постоянно возобновляются в условиях in vivo, начиная примерно с последней недели перед рождением (не показано).
Заключение
Для понимания программ развития индивидуальных клеток эмбриона необходимо проследить их историю, проведя анализ клеточной родословной. Для генеалогии позвоночных характерна случайная изменчивость. Но у определенных нематод и некоторых других групп беспозвоночных схема клеточных делений в процессе развития контролируется настолько точно и настолько предсказуемо, что клетки, занимающие в теле животного определенное положение, у всех особей данного вида развиваются по одному и тому же пути. Была прослежена нормальная судьба всех клеток нематоды Caenorhabditis elegans в течение всего периода развития и изучены последствия экспериментального воздействия на уровне индивидуальных идентифицируемых клеток. Идентифицированы многие гены, определяющие реализацию программы, контролирующей развитие клеток. Для этого были изучены изменения клеточных родословных, возникающие вследствие мутации данных генов. В общем можно отметить, что мутации генов, контролирующих развитие, координированно влияют на дифференцировку и деление клеток. Эти наблюдения позволяют предположить, что контроль указанных клеточных процессов обеспечивается неким общим базовым механизмом. При разрушении клеток лазерным лучом было выявлено, что постоянство развития С. elegans является результатом точной взаимосвязи межклеточных взаимодействий и автономных процессов, реализуемых в отдельных клетках. Например, наблюдая за процессом развития вульвы, можно установить индукционные взаимодействия, которые могут быть связаны с действием определенных генов, контролирующих развитие.
Другим методом анализа программ, контролирующих развитие индивидуальных клеток, является изучение поведения клеток в культуре. Этот подход был использован с целью выявить правила, определяющие клеточную дифференцировку и деление в процессе развития глиальных клеток зрительного нерва млекопитающих. Здесь было получено еще одно подтверждение того, что поведение клеток регулируется не только межклеточными сигналами, но и автономными программами развития отдельных клеток.