Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Клеточные механизмы развития
Клеточная память и возникновение разнообразия клеток
Из оплодотворенного яйца может развиться самец или самка, морской еж, лягушка или человек. Результат развития определяется геномом: линейная последовательность А, G-, С- и Т-нуклеотидов в ДНК организма должна направлять создание множества различающихся химически клеточных типов, которые организованы в пространстве определенным образом. Задача биологии развития состоит в объяснении этого процесса. Прежде всего необходимо ответить на вопрос, каким образом в эмбриогенезе возникают различия между исходно одинаковыми клетками. Для иллюстрации основных законов развития обратимся сначала к земноводным, а затем к млекопитающим.
16.2.1. В ходе развития геном сохраняет постоянство, но меняется экспрессия генов [15]
Клетки различных типов отличаются друг от друга главным образом потому, что помимо многочисленных белков, необходимых всем им без исключения для поддержания жизнедеятельности, клетки каждого типа синтезируют свой собственный набор специализированных белков. Например, в клетках эпидермиса синтезируется кератин, в эритроцитах - гемоглобин, в клетках кишечника - пищеварительные ферменты, в клетках хрусталика - кристаллины и т.д. Поскольку для клеток каждого типа характерны специфические наборы генных продуктов, может возникнуть вопрос: не объясняется ли это просто тем, что клетки обладают различными наборами генов? Клетки хрусталика, например, утратили гены кератина, гемоглобина и т.д., но сохранили гены кристаллитов; или же в них за счет амплификации избирательно увеличилось число копий кристаллиновых генов. Однако целый ряд данных показывает, что это не так: клетки почти всех типов содержат одинаковый полный геном, имевшийся первоначально в оплодотворенном яйце. Причина различия в свойствах клеток заключена не в обладании разными наборами генов, а в их дифференциальной экспрессии. Иными словами, активность генов регулируется: они могут включаться и выключаться (см. гл. 10).
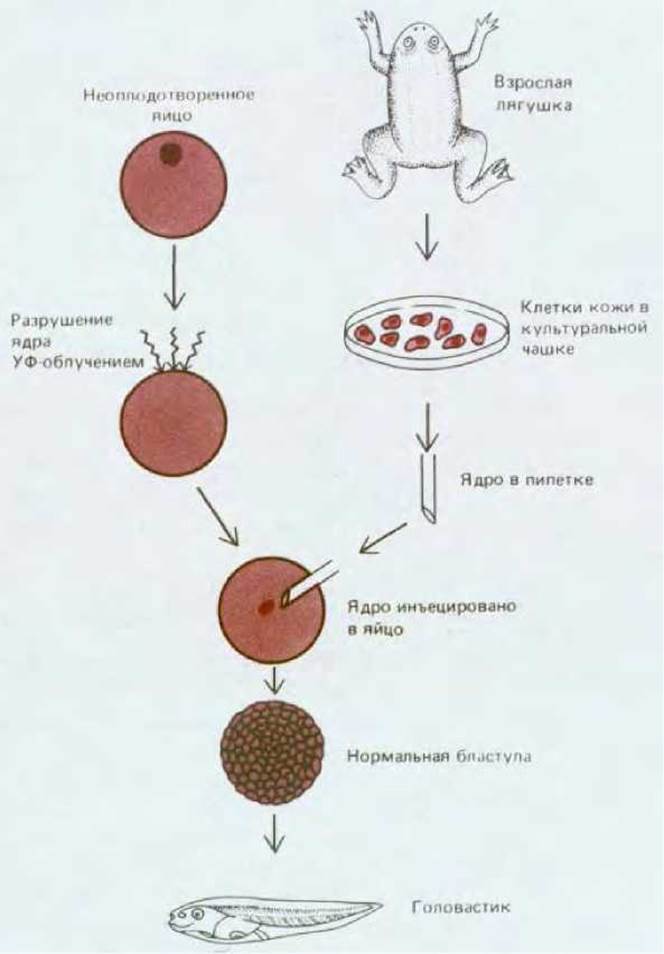
Рис. 16-18. Схема опыта, демонстрирующего, что ядро дифференцированной клетки кожи лягушки содержит весь необходимый генетический материал, обеспечивающий развитие нормального головастика. (J. В. Gurdon, Gene Expression During Cell Differentiation. Oxford, U.K, Oxford University Press, 1973; с изменениями.)
Наиболее убедительные данные о том, что, несмотря на видимые изменения в клетках при дифференцировке, собственно геном остается в них неизменным, были получены в опытах с пересадкой ядер в яйцеклетки амфибий (рис. 16-18). Как правило, размеры яйцеклеток амфибий позволяют с помощью стеклянной микропипетки инъецировать в них ядра, полученные из других клеток. Ядро самого яйца предварительно разрушают, облучая ультрафиолетом. Укол микропипеткой побуждает яйцеклетку к началу развития (см. разд. 15.4.3). Таким образом можно определить, содержит ли ядро дифференцированной соматической клетки полный геном, эквивалентный геному нормальных оплодотворенных яйцеклеток и способный обеспечить развитие. Ответ оказался утвердительным: при замене ядра яйцеклетки ядром кератиноцита из кожи взрослой лягушки или ядром эритроцита были получены нормальные плавающие головастики. Такие эксперименты имеют ряд ограничений: они успешны при использовании ядер лишь некоторых дифференцированных клеток и яйцеклеток определенных видов. Тем не менее результаты и других исследований позволяют прийти к заключению о том, что в процессе развития постоянство генома сохраняется.
Из этого правила известно несколько исключений. Например, у некоторых беспозвоночных в соматических (не половых) клетках часть хромосом, представленных в клетках зародышевой линии (предшественниках гамет), утрачивается уже на ранних стадиях развития. В ооцитах некоторых других животных (в том числе и у Xenopus laevis) происходит избирательная репликация генов рибосомной РНК, а у личинок некоторых насекомых имеет место неравная политенизация хромосом, в результате чего происходит усиленная амплификация каких-то одних определенных генов (см. разд. 9.2.6). Синтез антител и антиген - специфических рецепторов лимфоцитами у позвоночных включает сплайсинг фрагментов ДНК, расположенных в геноме этих специализированных клеток в разных местах. Сплайсинг происходит по мере дифференцировки данных клеток (см. гл. 18).
16.2.2 Различия между бластомерами часто являются следствием асимметрии, присущей яйцеклетке (за исключением млекопитающих) [16]
При трансплантации ядра недифференцированной клетки в энуклеированную яйцеклетку Xenopus меняется характер экспрессии генов и такое ядро начинает походить на нормальное ядро яйцеклетки. Следовательно, поведение ядра может контролироваться цитоплазматическим окружением, в котором оно находится. Яйцеклетка Xenopus и многих других видов химически асимметрична, т. е. концентрация некоторых компонентов яйца различна в разных участках цитоплазмы. Вследствие этого с самого начала развития образующиеся эмбриональные клетки по некоторым свойствам отличаются друг от друга, поскольку их цитоплазма наследует неравное количество таких заранее синтезированных веществ. У разных видов значение локализованных в яйце детерминантов варьирует. Например, яйцеклетки млекопитающих симметричны и поэтому все ранние бластомеры совершенно одинаковые. Вместе с тем хорошо известен феномен «мозаичных» яиц у моллюсков, асцидий, морских нематод (см. разд. 13.5.17) и животных некоторых других групп. Такие яйца содержат определенный набор локализованных детерминантов. Плоскости первых делений дробления ориентированы в зависимости от расположения определенных веществ в яйце и поэтому каждый из бластомеров наследует предсказуемый набор молекул (рис. 16-19). После разделения ранних бластомеров, которые развиваются в этом случае вне связи между собой, большая часть таких изолированных бластомеров явится источником именно тех типов клеток, что и должны были образоваться из этих бластомеров в нормальном эмбрионе. Эта контролирующая функция содержимого яйцеклетки может быть продемонстрирована при искусственном изменении распределения веществ яйцеклетки по отношению к плоскостям делений дробления. Такие опыты можно поставить на яйцеклетках асцидий Styela (рис. 16-19), где различные участки цитоплазмы легко различимы, поскольку содержат разные пигменты. При нарушении распределения этих веществ в эмбрионе можно, исходя из типа наследованной каждым из бластомеров цитоплазмы, легко предсказать характер развития данного бластомера.
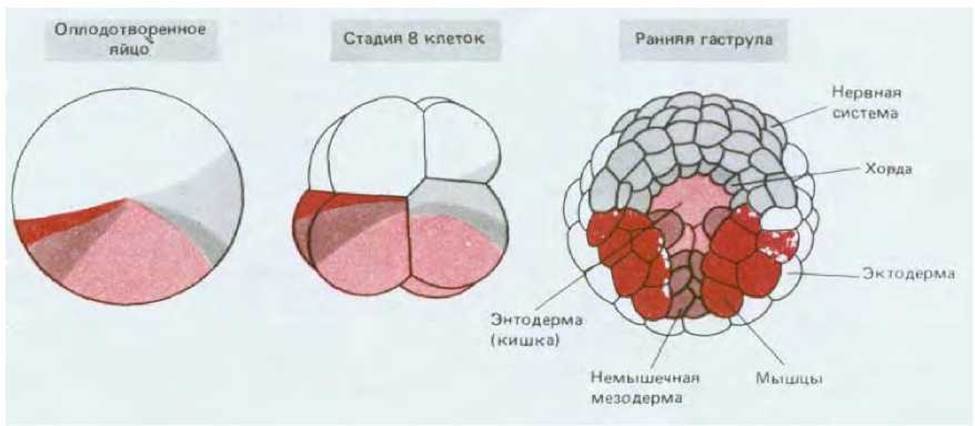
Рис. 16-19. Три последовательные стадии раннего развития асцидий Styela. Справа изображение ранней гаструлы (вид снизу), где можно видеть образующуюся полость кишки. Различные области цитоплазмы яйца пигментированы по-разному. Пигментация носит постоянный характер и связана с определенным типом делений дробления. Судьба каждого бластмера может быть представлена на основе того, какую часть цитоплазмы яйца унаследовали бластомеры (см. также рис. 16-29). (P. P. Grasse, Traite de Zoologie. Paris, Masson, 1966.)
Исследование мозаичных яиц ставит интересный для клеточной биологии вопрос: каким образом столь точно коррелированы характер дробления и распределение химических веществ? Возможно, что и то, и другое определяется строением цитоскелета. Некоторые факты свидетельствуют в пользу того, что локализованные химические детерминанты соединены с цитоскелетом и именно цитоскелет контролирует прохождение плоскостей делений дробления (см. разд. 13.5.13).
16.2.3. Химические взаимодействия между бластомерами приводят к возникновению новых типов клеток, расположение которых более детализировано: индукция мезодермы у Xenopus [17]
Яйцеклетка Xenopus представляет собой некое усреднение крайностей, примерами которых являются мозаичные яйца и яйца млекопитающих. Асимметричное расположение компонентов в цитоплазме яйцеклетки Xenopus обусловливает различия бластомеров анимального и вегетативного полюсов, что можно рассматривать в качестве характеристики начальных этапов пространственной организации эмбриона. Создание всего набора типов клеток определяется взаимодействиями между бластомерами. Если ранние эмбрионы Xenopus поместить в среду, лишенную ионов Са2+ или Mg2+, то бластомеры теряют липкость и легко отделяются друг от друга, причем каждый отделившийся бластомер способен развиваться независимо; в этой ситуации у некоторых бластомеров возникнут признаки, характерные для эктодермы, иные приобретут признаки энтодермы, но экспрессии генов актина (специфического для мышц), являющихся маркером мезодермальной дифференцировки, наблюдаться не будет. Обратный эксперимент подтверждает, что приобретение клетками мезодермальной природы определяется (по крайней мере частично) межклеточными взаимодействиями: при помещении клеток анимального полюса бластулы вблизи клеток вегетативного полюса первые переходят с эктодермального на мезодермальный путь развития (рис. 16-20). Переключение путей развития клеток под влиянием соседней группы клеток называется индукцией; в процессе нормального развития индукционные взаимодействия могут происходить как между клетками, исходно прилежащими друг к другу (индукция мезодермы), так и между клетками, сближающимися в результате морфогенетических движений, например при гаструляции. Взаимодействие нескольких типов клеток, реализуемое в результате серии последовательных индукций, позволяет создать множество разнообразных типов клеток (рис. 16-21).
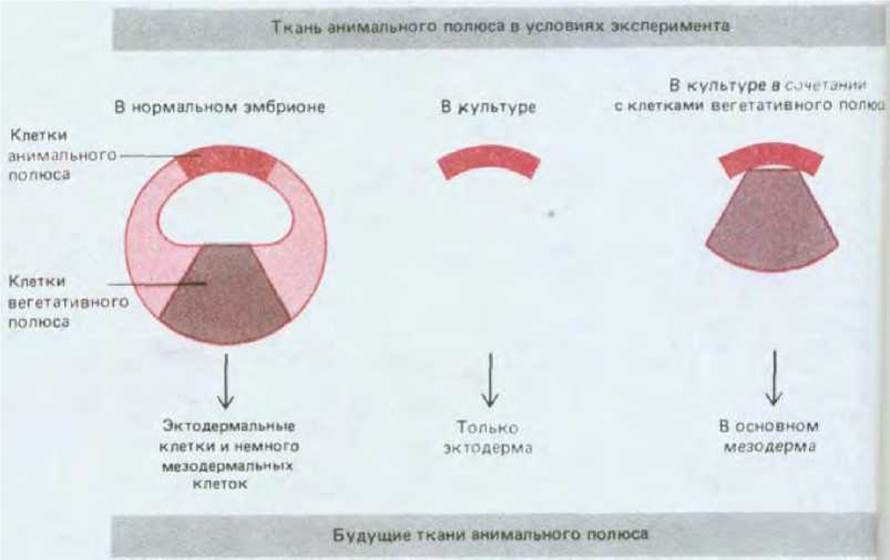
Рис. 16-20. Индукция мезодермы у Xenopus. Клетки анимального полюса бластулы, которые в норме формируют только эктодерму, при помещении их в культуру вместе с клетками вегетативного полюса, принимают участие в формировании мезодермы. При нормальном развитии такие индукционные взаимодействия происходят на более ранней стадии; к этому времени экваториальный участок бластулы уже приобретает способность формировать мезодерму в условиях изоляции в культуре.

Рис. 16-21. В результате серии индукционных взаимодействий из нескольких исходных может возникать множество различных типов клеток.
При индукции мезодермы у Xenopus непосредственный контакт между клетками необязателен, они могут располагаться на некотором расстоянии друг от друга. Отсюда следует, что индуцирующим агентом является диффундирующее вещество. Оказалось, что вместо бластомеров вегетативного полушария можно использовать фактор роста фибробластов (ФРФ) (см. табл. 13-1), который индуцирует клетки из области анимального полюса к развитию по мезодермальному пути; образование мезодермы можно также индуцировать трансформирующим фактором (ß2 (ТФ-β2), одним из двух вариантов ТФ-ß (см. табл. 13-1). Действие ФРФ, как правило, вызывает развитие вентральных производных мезодермы (например, клеток крови), а ТФ-β2 в основном индуцирует дорсальные производные (например, мышцы). Нормальные эмбрионы Xenopus содержат мРНК, кодирующую ФРФ. мРНК белка Vgl, обладающего частичной гомологией к ТФ-ß, не только присутствует в яйцеклетке, но, как было показано, локализована в области вегетативного полюса яйцеклетки и ранних эмбрионов (рис. 16-22). Эти наблюдения свидетельствуют о том, что ФРФ, ТФ-β2 или родственные им молекулы, опосредуют индукцию мезодермы. Этот и другие примеры, число которых быстро увеличивается, позволяют прийти к выводу, что в регуляции путей развития важную роль играют несколько десятков белков, именуемых факторами роста, которые в организме взрослых животных регулируют клеточные деления и дифференцировку, а также восстановление тканей (см. гл. 17). Подобно нейромедиаторам в нервной системе, такие факторы, по-видимому, используются в разных обстоятельствах для передачи различных сигналов между клетками.

Рис. 16-22. Окрашенные точки указывают на расположение мРНК, кодирующей белок Vgl, в вегетативном полушарии яйцеклетки Xenopus на различных стадиях развития. Это было продемонстрировано методом гибридизации in situ. Белок Vgl частично гомологичен фактору роста ТФ-ß и может быть составным элементом сигнала, индуцирующего мезодерму, который создается клетками вегетативного полюса на ранней стадии развития эмбриона. Механизм, контролирующий изменение локализации Vgl-мРНК, не изучен.
16.2.4. Эмбрионы млекопитающих развиваются в матке, обеспечивающей их защиту [18]
Развитие млекопитающих имеет ряд особенностей. Важнейшая из них состоит в том, что оно происходит в матке, которая защищает эмбрион и освобождает его от необходимости развиваться быстро. Кроме того, поскольку плацента обеспечивает эмбрион питательными веществами за счет материнского организма, яйцеклетке млекопитающих не нужны большие запасы этих веществ в виде желтка. В связи с этим диаметр яйца мыши составляет 80 мкм, и по объему оно примерно в 2000 раз меньше типичного яйца земноводных. Деления дробления происходят не быстрее делений обычных соматических клеток и транскрипция начинается уже на стадии 2-клеточного зародыша. Поздние стадии развития млекопитающих в основных чертах схожи с такими же стадиями развития других позвоночных, например Xenopus. Однако в ходе развития млекопитающих наблюдается большой «крюк», имеющий целью создание сложных структур, прежде всего амниона и плаценты, которые замыкаются вокруг собственно зародыша, защищают его и обеспечивают обмен метаболитами с материнским организмом. Эти структуры, как и остальные органы, образуются из оплодотворенного яйца, но их называют внезародышевыми, так как при рождении они отбрасываются и не участвуют в построении взрослого организма.
Этапы раннего развития мыши изображены на рис. 16-23. Вначале яйцо покрыто прозрачной оболочкой - zona pellucida. Оплодотворенное яйцо дробится внутри этой оболочки и из него образуется морула, представляющая собой группу клеток, по форме напоминающую ягоду малины (рис. 16-23). При переходе от 8-клеточной к 16-клеточной стадии поверхность морулы становится более гладкой, а форма более округлой, так как в результате изменения взаимной адгезивности клеток они укладываются более компактно (рис. 16-24). Между клетками наружного слоя образуются плотные контакты, и таким образом внутренние участки морулы изолируются от внешней среды. Затем внутренние межклеточные пространства расширяются и возникает бластоцель - полость, заполненная жидкостью. Морула превращается в бластоцисту. Клетки, окружающие бластоцель, образуют на этой стадии сферический пузырек, на одном из полюсов которого имеется более массивное скопление клеток. Наружный слой клеток называют трофэктодермой, а скопление клеток внутри трофэктодермы на одном из полюсов бластоцисты - внутренней клеточной массой (рис. 16-23).
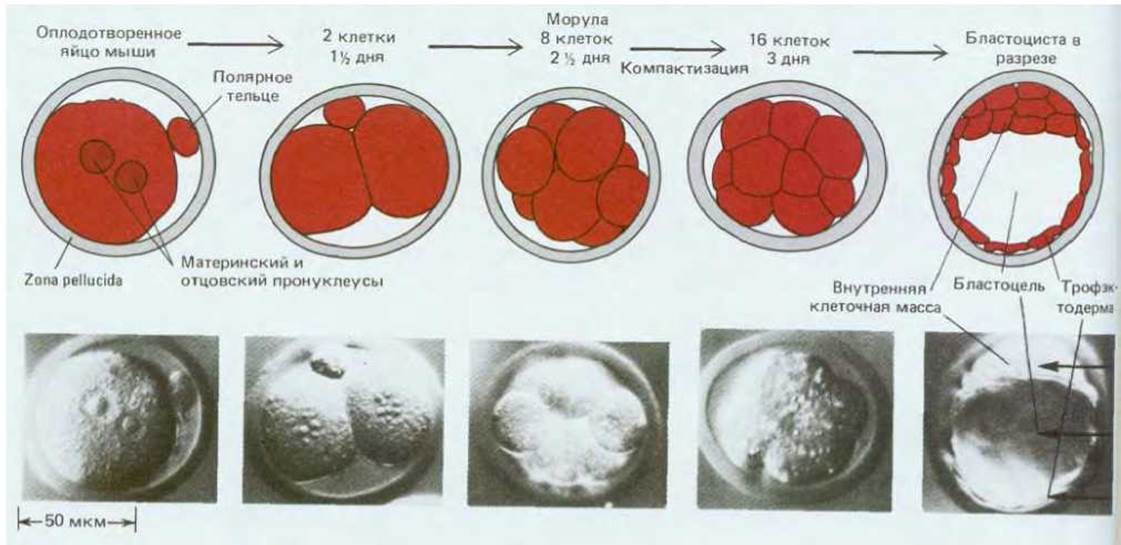
Рис. 16-23. Ранние стадии развития мыши. (Фотографии с любезного разрешения Patricia Calarco, из G. Martin, Science, 209, 768-776, 1980.Copyright 1980, American Association for the Advancement of Science.)

Рис. 16-24. Мышиный эмбрион на ранних стадиях развития. Микрофотографии получены с помощью сканирующего электронного микроскопа. Zona pellucida удалена. А. Стадия двух клеток. Б. Стадия четырех клеток (наряду с четырьмя бластомерами видно полярное тельце, см. разд. 15.3.3). В. Стадия морулы - 8 — 16 клеток; происходит компактизация зародыша. Г. Бластоциста. (С любезного разрешения Patrica Calarco; Г - из Р. Calarco, С. J. Epstein. Dev. Biol., 32, 208-213, 1973.)
Собственно зародыш формируется только из внутренней клеточной массы. Трофэктодерма служит предшественником плаценты и образуется ранее других внезародышевых структур. После исчезновения zona pellucida клетки трофэктодермы вступают в контакт со стенкой матки, в которую имплантируется эмбрион. Тем временем внутренняя клеточная масса растет и начинает дифференцироваться: часть ее также образует внезародышевые структуры, например желточный мешок, а из другой части формируется собственно зародыш. Здесь, подобно соответствующим этапам развития других видов позвоночных, также происходят процессы гаструляции, нейруляции и т.д., хотя в ряде случаев эта гомология внешне далеко не столь очевидна из-за особенностей геометрии зародышей млекопитающих.
16.2.5. Дифференцировка клеток раннего эмбриона млекопитающих зависит от межклеточных взаимодействий [19, 20]
Ранний зародыш млекопитающих вплоть до 8-клеточной стадии обладает поразительной способностью к регуляции развития и каждая из его клеток может образовать в дальнейшем любую из частей более позднего зародыша или даже взрослого организма. Примером тому может служить образование идентичных близнецов из одной оплодотворенной яйцеклетки. В данном случае возникают два вполне нормальных индивидуума, каждый из которых сформирован из части нормального зародыша. Если, например, одну из клеток 2-клеточного эмбриона мыши разрушить иглой, а оставшийся неполный эмбрион имплантировать в матку для дальнейшего развития, то в большом числе случаев на свет появится вполне нормальная мышь.
Вместе с тем можно объединить два восьмиклеточных эмбриона мыши в одну гигантскую морулу, которая в результате развития образует мышь нормального размера (рис. 16-25). Животных, возникающих вследствие развития агрегатов генетически различных клеток, называют химерами. Химер можно получать также в результате инъекции клеток ранних эмбрионов в бластоцисты иного генотипа. Введенные чужеродные клетки включаются в состав внутренней клеточной массы эмбриона-реципиента и в результате образуется химерное животное. Химер можно получить даже после инъекции одной клетки; это позволяет выяснить, насколько та или иная клетка сохраняет потенции к развитию. Из результатов подобных экспериментов следует важный вывод: клетки очень ранних эмбрионов млекопитающих (вплоть до 8-клеточной стадии) идентичны и обладают неограниченными потенциями, т. е. они тотипотентны.
Клетки становятся различными вследствие их взаимодействия друг с другом. У эмбриона мыши первые различия между клетками внутренней клеточной массы и трофэктодермы обусловливаются расположением межклеточных контактов. На 8клеточной стадии все бластомеры занимают примерно одинаковое положение, их внутренняя поверхность контактирует с другими бластомерами, а внешняя поверхность обращена наружу. Каждый из бластомеров обладает полярностью, характеризуемой присутствием микроворсинок на наружной поверхности и асимметричным расположением внутриклеточных компонентов. Результаты экспериментов на бластомерах in vitro показывают, что такая полярность определяется характером межклеточных контактов: сборка микроворсинок и ассоциированных с ними компонентов осуществляется при условии, что этот участок поверхности не имеет контакта с другими бластомерами. Плоскость следующего деления ориентирована так. чтобы использовать эту асимметрию для создания двух различных потомков, один из которых (клетка внутренней клеточной массы) обращен внутрь и лишен компонентов, ассоциированных с микроворсинками, а другой (клетка трофэктодермы) обращен наружу и наследует эти компоненты. Таким образом, расположение межклеточных контактов, вероятно, контролирует возникновение первых различий между клетками (рис. 16-26).
16.2.6. Поведение клеток тератокарциномы демонстрирует значение сигналов окружающей среды [21]
В раннем развитии млекопитающих судьба каждой из клеток зависит от взаимодействия с соседями, и такой зародыш можно отнести по характеру развития к регуляционным системам. Эксперименты на мышах, описанные ранее, являются хорошим примером этому: клетки половинных или удвоенных химерных эмбрионов подстраивают свое поведение так, чтобы в результате развития возникло животное, не отличающееся от нормы ни по размерам, ни по строению. Однако в сильно отклоняющихся от нормы условиях развития эмбриональные клетки выходят из-под контроля. Отсюда следует несколько важных выводов.

Рис. 16-25. Метод получения химерных мышей путем объединения двух морул с разными генотипами.
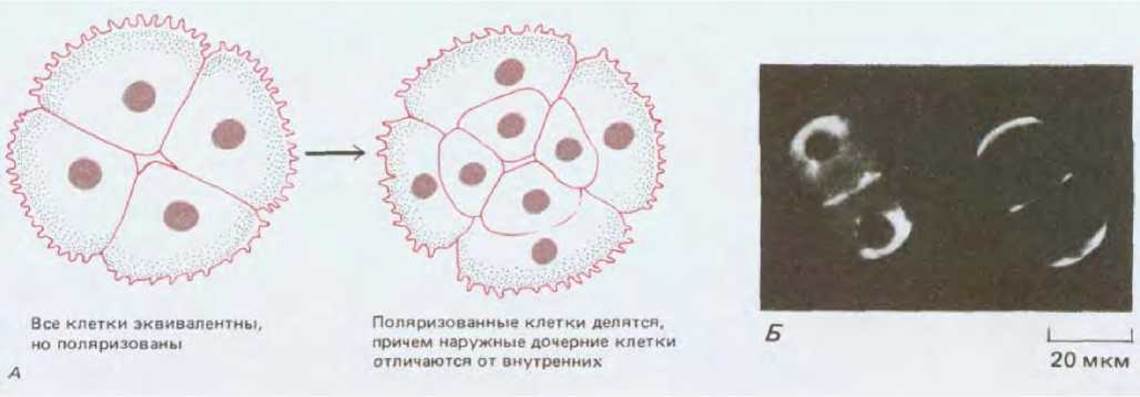
Рис. 16-26. А. Поляризация бластомеров мыши на стадии 8-клеточного зародыша приводит к тому, что на стадии 16 клеток наружные и внутренние клетки различаются по химическим свойствам. Б. Два бластомера из эмбриона мыши в конце 8-клеточной стадии, меченные флуоресцирующими антителами против клатрина (слева), или флуоресцирующим конканавалином А (справа). На рисунке видно, что имеет место поляризация внутренних компонентов клетки, а также свойств клеточной поверхности. (Б-из В. Maro, M.H. Johnson, S. J. Pickering, D. Louvard, J. Embryol. Exp. Morphol., 90, 287-309, 1985.)
При трансплантации нормальных ранних эмбрионов в почки или семенники взрослых животных происходит дезорганизация эмбрионов и нарушается нормальный контроль клеточной пролиферации. В результате аномального роста возникает тератома - дезорганизованная масса клеток, содержащая многие дифференцированные ткани (кожу, кости, железистый эпителий и т. д.) вперемешку с недифференцированными стволовыми клетками, которые продолжают делиться и создавать эти дифференцированные ткани. Тератома может возникать и спонтанно в результате случайного нарушения развития. В нормальных условиях дробление и эмбриогенез начинаются только после того, как произойдет оплодотворение яйцеклетки спермием. Это событие служит сигналом к развитию. Но в некоторых случаях ооцит приступает к развитию спонтанно. Такое спонтанное (без оплодотворения) развитие носит название партеногенетического (см. разд. 15.4.3). Если это происходит до высвобождения ооцита из яичника, то до стадии бластоцисты эмбрион развивается практически нормально, но затем возникает тератома. Тератома может возникать и у самцов из первичных половых клеток в семенниках; у грызунов образование тератомы можно спровоцировать искусственно путем пересадки взрослому животному развивающихся семенников эмбриона, содержащих первичные половые клетки.
Во всех этих случаях возникают весьма сходные тератомы и все они могут быть использованы для получения перевиваемых злокачественных опухолей тератокарцином. Тератокарцинома способна расти до тех пор, пока не вызовет гибели хозяина. Трансплантируя раковые клетки от одной особи к другой, тератокарциному можно поддерживать неопределенно долго. Тератокарцинома содержит часть недифференцированных стволовых клеток и часть дифференцированных клеток, образующихся из стволовых. Стволовые клетки тератокарциномы можно культивировать in vitro в виде постоянных клеточных линий. В подходящей среде они продолжают пролиферировать без дифференцировки неопределенно долго. Но если среду изменить, добавив индуктор дифференцировки, например ретиноевую кислоту, или создать условия, в которых клетки агрегируют, то стволовые клетки получают импульс к дифференцировке и образуют множество нормальных специализированных типов клеток.
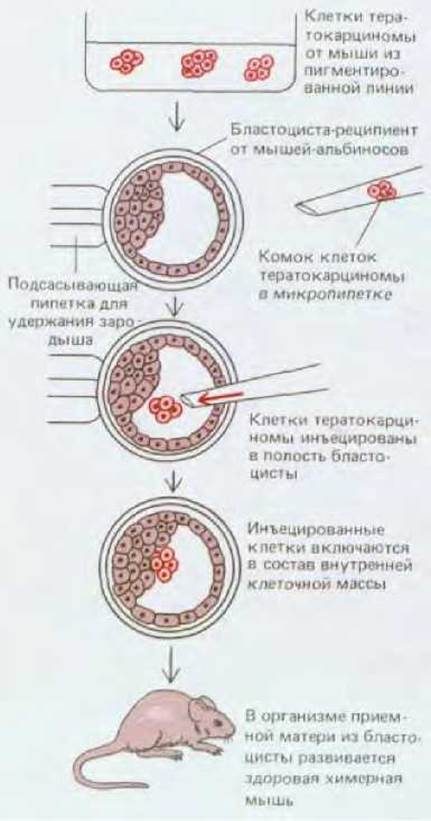
Рис. 16-27. Эксперимент, который, показывает, что в результате объединения клеток тератокарцином с клетками нормальной бластоцисты может получиться здоровая химерная мышь.
Можно думать, что любопытные свойства стволовых клеток тератокарциномы, как и в случае других видов опухолей, являются следствием мутации генов, ответственных за нормальный контроль поведения клеток (см. разд. 21.1.2). Однако дальнейшие наблюдения показали, что это не так. Оказалось, что очень похожие клетки можно получить, поместив клетки внутренней клеточной массы в культуральную среду и как только они начнут делиться, создать условия для их разобщения. Некоторые диспергированные клетки продолжают делиться неопределенно долго без изменения своих свойств; их можно использовать для создания постоянных клонов, обладающих многими свойствами нормальных клеток внутренней клеточной массы. Эти клеточные линии почти неотличимы от линий клеток, полученных из тератокарциномы, но их можно получать из нормальных эмбрионов со столь высокой частотой, которая опровергает предположение об их мутационной природе. Вероятно, разобщение клеток и лишение их нормального окружения мешает восприятию сигналов, ограничивающих их пролиферацию в норме и содействующих последовательной дифференцировке.
Более того, аномальное поведение таких стволовых клеток (независимо от того были ли они получены из тератокарциномы или как культура нормальных эмбриональных клеток) может измениться при их помещении в нормальное окружение. Для этого клетки следует инъецировать в полость нормальной бластоцисты (рис. 16-27). Инъецированные клетки включаются во внутреннюю клеточную массу нормальной бластоцисты и участвуют в образовании внешне нормальной химерной мыши: потомки инъецированных эмбриональных стволовых клеток могут быть обнаружены практически во всех тканях этого животного, где они дифференцируются в строгом соответствии с местоположением и даже способны принимать участие в формировании жизнеспособных половых клеток. Эти эксперименты убедительно свидетельствуют о том. что сигналы, воспринимаемые ранними эмбриональными клетками от соседних бластомеров, играют исключительную роль в определении их дальнейшей судьбы.
16.2.7. Поведение клеток многоклеточных животных определяется не только геномом и окружающей средой, но и их предысторией
В процессе развития организма определенные группы клеток должны не только приобрести некоторые характерные признаки, отличающие их друг от друга, но, кроме того, они должны сохранить приобретенные ими различия и после исчезновения внешних сигналов, инициировавших такие изменения, а также передать свои особенности клеткам-потомкам. Так, при делении пигментной клетки должны возникать пигментные клетки, при делении клетки печени ее потомки должны оставаться клетками печени и т. д. Отличительные черты клеток возникают вследствие восприятия ими различных воздействий, которым они подверглись в период эмбриогенеза; сохранение этих различий обусловлено способностью клеток каким-то образом закреплять влияние этих прошлых воздействий и передавать их своим потомкам. Даже самые примитивные бактерии в ответ на изменение окружающей среды способны к быстрому изменению своей химической активности. Но клетки высших животных устроены значительно сложнее; их поведение определяется не только геномом и нынешним окружением, но также их прошлой историей.
16.2.8. Будущая специализация клеток определяется задолго до появления внешних признаков дифференцировки [14, 22]
Наиболее известное доказательство существования клеточной памятистойкое сохранение дифференцированного состояния клеток во взрослом организме (см. разд. 13.4.1). Благодаря клеточной памяти стимул, направивший клетку на тот или иной путь дифференцировки, может оказывать свое действие на ее потомков. Некоторые клетки сомитов позвоночных специализируются как предшественники мышечных клеток на очень ранних стадиях развития и мигрируют из сомитов в различные части тела, в том числе в области формирования конечностей; все это сложное поведение определяется серией решений, принятых клетками значительно раньше, а именно до и во время гаструляции (см. разд. 16.6.5). Эти клетки-предшественники еще не содержат большого количества сократительных белков, характерных для зрелых мышечных волокон; они даже внешне не отличаются от других клеток зачатка конечности, имеющих иное происхождение. Только через несколько дней они приобретают внешние признаки, характерные для дифференцированных мышечных клеток и начинают интенсивно синтезировать специфические для этих клеток белки. Остальные клетки будущей конечности, расположенные здесь же, дифференцируются в элементы соединительной ткани. Следовательно, выбор программы развития (т.е. станет ли клетка мышечной или клеткой соединительной ткани) происходит задолго до того, как проявляются внешние признаки дифференцировки. Вероятно, эта программа записана в клетках в виде трудно уловимых химических модификаций (в данном случае, по-видимому, происходит активация первичного специфического для мышиных клеток регуляторного гена - см. разд. 10.1.8).
Детерминированными называют клетки, которые выбрали программу развития. В эмбриологии «детерминация»-настолько важное и тонкое понятие, что мы должны дать ему более строгое определение. Клетку считают детерминированной, если в ней произошло стойкое внутреннее изменение, которое делает ее и ее потомков отличными от других клеток эмбриона и предопределяет развитие по специализированному пути.
Рассмотрим некоторые пункты этого определения.
1. Изменение должно сделать клетку и ее потомков отличными от других клеток и направить эти клетки по определенному пути развития: клетка не считается детерминированной только потому, что обгоняет другие клетки в процессе своего созревания. Детерминация включает выбор определенного пути развития.
2. Изменения, происходящие в дифференцирующихся клетках, должны быть самоподдерживающимися. Детерминация подразумевает установление различий, наследуемых в ряду поколений клеток. Клетка не считается детерминированной только на том основании, что она занимает определенное положение в теле животного. Чтобы быть таковой, она должна сохранить свои характерные особенности при исчезновении внешних сигналов, вызвавших появление этих особенностей.
Детерминация иногда определяется, как необратимое изменение. Но поскольку мы не в состоянии проверить поведение клетки во всех возможных условиях окружающей среды, нельзя полностью исключить обратимость такого изменения; более того, в некоторых случаях клеточная память может быть нарушена, и тогда детерминированное состояние станет обратимым. Поэтому мы стремимся избегать крайних выражений и говорим о детерминации, как о самоподдерживающемся изменении свойств клеток.
Термин дифференцировка используется обычно для определения явно выраженной специализации, т.е. для определения клеточных свойств, которые ярко выражены. Обычно клетка становится детерминированной до дифференцировки, хотя в некоторых случаях оба процесса осуществляются одновременно. Однако в принципе дифференцировка может осуществляться без детерминации, если явная специализация клетки носит обратимый характер.
16.2.9. Время детерминации клеток можно определять в экспериментах с пересадками [23]
Для доказательства того, что клетка или группа клеток детерминированы, следует выделить у них определенный признак, сохраняющийся даже при экспериментальном изменении условий, в которых он возник. В этом случае обычно используют трансплантацию клетки или клеток, перенося их в необычные условия.
Простейший эксперимент такого рода был проведен на эмбрионах амфибий. Ранее мы уже упоминали, что можно построить карту презумптивных зачатков бластулы или гаструлы, содержащую подробные указания о том, какие органы взрослого организма разовьются из тех или иных областей зародыша. Легко проследить, что при нормальном ходе развития клетки одной области дадут начало эпидермису, а клетки другой - мозгу. Для получения ответа на наш вопрос необходимо поменять местами два кусочка эмбриональной ткани, вырезанные из разных областей, например так, чтобы часть будущего (презумптивного) эпидермиса оказалась на месте будущего мозга и наоборот. Если в момент трансплантации клетки уже детерминированы, то они будут развиваться автономно в соответствии со своим прежним положением, т.е. клетки из области презумптивного эпидермиса, будучи перенесены в область, из которой должен образоваться мозг, образуют эпидермис, а клетки из области будущего мозга после трансплантации в область, дающую начало эпидермису, образуют нервную ткань. Заметим, однако, что на стадии ранней гаструлы клетки еще «не помнят» своего происхождения и дифференцируются в соответствии со своим новым положением. Но если провести такой же эксперимент несколько позже (например, на стадии поздней гаструлы), то клетки презумптивного мозга в области эпидермиса будут дифференцироваться в нервную ткань, а клетки презумптивного эпидермиса, пересаженные в область будущего мозга, - в эпидермис. Следовательно, обе группы клеток стали детерминированными в какой-то момент между ранней и поздней гаструлой.
16.2.10. Состояние детерминации может определяться цитоплазмой или хромосомами [24, 25]
Клеточная память представляет собой одну из наиболее интригующих проблем молекулярной биологии: от чего зависит самоподдерживание определенного характера экспрессии генов? Подробное обсуждение этого вопроса с биохимической точки зрения вы найдете в гл. 10. Здесь же для дальнейшего обсуждения полезно разделить молекулярные механизмы на два класса, которые можно обозначить как цитоплазматические и ядерные.
Когда мы говорим о цитоплазматической памяти, мы подразумеваем, что компоненты, кодируемые определенным набором генов, присутствуют в цитоплазме (либо во внеклеточном окружении) и оказывают прямое или косвенное действие на геном по принципу обратной связи, поддерживая избирательную экспрессию определенного набора генов; в цитоплазме клеток разных типов содержатся различные контролирующие факторы. Таким образом, при получении ядра из дифференцированных клеток одного типа и инъекции этого ядра в цитоплазму клеток другого типа характер экспрессии генов должен измениться с тем, чтобы соответствовать цитоплазме хозяина. В экспериментах по ядерным пересадкам на яйцеклетках амфибий (см. разд. 16.2.1), равно как и в других экспериментах по искусственному слиянию клеток, были получены данные, свидетельствующие о том, что именно так все и происходит. Это позволяет говорить о важной роли механизмов, обеспечивающих цитоплазматическую память.
Вместе с тем ядерная память, известная также как геномный импринтинг, определяется самоподдерживающимися изменениями, которые обусловлены изменениями свойств хромосом. В ходе этих изменений последовательность нуклеотидов в ДНК остается постоянной, но происходит выбор генов, которые будут экспрессироваться. Наиболее хорошо изучены примеры ядерной памяти, связанные с метилированием ДНК: как объясняется в разд. 10.3.16, существующий характер метилирования цитозинов в ДНК может сохраняться в ряду клеточных поколений и это свойство определяется действием фермента метилазы.
Эмбриональное развитие является как бы экспериментом природы, поставленным ею для изучения ядерной памяти. Спермий и неоплодотворенная яйцеклетка существенно различаются по состоянию клеточной дифференцировки, и тем не менее они содержат практически идентичный набор генов и после оплодотворения их хромосомы объединяются в одной клетке. Сохраняются ли функциональные различия хромосом, происходящих из спермия и яйцеклетки, после их объединения в зиготе? В исследованиях на мышах на этот вопрос был получен положительный ответ.
16.2.11. Наборы хромосом, происходящие из спермия и яйца, несут отпечаток своей истории [25]
Как уже упоминалось, неоплодотворенное яйцо можно стимулировать к дроблению без помощи спермия: независимо от того, происходит активация спонтанно или вызвана искусственно, ее результатом является партеногенетический эмбрион (см. разд. 16.2.6). У животных определенных видов, в том числе и позвоночных (например, у некоторых ящериц), такой эмбрион способен развиться в нормальное здоровое взрослое животное. У млекопитающих партеногенетические эмбрионы погибают на ранних стадиях развития; у этих животных до сих пор неизвестны случаи развития без оплодотворения, несмотря на большой интерес к данной проблеме и многочисленные попытки экспериментаторов. Причина этих неудач была выявлена в экспериментах на яйцеклетке мыши.
Известно, что оплодотворенное яйцо (зигота) содержит два пронуклеуса, один из которых получен от отца, а второй - от матери. Используя микропипетку, можно извлечь один из пронуклеусов и заменить его пронуклеусом другого яйца (рис. 16-28). Таким образом мы создаем зиготу, содержащую либо два материнских, либо два отцовских пронуклеуса. В любом случае геном будет одним и тем же (если принять, что отцовский пронуклеус содержал не Y-, а Х-хромосому). Оказалось, что зигота с двумя отцовскими пронуклеусами образует эмбрион, у которого нет структур, развивающихся в норме из внутренней клеточной массы, а зигота с двумя материнскими пронуклеусами образует эмбрион, не содержащий структур, возникающих из трофэктодермы. Так как оба типа зигот обладают одинаковой цитоплазмой, эти эксперименты убедительно свидетельствуют о том, что ядерная память обусловливает экспрессию различных наборов генов в материнских и отцовских хромосомах; иными словами, одни гены экспрессируются только тогда, когда они наследуются от отца, а другие - когда наследуются от матери.
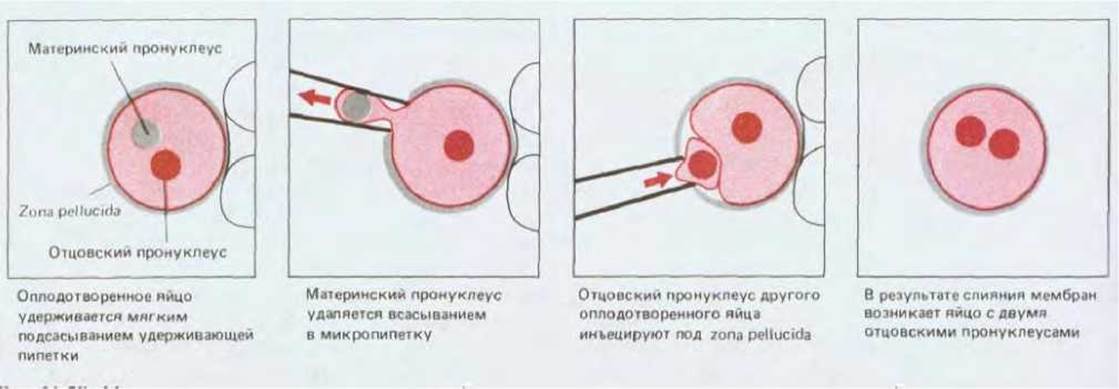
Рис. 16-28. Метод трансплантации пронуклеусов позволяет получать яйцеклетки, оба пронуклеуса которых принадлежат самцу (или самке). Слияние мембран происходит в результате воздействия частично инактивированного вируса Сендай, инъецированного на третьем этапе одновременно с трансплантацией пронуклеуса.
Наблюдения на трансгенных мышах показали, что в основе явления геномного импринтинга лежит метилирование ДНК. Например, можно скрестить трансгенных мышей, несущих последовательности чужеродной ДНК, и получить потомство, наследующее внедрившуюся чужеродную последовательность только от отца или только от матери. У таких мышей интегрированные последовательности могут метилироваться по-разному в зависимости от происхождения из спермия или яйцеклетки. Характер метилирования сохраняется в соматических тканях в течение всей жизни взрослого животного, но может измениться в процессе формирования клетками зародышевой линии следующего поколения гамет. Характер экспрессии одного из генов, о котором известно, что он ведет себя подобным образом, определяется метилированием; если ген наследуется от матери, он метилирован и не экспрессируется у данного животного, тогда как тот же ген, унаследованный от отца, не метилирован и экспрессируется.
Заключение
В процессе развития из оплодотворенной яйцеклетки возникает множество клеток различных типов. За редким исключением геномы дифференцированных клеток сохраняются в неизменном состоянии, изменяется лишь характер экспрессии генов. Различия, возникающие между клетками, могут быть следствием неравного распределения цитоплазматических детерминантов в яйцеклетке до начала деления или следствием последовательного изменения клеточного окружения в эмбрионе. Например, у Xenopus бластомеры анимального и вегетативного полушарий наследуют различные цитоплазматические детерминанты. Бластомеры вегетативного полушария индуцируют анимальные бластомеры к развитию по мезодермальному пути; в отсутствие такого воздействия анимальные бластомеры дают начало эктодерме. Индукция опосредуется сигнальными молекулами (ФРФ и ТФ-ß2 или их аналогами), которые в организме взрослых животных участвуют в регуляции роста и дифференцировки клеток.
Яйцеклетки млекопитающих обладают уникальными свойствами, являясь, по сути дела, симметричными. Благодаря этому свойству все бластомеры млекопитающих исходно не отличаются друг от друга; различия возникают как следствие межклеточных взаимодействий. По этой же причине клетки двух различных эмбрионов, объединенные в одно целое, способны скорректировать программу развития и сформировать химерную мышь. В отсутствие нормального влияния соседних клеток бластомеры раннего зародыша мыши могут, развиваться аномально, образуя тератокарциномы, используемые для получения эмбриональных стволовых клеток. При имплантации нормальным ранним эмбрионам такие клетки восстанавливают нормальное поведение, их потомки дифференцируются в зависимости от окружения и способны участвовать в формировании нормального эмбриона.
В процессе развития эмбриональные клетки приобретают определенные различия, которые они должны сохранить даже после исчезновения воздействия, вызвавшего такую диверсификацию клеток. Для этого необходимо, чтобы клетки обладали памятью, обеспечивающей детерминацию клеток в направлении определенной специализации задолго до проявления внешних признаков дифференцировки. Механизмы клеточной памяти могут быть либо цитоплазматическими, определяемыми как воздействие молекул цитоплазмы на ядро с целью поддержания собственного синтеза, либо ядерными, основанными на модификации хроматина, например метилировании ДНК.