Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Молекулярные основы функционирования белков
Белковые домены
Третичная структура белков с молекулярной массой (ММ) более 15 000 ММ обычно подразделяется на домены.
(Молекулярная масса, ММ (molecular weight, MW) измеряется в дальтонах, Да; 1 Да = 1 а.е.м. = 1,66-10 27 кг; 15 000 ММ = 15 кДа).
Структурно, домен - это компактно упакованный (folded) участок полипептида. Домены больших белков могут быть определены с помощью рентгеновской кристаллографии или электронной микроскопии.
Хотя домены достаточно хорошо физически отделены друг от друга, они, тем не менее, соединены взаимопроникающими сегментами полипептидной цепи. Например, каждая из субъединиц белка гемагглютинина содержит глобулярный и фибриллярный домены (рисунок 116(a)).
Структурный домен состоит из 100-150 остатков. Часто домену характерна какая-либо специфическая структурная особенность:
✵ необычно большое количество какой-либо аминокислоты (например, домены богатые пролином или домены с кислотными свойствами),
✵ последовательности аминокислот, повторяющиеся во многих белках,
✵ специфические мотивы (повторы) вторичной структуры (например, цинковый палец).
Иногда домены определяют не по их структурной обособленности, а по их функциям на основе выделения того участка белковой цепи, которая обеспечивает функциональную специфичность белка.
К примеру, определенный участок (или участки) обеспечивает каталитическую активность (например, киназный домен) или способность к специфическому связыванию (например, ДНК-связывающий домен или мембраносвязывающий домен).
Функциональные домены часто идентифицируют экспериментально, укорачивая белок с помощью протеаз (ферментов, которые разрезают пептидный остов) до его наименьшего активного фрагмента. Или же индуцируют мутации ДНК, кодирующей данный белок, с тем, чтобы удалить или изменить участки белковой цепи. Затем анализируют активность такого "усеченного" или измененного белка, синтезированного с мутантного гена, и таким образом определяют, какой из участков белка определяет его функциональность.

Рисунок 116 - Домены: а - третичная двухдоменная структура субъединицы гемагглютинина; б - четвертичная структура гемагглютинина, состоящая из трех субъединиц
Доменная организация больших белковых молекул иллюстрирует принцип, по которому сложные молекулы формируются из более простых компонентов. Так же как одинаковые мотивы (повторы) вторичной структуры присутствуют в разных белках, так и домены третичной структуры могут быть частью сложных молекул разных белков.
Модульный принцип строения белковой архитектуры достаточно легко определить в больших белках, которые фактически представляет собой мозаику, собранную из различных доменов, и, поэтому, обеспечивают одновременное выполнение нескольких функций.
Пример такого модуля, который присутствует в нескольких белках - домен эпидермального фактора роста (epidermal growth factor, EGF) (рисунок 117).
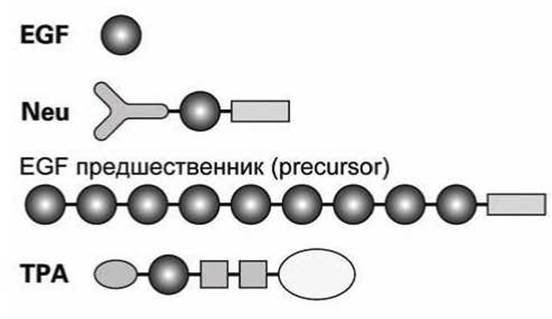
Рисунок 117 - Схема модульной структуры различных белков
EGF - это небольшой растворимый белковый гормон, который связывается с клетками в эмбриональной фазе развития, или с клетками кожи и соединительных тканей взрослого организма, вызывая их деление.
EGF образуется вследствие многократного протеолитического разрезания белка предшественника EGF, который фиксируется в клеточной мембране трансмембранным доменом. EGF-модули также присутствуют в других белках, например, в (1) плазмогенном активаторе ткани (tissue plasmogen activator, TPA) - протеаза, которая используется для растворения тромбов крови у пациентов с инфарктом миокарда, (2) в белке Neu, который участвует в клеточной дифференцировке эмбриона, (3) в Notch-белке (белок-маркер), который является частью мембранной сигнальной системы клетки.
Кроме EGF-доменов эти белки содержат домены, характерные и для других белков. Например, ТРА содержит трипсиновый домен, характерный для всех ферментов, обеспечивающих деградацию белков.