Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Молекулярные основы функционирования белков
Механизмы регуляции функций белков
Большинство клеточных процессов взаимозависимы, и их скорость зависит от текущей потребности клетки в них.
6.8.1. Аллостерия. Главным механизмом регулирования функции белков является аллостерическое регулирование - изменение третичной или четвертичной структуры белка в ответ на связывание с любым лигандом (ингибитором, активатором, субстратом или всеми тремя).
Кооперативность. Зачастую связывание с белком одного лиганда изменяет величину сродства белка по отношению к связыванию последующих лигандов.
Такой тип аллостерии называется кооперативностью.
Кооперативность позволяет мультидоменным белкам гораздо сильнее реагировать на изменения в концентрации лиганда, чем это следовало бы из простого химического равновесия при данной концентрации.
В случае положительной кооперативности последующее связывание облегчается.
В случае отрицательной кооперативности последующее связывание ингибируется.
Например, связывание кислорода одним из четырех доменов гемоглобина индуцирует такие конформационные изменения, которые облегчают связывание кислорода с тремя оставшимися доменами - положительная кооперативность.
Аллостерический переход. Связывание с лигандом может индуцировать аллостерическое освобождение каталитической субъединицы или переход в состояние с иной активностью.
Например, инактивированная протеин-киназа А может существовать в виде тетрамерного белка, состоящего из двух каталитических (рисунок 129) и двух регуляторных доменов. Каждый регуляторный домен имеет псевдосубстратную последовательность аминокислот, с которой связываются каталитические домены, иными словами регуляторные домены блокируют работу каталитических доменов, ингибируют их активность.
Активация ("включение") протеин киназы осуществляется сигнальной молекулой циклического аденозинмонофосфата, цАМФ (рисунок 128). Связывание цАМФ с регуляторным доменом индуцирует конформационное изменение в псевдосубстратной последовательности, сродство каталитических доменов к регуляторным резко снижается и каталитические домены освобождаются.
Таким образом, при росте концентрации цАМФ (в ответ на внешнее событие) киназный тетрамер диссоциирует на две мономерные каталитические субъединицы и одну димерную регуляторную субъединицу (рисунок 138).

Рисунок 138 - Активация протеин-киназы А (ПКА), индуцированная лигандом
Когда внешний сигнал исчезает и уровень цАМФ снижается, активность протеин-киназы А "выключается", поскольку восстанавливаются инактивные тетрамеры.
Многие мультидоменные ферменты претерпевают аллостерические превращения, которые изменяют структуру и свойства субъединиц, но не вызывают отделение субъединиц друг от друга. При этом активность белка в состоянии с присоединенным лигандом отличается от активности состояния без лиганда.
Например, шаперонин GroES (рисунок 121), состоящий из двух мультисубъединичных колец, может существовать в двух состояниях:
1) "напряженное" пептид-связывающее состояние,
2) "релаксированное" пептид-высвобождающее состояние.
Связывание АТФ с одним из колец шаперонина вызывает расширение полости обеих колец и переключение в релаксированное состояние.
6.8.2. Кальций-связывающие белки-переключатели. Для изменения активности ферментов часто используются кальций и ГТФ.
Ионные насосы в клеточной мембране поддерживают низкую концентрацию ионов Са2+ в цитозоле (<10-7 М), выкачивая ионы из клетки или закачивая их в эндоплазматический ретикулум. Соотношение концентраций кальция в цитозоле и вне его достигает 10-100 раз.
Сенсорами увеличения концентрации кальция в цитозоле являются Са2+-связывающие белки, в частности принадлежащие к EF-hand-семейству, все члены которого имеют мотив "спираль-петля-спираль", обсуждавшийся ранее (рисунок 115(a)).
Основатель (прародитель) этого семейства белок кальмодулин присутствует во всех эукариотических клетках, как в виде субъединицы сложных белков, так и индивидуально в виде мономера. Гантелеобразная молекула кальмодулина содержит четыре Са2+-связывающих центра, имеющих константу равновесия К ≈ 10-6 М (рисунок 139).
Связывание Са2+ с кальмодулином индуцирует изменение его конформации, в результате чего кальмодулин обвивается вокруг а-спиралей различных белков, тем самым резко изменяя их активность.
Таким образом, кальмодулин и родственные ему EF-hand-белки выполняют функцию переключающих белков (белков-переключателей), изменяющих активность других белков согласованно с изменением концентрации кальция в цитозоле.
6.8.3. ГТФазные переключатели. Другую группу внутриклеточных белков-переключателей составляет суперсемейство ГТФаз.
К таким ГТФазам относятся, например, белок Ras (рисунок 114) и Ga-субъединица тримерного G-белка.
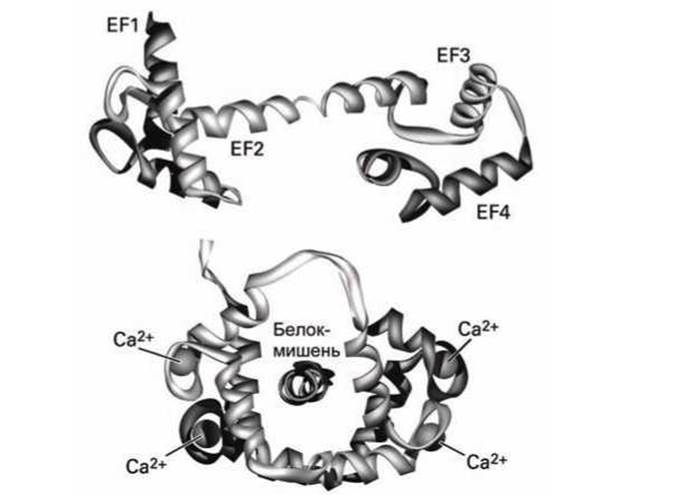
Рисунок 139 - Превращение, стимулируемое связыванием Са2+ с кальмодулином
И Ras, и Ga связываются с плазматической мембраной и играют ключевую роль в процессах клеточной сигнализации, размножения и дифференциации. Другие члены этого суперсемейства ГТФаз принимают участие в процессе синтеза белка, в транспорте белков между ядром и цитоплазмой, формировании окаймленных пузырьков и их слиянии с определенной мембраной, в процессах реорганизации актинового цитоскелета.
Все ГТФазные переключающие белки существуют в двух формах (рисунок 140):
1) активная ("вкл") форма с присоединенной молекулой ГТФ (гуанозин трифосфат), которая управляет активностью специфических белков,
2) неактивная ("выкл") форма со связанной молекулой ГДФ (гуанозин дифосфат).
ГТФазная активность этих белков-переключателей приводит к медленному гидролизу ГТФ в ГДФ, "выключая" белок. Последующая замена ГДФ на ГТФ, восстанавливающая активную форму, происходит ещё более медленно.
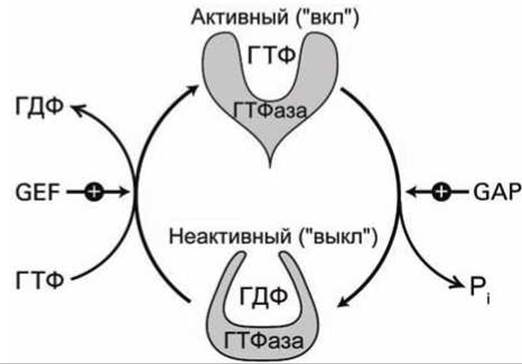
Рисунок 140 - Циклирование ГТФазы между активной и неактивной формами
Такая активация белка носит временный характер и управляется другими белками, осуществляющими аллостерическое регулирование ГТФазного белка-переключателя.
Такими белками, например, являются белки GAP (GTPase-accelerating proteins) и RGS (regulators of G-protein signaling), ускоряющие гидролиз ГТФ. Белки GDI (guanine nucleotide dissociation inhibitor), напротив, замедляют гидролиз. Реактивация ГТФазного белка-переключателя ускоряется белками GEF (guanine nucleotide-exchange factors).
6.8.4. Циклическое фосфорилирование-дефосфорилирование.
Циклическое фосфорилирование-дефосфорилирование белков регулирует многие клеточные процессы.
Одним из наиболее распространенных механизмов регуляции активности белков является фосфорилирование - присоединение или отсоединение фосфатной группы к оксиаминокислотам: тирозину, серину и треонину.
Фосфорилирование катализируют протеин-киназы, а дефосфорилирование - протеин-фосфотазы (рисунок 141).
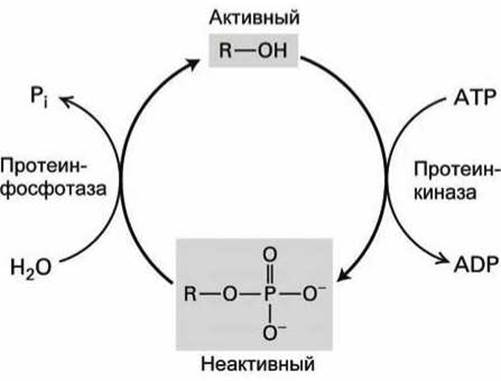
Рисунок 141 - Регуляция активности белка киназно-фосфотазным переключателем
Хотя обе реакции являются необратимыми, согласованная "работа" киназ и фосфотаз образует своеобразный киназно-фосфотазный "переключатель", управляющий функциями многих клеточных белков.
Фосфорилирование изменяет заряд белка, что, вообще говоря, приводит к изменению конформации белковой молекулы. Этот эффект может значительно изменить силу связи лиганда с белком, что приводит к резкому усилению или ослаблению активности белка.
Тот факт, что киназы и фосфотазы составляют около 3% всех белков клетки дрожжей, подтверждает важность реакций фосфорилирования и дефосфорилирования даже в простейших клетках.
Все классы белков, включая структурные белки, ферменты, мембранные каналы, сигнальные белки - регулируются киназно-фосфотазными переключателями.
Различные протеин-киназы и фосфотазы субстратно специфичны к различным белкам, что обеспечивает возможность регулировки различных метаболических реакций. Причем некоторые из этих ферментов действуют только на специфический белок, а некоторые специфичны к достаточно широкому набору белков. В последнем случае реализуется интегральная реакция различных белков в ответ на "срабатывание" одного "переключателя".
Часто субстратом киназ и фосфотаз бывают другие киназы и фосфотазы, что позволяет клетке создавать сложные взаимозависимые системы (ферментативные каскады и сети) тонкой регулировки метаболических процессов.
Например, для того, чтобы запустить процесс митоза (деления клетки) сигнальные белки-факторы роста должны связаться с соответствующими мембранными белками-рецепторами данной клетки. В результате срабатывания такой мембранной сигнальной системы стимулируется замену ГДФ на ГТФ в белке Ras, переводя его в активное состояние (рисунок 142).
Активизированный белок Ras запускает ферментативный каскад, состоящий из протеин-киназ, которые фосфорилируют друг друга и в конце этого каскада активируют (фосфорилированием) последнюю протеин-киназу, называемую митоген ассоциированная протеин киназа или MAP-киназа (МАРК, mitogen associated protein kinase).
Названия киназ - элементов этого каскада - не отличаются оригинальностью. Та киназа, которая фосфорилирует MAP-киназу, называется МАР-киназа-киназа или МАРКК. А её в свою очередь фосфорилирует МАР-киназа-киназа-киназа или МАРККК. И уже эту киназу "третьего" уровня активирует белок Ras.
Слово митоген в названии киназ означает, что они участвуют в стимуляции процесса митоза (MITosłs GENeration, mitogen), поэтому MAP-киназа, активированная фактором роста таким сложным образом, запускает процесс клеточного деления.
Фосфорилированная MAP-киназа переносится в ядро, где она фосфорилирует белковые факторы транскрипции тех генов, экспрессия которых завершается репликацией ДНК и синтезом белков, обеспечивающих митоз.
Отметим важное терапевтическое использование МАР-киназных каскадов. Эти каскады выключаются, когда происходит дезактивация ГТФазы Ras в результате гидролиза ГТФ. Мутантная форма белка Ras с нарушенной ГТФазной активностью не гидролизует ГТФ, не дезактивируется и, следовательно, постоянно активизирует MAP-киназный каскад, что приводит к делению клеток даже при отсутствии факторов роста. Такая мутантная форма белка Ras обнаружена в 20% раковых клеток человека. Лекарственный препарат R115777 блокирует фосфорилирование белком Ras киназы МАРККК, каскад прерывается, и характерное для раковых заболеваний неконтролируемое деление клеток останавливается.
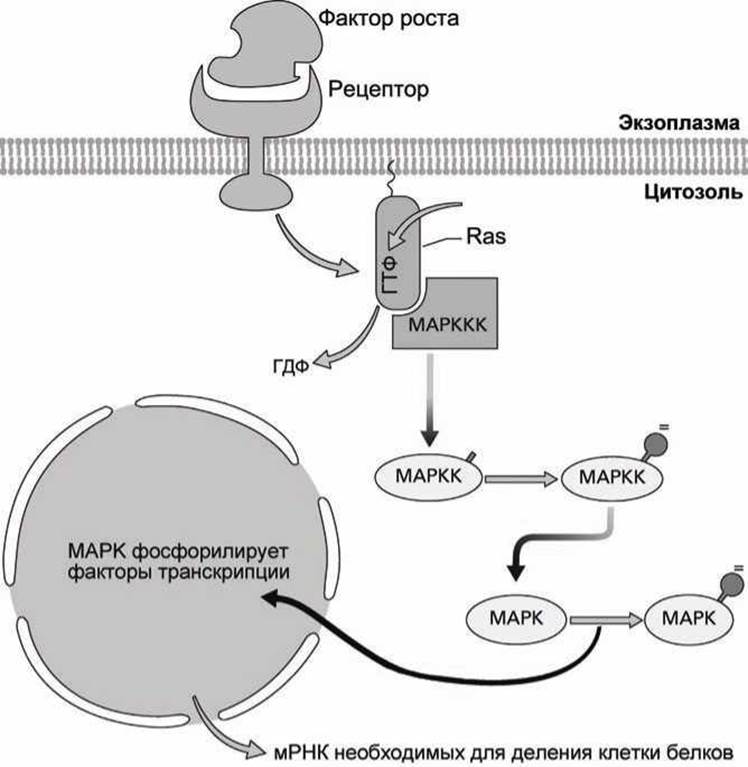
Рисунок 142 - Схема инициации MAP-киназного каскада
6.8.5. Протеолиз. Принципиально отличным от механизмов "включить-выключить" является механизм регуляции белковой активности путем протеолитического разрезания полипептидной цепи белка. Протеолиз необратимо активирует или деактивирует некоторые белки. Этот механизм наиболее часто используется для управления активностью гормонов (например, инсулина) и пищеварительных ферментов.
Примером таких протеаз являются трипсин и химотрипсин, которые синтезируются в клетках печени и секретируются в тонкий кишечник в виде неактивных зимогенов - трипсиногена и химотрипсиногена, соответственно. Энтерокиназа (аминопептидаза, секретируемая клетками поверхности тонкого кишечника) превращает трипсиноген в трипсин, который в свою очередь "обрезает" химотрипсиноген до химотрипсина. То, что эти протеазы активируются таким сложным образом, защищает ткани печени от "самопереваривания" ферментами, которые они же сами и синтезируют.
Протеолитическое разрезание также используется для регуляции свертывания крови, когда компоненты, формирующие сгусток (тромб) присутствуют в крови в большой концентрации, но активируются только в месте повреждения кровеносного сосуда. Это позволяет ассемблировать тромб размером порядка миллиметра за время порядка секунды.
Разрезание также используется иммунной системой, когда молекулы активизируются только в необходимом месте организма. Во всех этих случаях белок синтезируется в форме профермента, с лишними сегментами, которые блокируют активный центр или удерживают фермент в неактивной форме.
Протеолитические разрезание напоминает выдергивание чеки из гранаты - активизация фермента происходит вследствие удаления блокирующего белкового сегмента.
Вопросы для самоконтроля
1. Перечислите способы графического представления структуры белка?
2. Что называется повтором в структуре белка? Какие вы знаете повторы?
3. Что называется белковым доменом?
4. В чем сходство и отличие структурных и функциональных белковых доменов?
5. В чем сходство и различие мультимерных белков и макромолеку- лярных ассоциатов?
6. Какие белки составляют белковое семейство?
7. Какие белки называют гомологичными?
8. Что такое фолдинг и мисфолдинг?
9. В чем сходство и различие самопроизвольного фолдинга белковой нити и фолдинга с участием шаперонов?
10. Какие белки называются молекулярными шаперонами?
11. В чем сходство и различие функций шаперонов и шаперонинов?
12. Приведите примеры посттрансляционной химической модификации белков?
13. В чем заключается ацетилирование (химическая модификация) белка?
14. В чем заключается фосфорилирование (химическая модификация) белка?
15. В чем заключается гликозилирование (химическая модификация) белка?
16. В чем заключается гидроксилирование (химическая модификация) белка?
17. В чем заключается метилирование (химическая модификация) белка?
18. В чем заключается у-карбоксилирование (химическая модификация) белка?
19. В чем заключается протеолиз (химическая модификация) белка?
20. В чем заключается самосплайсинг (химическая модификация) белка?
21. Какие белки подвергаются деградации в клетке?
22. Перечислите механизмы деградации белков в клетке.
23. В каких случаях используется юбиквитиновая деградация белков?
24. Перечислите этапы юбиквитирования белков.
25. Что называется специфичностью белка?
26. Что характеризует сродство белка к лиганду?
27. Что объединяет и в чем различие между антителами и антигенами?
28. Что такое эпитоп антигена?
29. Опишите строение молекулы антитела.
30. В чем сходство и различие антител и ферментов?
31. Что такое каталитическая активность фермента?
32. Что называется активным центром фермента?
33. Перечислите способы объединения ферментов в молекулярные конвейеры.
34. Какие виды движения создают молекулярные моторы?
35. Перечислите моторные белки.
36. За счет какого потока работает АТФ-синтаза?
37. Перечислите конформации каталитических субъединиц, которые поочередно принимаются в ходе каталитического цикла АТФ-синтазы.
38. Перечислите три общих свойства всех белковых моторов.
39. Перечислите основные структурные части молекулы миозина.
40. Что называется саркомером? Опишите его устройство.
41. Перечислите этапы цикла протягивания актиновой нити миозином.
42. Что называется аллостерическим регулированием активности белка?
43. Какой тип аллостерии называется кооперативностью?
44. В чем сходство и отличие положительной и отрицательной кооперативности?
45. Приведите примеры белковых переключателей. Какие механизмы обеспечивают их работу?
46. Как модифицирует оксиаминокислоты киназно-фосфотазный белковый переключатель?
47. Как протеолитическое разрезание регулирует белковую активность зимогенов?