Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Генерация протондвижущей силы и синтез АТФ
Перенос электронов по дыхательной цепи
В митохондрии каждая молекула НАДН доставляет два высоко-энергетичных электрона в дыхательную цепь. Эти электроны в конце своей релаксации восстанавливают атом кислорода, в результате чего получается молекула воды. Суммарно весь этот процесс можно записать как
![]()
Релаксация электрона с НАДН на O2 сопровождается снижением энергии электрона на 1,14 эВ, что соответствует 26,2 ккал/моль. Соответственно, для двух электронов снижение энергии будет ≈ 53 ккал/моль. Большая часть этой энергии превращается в протондвижущую силу.
Каждый из четырех мультибелковых комплексов дыхательной цепи проходит сквозь внутреннюю мембрану митохондрии (является интегральным белком внутренней мембраны) и содержит в себе несколько различных простетических групп - акцепторов электронов, которые участвуют в переносе электронов. Эти небольшие небелковые молекулы или ионы металлов прочно и специфически связаны с мультибелковыми комплексами (таблица 9) и, в отличие от переносчиков электронов, не перемещаются механически независимо от комплексов.
Несколько типов гемов - железосодержащих простетических групп, подобных тем, которые содержатся в гемоглобинах и миоглобинах (рисунок 164) - прочно связаны или даже ковалентно присоединены к митохондриальным белкам, образуя цитохромы (обозначены Cyt на рисунке 162).
Таблица 9 - Электрон-несущие простетические группы (электрон-акцепторные группы) в дыхательной цепи
|
Комплекс |
Простетические (акцепторные) группы |
|
I |
ФМН, Fe-S |
|
II |
ФАД, Fe-S |
|
III |
Гем bL, Гем bH, Fe-S, Гем c1 |
|
IV |
Cua2+, Гем а, Cu2+b, Гем a3 |
Атомы железа в центре гема присоединяют и отдают электроны (окисление и восстановление Fe) в процессе переноса электронов по дыхательной цепи:
![]()
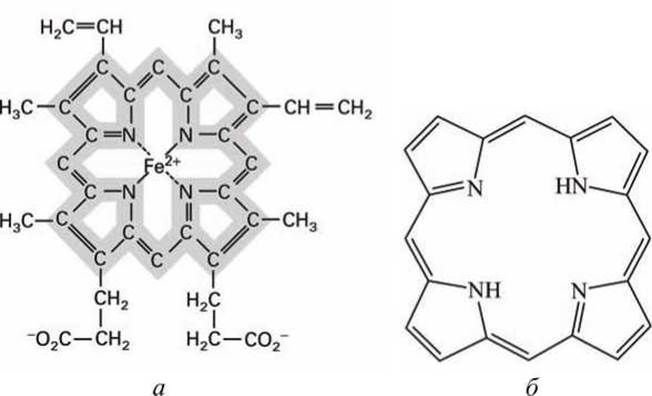
Рисунок 164 - Схема гема: а - схема гемов цитохромов b1 и bH; б - порфириновое кольцо (циклический тетрапиррол) является основой структуры гема любого типа
В дыхательной цепи электроны переносятся по цитохромам в последовательности b, с1, с, а, a3 (рисунок 162). Разные цитохромы имеют разные гемы, которые отличаются химическими группами, присоединяемыми к периметру порфиринового кольца, и различным аминокислотным окружением гемов. Поэтому каждый цитохром имеет специфический восстановительный потенциал. Набор значений восстановительных потенциалов разных цитохромов однозначно задает направление и необходимую последовательность переноса электронов вдоль дыхательной цепи.
Поскольку порфириновое кольцо гема в цитохромах состоит из чередующихся двойных и одинарных связей (рисунок 164), в нем возможно большое количество разнообразных резонансов, и дополнительный электрон может связаться с атомами углерода или азота или с ионом железа. Все цитохромы, кроме цитохрома с, входят в состав мультибелковых комплексов на внутренней мембране митохондрии. А цитохром с, хотя он также представляет собой гем-протеиновый комплекс, является водорастворимым белком и свободно перемещается в межмембранном пространстве митохондрии.
Кластеры из атомов железа и серы (Fe-S) являются железосодержащими простетическими группами, в которых атом Fe присоединен к неорганическим атомам S и к цистеиновым атомам серы из аминокислотного окружения простетической группы (рисунок 165).
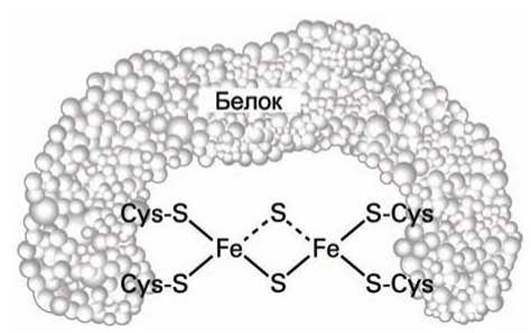
Рисунок 165 - Димерный кластер атомов железа и серы
Все Fe-S кластеры могут присоединить (и отдать) один электрон. В кластерах некоторые атомы железа имеют заряд (+2), а другие атомы железа - (+3), хотя реальный заряд атома Fe между (+2) и (+3), поскольку электроны внешних орбит атомов Fe обобществлены и формируют общую орбиталь. Присоединяемый к кластеру электрон также становится общим электроном всех атомов Fe, входящих в кластер.
Кофермент Q (CoQ), который чаще называют убихинон (ubiquinone), является единственным переносчиком электронов в дыхательной цепи, в котором электрон связывается не с простетической группой белка (рисунок 166).
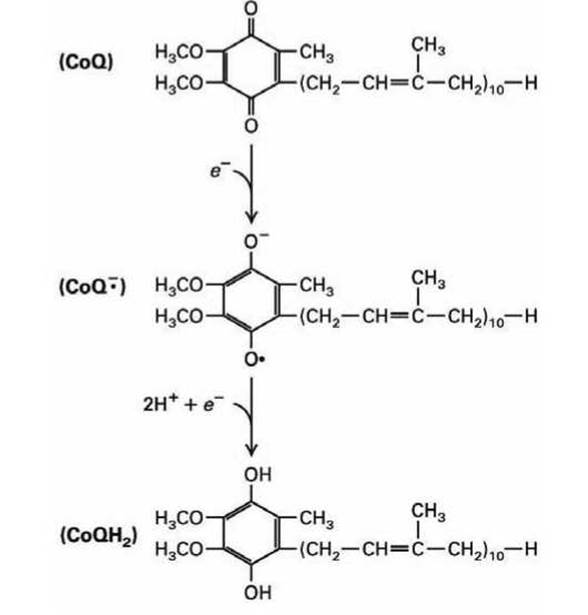
Рисунок 166 - Схема восстановления убихинона до дигидроубихинона
В действительности убихинон переносит не один электрон, а два атома водорода, то есть два электрона и два протона. Сначала окисленная хинонная форма CoQ принимает на себя один электрон, образуя промежуточный заряженный свободный радикал полухинон (semiquinone), который обозначают (CoQ-●).
Затем присоединением ещё одного дополнительного электрона и двух протонов образуется полностью восстановленная форма убихинона дигидроубнхинон (CoQH2) (dihydroquinone) (рисунок 166).
Обе формы убихинона: и CoQ, и CoQH2 - являются жирорастворимыми (липофильными), они свободно диффундируют по внутренней мембране митохондрии. Убихинон получает электроны и от НАДН-CoQ-редуктазы (комплекс I) (рисунок 167), и от cyкцинaт-CoQ-peдyктaзы (комплекс II) (рисунок 168) и передает их на CoQH2-цитохром с редуктазу (комплекс III).
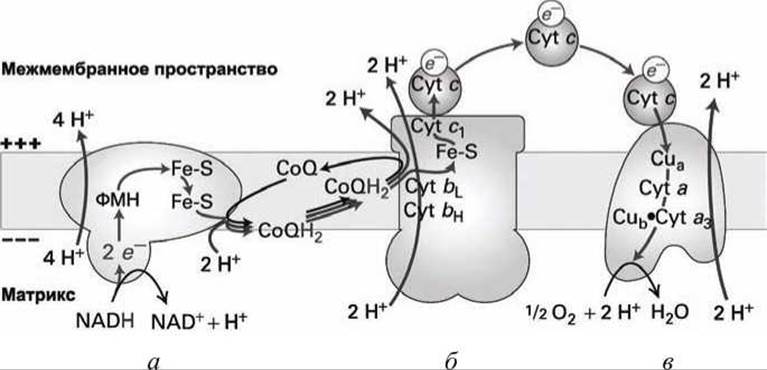
Рисунок 167 - Схема взаимодействия компонентов дыхательной цепи: а - НАДН-СоQ-редуктаза (комплекс I); б - СоQH2-цитохром с редуктаза (комплекс III); в - цитохром с оксидаза (комплекс IV)
Важно, что восстановление и окисление убихинона (CoQ) сопряжено с перекачкой (транслокацией) протонов через мембрану из матрикса в межмембранное пространство митохондрии.
Суммарно (рисунок 167) на каждую пару электронов с НАДН через мембрану перекачивается десять протонов.
Завершается процесс переноса электронов в матриксе образованием ферментом цитохром-с-оксидаза молекулы воды из молекулярного кислорода (рисунок 167(b)).
При окислении сукцината в фумарат (рисунок 168) и переносе электронов с комплекса (II) на убихинон не происходит перекачка протонов через мембрану, а дальнейшая цепь переноса электронов через комплексы (III) и (IV) в этом случае идентична переносу электронов с НАДН (рисунок 167(6, в)). Поэтому на каждую пару электронов переносимых с сукцината на O2 через мембрану транслоцируется только шесть протонов.
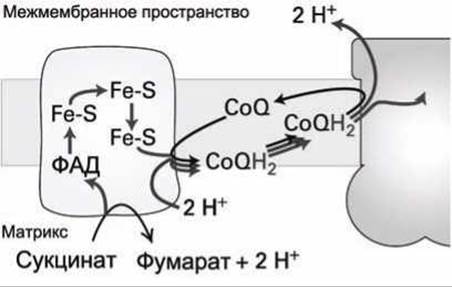
Рисунок 168 - Схема переноса электрона убихиноном CoQ с сукцинат-CoQ-редуктазы (комплекс II) на CoQH2-цитохром с редуктазу (комплекс III)
Убихинон получает электроны с той части комплексов (I) и (II), которые ориентированы в матрикс (рисунки 167 и 168). Восстановленный убихинон CoQН2 (дигидроубихинон) передает электроны комплексу (III) на домен, который ориентирован в межмембранное пространство, высвобождая при этом два связанных с CoQH2 протона в межмембранное пространство. Поэтому перенос каждой пары электронов убихиноном обязательно сопровождается транслокацией двух протонов из матрикса в межмембранное пространство. Такое циклическое циркулирование убихинона, в результате которого комплекс (III) переносит дополнительно два электрона, называют "Q-цикл".