Основы молекулярной биологии. Часть 2: Молекулярные генетические механизмы - А.Н. Огурцов 2011
Синтез белков на рибосомах
Элонгация трансляции
Итак, установленный на старт-кодоне эукариотический комплекс (80S-pибocoмa-Met-tRNAiMet) готов к пошаговому наращиванию белковой цепи. Подобно стадии инициации трансляции, необходим набор специализированных белков — факторов элонгации, EF (elongation factors).
Основными этапами элонгации являются:
1) присоединение следующей аминоацил-тРНК,
2) конформационное изменение рибосомы,
3) формирование пептидной связи,
4) сдвиг, или транслокация, рибосомы на один кодон вдоль мРНК.
В момент завершения инициации трансляции Met-tRNAiMet связана с P-центром 80S-рибосомы (рисунок 43). Этот центр называется "Р", поскольку именно здесь располагается тРНК, химически связанная с растущей полиПептидной (polyPeptide) цепью.
Вторая аминоацил-тРНК доставляется к рибосоме в виде тройного комплекса в комбинации с EF1а и GTP и присоединяется к A-центру, названному так, поскольку к нему присоединяется Аминоациллированная тРНК (рисунок 43, этап 1). Если антикодон второй аминоацил-тРНК правильно спаривается со вторым кодоном мРНК, то происходит гидролиз GTP, связанного с EF1a.

Рисунок 43 - Этапы элонгации трансляции
Гидролиз GTP стимулирует конформационное изменение рибосомы (на рисунке 43 первоначально "овальная" рибосома стала "квадратной"). Это конформационное изменение рибосомы
✵ прочно связывает аминоацил-тРНК в А-центре,
✵ индуцирует десорбцию дефосфорилированного комплекса (EF1a-GDP),
✵ сближает 3'-конец тРНК на A-центре с 3'-концом Met-tRNAiMet в P-центре (рисунок 43, этап 2).
Гидролиз GTP и, следовательно, прочное связывание с рибосомой не происходит, если антикодон аминоацил-тРНК не спаривается с кодоном в A-центре. В этом случае, тройной комплекс диффундирует прочь, оставляя свободным A-центр, с которым будут пытаться связаться очередные комплексы (аминоацил-тРНК-EF1a-GTP) до тех пор, пока не образуется правильная комбинация кодон-антикодон и произойдет их спаривание. Это явление обеспечивает "точность сборки" полипептидной цепи.
Трёхмерная модель рибосомы изображена на рисунке 44.
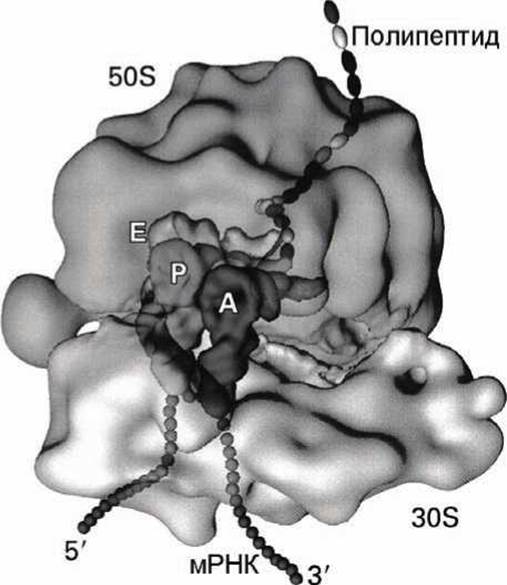
Рисунок 44 - Модель 70S рибосомы Е. coli с тремя тРНК в Е, Р и А центрах
Когда Met-tRNAiMet находится в P-центре и вторая аминоацил-тРНК прочно связана в A-центре а-аминогруппа второй аминокислоты реагирует с инициаторной тРНК (Met-tRNAiMet), которая активирована метионином, при этом образуется пептидная связь (рисунок 43, этап 3, рисунки 32 и 35). Эта пептидилтрансферазная реакция катализируется большой рРНК, которая идеально точно ориентирует в пространстве взаимодействующие атомы, обеспечивая протекание реакции.
Каталитическая активность именно большой рРНК была доказана, тем, что она катализировала пептдилтрансферазную реакцию даже в условиях, когда из большой субъединицы рибосомы были удалены все малые белки. Другой аргумент в пользу каталитической активности большой рРНК, был получен из кристаллографических исследований пространственной структуры рибосомы, которые показали, что вблизи места, где происходит синтез пептидной связи, нет рибосомных белков.
После синтеза пептидной связи рибосома сдвигается (происходит так называемая транслокация) вдоль мРНК на один кодон. Этот шаг транслокации обеспечивается гидролизом GTP эукариотического комплекса (EF2-GTP). В результате транслокации tRNAiMet, уже без активированного метионина, смещается в Е-центр - центр "выхода" (exit) тРНК из рибосомы. А вторая тРНК, ковалентно связанная теперь с дипептидом, перемещается в P-центр (рисунок 43, этап 4).
Таким образом, транслокация возвращает рибосому в "исходную" конформацию, в состояние, в котором A-центр свободен и способен принять очередную аминоациллированную тРНК, в комплексе с EF1a и GTP, начиная второй (а затем и все последующие) цикл элонгации (рисунок 43, этап 5).
Такие циклы элонгации, которые изображены на рисунке 43, добавляющие к С-концу растущей полипептидной цепи за цикл по одной аминокислоте в соответствии с последовательностью кодонов мРНК, повторяются до тех пор, пока не будет достигнут стоп-кодон.
При этом каждый раз на этапе 2 конформационное изменение, которое претерпевает рибосома, стимулирует сброс уже дезациллированной тРНК с Е-центра. По мере того, как растущая полипептидная цепь становится длиннее, она проходит сквозь особый канал в теле большой рибосомной субъединицы и выходит из неё наружу напротив той стороны, вдоль которой большая субъединица взаимодействует с малой (рисунок 44).
Положение тРНК в центрах А, Р и Е было также визуализировано при определении кристаллической структуры бактериальной рибосомы. Насколько это возможно в черно-белом исполнении, это показано на рисунке 45.

Рисунок 45 - Модель 70S рибосомы N. thermophilus
Оказалось, что между тРНК, расположенными в А и Р центрах, происходит спаривание нуклеиновых оснований (рисунок 45, справа вверху).
Такой гибрид РНК-РНК, связанный только тремя парами нуклеотидов нестабилен при физиологических условиях. Однако множественные взаимодействия между молекулами рРНК с одной стороны и базовыми доменами тРНК (например D- и ТΨСС-петлями (рисунок 36)), с другой стороны, стабилизируют тРНК в А и Р центрах, в то время, пока остальные РНК-РНК взаимодействия "чутко" контролируют правильность кодон-антикодонового спаривания, обеспечивая правильность чтения генетического кода.