Основы молекулярной биологии. Часть 2: Молекулярные генетические механизмы - А.Н. Огурцов 2011
Идентификация клонов ДНК
Полимеразная цепная реакция
11.3.1. Амплификация фрагментов ДНК. Если известны нуклеотидные последовательности на концах данного участка молекулы ДНК, то весь этот участок молекулы можно многократно реплицировать используя полимеразную цепную реакцию (ПЦР) (polymerase chain reaction, PCR). Такая многократная репликация называется амплификацией (от англ. amplify - усиливать).
В ПЦР используется свойство двойной нити ДНК обратимо денатурировать (плавиться) на две отдельные нити при изменении температуры (см. рисунок 4). Так же как и в методе мембранной гибридизации, присутствие некомплементарных нитей ДНК в растворе не препятствует спариванию нуклеиновых оснований комплементарных нитей ДНК или отдельных комплементарных участков нитей.
Второе необходимое условие для ПЦР - это наличие предварительно синтезированных праймеров - олигонуклеотидов длиной 18-20 нуклеотидов с заранее определённой последовательностью. Как правило, такие олигонуклеотиды синтезируют на автоматических синтезаторах, основанных на стандартной схеме, показанной на рисунке 94.
Общая схема ПЦР изображена на рисунке 103.

Рисунок 103 - Схема полимеразной цепной реакции
ПЦР начинается с тепловой денатурации ДНК на две одинарные нити. Затем в раствор добавляют два предварительно синтезированных олигонуклеотида (праймера) комплементарных 3'-концам одинарных нитей того участка ДНК, который предполагается амплифицировать. При этом необходимо, чтобы концентрация праймеров в растворе намного превышала концентрацию тех однонитевых ДНК, которые предстоит амплифицировать. На рисунке 103 праймеры изображены черными и белыми прямоугольниками.
Затем раствор охлаждают до 50-60°С. При этом происходит гибридизация (спаривание) праймеров (концентрация которых намного выше концентрации ДНК) с комплементарными участками нитей ДНК вблизи 3'-концов. А сами одинарные нити ДНК, вследствие их низкой концентрации, при данной температуре ещё не ренатурируют.
Такие гибридизированные олигонуклеотиды затем выполняют функцию праймеров синтеза комплементарных нитей ДНК, используя исходные одинарные ДНК в качестве матриц.
Для этого необходимо, чтобы в растворе в избытке были
1) дезоксинуклеотиды,
2) термически устойчивые ДНК-полимеразы.
В качестве такой ДНК-полимеразы можно использовать, например, ДНК-полимеразу термофильной бактерии Thermus aquaticus, которая называется Taq-полимераза. Поскольку Thermus aquaticus живут в горячих источниках, то Tаq-полимераза сохраняет глобулярную структуру и активность даже при нагреве до 95°С и может инициировать реакцию полимеризации, начиная с гибридизированного с ДНК синтетического олигонуклеотидного праймера, при температуре 72°С.
После того, как синтез комплементарных цепей закончен, смесь нагревают до 95°С, чтобы расплавить (денатурировать) только что синтезированные дуплексы ДНК.
После этого, поскольку в растворе сохраняется избыток олигонуклеотидных праймеров, охлаждение смеси до 50-60°С снова приводит к гибридизации праймеров с нитями ДНК и начинается новый цикл ПЦР.
Повторение циклов плавления (при нагреве) и синтеза (после охлаждения), в каждом из которых число синтезируемых участков ДНК удваивается, приводит к резкому росту концентрации (амплификации) интересующего нас участка ДНК ограниченного праймерами. После 20 циклов амплификации ПЦР число исходных молекул увеличивается в миллион раз (220 = 1 048 576), в то время, как другие участки исходной молекулы ДНК остаются неамплифицированными.
11.3.2. Изоляция специфического сегмента геномной ДНК. Для тех организмов, чей геном полностью расшифрован, обычно простейшим способом клонирования специфического фрагмента геномной ДНК является последовательность операций, которая начинается с ПЦР в смеси содержащей всю геномную ДНК. В этом случае сначала синтезируются два олигонуклеотидных праймера, которые
1) способны гибридизироваться с ДНК по обе стороны от интересующего нас участка,
2) содержат в себе те нуклеотидные последовательности, которые распознаются определёнными рестрикционными ферментами (рисунок 104).
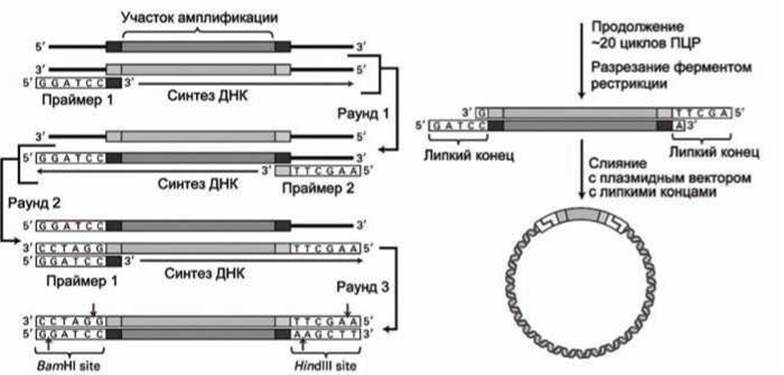
Рисунок 104 - ПЦР участка ДНК для клонирования в составе плазмидного вектора
Уже после третьего цикла ПЦР амплифицироваться будут только фрагменты ДНК между праймерами. После амплификации необходимого количества данных фрагментов ДНК (~20 циклов ПЦР) смесь обрабатывается рестрикционными ферментами, которые формируют "липкие" концы у фрагментов ДНК. Это позволяет эффективно встраивать такие фрагменты ДНК в полилинкеры плазмидных векторов, разрезанных теми же рестрикционными ферментами (рисунок 104). Образованные таким методом рекомбинантные плазмиды затем могут быть клонированы в клетках Е. coli.
Особенностью данного метода является то, что в нем нет необходимости клонировать большое количество разных (вообще говоря, случайным образом полученных) рестрикционных фрагментов исходной геномной ДНК, с последующим скринингом для идентификации и выделения именно того фрагмента, который подлежит исследованию.
Фактически, методика ПЦР инвертирует традиционную методику - отбор специфического фрагмента осуществляется до клонирования, а не после.
Методика ПЦР используется для выделения определённых последовательностей генов с целью дальнейшей манипуляции ими. Она так же может быть использована для нахождения и выделения генных последовательностей из мутантного организма для выяснения их отличия от исходного "дикого" генома.
11.3.3. Подготовка проб (зондов) методом ПЦР. Олигонуклеотидные пробы для скрининга методом гибридизации могут быть приготовлены методом ПЦР амплификации, причем предварительно необходимо только химически синтезировать два относительно коротких праймера, соответствующих двум концам специфических для каждой пробы последовательностей нуклеотидов.
Для ПЦР амплификации можно использовать либо геномную ДНК, либо мРНК после процессинга. В последнем случае, полный набор кДНК синтезируется с полного набора мРНК, используя обратную транскриптазу, или же формируется общая смесь ("пул") кДНК со всех клонов λ-кДНК библиотеки.
Для создания с помощью ПЦР радиоактивных проб (зондов), в ходе нескольких последних циклов ПЦР используют дНТФ-ы с радиоактивным фосфором 32Р. Поскольку пробы (зонды), образованные с помощью ПЦР, относительно длинные, то в их состав входит относительно много радиоактивных атомов 32P. Поэтому, эти ПЦР-пробы будут давать более сильный и более специфический сигнал, чем пробы, которые были синтезированы химически.