Основы молекулярной биологии. Часть 2: Молекулярные генетические механизмы - А.Н. Огурцов 2011
Использование клонов ДНК
Использование систем экспрессии Е. coli
Большинство гормональных протеинов и других сигнальных или регуляторных белков экспрессируется в организме в настолько малых количествах, что их практически невозможно выделить в чистом виде в значительных количествах, используя стандартные биохимические методики. Широкое терапевтическое использование таких белков, равно как и проведение фундаментальных исследований их структуры и функций, зависит от умения синтезировать их в больших количествах при разумных затратах на производство.
В настоящее время широко применяются методики рекомбинантных ДНК, которые превращают клетки Е. coli в "фабрики" по синтезу таких белков. Так, например, налажено коммерческое производство фактора VIII (фактора сворачивания крови), колоние-стимулирующего фактора гранулоцитов (granulocyte colony-stimulating factor, G-CSF), инсулина, гормона роста и других белков человека для терапевтического использования.
Например, G-CSF стимулирует синтез гранулоцитов, фагоцитных белых кровяных телец, ответственных за защиту организма от бактериальных инфекций. Назначение G-CSF раковым больным помогает компенсировать снижение синтеза гранулоцитов, вызванное действием химиотерапии, тем самым защищая пациентов от тяжелых инфекций во время курса химиотерапии.
Для производства "экзотических" белков в больших количествах, во-первых, необходимо синтезировать кДНК клон, кодирующий данный белок. Во-вторых, следует сконструировать плазмидный вектор, который будет экспрессировать большое количество данного белка, если поместить этот вектор в клетку Е. coli. Ключевым в создании таких экспрессирующих векторов (expression vector) является включение в их состав промотора - последовательности нуклеотидов (фрагмент ДНК), с которой начинается транскрипция кДНК.
Для примера рассмотрим относительно простой экспрессирующий вектор для экспрессии белка G-CSF (рисунок 107).
Исходный плазмидный вектор включает в себя фрагмент хромосомы Е. coli, содержащий промотор lac и ген lacZ, кодирующий белок ß-галактозидаза. Когда в клетке присутствует лактоза (или аналог лактозы изопропилтиогалактозид, IPTG (рисунок 23)), РНК-полимераза эффективно транскрибирует ген lacZ, синтезируя мРНК lacZ, которая, затем, транслируется в белок ß-галактозидазу (рисунок 107, вверху).
Модификация плазмидного вектора заключается в следующем. Ген lacZ вырезается из исходного вектора с помощью рестрикционных ферментов, а вместо него вставляется клонированная кДНК, в нашем случае - ген, кодирующий экспрессию белка G-CSF.
После трансформации Е. coli (захват плазмидного вектора в состав клетки) добавление в культуральную среду лактозы или IPTG вызывает транскрипцию с /ас-промотора мРНК G-CSF, которая затем эффективно транслируется в белок G-CSF.
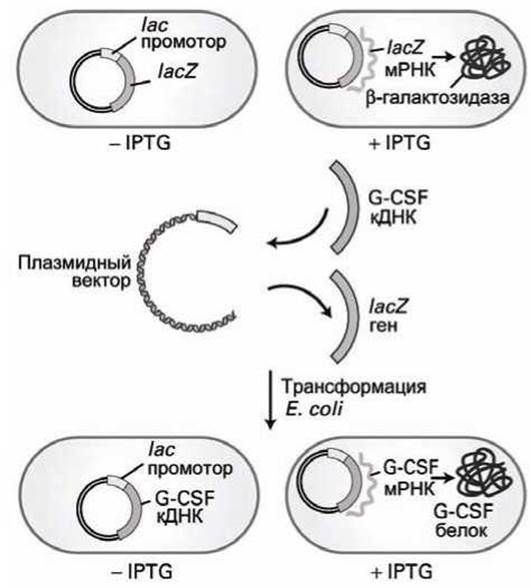
Рисунок 107 - Экспрессия G-CSF кДНК в клетках Е. coli
Аналогично могут быть сконструированы и более сложные экспрессирующие векторы, которые реализуют на базе Е. coli более сложные экспрессирующие системы для синтеза большого количества необходимых белков.
Для того, чтобы упростить процедуру выделения синтезированного рекомбинантного белка из культуральной среды обычно используют метод модификации кДНК, кодирующей рекомбинантный белок. Обычно добавляют короткую нуклеотидную последовательность к концу кДНК так, чтобы экспрессированный белок имел шесть гистидиновых оснований (гексагистидин) на С-конце.
Белки, которые модифицированы таким способом, прочно связываются с аффинной матрицей, содержащей хелатируемые атомы никеля, в то время как большинство белков Е. coli не будут иммобилизоваться на этой матрице. Связанные с никелем белки, затем, могут быть высвобождены, если снизить pH среды.
В большинстве случаев использование такого метода позволяет получать чистый рекомбинантный белок, сохраняющий свою функциональность, поскольку добавление короткой нуклеотидной последовательности к С- или N-концу полипептидной цепи обычно не влияет на биохимическую активность белка.