Общая микробиология - Шлегель Г. 1987
Регуляция метаболизма
Регуляция синтеза ферментов
Многие бактерии могут расти, используя большое число различных субстратов. Это означает, что они способны синтезировать все ферменты, необходимые для превращения этих субстратов, т. е. имеют соответствующие структурные гены. Если в питательной среде содержится только один субстрат, то в клетках образуются ферменты, необходимые для расщепления (катаболизма) именно этого субстрата. Соответственно говорят об индукции ферментов, индуцирующем субстрате и индуцируемых (индуцибельных) ферментах. Для синтеза большинства ферментов, участвующих в катаболизме субстратов, требуется индукция.
Образование ферментов, участвующих в процессах анаболизма, например в биосинтезе пиримидинов, пуринов и 20 аминокислот, регулируется путем репрессии. В большинстве случаев сигнал к остановке биосинтеза белков исходит от конечных продуктов этого процесса (репрессия конечным продуктом). Если в среде имеются одновременно два субстрата, то бактерия обычно «предпочитает» тот субстрат, который обеспечивает более быстрый рост. Синтез ферментов, расщепляющих второй субстрат, репрессируется; в этом случае говорят о катаболитной репрессии.
16.1.1 Индукция
Индукция ß-галактозидазы. Один из наиболее изученных примеров индукции синтеза ферментов - это синтез фермента, необходимого для использования лактозы клетками Escherichia coli (рис. 16.1). Лактоза - дисахарид, который, прежде чем вступить на путь катаболизма гексоз, должен быть расщеплен:
![]()
Клетки дикого типа, растущие на среде с глюкозой, содержат лишь едва заметные следы ß-галактозидазы. Если же выращивать их на среде с лактозой или иным ß-галактозидом, то ß-галактозидазная активность увеличивается в 1000 раз: этот фермент может составлять около 3% всего клеточного белка! Он обычно образуется только в присутствии индуцирующего вещества - лактозы. Изучению механизма регуляции существенно помогло применение не используемого бактерией индуктора-2-пропил-β-тиогалактозида. Добавление этого вещества приводит к «обманной» индукции ß-галактозидазы: фермент образуется, но не может гидролизовать соединение, индуцировавшее его синтез, и сделать его доступным для дальнейших превращений.
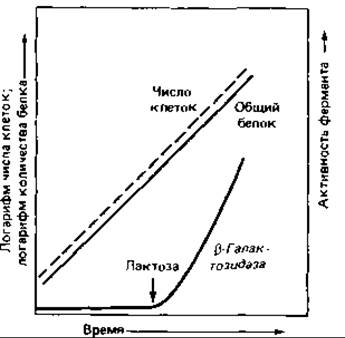
Рис. 16.1. Индукция образования ß-гaлактозидазы. После добавления к питательной среде лактозы начинается синтез ß-галактозидазы.
Координированная и последовательная индукция. Если при расщеплении субстрата А образуется последовательный ряд промежуточных продуктов В, С и т.д. и в этом процессе участвуют ферменты а, b, с и т.д.:
![]()
то теоретически возможны несколько схем индукции ферментов (рис. 16.2):
1. Синтез отдельных ферментов может происходить поэтапно, или последовательно; при этом каждый следующий фермент индуцируется продуктом предшествующей реакции.
2. Синтез всех ферментов данной цепи реакций индуцируется координированно, т. е. субстрат А вызывает одновременное образование всего ряда ферментов от а до е.
3. Несколько ферментов, катализирующих ряд начальных реакций (например, а, b, с), индуцируются совместно, после чего продукт последней из этих реакций (D) или какой-либо другой из них (например, С) индуцирует синтез ферментов следующей серии реакций (d, е).
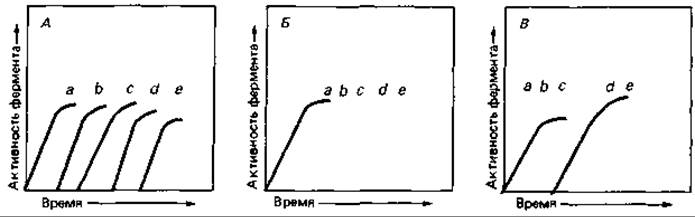
Рис. 16.2. Время появления индуцибельных ферментов при разных типах индукции. А. Строго последовательная индукция. Б. Полностью координированная индукция. В. Последовательная индукция координированно регулируемых групп ферментов. В нулевое время к клеткам, выросшим в условиях, не вызывавших индукции, добавляли индуцирующий субстрат.
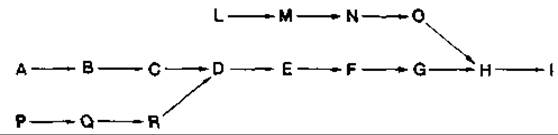
Координированный синтез всех ферментов, необходимых для использования того или иного субстрата, дает клетке то преимущество, что она может быстро реагировать на его появление. При последовательной индукции скорость превращения субстрата, а значит, и скорость роста клеток увеличиваются медленно, так как концентрация продукта первой реакции в клетке должна достигнуть определенного порогового уровня, прежде чем она будет стимулировать образование второго фермента. При регуляции синтеза ферментов конвертирующих (сходящихся) путей катаболизма представляется целесообразным под разделение этих ферментов на совместно (координированно) регулируемые группы, синтез которых в свою очередь индуцируется продуктом предыдущей группы ферментов. Регуляция синтеза ферментов сходящихся катаболических путей детально изучалась на примере расщепления миндальной кислоты, 4-гидроксибензойной кислоты и триптофана клетками Pseudomonas putida, Acinetobacter calcoaceticus и Alcaligenes eutrophus; схемы регуляции у разных видов оказались различными.
Индукция продуктами реакций. Синтез некоторых ферментов индуцируется продуктом первой или следующей реакции данного катаболического пути. Это имеет место, например, при расщеплении триптофана; путь этого процесса идет от L-триптофана через L-формилкинуренин, L-кинуренин и антраниловую кислоту к пирокатехину. Индуктором для соответствующей группы ферментов служит кинуренин:
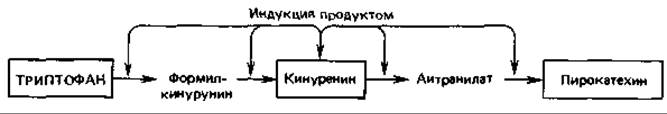
При этом типе индукции «основной» (минимальный) уровень ферментов, участвующих в превращении триптофана в кинуренин, должен быть достаточно высок для того, чтобы при наличии высокой концентрации субстрата - триптофана - могли образоваться хотя бы следовые количества кинуренина. Индукцию продуктом при расщеплении L-триптофана через L-кинуренин можно рассматривать как защитный механизм, предотвращающий индукцию катаболических ферментов эндогенно синтезируемым триптофаном, необходимым для синтеза белка. Триптофан разлагается лишь тогда, когда он добавлен к питательной среде и поэтому клетки содержат его в высокой концентрации.
16.1.2 Репрессия
Репрессия конечным продуктом. Влияние конечного продукта биосинтетического пути на концентрацию ферментов этого пути можно проиллюстрировать на примере синтеза аргинина (рис. 16.3). Аргинин синтезируется из глутамата (см. рис. 7.17) через орнитин, цитруллин и аргининосукцинат:
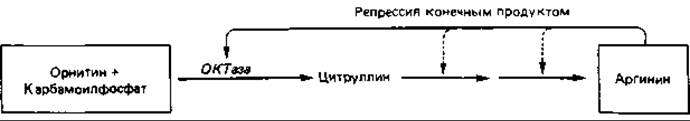
При выращивании клеток Escherichia coli на минимальной среде концентрация одного из ферментов биосинтеза аргинина - орнитин: карбамоил-трансферазы (ОКТазы) - оказывается «обычной». При добавлении к минимальной среде аргинина (20 мкг/мл) образование ОКТазы сразу же прекращается вследствие репрессии. В результате дальнейшего роста клеток в присутствии аргинина происходит «разбавление» фермента, и его активность падает до очень низкого уровня. Если теперь отмыть клетки от аргинина и перенести их в минимальную среду, не содержащую этой аминокислоты, то сразу же произойдет дерепрессия и синтез ОКТазы возобновится. Спустя короткое время концентрация фермента во много раз превысит его содержание в исходной суспензии клеток (рис. 16.4).
Лишь постепенно, после того как синтез анаболических ферментов приведет к образованию и накоплению аргинина, активность ОКТазы вновь снизится и достигнет «обычного» уровня.
На мутантах, дефектных по одному из ферментов биосинтеза аргинина, путем опытов в хемостате удалось показать, что состояние дерепрессии может сохраняться: если рост клеток лимитируется аргинином, активность фермента в 25 раз выше «обычного» уровня.
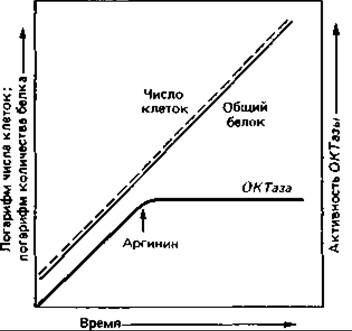
Рис. 16.3. Репрессия орнитин: карбамоил-трансферазы. Образование ферментов, необходимых для биосинтеза аргинина, при добавлении к среде аргинина почти мгновенно прекращается (репрессируется).
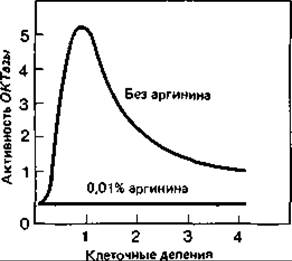
Рис. 16.4. Ускоренное образование орнитин: карбамоил-трансферазы при дерепрессии аргининового оперона. Клетки Escherichia coli (дикого типа) выращивали на минимальной питательной среде, содержавшей избыток аргинина. Затем клетки отмывали, суспендировали одну часть в минимальной среде с аргинином, а другую в среде без аргинина и снова инкубировали. Через различные промежутки времени брали пробы и определяли в них плотность бактериальной суспензии и активность важного фермента данного биосинтетического пути - орнитин: карбамоил-трансферазы. Как видно из графика, в отсутствие аргинина активность этого фермента за короткое время превысила нормальную, но в дальнейшем в результате разбавления снизилась до нормы. При наличии в среде аргинина фермент не синтезировался. (Gorini L., Maas W. К., Biochim. Biophys. Acta, 25 [1957], 208.)
Схемы регуляции при разветвленных путях биосинтеза. Регуляция образования ферментов, участвующих в разветвленных путях биосинтеза, очень сложна. Примерами могут служить системы, синтезирующие «семейство ароматических аминокислот», «семейство аспарагиновой кислоты» и «семейство пировиноградной кислоты» (см. рис. 7.17). Очевидно, что каждый конечный продукт может репрессировать образование ферментов только специфического пути биосинтеза. Ферменты, находящиеся перед местом разветвления путей, подвержены репрессии всеми конечными продуктами, действующими одновременно (мультивалентная репрессия). Синтез этих ферментов подавляется лишь тогда, когда в питательной среде присутствуют все конечные продукты; если же добавлять их по отдельности, они такого эффекта не оказывают.
Интересный пример разветвленного пути биосинтеза - образование L-изолейцина, L-лейцина и L-валина. В роли катализатора четырех этапов биосинтеза валина из пирувата и изолейцина из 2-оксобутирата выступает на каждом этапе в обеих цепях один и тот же фермент (рис. 16.5), а образующийся 2-оксоизовалерат (2-оксо-3-метилбутират) служит общим предшественником валина и лейцина.
Катаболитная репрессия. В то время как репрессия конечным продуктом действует на путях биосинтеза, при помощи катаболитной репрессии регулируются катаболические реакции. Если в питательной среде содержатся два разных субстрата, то, как правило, бактерии «предпочитают» тот, который обеспечивает более быстрый рост. Этот субстрат вызывает репрессию синтеза тех ферментов, которые нужны для использования второго субстрата (рис. 16.6). Катаболитная репрессия лежит в основе, например, известного явления диауксии (см. рис. 6.7). При наличии двух субстратов (глюкоза + сорбит, глюкоза + ацетат) они используются клетками Е. coli не одновременно, а последовательно. Сначала используется глюкоза, и при этом она подавляет синтез ферментов, необходимых для расщепления второго субстрата.
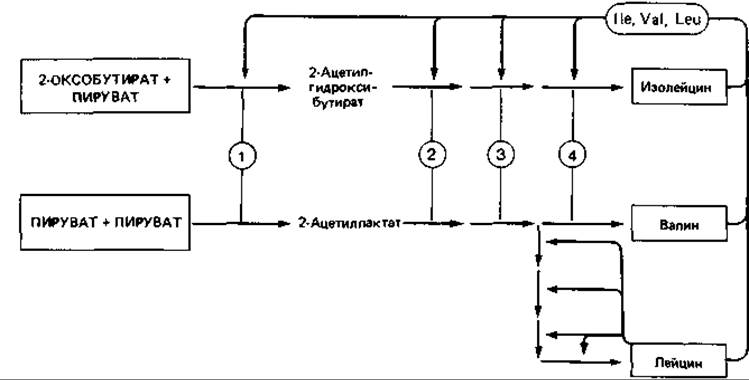
Рис. 16.5. Регуляция образования ферментов, находящихся на путях биосинтеза L-изолейцина, L-валина и L-лейцина, путем мультивалентной (в данном случае тривалентной) репрессии. Ферменты синтаза ацетилгидроксикислот (1), изомероредуктаза ацетилгидроксикислот (2), дегидратаза дигидроксикислот (J) и трансаминаза (4) функционируют одновременно на путях биосинтеза изолейцина и валина.
Сложнее обстоит дело, когда та или иная аминокислота служит для клеток не только источником энергии и углерода, но также источником у Escherichia coli. Питательная среда вначале содержала 0,4 мг/мл глюкозы и 2 мг/мл лактозы. Пока в среде есть глюкоза, образование ß-галактозидазы репрессируется. (Epstein W. et al., Biochem. Biophys. Res. Comm, 24 [1966],. 588.) азота. На примере использования гистидина клетками Enterobacter aerogenes видно, как может влиять глюкоза на содержание ферментов, с помощью которых происходит усвоение какой-либо аминокислоты. Измеряли содержание в клетках гистидазы, взятой в качестве типичного катаболического фермента (табл. 16.1). В среде, содержавшей глюкозу и аммонийный азот, образования гистидазы не происходило даже в присутствии гистидина. Глюкоза и ионы аммония совместно почти полностью подавляли синтез этого фермента. При отсутствии ионов NH4, т.е. в условиях, когда клетки не имели дополнительного источника азота и должны были использовать азот гистидина, репрессирующее действие глюкозы на синтез гистидазы было менее выражено. Этот пример показывает, что недостаток азота может частично снимать катаболитную репрессию, вызываемую глюкозой. Таким образом, синтез катаболического фермента зависит здесь не только от наличия индуктора и источника энергии, но и от присутствия азота в среде.
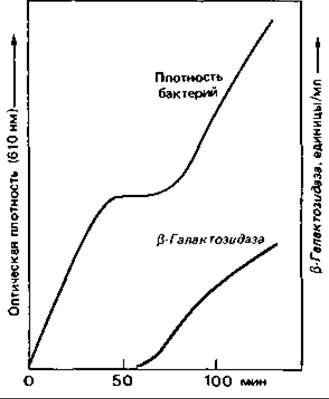
Рис. 16.6. «Эффект глюкозы», или катаболитная репрессия. Замедленное образование ß-галактозидазы
Таблица 16.1. Содержание гистидазы в клетках Enterobacter aerogenes после роста на различных средах (Neidhardt F. С., Magasanik В., J. Bacteriol., 73, [1957], 253)
|
Добавки к основной питательной среде |
Содержание гистидазы, Е на 10 мг клеточной массы |
||
|
Глюкоза |
Гистидин |
(NH4)2SO4 |
|
|
+ |
- |
+ |
<5 |
|
+ |
+ |
+ |
<5 |
|
- |
+ |
- |
182 |
|
_ |
+ |
+ |
170 |
|
+ |
+ |
- |
70 |
Регулирование концентрации ферментов центральных метаболических путей. Эти ферменты тоже могут быть подвержены регуляции. В клетках Escherichia coli, растущих в аэробных условиях, ферменты цикла трикарбоновых кислот присутствуют в высокой концентрации; между тем при росте в анаэробных условиях их активность в 10-20 раз меньше, а образование 2-оксоглутаратдегидрогеназы бывает полностью подавлено. Некоторые анаплеротические ферменты, такие как малатсинтаза, изоцитратлиаза и глиоксилат-карболигаза, содержатся только в тех клетках, которым они необходимы для использования имеющегося субстрата.
16.1.3 Механизмы индукции и репрессии
Теоретически регуляция синтеза ферментов могла бы осуществляться как при транскрипции, так и при трансляции. Как выяснилось, экспрессия генов у прокариот регулируется главным образом на уровне транскрипции. Большинство генов, кодирующих структуру полипептидных цепей, подвержено регуляции - точнее, регулируется их транскрипция. От условий среды и состояния клеточного метаболизма зависит, будутли синтезироваться определенные ферменты, т. е. будут ли вообще и с какой частотой транскрибироваться соответствующие гены.
Для такой регуляции нужно, чтобы к ДНК из других частей клетки поступали определенные сигналы. Сигнальные вещества, или молекулы- эффекторы, представляют собой низкомолекулярные соединения, такие как сахара или их производные, аминокислоты или нуклеотиды. Поскольку такие эффекторы не могут вступать в прямое взаимодействие с ДНК, посредником для каждого из них служит определенный регуляторный белок. Если эффектор присутствует в клетке в высокой концентрации, то в результате специфического присоединения к регуляторному белку он изменяет его конформацию и тем самым - его способность связываться с ДНК. Регуляторный белок, который связывается с ДНК в отсутствие эффектора (индуктора), называют репрессором. Если же белок связывается с ДНК в присутствии эффектора (корепрессора), его называют апорепрессором.
Участки ДНК, к которым присоединяются регуляторные белки, - это не сами структурные гены, а непосредственно прилегающие к ним области, называемые промоторами и операторами. Промотор представляет собой последовательность оснований, распознаваемую ДНК-зависимой РНК-полимеразой, он служит местом связывания РНК-полимеразы, и от него начинается транскрипция. С промотором связаны и гены, экспрессия которых не подвержена регуляции. Промоторы регулируемых генов могут изменять свои свойства в результате связывания регуляторных белков. Оператор представляет собой нуклеотидную последовательность, расположенную между промотором и структурными генами. Он тоже взаимодействует с регуляторным белком-репрессором, от которого зависит, будет ли подавлена транскрипция или она произойдет. Промотор, оператор и структурные гены образуют оперон. Опероном называют группу функционально связанных между собой генов. Белки, кодируемые генами одного оперона, - это, как правило, ферменты, катализирующие разные этапы одного метаболического пути. Транскрипция генов оперона ведет к синтезу одной общей (полицистронной) молекулы мРНК.
За синтез регуляторных белков ответственны гены-регуляторы, которые, вероятно, являются конститутивными. Они могут располагаться по соседству с соответствующим опероном, но это не обязательно.
По-видимому, РНК-полимераза способна правильно присоединяться к промотору только в форме полного голофермента. Она состоит из субъединиц а, ß, ß1, σ и ω. В отсутствие легко отделяющегося фактора сигма (а) фермент обладает полной каталитической активностью, но не способен связываться со специфическим участком ДНК - промотором. Этот фактор транскрипции (сигма) играет, вероятно, важную роль при специфическом присоединении полимеразы к ДНК.
За прекращение (терминацию) синтеза мРНК у конца оперона или отдельного гена, по-видимому, также ответственна специфическая область ДНК - терминатор. Какую роль играет фактор терминации (р) - тетрамерный белок - при отделении РНК-полимеразы от ДНК, пока неясно.
Матричная РНК (мРНК) в отличие от тРНК и рРНК неустойчива и недолговечна; время ее полураспада составляет от 0,5 до 5 мин. Концентрация той или иной мРНК в клетке зависит только от частоты транскрипции соответствующего гена; и в свою очередь она определяет содержание в клетке ферментов, кодируемых этим геном.
Различают индуцибельные и репрессибельные опероны. Опероны, управляющие катаболизмом лактозы, галактозы и арабинозы, являются индуцибельными, т. е. максимальная частота их транскрипции достигается только тогда, когда в питательной среде присутствует внешний эффектор - лактоза, галактоза или арабиноза. Внешние эффекторы называют также внешними индукторами. Синтез ферментов индуцибельных оперонов включается посредством индукции. Наоборот, опероны, управляющие синтезом аргинина, гистидина или триптофана, являются репрессибельными, т. е. максимальная частота транскрипции достигается только при отсутствии в клетке соответствующих низкомолекулярных эффекторов - аргинина, гистидина и триптофана (или в том случае, если их концентрация ниже критического порогового уровня).
Такие эффекторы называют корепрессорами, а соответствующие регуляторные белки - белками-репрессорами или апорепрессорами. Синтез ферментов репрессибельного оперона включается посредством дерепрессии.
Индукция лактозного оперона (отрицательный контроль). Лактозный оперон (lас-оперон) Escherichia coli содержит lас-промотор, lас-оператор и структурные гены для трех ферментов: ß-галактозидазы, пермеазы и трансацетилазы (рис. 16.7). Этот оперон был тщательно исследован; удалось выделить его ДНК; была определена нуклеотидная последовательность области промотор - оператор; были выделены и исследованы регуляторные белки.
Оперон находится под отрицательным контролем, т. е. регуляторный белок (lас-репрессор) остается связанным с оператором и препятствует транскрипции до тех пор, пока отсутствует индуктор. Внешним индуктором служит лактоза (а-D-галактозил-β-1,4-D-глюкоза). Она транспортируется с помощью пермеазы и превращается в аллолактозу (а-D-галактозил-β-1,6-D-глюкозу), действующую как индуктор (внутренний). Катализатором этого превращения служит ß-галактозидаза. Оба фермента-пермеаза и ß-галактозидаза - присутствуют и в неиндуцированных клетках, но в концентрациях, составляющих менее 0,001 от их концентраций после полной индукции. Связав аллолактозу, lac-репрессор претерпевает конформационное изменение, уменьшающее его сродство к ДНК оператора, и в результате освобождает оперон для транскрипции.
Лактозный оперон подвержен также второму контролю - положительному. Это означает, что транскрипция происходит лишь тогда, когда с промотором связан второй регуляторный белок - САР, или CRP.
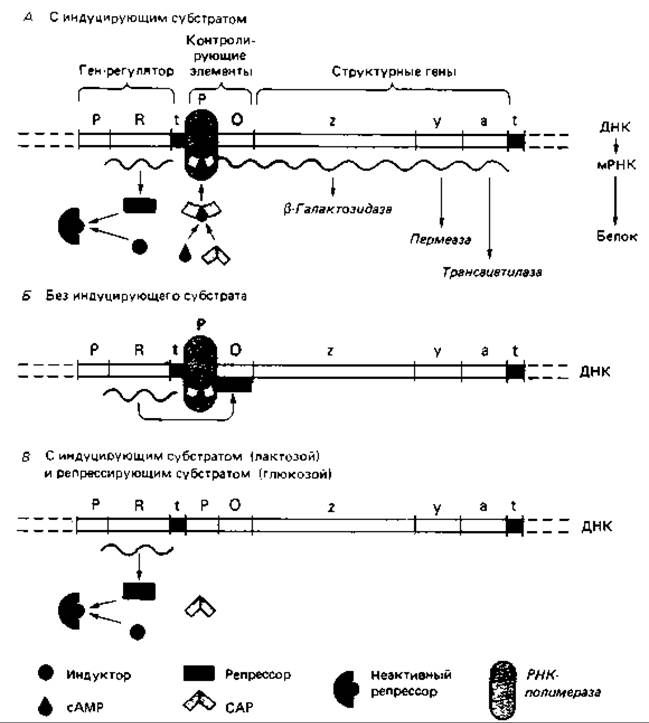
Рис. 16.7. Модель регуляции лактозного оперона, активность которого определяется как индуцирующим действием субстрата, так и катаболитной репрессией. Для транскрипции оперона необходимо присоединение САР (сАМР-рецепторного белка) к промотору. Оно происходит только в присутствии сАМР. Глюкоза тормозит синтез сАМР и тем самым транскрипцию lас-оперона.
Сокращения CAP (catabolite activator protein) и CRP (cyclic AMP receptor protein) - синонимы. Связывание CAP служит необходимым условием для присоединения РНК-полимеразы к ДНК. Однако САР может связаться с промотором только в том случае, если в клетке в достаточно высокой концентрации присутствует циклический АМР (сАМР).
Катаболитная репрессия lас-оперона. Если в питательной среде для Escherichia coli содержатся лактоза и глюкоза, синтез ферментов lac-оперона подавляется (см. рис. 16.6 и 16.7). Такое действие глюкозы обусловлено тем, что в ее присутствии внутриклеточная концентрация сАМР остается низкой. Глюкоза (так же как фруктоза и глюкозо-6-фосфат) репрессирует и другие индуцибельные пути катаболизма (расщепление арабинозы, галактозы, сорбитола, глицерола и др.).
Снижение концентрации сАМР под действием глюкозы обусловлено, вероятно, локализацией фермента аденилатциклазы, при участии которого образуется сАМР:
![]()
Фермент в клетке связан с мембраной. Его активность высока, если система транспорта сахаров находится в фосфорилированной форме. Если же эта система затрачивает много энергии на транспорт сахаров (что связано с их фосфорилированием), активность аденилатциклазы снижается.
Индукция арабинозного оперона (положительный контроль). Арабинозный оперой Е. coli подвержен похожительной регуляции, так же как рамнозный и мальтозный опероны. Он содержит структурные гены ага В, ага А и ага D для ферментов, участвующих в превращении L-арабинозы в D-ксилулозо-5-фосфат. Экспрессия оперона индуцируется арабинозой. Как и многие другие системы катаболизма, оперон подвергается регуляции в области промотора, с которым связан САР, активированный циклическим АМР. Кроме того, в этом опероне есть еще два регулируемых участка - оператор и инициатор. С оператором связан регуляторный белок, кодируемый геном ага С. Этот белок действует как репрессор - присоединяясь к оператору, он препятствует транскрипции. Однако в присутствии арабинозы он становится активатором - присоединяется к промотору и делает возможной транскрипцию. Таким образом, арабинозный оперон находится под влиянием как отрицательного, так и положительного контроля со стороны специфического белка-регулятора.
Репрессия триптофанового оперона конечным продуктом. Триптофановый оперон Е. coli содержит структурные гены для синтеза пяти ферментов, участвующих в превращении хоризмата в триптофан, а также оператор и промотор в начале оперона. Второй, малоэффективный промотор внутри серии структурных генов можно оставить без внимания. Детально изученная функция данного оперона полностью соответствует обобщенной модели, предложенной в 1961 г. Жакобом и Моно для репрессибельного оперона (рис. 16.8). Расположенный далеко от оперона ген-регулятор trp R кодирует эффекторный белок - апорепрессор. В присутствии корепрессора - триптофана, имеющего высокое сродство к белку-апорепрессору, репрессор подавляет транскрипцию оперона. Снижение концентрации триптофана вновь приводит к освобождению оператора и синтезу мРНК.
Аутогенная регуляция. Это такой механизм, в котором функцию белка-регулятора выполняет продукт одного из генов, находящихся в самом опероне. Принцип аутогенной регуляции состоит в том, что регуляторный белок управляет транскрипцией оперона и тем самым влияет на свой собственный синтез. При этом безразлично, какому контролю подвергается оперон - положительному или отрицательному.
Наиболее изученной системой такого типа является регуляция использования гистидина у Salmonella. Превращение гистидина в глутамат, ионы аммония и формамид катализируют четыре фермента, структурные гены которых (гены hut) расположены рядом, образуя один оперой. Их экспрессия контролируется репрессорным белком. Ген, кодирующий этот белок, находится между структурными генами, т. е. в самом опероне. Этот оперой - hut - индуцируется первым продуктом катаболизма - уроканатом (индукция продуктом). В связи с этим индукция оперона ведет не только к синтезу ферментов, расщепляющих гистидин, но и к накоплению белка-репрессора. Последний вновь притормаживает транскрипцию генов hut, включая ген-регулятор. Аутогенная регуляция создает возможность мягкого, плавного управления синтезом ферментов. Такого рода саморегулирующиеся системы широко распространены у бактерий, эукариот и бактериофагов.
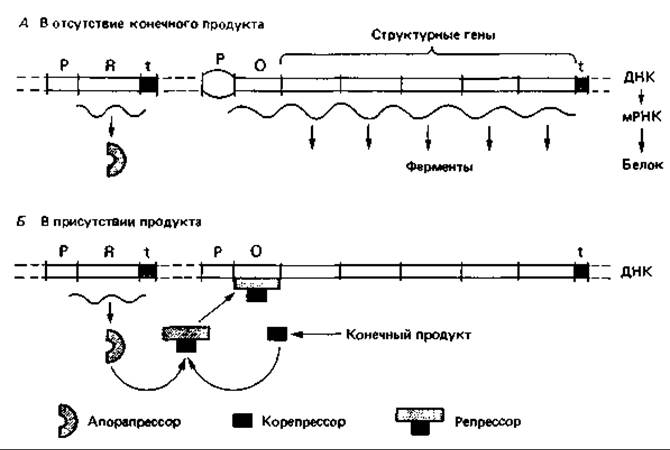
Рис. 16.8. Модель регуляции образования биосинтетических ферментов, осуществляемой путем репрессии конечным продуктом. В отсутствие конечного продукта происходит синтез фермента. Эффективный репрессор, блокирующий оператор («активированный репрессор»), образуется только при связывании конечного продукта или корепрессора с апорепрессором.
Регуляция синтеза рРНК и тРНК. В то время как синтез мРНК регулируется путем индукции и репрессии (в частности, катаболитной), регуляция синтеза стабильных РНК происходит совершенно иначе. Как уже давно известно, штаммы дикого типа Escherichia coli, Salmonella typhimurium и Bacillus subtilis очень резко реагирует на недостаток какой-либо аминокислоты. Они сразу же перестают синтезировать не только белки, но и РНК. Эта строгая зависимость от наличия «строительных блоков» для биосинтеза белка - аминокислот - позволяет заключить, что синтез стабильных РНК зависит не только от наличия их собственных предшественников - нуклеотидов. Выделение мутантов с менее строгой, «расслабленной» регуляцией, синтезирующих РНК даже при отсутствии одной аминокислоты, привело к выводу, что в регуляции участвует по меньшей мере один ген (rel А). Если отсутствие какой-либо аминокислоты в клетках дикого типа приводит к накоплению необычных нуклеотидов (ppGpp и pppGpp), то у мутантов этого не наблюдается. Можно предположить, что эти нуклеотиды служат сигнальными веществами, приостанавливающими синтез рРНК и тРНК.