Общая микробиология - Шлегель Г. 1987
Вирусы: распространение и структура
Вирусы бактерий (бактериофаги)
Выделение и выявление. Выделить бактериофаг нетрудно. Нужно лишь взять материал из естественного местообитания соответствующего вида бактерий и вместе с бактериями залить питательной средой. Если такую накопительную культуру инкубировать в условиях, благоприятных для данных бактерий, то вскоре размножатся и содержавшиеся в пробе фаги. Вирус размножается всегда только в растущих клетках. Можно путем центрифугирования или фильтрации удалить оставшиеся бактерии, а затем в надосадочной жидкости - «лизате» - определить количество фагов. Если засеять плотную питательную среду бактериальной взвесью, не содержащей фагов, то на ее поверхности образуется сплошной газон из бактерий. Если же теперь высеять суспензию, содержащую небольшое число фагов, в газоне появятся свободные от бактерий участки (стерильные пятна, или бляшки). В том месте, куда попал фаг и где он поразил бактерию, лизируется все большее число бактериальных клеток; через некоторое время инфицированная фагом область становится заметной уже невооруженным глазом как пятно, не содержащее бактерий, на фоне бактериального газона (рис. 4.1, В). Используя подходящие методы, можно быстро размножать бактериофаги на бактериальных газонах на твердых средах или в суспензиях бактерий. Затем отделяют бактериальные клетки центрифугированием, убивают оставшиеся бактерии хлороформом и получают таким образом фаговый лизат, содержащий обычно от 1010 до 1013 фагов в 1 мл.
Морфология бактериофагов. Строение бактериофагов в основном изучали на примере фагов серии Т Escherichia coli. Колифаг Т2 состоит из полиэдрической головки длиной 100 нм и отростка, или «хвоста», примерно такой же длины. Поэтому говорят о «составных» вирусах (табл. 4.1). Головка состоит из капсомеров и содержит внутри ДНК. Количество белка и ДНК примерно одинаково. Отросток фага Т2 имеет сложное строение. В нем можно различить не менее трех частей: полый стержень, окружающий его сократимый чехол и находящуюся на дистальном конце стержня базальную пластинку с шипами и нитями (от последних зависит специфическая адсорбция на клетке-хозяине). На электронных микрофотографиях, полученных при негативном контрастировании, можно видеть фаговые частицы в двух состояниях: у одних частиц головка очень резко выделяется на электроноплотном фоне и чехол отростка растянут, у других головка мало отличается от фона по плотности и чехол находится в сокращенном состоянии. Это схематически изображено на рис. 4.7. Первое состояние (А) характерно для активного фага, в головке которого заключена ДНК, второе (Б) - для фага, который инъецировал свою ДНК в бактериальную клетку.
Многие бактериофаги имеют более простое строение. В зависимости от формы зрелых фаговых частиц различают ряд типов, которые представлены на рис. 4.8 и 4.9. Большинство фагов содержит двухцепочечную ДНК. В последние годы, однако, было обнаружено несколько фагов с одноцепочечной ДНК и несколько с одноцепочечной РНК. Содержащие РНК фаги fr (рис. 4.9, Д), R17, Qß и другие обладают наименьшими из известных геномов: в них 3500-4500 нуклеотидов.
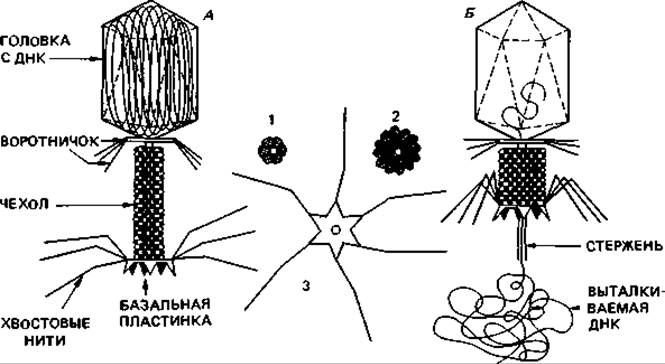
Рис. 4.7. Модель фага Т2. А. Фаг с вытянутым чехлом до адсорбции. Б. Фаг с сократившимся чехлом после адсорбции и инъекции. 1 - поперечный разрез вытянутого отростка: видны 6 белковых субъединиц чехла в одной плоскости; 2 - поперечный разрез сократившегося чехла: видны 12 белковых субъединиц чехла в одной плоскости; 3 - базальная пластинка готового к адсорбции фага со свободными нитями.
4.2.1 Размножение вирулентного фага: литический цикл
Репродукция вируса в клетке-хозяине - процесс очень сложный. Его отдельные этапы, от заражения клетки-хозяина до освобождения зрелых инфекционных частиц, довольно хорошо изучены с биохимической, генетической и морфологической стороны на примере фагов серии Т (Т2, Т4, Т6). Благоприятной предпосылкой для таких исследований явилось то, что в фаговой ДНК вместо цитозина содержится 5-гидроксиметил-цитозин, и поэтому ее синтез легко проследить по появлению этого основания. Кроме того, можно получить мутантные формы фага, у которых та или иная стадия процесса репродукции блокирована или же протекает только в определенных условиях. С помощью таких мутантов удалось выяснить, как происходит внутри клетки-хозяина морфологическое развитие (морфопоэз) фага, т.е. в какой временной последовательности синтезируются и соединяются различные компоненты фаговых частиц.
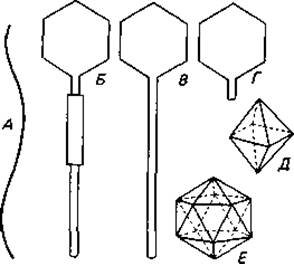
Рис. 4.8. Различные формы бактериофагов (А-Г) и геометрические формы головок фагов (Д, Е). А. Нитевидная форма (колифаг fd). Б. Головка (гексагональный контур) с отростком и сократимым чехлом (например, колифаги Т2, Т4 и Т6). В. Головка с длинным, гибким несократимым отростком (например, колифаги Т1 и Т5). Г. Головка с коротким отростком (например, колифаги Т3 и Т7, фаг сальмонеллы Р22). Д. Октаэдр. Е. Икосаэдр. (Bradley D. Е., Bacteriol. Rev., 31 [1967], 230.)
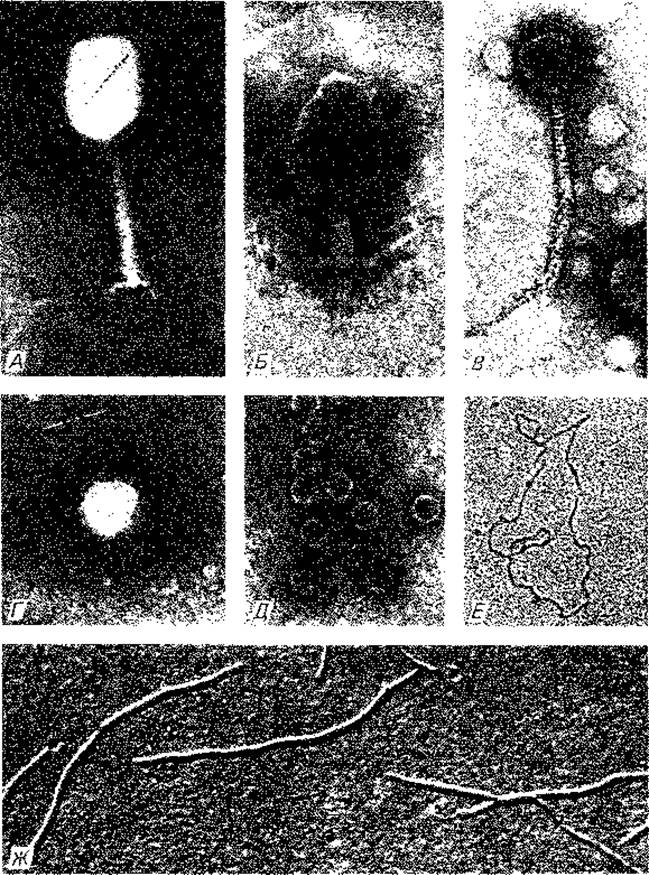
Рис. 4.9. А. Фаг Т2; 168 000 х, негативный контраст (фосфорновольфрамовая кислота. Б. Фаг Т2 с сократившимся чехлом и пустой головкой; 168 000 х, негативный контраст (фосфорновольфрамовая кислота. В. Фаг лямбда; 168 000 х, негативный контраст (уранилацетат). Г. Фаг Т7 с коротким отростком; 168 000 х, негативный контраст (уранилацетат). Д. РНК-фаг fr; 168 000 х, негативный контраст (уранилацетат). Е. Кольцевая молекула ДНК (репликативная форма) фага fd; 50000 х, после расправления в цитохроме конусное напыление. Ж. Фаг fd с кольцевой одноцепочечной ДНК; 50 000 х, напыление под углом. (Фото Н. Frank.)
Подобно другим вирусам, фаги неподвижны. При смешивании взвеси свободных фагов со взвесью бактерий фаговые частицы в результате случайных столкновений с клетками прикрепляются к поверхности последних (адсорбция) и вводят в клетку свою ДНК (инъекция). По прошествии некоторого времени, необходимого для процессов синтеза и созревания, клетки лизируются и новообразованные фаговые частицы выходят наружу (см. рис. 4.13).
Адсорбция. Не всякий фаг адсорбируется на любой бактерии. Специфичность отношений хозяина и фага определяется специфичностью адсорбции, которая зависит от рецепторов, имеющихся в клеточной стенке. Рецепторы для одних фагов находятся в липопротеиновом слое, для других - в липополисахаридном. Фагорезистентность некоторых бактерий определяется, вероятно, отсутствием у них соответствующих рецепторов. При избытке бактериофага на одной клетке может адсорбироваться 200-300 фаговых частиц.
Внутриклеточное развитие фага. За адсорбцией следует инъекция, т. е. введение ДНК в клетку. У фага Т2 при этом базальная пластинка, по- видимому, фиксируется на клетке, чехол отростка сокращается и в результате этого полый стержень входит в бактериальную клетку. Опыты с фагом, у которого нуклеиновая кислота была помечена 32Р, а белок - 35S, показали, что в клетку проникает только нуклеиновая кислота, а белковая оболочка остается снаружи. Можно было отделить эту оболочку от зараженной клетки без всякого ущерба для размножения фага. Во время так называемого латентного периода, продолжающегося у Escherichia coli в среднем 25 мин, в искусственно разрушенных бактериальных клетках не удается обнаружить фага. Инъецированная ДНК фага прежде всего вызывает полную перестройку метаболизма зараженной клетки (рис. 4.10). Сразу же прекращается синтез бактериальной ДНК. Через несколько минут прекращается также синтез бактериальной РНК и бактериальных белков, хотя общее количество белка продолжает непрерывно возрастать. Синтез ДНК возобновляется, даже с повышенной скоростью. Сначала фаговая ДНК образуется за счет распавшейся бактериальной. Эту перестройку и последующее новообразование фаговой ДНК можно количественно проследить по увеличению количества 5-гидроксиметилцитозина - основания, специфичного для ДНК некоторых Т-фагов. Необходимые для синтеза фаговой ДНК ферменты образуются уже вскоре после заражения; это так называемые «ранние белки». К «поздним белкам» относятся белки оболочки и фаговые лизоцимы, или эндолизины; они образуются лишь во второй половине скрытого периода.
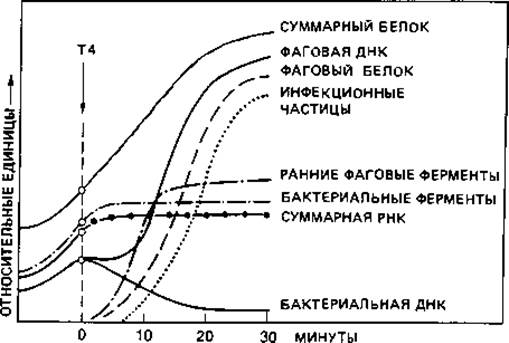
Рис. 4.10. Временной ход процессов биосинтеза у Escherichia coli после заражения клеток фагом Т4. (Luria, Darnell, 1967.)
Заключительный процесс - созревание - состоит в соединении фаговой ДНК с белком оболочки и образовании зрелых инфекционных фаговых частиц. Созревание Т-фагов - сложный многоступенчатый процесс. Сначала образуются капсиды, наполненные внутри белками. После растворения этих внутренних белков готовые головки наполняются ДНК до определенной, зависимой от типа фага плотности и закрываются. После этого пристраиваются компоненты отростка. Последовательность этих процессов можно проследить на условно летальных мутантах, у которых при 25°С все процессы синтеза протекают нормально, а при 43°С тот или иной этап блокируется.
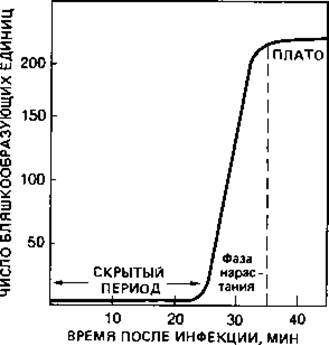
Рис. 4.11. Определение скрытого периода и урожая фага (на примере экспериментов с размножением фага Т2 в клетках Escherichia coli В). Молодую культуру бактерий заражали суспензией фага, а затем свободные (не адсорбировавшиеся) фаговые частицы инактивировали добавлением антифаговой сыворотки. После сильного разведения через определенные интервалы времени брали пробы и высевали на агар вместе с избытком бактерий, чувствительных к данному фагу. В течение 25 мин число бляшкообразующих единиц оставалось неизменно равным 5 (скрытый период), а затем возрастало до 235 (плато). Согласно этим данным, выход фага на одну инфицированную клетку бактерии (урожай фага) составлял в среднем 47 частиц.
В конце концов клеточная стенка бактерии размягчается под действием фагового лизоцима, и новые фаги освобождаются. Такое внезапное разрушение клетки можно наблюдать под микроскопом в условиях темного поля. Продолжительность латентного периода и величина урожая фаговых частиц варьируют в широких пределах в зависимости от вида фага, вида бактерии и условий среды (рис. 4.11). Удалось инфицировать такие бактерии, как Haemophilus influenzae и Bacillus subtilis, нативной ДНК, выделенной из бактериофага. Подобную инфекцию, соответствующую генетической трансформации, называют трансфекцией.
4.2.2 Развитие умеренных фагов: лизогения
Описанные выше бактериофаги, как правило, лизируют зараженные ими бактерии, и потому их называют вирулентными. Некоторые фаги, однако, заражают бактерий-хозяев, но не размножаются в них автономно и не вызывают лизиса. Такие фаги называются умеренными. Видимо, их размножение происходит синхронно с размножением бактерии. Лишь очень редко, в одной из 102-105 таких «лизогенных» бактерий, фаг начинает спонтанно размножаться и клетка подвергается лизису. В этом случае для того, чтобы обнаружить выход инфекционного фага, в качестве индикатора нужен другой бактериальный штамм, для которого этот фаг вирулентен. Если смешать лизогенные бактерии с избытком бактерий-индикаторов и посеять смесь на агаризованную среду, то будут расти также и колонии лизогенных бактерий. Время от времени некоторые клетки будут лизироваться и выходящие из них фаговые частицы будут заражать находящиеся по соседству чувствительные (индикаторные) бактерии. Это приведет к появлению бляшек в сплошном бактериальном газоне. Однако в середине каждой такой бляшки сохранится колония лизогенной бактерии (рис. 4.12).
Лизогенные бактерии обладают потенциальной способностью продуцировать фаги, но эту способность нельзя обнаружить ни морфологическим, ни серологическим исследованием. Фаг в таком неинфекционном состоянии, передающийся только дочерним клеткам при делении, называют профагом. Подобно другим признакам бактериальной клетки, наличие в ней профага наследуется. Поскольку все потомство лизогенной клетки тоже лизогенно, профаг, очевидно, должен реплицироваться синхронно и регулярно вместе с хромосомой клетки-хозяина (рис. 4.13).
Лизогенные бактерии иммунны к заражению теми фагами, которые присутствуют в них в виде профага. Обеспечиваемый профагами иммунитет обусловлен не невозможностью адсорбции (как при устойчивости к вирулентным фагам), а образованием особого цитоплазматического белка-репрессора, препятствующего размножению вегетативных фагов. Этот же репрессор препятствует обратному переходу профага в вегетативное состояние и подавляет синтез фаговых белков. Возникновение лизогенного состояния связано, таким образом, с образованием репрессорного белка.
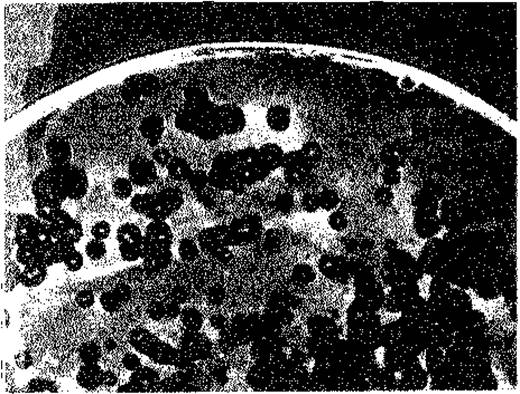
Рис. 4.12. Образование бляшек лизогенными бактериями и свободными фагами. На поверхность агара была нанесена плотная суспензия нелизогенных чувствительных бактерий (Bacillus megaterium), содержащая немного клеток лизогенного штамма того же вида и небольшое количество свободных фаговых частиц. Прозрачные бляшки - результат лизирующего действия одной частицы свободного фага; пятнышки в центре бляшек - колонии лизогенных бактерий.
Спонтанно, без воздействия извне лизогенные бактерии лизируются редко. Однако целый ряд факторов (ультрафиолетовые лучи, митомицин С или алкилирующие агенты) может индуцировать в каждой клетке развитие профага, ведущее к образованию и высвобождению инфекционного фага. Успех такой индукции зависит от генетической конституции профага, физиологического состояния хозяина и условий культивирования. Индукция связана, очевидно, с устранением или инактивацией имеющихся молекул репрессора. Некоторые мутанты умеренных фагов образуют термолабильный репрессор, и тогда достаточно уже повышения температуры до 44°С, чтобы вызвать лизис бактерий.
Интеграция и индукция фага λ (лямбда). Изучение фага лямбда (λ), лизогенного для Escherichia coli K12, позволило выяснить, каким образом профаг связан с бактериальной хромосомой. Лизогенизация бактерий этим фагом может служить примером жизненного цикла умеренного бактериофага. Длина хромосомы фага лямбда оставляет всего 2% длины бактериальной хромосомы.
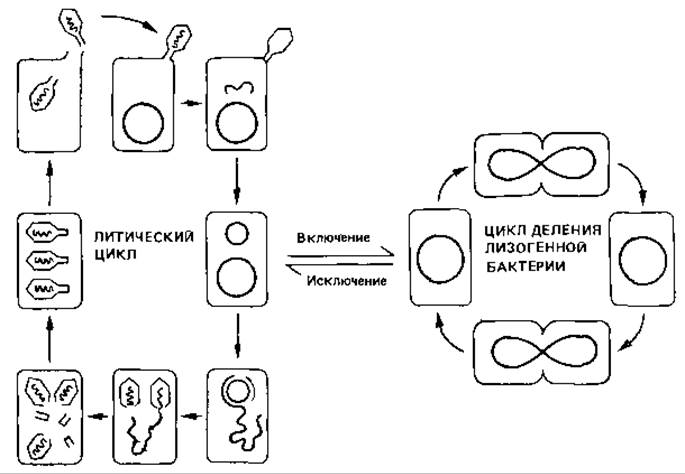
Рис. 4.13. Жизненные циклы умеренного фага (на примере фага лямбда). После инфекции Escherichia coli фагом лямбда происходит либо репродукция фага с последующим лизисом (литический цикл), либо лизогенизация бактерии. ДНК фага представлена линейной двойной спиралью. В бактерии она замыкается в кольцо. Это кольцо может оставаться автономным или интегрироваться в бактериальную ДНК. В первом случае развертывается литический цикл. Замкнутая в кольцо ДНК реплицируется. В результате репликации по способу «катящегося кольца» получается цепочка из четырех копий фаговой ДНК. Гены фага запускают синтез и сборку белков головки и отростка и упаковку по одной копии ДНК в каждую головку фага. Головки спонтанно соединяются с отростками. При лизисе клетки-хозяина высвобождается около сотни зрелых фагов, которые в свою очередь могут инфицировать клетки. Однако кольцевая ДНК фага может также потерять свою автономию и включиться (интегрироваться) в ДНК хозяина. В ЭТОМ случае клетка становится лизогенной. Латентный фаг, или «профаг», реплицируется совместно с хромосомой клетки-хозяина. Лизогенная бактерия может неограниченно делиться, не подвергаясь лизису. Исключение (из хромосомы) фаговой ДНК, приводящее к лизису клетки, может произойти спонтанно или под действием индуцирующего фактора-облучения или мутагена.
В свободных фаговых частицах ДНК присутствует в виде линейной (не кольцевой) двойной спирали (рис. 4.14). Каждая из цепей на одном конце выступает за пределы дуплекса на 12 нуклеотидов. Эти два одноцепочечных конца комплементарны друг другу; путем спаривания оснований они могут соединяться друг с другом, поэтому их называют «липкими» концами. Если поместить такие молекулы ДНК in vitro в раствор, то благодаря взаимодействию между комплементарными основаниями одноцепочечных концов наступает равновесие между линейными и кольцевыми ДНК. Такое же замыкание в кольцо происходит после того, как фаг лямбда инфицирует клетку. При этом оба разрыва между концами цепей закрываются полинуклеотид-лигазой. Функция этого бактериального фермента состоит в том, чтобы устранять разрывы в отдельных цепях двойных спиралей ДНК путем связывания нуклеотидов. Таким образом, для замыкания линейной ДНК фага в кольцо никакие фаговые ферменты не нужны.
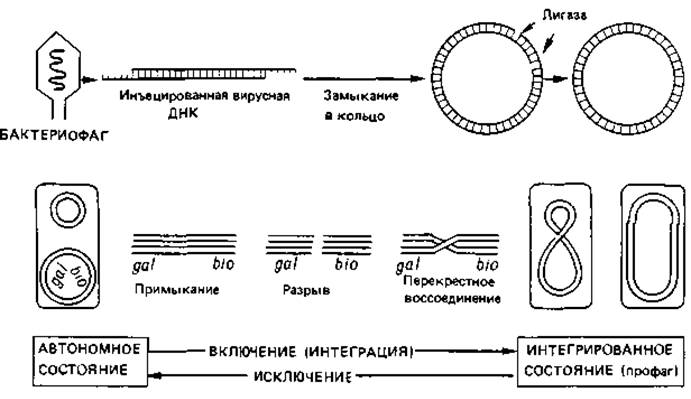
Рис. 4.14. Интеграция (включение) фага лямбда в хромосому Escherichia coli и его освобождение из хромосомы (исключение). В фаговой частице ДНК представлена линейной двойной спиралью с неспаренными комплементарными концами. В растворе или в бактериальной клетке «липкие» комплементарные концы связываются друг с другом, и разрыв в каждой цепи закрывается с помощью лигазы. После этого замкнутое двухцепочечное кольцо подходит к хромосоме (между генами gal и bio), обе двойные спирали разрываются и образовавшиеся свободные концы воссоединяются крест-накрест. В результате фаговая ДНК оказывается включенной (встроенной, или интегрированной) в хромосому хозяина. Фаг превратился теперь в профаг, и клетка стала лизогенной (в данном случае по фагу лямбда). В результате обратного процесса может произойти выключение ДНК фага и переход ее в автономное состояние.
В лизогенных клетках профаг прочно связан с хромосомой клетки-хозяина. При конъюгации клеток профаг вместе с хромосомой хозяина переносится из клетки-донора в клетку-реципиент. Генетические эксперименты показывают, что фаг лямбда присоединен к хромосоме хозяина в совершенно определенном месте (между галактозным опероном и биотиновым локусом). Вначале предполагали, что ДНК бактериофага только прикрепляется к хромосоме бактерии в этом участке. Однако в результате составления генетических карт фага, а также из опытов по рекомбинации стало ясно, что фаговая ДНК при лизогенизации не просто прикрепляется к бактериальной ДНК, а включается в нее.
Включение (интеграция) ДНК профага в хромосому клетки-хозяина происходит, очевидно, в результате разрыва и перекрестного воссоединения (рис. 4.14). За эту реакцию ответствен фермент, названный лямбда-интегразой. Он узнает две разные, негомологичные последовательности нуклеотидов-одну в хромосомной ДНК и одну в ДНК фага - и тесно сближает обе двойные спирали друг с другом; затем последние разрываются и снова соединяются крест-накрест. Отдельные этапы этой сайт-специфической рекомбинации показаны на рис. 4.14.
В интегрированном состоянии фаговая ДНК реплицируется вместе с бактериальной и подвержена тем же регуляторным воздействиям, что и удвоение бактериальных хромосом. Информация, содержащаяся в фаговой ДНК, в это время не проявляется. Только в результате перехода профага в вегетативное состояние восстанавливается автономия фаговой ДНК и начинается размножение фага. Этот обратный процесс может произойти спонтанно или в результате индукции (например, под действием ультрафиолетового облучения). Исключение фаговой ДНК из бактериальной хромосомы происходит, вероятно, путем обращения процессов, приведших к ее включению, и осуществляется очень точно: более 99% фаговых частиц, освобождающихся из лизогенных клеток, идентичны с исходным (инфицирующим) фагом. Это означает, что фаговая ДНК при ее выключении выцепляется точно в том же месте, где происходила интеграция. Только в редких случаях (одном из 100 000) выключение ДНК фага происходит аномально (см. разд. 15.3.3, где говорится о трансдукции).
Как только профаг в результате выключения перешел в вегетативное состояние, он опять становится автономным и может размножаться в бактериальной клетке как вирулентный фаг. Выключение, таким образом, приводит к лизису бактерии и высвобождению фага лямбда.