Общая микробиология - Шлегель Г. 1987
Типы брожения
Муравьинокислое брожение и семейство Enterobacteriaceae
Некоторые микроорганизмы, образующие при брожении кислоты, объединяют в одну физиологическую группу на том основании, что характерным, хотя и не главным продуктом брожения является у них муравьиная кислота. Наряду с муравьиной кислотой такие бактерии выделяют и некоторые другие кислоты; такой тип метаболизма называют поэтому муравьинокислым брожением или брожением смешанного типа. Так как некоторые типичные представители этой группы обитают в кишечнике, все семейство носит название Enterobacteriaceae. Это грам-отрицательные, активно подвижные, не образующие спор палочки с перитрихальным жгутикованием. Будучи факультативными аэробами, они обладают гемопротеинами (цитохромами и каталазой) и способны получать энергию как в процессе дыхания (в аэробных условиях), так и в процессе брожения (в анаэробных условиях). В отношении питания эти бактерии исключительно нетребовательны - растут на простых синтетических средах, содержащих минеральные соли, углеводы и аммоний. Сбраживание глюкозы у всех представителей этой группы происходит с образованием кислот. Значение Enterobacteriaceae для эпидемиологии, а также для разного рода экспериментальных исследований общеизвестно; поэтому полезно будет рассмотреть здесь некоторых представителей этого семейства.
Наиболее важные виды. Escherichia coli - обитатель кишечника, в количественном отношении, однако, не главный (в кишечной флоре преобладают Bacteroides и Bifidobacterium). Эта бактерия может некоторое время сохранять жизнеспособность и вне кишечника, и ее легко выявить. Этим пользуются для того, чтобы обнаружить загрязнение питьевой воды фекалиями.
Таблица 8.4. Признаки родов, относящихся к Enterobacteriaceae
|
Род |
Знак «плюс» означает, что большинство штаммов признаку положительно |
по данному |
||||||
|
Подвижность |
Сбраживание глюкозы |
Сбраживание лактозы |
Образование Н2 |
Образование индола |
Образование ацетоина |
Протеолиз |
Использование мочевины |
|
|
Escherichia |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
|
Klebsiella |
- |
+ |
+ |
+ |
- |
+ |
- |
+ |
|
Enterobacter |
+ |
+ |
+ |
+ |
- |
+ |
( + ) |
( + ) |
|
Serratia |
+ |
+ |
- |
+ |
- |
+ |
+ |
- |
|
Proteus |
+ |
+ |
- |
+ |
+ |
- |
+ |
+ |
|
Citrobacter |
+ |
+ |
+ |
( + ) |
+ |
- |
- |
( + ) |
|
Salmonella |
+ |
+ |
- |
+ |
- |
- |
- |
- |
|
Shigella |
- |
+ |
- |
- |
+ |
- |
- |
- |
|
Erwinia |
+ |
+ |
( + ) |
- |
( + ) |
( + ) |
_ |
|
Proteus vulgaris тоже принадлежит к нормальной кишечной флоре, но, кроме того, широко распространен в почве и воде. Эта бактерия известна своей склонностью к изменению формы (отсюда ее название) и большой подвижностью, а также способностью образовывать на поверхности агара сплошную пленку (разд. 2.2.5).
Enterobacter aerogenes можно в известном смысле считать «близнецом» Е. coli (оба вида относят к «группе кишечной палочки»). Эта бактерия широко распространена в почве; как показывает ее видовое название, она образует много газообразных продуктов. От Е. coli она отличается лишь немногими биохимическими признаками (см. табл. 8.4 и 8.5).
Serratia marcescens (прежнее название - Bacterium prodigiosum, или чудесная палочка) может рассматриваться как вариант Enterobacter, отличающийся образованием пигмента.
К роду Erwinia относятся некоторые фитопатогенные виды, поражающие стебли, листья и корни. В результате выделения пектиназ они вызывают мягкие гнили.
Klebsiella pneumoniae отличается от Enterobacter только более толстой слизистой капсулой и неподвижностью. Ее находят при некоторых тяжелых формах пневмонии.
Salmonella typhimurium - самая распространенная из бактерий, вызывающих гастроэнтерит, или так называемую «пищевую токсикоинфекцию»; в основе симптомов лежит раздражение слизистой желудочно-кишечного тракта выделяемыми липополисахариднымй токсинами бактерии. В кровяное русло возбудитель не проникает. S. typhi является
возбудителем эпидемического брюшного тифа, а Shigella dysenteriae и родственные штаммы - возбудителями дизентерии.
Vibrio cholerae - возбудитель холеры, эпидемической болезни. Он не относится к группе Enterobacteriaceae, но близок к ней по типу метаболизма. Холерный вибрион размножается в кишечнике. Он прикрепляется к кишечному эпителию, но не проникает в клетки. Холерный энтеротоксин - белок, связываемый клетками кишечного эпителия (специфическими рецепторами). Он вызывает переход воды и ионов натрия, бикарбоната и хлорида в просвет кишечника.
Yersinia pestis - возбудитель чумы. Род Yersinia не относится к таксономической группе Enterobacteriaceae, но близок к ней по своему факультативно-анаэробному образу жизни и по типу брожения. Природным резервуаром этого возбудителя эпидемий служат дикие грызуны, главным образом крысы. Бактерии передаются человеку инфицированными блохами и другими эктопаразитами; в результате развивается бубонная или легочная чума. Быстрое размножение бактерий в организме и интенсивная выработка ими токсина могут приводить к скорой смерти.
Анализ питьевой воды. Основная цель анализа питьевой воды - обнаружение Escherichia coli. Этот анализ - простой пример бактериологической дифференциальной диагностики, поэтому на нем стоит остановиться подробнее. Е. соli - обычный и совершенно безвредный обитатель кишечника человека, и его присутствие в питьевой воде само по себе неопасно. Однако в кишечнике может находиться и ряд патогенных бактерий. Вместе с Е. coli эти бактерии выделяются с калом больных, реконвалесцентов и бациллоносителей, так что и они могут попадать в питьевую воду. Чтобы не применять специальных методов для выявления каждой из таких патогенных бактерий, пользуются общим индикатором загрязнения. Таким индикатором и служит постоянный обитатель кишечника Е. coli. Обнаружение этого вида в пробе воды показывает, что вода загрязнена содержимым кишечника и кишечными бактериями, среди которых могут быть и патогенные формы. В таком случае требуется принять соответствующие меры. Нормой для питьевой воды считается, когда общее число бактериальных клеток в 1 мл не превышает 100; при этом в 100 мл воды не должно быть ни одной клетки Е. coli.
Е. coli хорошо растет на средах, содержащих глюкозу или лактозу и пептон. Для того чтобы создать условия, при которых рост других бактерий сводился бы к минимуму, пользуются лактозой. На средах с лактозой могут расти только те бактерии, которые способны ее расщеплять с помощью ß-галактозидазы. Этот фермент синтезируют бактерии группы кишечной палочки и молочнокислые бактерии, тогда как многие почвенные и водные бактерии его лишены.
Первые указания на присутствие газообразующих бактерий дает появление газа во время инкубации пробы в растворе с лактозой и пептоном в бродильных трубках Эйихорна. Если в одну трубку высеять Escherichia coli, а в другую - Enterobacter aerogenes, то уже после 24-часовой инкубации при 37°С станет заметной разница в выделении газообразных продуктов. Е. aerogenes оправдывает свое название и образует примерно вдвое больше газа, чем Е. coli. Различен и состав выделяющегося газа: Е. coli выделяет Н2 и СO2 примерно в соотношении 1:1, тогда как Enterobacter aerogenes образует больше СO2, чем водорода.
Таблица 8.5. Реакции для дифференциации Escherichia coli и Enterobacter aerogenes
|
Образование индола |
Проба с метиловым красным |
Образование ацетоина |
Цитрат |
|
|
Escherichia coli |
+ |
+ |
_ |
- |
|
Enterobacter aerogenes |
- |
- |
+ |
+ |
Некоторые молочнокислые бактерии тоже обладают способностью расщеплять лактозу с образованием газа, так что их присутствие может исказить результаты анализа. Это делает необходимым применение дальнейших методов дифференциации. Если такую культуру высеять на агар с эозином и метиленовым синим (лактоза-пентон-эозин-метиленовый синий), то появляются колонии Е. coli, окрашенные в темно-синий цвет с металлическим отливом (результат отражения света); Enterobacter же образует розовые слизистые колонии без металлического блеска.
Для более точной дифференциации этих двух микроорганизмов требуется полный анализ брожения. Это, конечно, самый точный, но и самый трудоемкий способ. В повседневной практике для заключительной дифференциации используют метод, основанный на качественных различиях между двумя рассматриваемыми видами бактерий (табл. 8.5). Учитываются следующие показатели: 1) образование индола из триптофана; 2) количество кислоты, образуемой из сахара (проба с метиловым красным); 3) образование ацетоина при сбраживании глюкозы (реакция Фогес П роскауэра) и 4) рост на среде с цитратом в качестве источника углерода. 1
1. Образование индола. Индол, образуемый из триптофана, выявляется с помощью реактива Эрлиха (и-диметиламинобензальдегида) по вишнево-красному окрашиванию.
2. Проба с метиловым красным. Образование кислоты приводит к изменению цвета pH-индикатора (метилового красного): красный < pH 4,5 < желтый.
3. Образование ацетоииа (реакции Фогес-Проскауэра). Ацетоин, образовавшийся в питательной среде с глюкозой и пептоном, в сочетании с креатином, содержащимся в пептоне, вызывает после прибавления сильной щелочи (1 мл 10%-ного КОН на 5 мл питательного раствора) появление красной окраски. Чувствительность метода повышается при добавлении креатина и а-нафтола.
4. Использование цитрата. В синтетическом питательном растворе с цитратом использование последнего можно обнаружить по помутнению и подщелачиванию (выявляется с помощью бромтимолового синего).
Продукты брожения и метаболические пути. При брожениях, вызываемых факультативными анаэробами, в том числе представителями Enterobacteriaceae, многими видами Bacillus и другими бактериями, образуется большое число различных соединений, среди которых преобладают органические кислоты. Важнейшими продуктами брожения являются уксусная, муравьиная, янтарная и молочная кислоты, этанол, глицерол, ацетоин, 2,3-бутандиол, СО2 и молекулярный водород. Гексозы расщепляются в основном по фруктозобисфосфатному пути и только в незначительной части - по пентозофосфатному. Разложение глюконата идет по 2-кето-3-дезокси-6-фосфоглюконатному пути.
Таблица 8.6. Продукты сбраживания глюкозы бактериями Escherichia coli и Enterobacter aerogenes. (Thimann К. V., The Life of Bacteria. Macmillan, New York, 1955)
|
Продукт |
Число молей на 100 молей глюкозы |
||
|
Е. coli |
Е. aerogenes |
||
|
2,3-Бутандиол |
СН3—СНОН—СНОН—СН3 |
0 |
66,5 |
|
Этанол |
СН3—СН2ОН |
42 |
70 |
|
Янтарная кислота |
СООН—СН2—СН2—СООН |
29 |
0 |
|
Молочная кислота |
СН3СНОН—СООН |
84 |
3 |
|
Уксусная кислота |
СН3—СООН |
44 |
0,5 |
|
Муравьиная кислота |
НСООН |
2 |
18 |
|
Водород |
Н2 |
43 |
36 |
|
Двуокись углерода |
СО2 |
44 |
172 |
В зависимости от того, какие продукты брожения выделяются в анаэробных условиях, различают два типа процессов: а) при брожении, характерном для Escherichia coli, образуются главным образом кислоты и совсем не образуется бутандиол; б) при брожении, характерном для Enterobacter, основной продукт - бутандиол, кислоты же занимают второе место. В табл. 8.6 приведены результаты типичного анализа продуктов брожения. Два указанных типа брожения различаются главным образом по реакциям, связанным с превращениями пирувата.
Особенности брожения, осуществляемого Escherichia coli. Для этой бактерии характерны следующие особенности брожения; 1) расщепление пирувата с образованием адетил-СоА и формиата; 2) разложение формиата на СО2 и молекулярный водород; 3) восстановление ацетил- СоА до этанола; 4) отсутствие способности образовывать из пирувата ацетоин и 2,3-бутандиол.
Превращение пирувата в ацетил-СоА и формиат происходит только в анаэробных условиях; его катализирует пируват : формиат-лиаза (см. разд. 7.2.4). Этот фермент чрезвычайно чувствителен к кислороду, удерживается флаводоксином в восстановленном состоянии и для своей активации нуждается в S-аденозил-L-метионине.
Муравьиную кислоту большинство штаммов Е. coli и другие газообразующие виды энтеробактерий расщепляют на СО2 и молекулярный водород:
![]()
Эту реакцию катализирует ферментная система, называемая формиат- гидроген-лиазой. Речь идет, вероятнее всего, о комбинированном действии формиатдегидрогеназы (НСООН + X → СО2 + ХН2) и гидрогеназы (ХН2 → X + Н2). У Е. coli газообразные продукты Н2 и СО2 образуются почти в равных количествах. Такое стехиометрическое отношение (1 : 1) согласуется с образованием обоих газов в результате расщепления формиата. Однако при изменении pH это отношение меняется.
Этанол, образуемый энтеробактериями, является продуктом восстановления ацетил-СоА. У этих бактерий нет пируватдекарбоксилазы, декарбоксилирующей пируват с образованием ацетальдегида. Часть образующегося ацетил-СоА выделяется в виде ацетата; высокоэнергетическая связь может при этом сохраняться благодаря реакциям, осуществляемым фосфотрансацетилазой и ацетаткиназой.
Лактат получается в результате восстановления пирувата.
Сукцинат является продуктом «фумаратного дыхания», при котором происходит фосфорилирование, сопряженное с транспортом электронов (разд. 9.6). Сначала в результате карбоксилирования фосфоенолпирувата образуется оксалоацетат, который затем через малат превращается в фумарат. Фумарат при участии мембраносвязанной фумаратредуктазы восстанавливается до сукцината, который выделяется в окружающую среду. Выделение значительных количеств сукцината (табл. 8.6), синтез которого включает фиксацию СО2, позволяет объяснить то, что Escherichia coli может покрывать за счет СО2 до 20% своей потребности в углероде.
Особенности брожения, осуществляемого Enterobacter aerogenes. Эта бактерия в анаэробных условиях тоже образует целый ряд кислот; в количественном отношении они, однако, существенно уступают ацетоину и 2,3-бутандиолу. Ацетоин образуется из двух молекул пирувата. Процесс включает двукратное декарбоксилирование. Образование нейтрального продукта брожения - будандиола - в известной мере конкурирует за промежуточный продукт - пируват, подавляя тем самым синтез кислот.
С другой стороны, образование бутандиола связано с дополнительным освобождением СО2. Количество дополнительно образуемой двуокиси углерода находится в стехиометрическом соотношении с количеством бутандиола. Из табл. 8.6 видно, что некоторая часть СО2 образуется при расщеплении формиата, однако основное ее количество выделяется в процессе образования бутандиола. Своим названием Enterobacter aerogenes обязан, как уже говорилось, очень интенсивному выделению газообразных продуктов. Соответствующие отличия от брожения, осуществляемого Escherichia coli, составляют основу для применения пробы с метиловым красным и проведения реакции Фогес - Проскауэра на ацетоин.
Образование ацетоина у Enterobacter идет через 2-ацетиллактат. Активный ацетальдегид (гидроксиэтилтиаминпирофосфат; см. рис. 7.6) участвует в реакции с пируватом, катализируемой ацетиллактатсинтазой (ферментом I), в результате чего образуется 2-ацетиллактат:
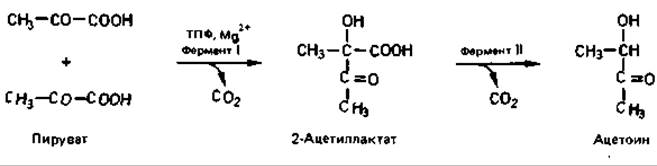
Второй фермент (ІІ) - 2-ацетиллактатдекарбоксилаза - отщепляет СО2. Продуктом этой стереоспецифической реакции является ацетоин (ацетилметилкарбинол).
2,3-Бутандиол образуется при восстановлении ацетоина бутандиолдегидрогеназой:
![]()
У Enterobacter aerogenes, Bacillus subtilis, В. polymyxa, Serratia, Aeromonas hydrophila и некоторых других бактерий образование бутан- диола идет через 2-ацетиллактат. Брожение с выходом бутандиола находит применение в промышленности.
При окислении ацетоина кислородом воздуха легко образуется сходное с ацетоином соединение диацетил. Его выделяют и различные молочнокислые бактерии (Leuconostoc cremoris, Lactobacillus plantarum), добавляемые к молоку специально для этой цели в процессе приготовления молочнокислых продуктов (масла, йогурта). Диацетил придает продукту запах масла. У названных бактерий он синтезируется не через 2-ацетиллактат, а из гидроксиэтил-тиаминпирофосфата и ацетил-СоА.
8.4.1 Светящиеся бактерии и биолюминесценция
Светящиеся бактерии - в основном морские организмы. Это хемоорганотрофные бактерии, по своим морфологическим и физиологическим признакам сходные с Enterobacteriaceae; поэтому их называют также «морскими энтеробактериями».
Светящиеся бактерии легко выделить из морской и солоноватой воды. На мясе и рыбе они образуют естественные накопительные культуры, особенно при низких температурах. Если морскую рыбу в неглубокой посуде наполовину залить соленой водой и оставить на несколько дней в холодильнике (при 4-6°С), то на поверхности рыбы появятся колонии светящихся бактерий, которые можно выделить и получить в чистой культуре. Как правило, они не вызывают гниения и не образуют токсичных веществ, но выделяют амины. Р. Бойль (1667) писал: «Иной кусок мяса вчера еще светился, а сегодня из него уже приготовлено питательное и вкусное блюдо».
Светящиеся бактерии. Все выделенные до сих пор светящиеся бактерии - грам-отрицательные факультативные анаэробы, передвигающиеся с помощью 1-8 жгутиков. В зависимости от морфологии жгутиков (полярное или перитрихальное расположение, простые жгутики или жгутики в чехле) их относят к родам Photobacterium или Вепескеа. В анаэробных условиях большинство светящихся бактерий осуществляет муравьинокислое брожение или брожение смешанного типа, как это свойственно Enterobacteriaceae, и образует муравьиную, уксусную, молочную и янтарную кислоты, спирт, СО2 и ацетоин. Как и многие другие морские бактерии, они являются галофилами; если поместить их в гипотоничную среду (дистиллированную воду), они мгновенно лизируются.
Рост и биолюминесценция в сильной степени зависят от состава среды. Свечение наблюдается только в присутствии кислорода, поэтому такие бактерии еще в конце прошлого века использовались как чувствительные индикаторы для выявления фотосинтетического образования кислорода у зеленых и красных водорослей в опытах со светом разной длины волны.
Процесс свечения. Свечение следует рассматривать как процесс аэробного окисления, своего рода побочный путь дыхания, приводящий не к образованию АТР, а к возбуждению какого-то промежуточного продукта, испускающего при этом свет. Дюбуа первым в 1885 г. исследовал процесс свечения, использовав водные экстракты из светящегося органа моллюска-точильщика Pholas dactylus; он выяснил, что в реакции участвуют вещество, экстрагируемое горячей водой (люциферин), и фермент, экстрагируемый холодной водой (люцифераза):
![]()
В разных системах вещества, участвующие в биолюминесценции, различны. Лучше всего этот процесс изучен у Photinus pyralis - американского светлячка. Люциферин его люминесцентной системы оказался производным бензтиазола. Люцифераза (Е) катализирует реакцию восстановленного люциферина (LН2) с АТР; продукт этой реакции - аденилат - при окислении испускает свет:
![]()
Между количеством вступившего в реакцию АТР и интенсивностью свечения существует прямая зависимость. Поэтому «светлячковая реакция» стала излюбленным методом количественного определения АТР.
В бактериальном свечении тоже участвует несколько компонентов: восстановленный FMN, O2 и альдегид с длинной цепью (тетрадеканаль). Люцифераза представляет собой монооксигеназу (см. разд. 14.11.4). Уравнение реакции можно написать следующим образом:
![]()
Окисление FMNH2, вероятно, приводит к возбуждению FMN, т. е. к образованию [FMN ∙ Н2O], который испускает свет, возвращаясь в основное состояние:
![]()
Способность к свечению очень распространена у грибов (Armillaria mellea, Panus stipticus и др.), у простейших (динофлагеллят) и у различных многоклеточных животных. У каракатиц и некоторых глубоководных морских рыб за свечение ответственны симбиотические бактерии, находящиеся в светящихся органах. Значение биолюминесценции для таких животных понятно, однако биологическая роль ее у одноклеточных организмов пока не ясна.