Общая микробиология - Шлегель Г. 1987
Клетка и ее структура
Прокариотическая клетка (протоцит)
Структуру и некоторые функции прокариотических клеток мы рассмотрим более подробно. Прежде чем перейти к деталям, отметим основные признаки, отличающие прокариотическую клетку от эукариотической. Как уже было отмечено, клетки прокариот очень малы. Подавляющее большинство бактерий имеет форму палочек не более 1 мкм толщиной и 5 мкм длиной. Многие псевдомонады имеют ширину 0,4-0,7 мкм и длину 2-3 мкм. Диаметр микрококков составляет всего лишь 0,5 мкм. Среди бактерий очень немного «гигантов» (Chromatium okenii, Thiospirillum jenense, Achromatium и др.), и все такие формы растут сравнительно медленно.
Компартментализация клетки значительно менее выражена, чем у эукариотических клеток (рис. 2.4). ДНК не окружена ядерной мембраной, а органеллы типа митохондрий и хлоропластов отсутствуют. Область ядра, видимая на электронной микрофотографии ультратонкого среза клетки в виде сетчатой структуры из тонких нитей, непосредственно граничит с заполненной рибосомами цитоплазмой (рис. 2.5). У многих бактерий впячивания плазматической мембраны образуют определенные структуры во внутреннем пространстве протопласта (внутриклеточные мембраны). С плазматической мембраной связаны процессы дыхания или фотосинтеза, доставляющие клетке энергию, т. е. функции, за которые в эукариотических клетках ответственны мембраны митохондрий и хлоропластов.
Рибосомы прокариот меньше, чем цитоплазматические рибосомы эукариот; они относятся к типу 70S.
Вся генетическая информация протоцита содержится в одной-единственной нити ДНК - «бактериальной хромосоме». Эта молекула ДНК у всех до сих пор исследованных бактерий имеет вид кольцевой нити; длина ее контура составляет от 0,25 до 3 мм. Гистонов нет. У многих бактерий была, кроме того, обнаружена внехромосомная ДНК; она состоит из небольших, тоже замкнутых в кольцо молекул ДНК, получивших название плазмид. Информация, содержащаяся в плазмидах, не является необходимой для клеток.
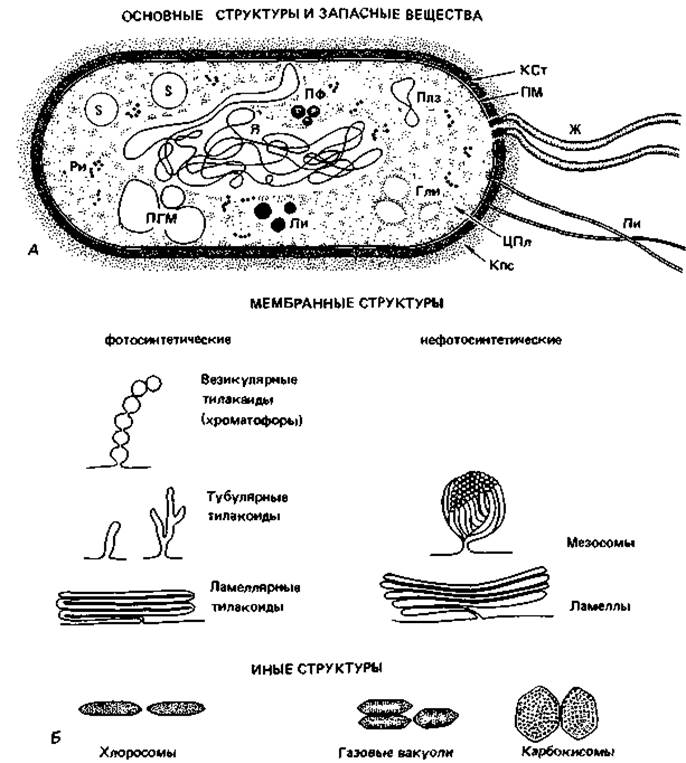
Рис. 2.4. А. Схема строения прокариотической клетки (бактериальная клетка в продольном разрезе). Гли - гранулы гликогена; Ж - жгутик; Кпс - капсула; КСт - клеточная стенка; Ли - липидные капельки; ПГМ - поли-β-гидроксимасляная кислота; Пи - пили; Плз - плазмида; ПМ - плазматическая мембрана; ПФ - гранулы полифосфата; Pи - рибосомы и полисомы; Я - ядро (нуклеоид); S - включения серы. Б. Различные цитоплазматические структуры.
Бактерии, как правило, размножаются путем деления надвое (бинарное деление). Клетка удлиняется, а затем происходит образование поперечной перегородки, постепенно врастающей снаружи внутрь (или перетяжки), после чего дочерние клетки расходятся. У многих бактерий, однако, после деления в определенных условиях среды дочерние клетки некоторое время остаются связанными между собой, образуя характерные группы. При этом в зависимости от ориентации плоскостей деления и числа делений возникают различные формы, например у сферических бактерий-пары клеток (Diplococcus), цепочки (Streptococcus), пластинки или же пакеты (Sarcina). Палочковидные бактерии также могут образовывать пары или цепочки клеток. Размножение почкованием встречается у прокариот как исключение. Делению клетки предшествует удвоение, или репликация, бактериальной хромосомы. Однако диплоидная фаза в клеточном цикле ограничена очень короткой стадией. Таким образом, прокариоты-гаплоидные организмы.
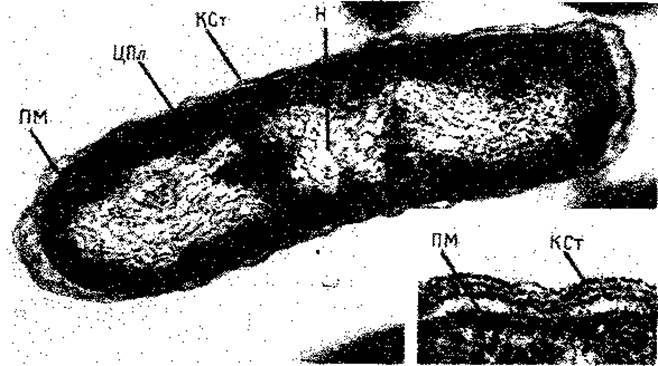
Рис. 2.5. Электронная микрофотография ультратонкого среза клетки Escherichia coli В. В результате слабого плазмолиза протопласт отделился от клеточной стенки, поэтому клеточная стенка (КСт) и плазматическая мембрана (ПМ) хорошо различимы. H - нуклеоид (ядро); ЦПл - цитоплазма с рибосомами. Увеличение 56 200 х, в нижнем правом углу - 216 600 х. (Фото Н. Frank, Max-Plank-Institut für Virusforschung, Tübingen.)
Клетки прокариот, за немногими исключениями (Mycoplasma), окружены клеточной стенкой. Основной «каркас» стенки состоит из пептидогликана, или муреина. Это характерный для прокариот гетерополимер, который не встречается у эукариот. Многие прокариоты подвижны - они перемещаются путем плавания или скольжения. Органами движения плавающих бактерий служат особые «бактериальные» жгутики. Эти жгутики устроены значительно проще, чем у эукариот, и состоят из одной-единственной фибриллы.
По форме, за немногими исключениями, все бактерии можно отнести к сферическим, цилиндрическим (палочковидным) или искривленным цилиндрическим. Основными формами считаются поэтому кокки, прямые палочки и изогнутые палочки (рис. 2.6). Как прямые палочки под микроскопом выглядят бактерии, относящиеся к родам Pseudomonas и Bacillus. Спириллы имеют штопорообразную форму. Вибрионами (Vibrio) называют искривленную палочку. Для некоторых бактерий характерны отклонения от этих основных форм. Для рода Corynebacterium и для коринеформных бактерий характерна булавообразная или изменчивая неправильная форма. У многих видов Mycobacterium встречаются намеки на ветвление клетки. Стрептомицеты образуют даже мицелий, подобный грибному, но отличающийся от последнего меньшим диаметром клетки (менее 1 мкм, тогда как у грибов более 5 мкм).

Рис. 2.6. Формы одноклеточных бактерий. 1 - микрококки; 2 - диплококки; 3 - стрептококки; 4 - стафилококки; 5 - сарцины; 6 -палочковидные бактерии; 7 - спириллы; 8 - вибрионы.
Химический состав одноклеточных организмов. Вес сырой биомассы бактерий определяют после отделения клеток от жидкой питательной среды путем центрифугирования. Осевшая клеточная масса содержит 70-85% воды; таким образом, сухая биомасса составляет 15-30% от сырой массы. Если клетки содержат много запасного материала (липиды, полисахариды, полифосфаты или серу), доля сухой массы больше. Сухое вещество бактерий - это в основном полимеры [белки (50%), компоненты клеточной стенки (10-20%), РНК (10-20%), ДНК (3-4%)], а также липиды (10%). Десять важнейших химических элементов представлены в клетках бактерий примерно следующим образом: углерод-50%, кислород-20%, азот-14%, водород-8%, фосфор-3%, сера-1 %, калий-1%, кальций-0,5%, магний -0,5% и железо 0,2%.
2.2.1 Бактериальное ядро
Малые размеры бактериальной клетки и наличие двух типов нуклеиновых кислот очень затруднили цитохимическое выявление ядерного материала. Тем не менее классические цитологические методы, а затем и техника ультратонких срезов в сочетании с электронной микроскопией позволили в конце концов установить, что бактерии содержат ДНК и что эта ДНК не распределена диффузно в цитоплазме, а локализована в ограниченных участках, которые делятся перед делением клетки.
Цитологическое выявление бактериального ядра. Способность ДНК к специфическому окрашиванию лежит в основе реакции Фёльгена на ядерное вещество. В результате взаимодействия свободных альдегидных групп с бесцветной фуксинсернистой кислотой появляется фиолетовая окраска, свойственная основному фуксину. Для удаления из клеток РНК и освобождения альдегидных групп дезоксипентозы, входящей в состав ДНК, клетки предварительно обрабатывают горячей разведенной НСl (4 мин в 1 М НСl при 60°С). Лучшие результаты получались при окрашивании клеток после такой же предварительной обработки основным красителем Гимза. В дальнейшем методы фиксации были усовершенствованы; РНК стали удалять с помощью рибонуклеазы. Таким способом удалось получить препараты Escherichia coli, Bacillus cereus var. mycoides и В. megaterium, позволившие сделать вывод, что у бактерий существуют особые образования, сходные с ядром. Их называют хроматиновыми тельцами, нуклеоидами или эквивалентами ядра (рис. 2.7 и 2.8).
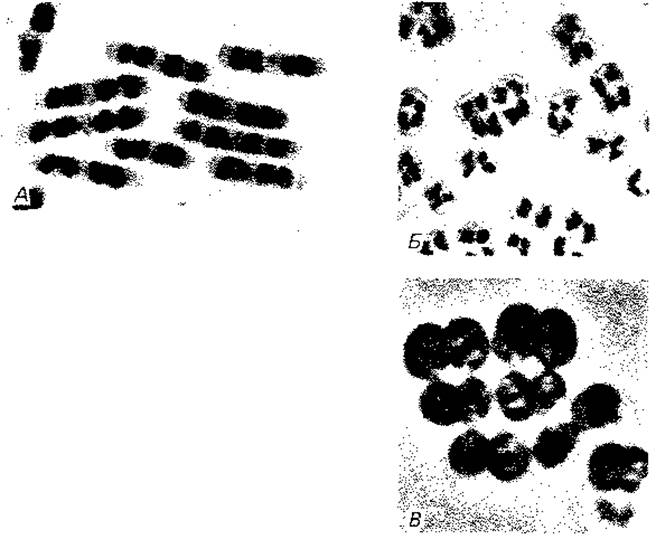
Рис. 2.7. Ядерные структуры бактерий. А. Bacillus cereus. Б и В. Micrococcus radiodurans, штамм «Sark». Два первых снимка в светлом поле после окраски по Гимза; третий снимок - фазовый контраст. (Фото C. F. Robinow.)
К решению вопроса о структуре бактериального ядра удалось приблизиться только благодаря электронной микроскопии ультратонких срезов через бактериальную клетку. Для получения оптимальной картины нативной тонкой структуры клеточного ядра решающее значение имела надлежащая фиксация (с помощью четырехокиси осмия, уранил- ацетата или фосфорновольфрамовой кислоты) в совершенно определенных условиях. Область ядра (нуклеоплазма) в бактериальной клетке равномерно заполнена очень тонкими нитями (рис. 2.5). В электронном микроскопе она выглядит менее плотной, чем окружающая цитоплазма, содержащая рибосомы. Какой-либо мембранной структуры, отделяющей область ядра от цитоплазмы, выявить не удалось.
Радиоавтография. То, что ядерный материал состоит из ДНК и, например, у Escherichia coli представлен единственной нитью длиной около 1 мм, замкнутой в кольцо, впервые удалось показать Кэрнсу с помощью метода радиоавтографии. Для этого были использованы препараты клеток, вырашенных на среде с тимидином (предшественник тимина), меченным тритием (3Н). ДНК - единственное вещество в клетке, содержащее тимин. Если клетки, включившие 3Н в тимин, обработать лизоцимом или лаурилсульфатом на мембранном фильтре с целью вызвать их лизис, то можно получить радиоавтограф развернутой бактериальной хромосомы. Такие радиоавтографы (рис. 2.9) убедительно доказывают, что бактериальная ДНК имеет форму нити, замкнутой в кольцо. Эта нить в генетическом смысле соответствует группе сцепления и называется бактериальной хромосомой. Кроме того, радиоавтографы позволяют представить себе способ деления такой нити. На рис. 2.10 изображена ДНК бактериофага, выявленная другим методом.

Рис. 2.8. Электронные микрофотографии клеток Escherichia coli, обработанных ферментами. В клетках на верхнем снимке цитоплазма вместе с ее РНК разрушена воздействием рибонуклеази и пепсина; сохранились только клеточные стенки и нуклеоиды (ядра). Клетки на нижнем снимке были последовательно обработаны рибонуклеазой, дезоксирибонуклеазой и пепсином; в результате разрушены и нуклеоиды, так что видны только пустые клеточные стенки. Такая последовательная дифференцирующая обработка ферментами показывает, что темные области (на верхнем снимке) соответствуют нуклеоидам (ДНК). (Peters D., Wigand R., Z. Naturforsch., 8b [1953], 180.)

Рис. 2.9. Радиоавтографы делящихся хромосом Escherichia coli. Клетки на протяжении двух генераций росли в присутствии тимина, меченного тритием, а затем были разрушены лизоцимом; объяснение см. в тексте. (Bleeckens S., Strohbach G., Sarfert E., Z. allg. Microbiol., 6 [1966], 121.)
Структура ДНК. Дезоксирибонуклеиновая кислота (ДНК) - макромолекула. При кислотном гидролизе она расщепляется на свои структурные элементы - дезоксирибозу, фосфорную кислоту и азотистые основания в эквимолярных соотношениях. В состав ДНК входят четыре различных основания: два пуриновых (аденин и гуанин) и два пиримидиновых (цитозин и тимин).

Рис. 2.10. Молекулы ДНК бактериофага РМ2. Изображены молекулы в различном состоянии. Каждый клубок состоит из ccc-ДНК (covalently closed circular DNA, т. e. ковалентно замкнутой кольцевой ДНК). В результате облучения ультрафиолетом в некоторых молекулах произошел разрыв одной из цепей и получилась ос-ДНК (open circular DNA, т. е. открытая кольцевая ДНК), имеющая вид большого кольца с длиной контура 3,02 мкм. ДНК была распластана с помощью соединения четвертичного аммония и обработана уранилацетатом (позитивный контраст); темнопольная электронная микрофотография. (U. Hahn, Göttingen.)
Если произвести расщепление ДНК с помощью нуклеаз (ДНКазы I из поджелудочной железы или диэстеразы змеиного яда), то освобождаются 3’- или 5'-нуклеотиды. Эти дезоксирибонуклеотиды соединены в нуклеиновых кислотах в длинные цепи. В ДНК молекулы пентозы чередуются с молекулами фосфорной кислоты; с каждым сахаром связано одно из четырех оснований. Такая полинуклеотидная цепь не одинакова в обоих направлениях, т.е. обладает полярностью: на одном ее конце находится фосфатная группа в положении 5', а на другом-свободная гидроксильная группа в положении 3'.
Еще в 1950 г. Чаргафф установил ряд закономерностей: аденин присутствует в ДНК в том же количестве, что и тимин, а гуанин - в том же, что и цитозин (А = Т, G = С); сумма пуриновых оснований равна сумме пиримидиновых оснований; отношение (G + С)/(А + Т) может варьировать в широких пределах от вида к виду, но остается постоянным для данного вида.
Пространственное расположение отдельных компонентов (т.е. вторичная структура ДНК) было выяснено с помощью рентгеноструктурного анализа. Если вытянуть ДНК в нить и вращать ее в монохроматическом пучке рентгеновского излучения, а отклоняющиеся лучи проецировать на пленку с эмульсией, то можно получить дифракционную рентгенограмму. Рентгенограммы ДНК различного происхождения (из спермы, тимуса, бактериальных клеток и бактериофагов) оказались почти идентичными. Анализ таких рентгенограмм, произведенный Уилкинсом, показал, что пуриновые и пиримидиновые кольца располагаются под прямым углом к продольной оси полинуклеотидного тяжа; этот тяж должен быть спирально закручен вокруг центральной оси с шагом 3,4 нм. Исходя из данных о плотности, следовало предполагать, что спираль состоит более чем из одного тяжа.
Полученные результаты дали возможность Уотсону и Крику сформулировать (в 1953 г.) блестящую теорию о структуре ДНК. Согласно модели Уотсона-Крика, полинуклеотидные цепи закручены в двойную спираль вокруг воображаемой оси. Обе цепи скреплены водородными связями, соединяющими основания, которые обращены внутрь спирали (рис. 2.11) При этом если учесть расстояния и условия образования связи, то против каждого аденина должен находиться тимин, а против каждого гуанина-цитозин. На один виток спирали приходится около 10 пар оснований. Последовательность оснований в двух цепях по необходимости комплементарна. Направление цепей противоположно (5' → 3' и 3' → 5'). Длина хромосомы Escherichia coli составляет примерно 1,4 мм. Один микрометр одноцепочечной ДНК соответствует относительной молекулярной массе около 2∙106, или примерно 3000 пар оснований. Таким образом, хромосома Е. coli имеет молекулярную массу 2,9∙09.
Водородные связи, соединяющие А с Т и G с С, неодинаково прочны. Связи эти имеют в основном электростатическую природу. В их образовании участвуют ОН- и NH2-rруппы. О и N - сильно электроотрицательные элементы; они оттягивают электроны и сообщают связанному с ними водороду положительный заряд. Положительно заряженный атом водорода может притягиваться другими электроотрицательными группами с неподеленными парами электронов, и в этом случае образуется водородная связь. Прочность ее зависит от кислотности атома водорода и основности атома-акцептора. Водородные связи прочнее межмолекулярных сил Вандер-Ваальса: энергия связи может достигать 38 кДж (9 ккал) на 1 моль; в среднем это лишь не намного больше, чем энергия тепловых колебаний при 37°С. Как видно из рис. 2.11, между гуанином и цитозином имеются три, а между тимином и аденином - две водородные связи. Из-за малой энергии связи такие воздействия, как повышение температуры, незначительные изменения концентрации магния или добавление мочевины, могут приводить к большим изменениям и даже разрыву связи. При повышении температуры происходит разрыв водородных связей и расхождение полинуклеотидных цепей. Такое разрушение вторичной структуры ДНК сопровождается поглощением света (при длине волны 259 нм) (гиперхромным эффектом). Температуру, при которой прирост экстинкции достигает половины максимальной величины, называют точкой плавления (Тm). Точка плавления тем выше, чем больше в ДНК гуанина и цитозина - оснований, соединенных между собой тремя водородными связями. Поэтому точка плавления выделенной и очищенной ДНК (рис. 2.12) служит показателем, позволяющим легко определить относительное содержание в ней цитозина и гуанина. Содержание пар GC - это отношение суммы молей гуанина и цитозина к сумме молей всех четырех оснований в данной ДНК (в процентах).
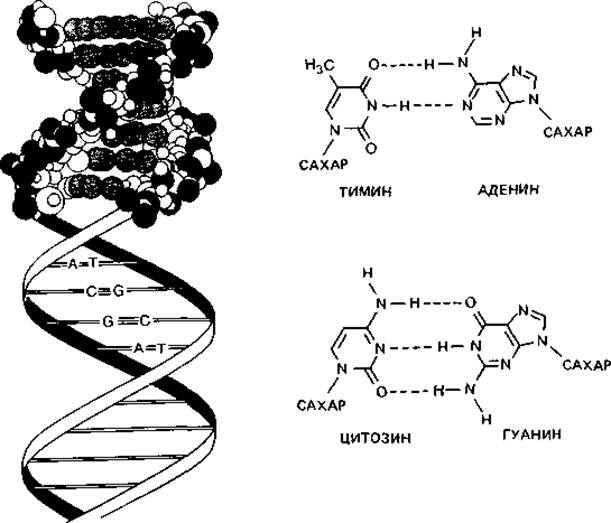
Рис. 2.11. Структура дезоксирибонуклеиновой кислоты (ДНК). Одиночные цепи ДНК соединены водородными связями. Слева - двойная спираль ДНК, вверху в виде модели из шариков, а ниже показано расположение оснований наподобие ступенек винтовой лестницы. Справа показано спаривание оснований - аденина с тимином и гуанина с цитозином. Пунктирными линиями представлены водородные связи.
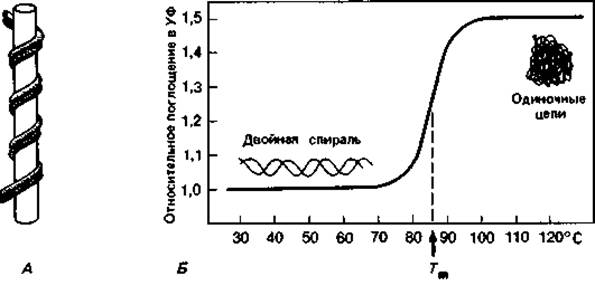
Рис. 2.12. А. Модель плектонемической двойной спирали. Ее можно получить, если обмотать вокруг стержня два сложенных вместе куска проволоки, а затем вынуть стержень. Две одиночные цепи переплетаются, и их можно разделить только путем раскручивания. Б. Кривая плавления бактериальной ДНК. Тm-температура, при которой экстинкция достигает половины максимальной величины.
По содержанию GC в ДНК бактерии очень сильно различаются между собой. Эта величина может варьировать в пределах от 30% (у некоторых стафилококков и представителей группы Cytophaga) до более чем 70% (у представителей рода Micrococcus и некоторых миксобактерий, образующих плодовые тела). Содержание GC видоспецифично и рассматривается как таксономический признак.
Репликация ДНК. ДНК содержит генетическую информацию клетки. Поэтому удвоение ДНК, всегда предшествующее клеточному делению, должно приводить к образованию двух совершенно идентичных хромосом. На первый взгляд этот процесс - идентичная редупликация, или репликация, ДНК-представляется очень простым: двум цепям достаточно только разойтись, чтобы вдоль каждой из одиночных полинуклеотидных цепей против комплементарных оснований начали выстраиваться свободные нуклеотиды, которым после этого останется лишь связаться между собой в цепь. Одна из главных трудностей состоит в том, как представить себе расхождение двух исходных цепей. Согласно данным рентгеноструктурного анализа, ДНК представляет собой плектонемическую, а не паранемическую двойную спираль (рис. 2.12, A). Для того чтобы выяснить, необходимо ли вообще раскручивание спирали, в качестве эвристических гипотез были рассмотрены три принципиально возможных способа репликации ДНК (рис. 2.13) (Дельбрюк и Стент, 1957):
1. Консервативный (сохраняющий) механизм. Раскручивания спирали не происходит; родительская двойная спираль служит матрицей для синтеза двух новых цепей. Дочерняя двойная спираль строится целиком из нового материала, а родительская как таковая сохраняется.
2. Дисперсивный механизм. Родительская спираль при удвоении разрывается на каждом полуобороте путем множественной фрагментации; синтез новых цепей происходит на фрагментах, которые затем крест-накрест сливаются с отрезками нового материала. Каждая полинуклеотидная цепь в этом случае должна была бы состоять из чередующихся отрезков старого и нового материала.
3. Полуконсервативный механизм. Родительская двойная спираль раскручивается, и на каждой полинуклеотидной цепи образуется новая комплементарная цепь. Таким образом, новая двойная спираль оказывается «гибридом» старой и вновь синтезированной цепей.
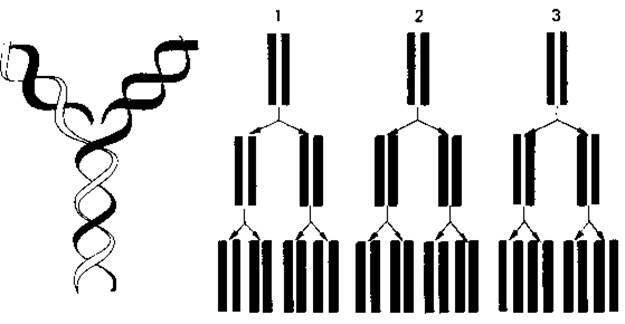
Рис. 2.13. Слева - модель полуконсервативного способа репликации ДНК. Справа схематически представлены три теоретически возможных механизма репликации ДНК: консервативный (1), дисперсивный (2) и полуконсервативный (3). Объяснение в тексте.
С целью выяснить, какая из этих трех возможностей соответствует действительности, Меселсон и Сталь провели эксперименты с использованием метки и последующим разделением меченой ДНК в градиенте плотности (рис. 2.14).
Если центрифугировать 6 М раствор хлористого цезия в течение многих часов при 100000 д, устанавливается градиент плотности (равновесие между действием центробежной силы и диффузией). Если этот раствор содержит ДНК, она скапливается в зоне, положение которой в градиенте соответствует ее удельному весу. ДНК, выделенная из бактерий, которые росли в присутствии 15NH4Cl, оказывается на 0,8% тяжелее обычной 14N-ДНК. Поэтому такая ДНК образует в градиенте CsCl особую полосу. Бактерию Escherichia coli на протяжении многих поколений выращивали на 15N в качестве источника азота, так что ее ДНК содержала только 15N. Затем к питательной среде прибавляли в избытке 14N. До и после этого добавления брали пробы: экстрагировали ДНК и анализировали ее в градиенте плотности Csl. После одного деления клеток в среде с 14N вся ДНК имела промежуточную плотность («полутяжелая», или «гибридная», ДНК). Общее количество такой полутяжелой ДНК оставалось постоянным на протяжении нескольких поколений, тогда как количество легкой ДНК возрастало. Для доказательства того, что одна цепь полутяжелой ДНК действительно содержала 15N, а другая-14N, полутяжелую ДНК подвергали «плавлению» (нагревали до 100 °С) и быстро охлаждали. После этого в градиенте плотности CsCl появлялись две полосы, из которых одна была типична для одноцепочечной ДНК с 14N, а другая-для такой же ДНК с 15N.
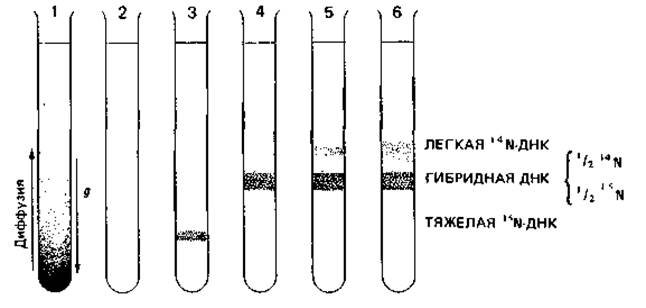
Рис. 2.14. Полуконсервативная редупликация ДНК. Схема опыта Меселсона и Сталя. Разделение ДНК, меченной 15N и 14N, путем центрифугирования в 6 М растворе CsCl. 1 - градиент плотности, возникший в результате установления равновесия между диффузией и действием силы тяжести; 2-ДНК из нормальных клеток, выросших в среде с 14NH4Cl; 3 - ДНК из клеток, росших в течение нескольких генераций в среде с 15NH4Cl; 4 - ДНК из клеток, меченных 15N, а затем росших в течение одной генерации в среде с 14NH4Cl; 5 - ДНК из клеток, меченных 15N, которые затем росли в течение двух генераций в среде с 14NH4Cl; 6 - ДНК из клеток, меченных 15N, а затем росших в течение трех генераций в среде с 14NH4Cl.
Результаты этих опытов не совместимы ни с консервативным, ни с дисперсивным механизмом репликации ДНК; они согласуются с представлением о полукоисервативном механизме. При репликации цепи раскручиваются и расходятся. На каждой одиночной цепи происходит синтез новой комплементарной цепи. В этом процессе участвуют ДНК-полимеразы. Функция их проста: они связывают между собой нуклеотиды, расположившиеся путем спаривания оснований в правильном порядке, и таким образом синтезируют новую полинуклеотидную цепь. Биохимические механизмы показаны на рис. 2.15 и поясняются в подписи к этому рисунку. С подробностями можно ознакомиться в учебниках по молекулярной биологии.
Синтез одной полинуклеотидной цепи таким способом объяснить нетрудно: ДНК-полимераза способна непрерывно связывать нуклеотиды по направлению от 5' к 3'-концу. Но так как двойная спираль ДНК антипараллельна, синтез второй, противолежащей цепи должен происходить в обратном направлении. Эти соображения и экспериментальные данные привели к представлению, которое иллюстрируют схемы на рис. 2.16. Вероятно, сначала образуются только короткие (длиной около 1000 нуклеотидов) отрезки-так называемые фрагменты Оказаки. Их синтез начинается с образования короткой цепи РНК, которая служит «затравкой» (праймером). Затем с помощью ДНК-полимеразы синтезируется цепь ДНК, примыкающая к РНК, длиной в 1000-2000 нуклеотидов. В конце концов РНК-праймер удаляется, разрыв заполняется при участии другой полимеразы, и все отрезки соединяются при помощи лигазы. Такой механизм посегментного синтеза полинуклеотидов позволяет объяснить репликацию второй цепи ДНК. Возможно даже, что таким способом реплицируются обе цепи.
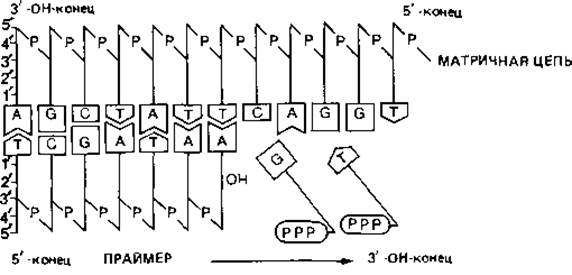
Рис. 2.15. Функционирование ДНК-полимераз. Двойная спираль ДНК состоит из двух полинуклеотидных цепей противоположной полярности (они «антипараллельны»). Если «свободная», не связанная с соседним нуклеотидом 3'-ОН группа находится у одной цепи на левом конце, то в другой цепи такая же группа находится на правом конце. Репликация ДНК катализируется ДНК-полимеразами. Для функционирования такого рода ферментов необходимы: 1) матрица, которая представляет собой одиночную цепь ДНК, 2) праймер-короткий отрезок реплицированной нуклеиновой кислоты и 3) смесь дезоксинуклеозид-5'-трифосфатов. ДНК-полимеразы способны присоединять свободные нуклеотиды только к свободному 3'-ОН-концу нуклеотидной цепи. Таким образом, синтез протекает только в направлении 5' → 3', но не наоборот.
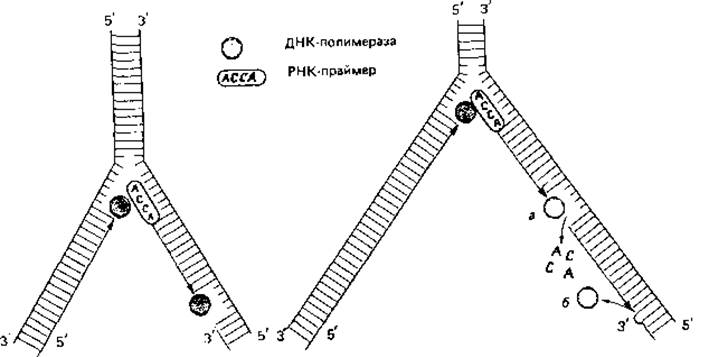
Рис. 2.16. Репликация двухцепочечной ДНК. При деспирализации ДНК возникает промежуточная разветвленная структура (репликативная вилка). Обе одиночные цепи ДНК имеют противоположную полярность (5' → 3' и 3'→ 5'). ДНК-полимеразы способны катализировать синтез только в одном направлении (5' → 3'). Поэтому синтез одной цепи может происходить непрерывно в направлении продвигающегося раскручивания двойной спирали. Другая же цепь должна синтезироваться в обратном направлении. Синтез начинается с образования короткого отрезка РНК, служащего «затравкой» (праймером) (у бактериофага Т7 это основания А-С-С-А). Затем ДНК-полимераза осуществляет синтез цепи ДНК длиной в 1000-2000 нуклеотидов, примыкающей к этой РНК. В конце концов РНК-праймер удаляется экзонуклеазой, брешь заполняется ДНК-полимеразой (а) и закрывается ДНК-лигазой (б). Такой механизм «дробного», или «прерывистого», синтеза ДНК с последующим связыванием отдельных отрезков позволяет объяснить репликацию ДНК на антипараллельной цепи.
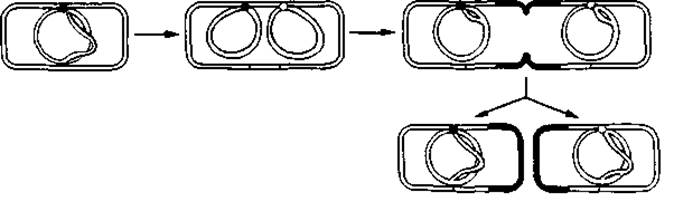
Рис. 2.17. Репликация кольцевой бактериальной хромосомы и деление бактериальной клетки. В этой схеме предполагается однонаправленный механизм репликации ДНК, т. е. механизм с участием только одной репликативной вилки.
На рис. 2.17 показано, как можно представлять себе репликацию бактериальной хромосомы и деление бактериальной клетки; в данной схеме предполагается, что репликация всего кольца ДНК происходит в одном направлении.
Оказалось, однако, что синтез обеих новых цепей может идти не только в одном направлении, но и сразу в обе стороны от точки инициации. Такой механизм предполагает раскручивание двойной спирали сразу в двух местах - с образованием двух разветвлений репликационных вилок на одной молекуле ДНК. Удвоение хромосомы у Е. coli занимает примерно 40 мин. Между тем эта бактерия при благоприятных условиях делится со временем удвоения порядка всего лишь 20 мин. Этот факт можно объяснить тем, что обе дочерние хромосомы, по имеющимся данным, начинают новый цикл деления еще до того, как заканчивается предыдущий. О механизме репликаций ДНК получено гораздо больше детальных сведений, чем можно было здесь изложить. Между механизмами репликации фагов, плазмид и бактериальных хромосом существуют значительные различия. Для углубленного изучения этих вопросов следует обратиться к литературе по молекулярной биологии.
Размеры генома и число геномов. Величина генома у бактерий варьирует от вида к виду в пределах от 0,8 до 8∙106 пар оснований. Число геномов в клетке тоже может быть у разных видов различным и зависит к тому же от условий культивирования. В периодической культуре растущие клетки Escherichia coli имеют от 2 до 4, Azotobacter chroococсиm - от 20 до 25 и Desulfovibrio gigas - от 10 до 15 геномов на одну клетку. (Для сравнения приведем размеры геномов эукариот: у Neurospora crassa 19∙106, у Aspergillus niger 40∙106, у человека 2,9∙109и у Zea mays 7∙109 пар оснований.)
ДНК/ДНК-гибридизация: гомологичные последовательности нуклеотидов в ДНК разных видов. Как мы уже говорили, при нагревании изолированной ДНК две полинуклеотидные цепи расходятся в результате разрыва водородных связей. Такая денатурация (или «плавление»), приводящая к образованию одиночных цепей, обратима: при очень медленном охлаждении препарата будет происходить спаривание и реассоциация комплементарных участков. Если смешать короткие фрагменты денатурированных ДНК, полученных из двух различных, но близких между собой видов бактерий, при температуре выше точки их плавления и затем медленно охладить смесь, тоже будет происходить реассоциация. Двойные спирали, образовавшиеся из одиночных цепей ДНК двух разных организмов, называют гетеродуплексными молекулами. Для того чтобы в эксперименте можно было проследить за образованием гетеродуплексов, нужно, конечно, пометить ДНК одной из бактерий тяжелым или радиоактивным изотопом.
Если, например, вырастить культуру одной из бактерий на тяжелой воде (D2O), то у нее будет «тяжелая» ДНК, и тогда образование гетеродуплекса можно будет выявить путем центрифугирования в градиенте плотности CsCl - так же, как в опыте Меселсона и Сталя было доказано образование 14N/15N-гибридной ДНК. Можно, однако, пометить ДНК одного из партнеров, выращивая его на среде с 14С или с 32Р. Если теперь смешать длинные отрезки денатурированной ДНК (из непомеченной 14С бактерии А) с короткими отрезками денатурированной ДНК (из помеченной 14С бактерии В), медленно охладить смесь и провести ее через фильтр, задерживающий длинные цепи, но пропускающий короткие, то на фильтре останутся молекулы гетеродуплекса. Оставшаяся на фильтре радиоактивность будет тем выше, чем больше радиоактивных отрезков (В) связалось с A-цепями, т. е. она будет зависеть от того, идентичны ли (либо очень сходны) последовательности оснований ДНК А и В или же они совсем различны. Таким образом, реассоциация ДНК/ДНК дает возможность определять степень гомологии последовательностей ДНК разного происхождения. Контрольный опыт проводят с молекулами ДНК из одних и тех же бактерий (одну пробу метят, другую не метят) и произвольно принимают степень реассоциации за 100. Степень реассоциации молекул ДНК из различных штаммов выражают затем в процентах от этой величины. Рутинные методы определения гомологии между ДНК различных штаммов бактерий многократно видоизменялись, но все они основаны на том же принципе образования гетеродуплексов; во всех случаях необходимо пометить одного из партнеров.
Гомологичность ДНК, т. е. совпадение последовательности оснований в молекулах ДНК двух разных штаммов бактерий, тем больше, чем ближе родство этих штаммов между собой. Этот способ оправдал себя при сравнении близких штаммов и видов; между родами же, находящимися между собой в отдаленном родстве, степень гомологии ДНК слишком мала, чтобы можно было выявить образование гетеродуплексов. Одноцепочечная ДНК может реассоциировать и с РНК. Поэтому описанные методы позволяют также оценивать гомологию между ДНК и РНК.
Плазмиды. Многие бактерии наряду с хромосомной ДНК содержат и внехромосомную ДНК, тоже представленную двойными спиралями, замкнутыми в кольцо. Эти автономно реплицирующиеся элементы ДНК называют плазмидами (см. подраздел «Плазмиды» в разд. 15.3.2).
2.2.2 Цитоплазма и мембраны
Цитоплазма отделена от клеточной стенки плазматической мембраной. В цитоплазме находятся различные включения (пузырьки, гранулы) и ядро. Как показали электронно-микроскопические и биохимические исследования, цитоплазма - не гомогенный раствор белка; она содержит многочисленные мембраны и разного рода мембранные структуры, а остальное пространство занимают жидкая фаза и рибосомы. Многочасовым центрифугированием при 100 000 д можно разделить разбавленную водной средой цитоплазму на «растворимую» фракцию, содержащую главным образом растворимые ферменты и растворимую рибонуклеиновую кислоту (РНК), и фракцию частиц, в которую наряду с мембранами в первую очередь входят рибосомы. Растворимые ферменты катализируют множество различных реакций распада и синтеза. Растворимые рибонуклеиновые кислоты [матричные (мРНК) и транспортные (тРНК)] и рибосомы участвуют в синтезе белка.
Белки. Белки состоят из аминокислот, соединенных в определенной последовательности пептидными связями в полипептидные цепи. Эти цепи имеют совершенно определенную пространственную конфигурацию (конформацию), которая стабилизируется дополнительными связями - ковалентными и нековалентными (рис. 2.18). В зависимости от роли, которую играют в поддержании структуры те или иные связи, различают несколько структурных уровней. Первичная структура белка определяется числом и последовательностью ковалентно связанных аминокислот. Полипептидная цепь благодаря водородным связям, образующимся между кислородными атомами карбонильных групп и азотными атомами амидных групп, приобретает вторичную структуру; она может образовать спиральную конфигурацию (а-спираль) или конфигурацию так называемого складчатого слоя. Третичной структурой называют определенное пространственное расположение пептидной цепи, обусловленное взаимодействием между различными ее боковыми группами. В поддержании третичной структуры участвуют другие водородные связи, ионные связи и неполярные (гидрофобные) взаимодействия. Поперечные связи, соединяющие различные участки полипептидной цепи, могут быть и ковалентными; таковы, например, дисульфидные связи, образующиеся при окислении SH-групп. И наконец, благодаря взаимодействиям нескольких полипептидных цепей могут возникать надмолекулярные агрегаты. Такое строение (при котором белок состоит из определенного числа полипептидных цепей, или субъединиц) называют четвертичной структурой. При физиологических условиях белок находится в водной фазе. Поэтому между белками и диполями воды тоже имеет место взаимодействие. Полярные группы гидратированы. Факторы, вызывающие изменение заряда белков (концентрации ионов Н +, Ca2 +, Mg2 +, К + и др.), неизбежно влияют также на степень гидратации, а тем самым и на степень набухания белков.
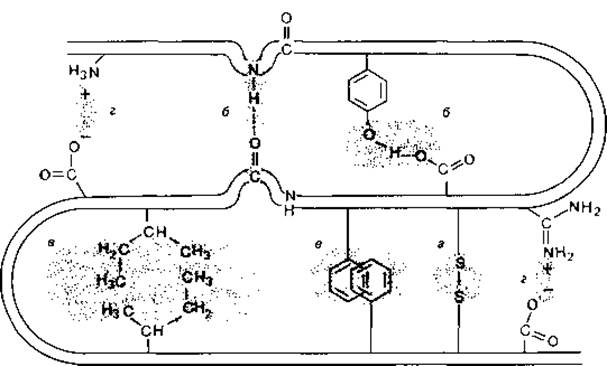
Рис. 2.18. Возможные внутримолекулярные связи между различными участками полипептидной цепи, а - ковалентные дисульфидные связи; б - водородные связи; в - неполярные (гидрофобные) взаимодействия; г - ионные связи. [Lynen F., Naturw. Rdsch., 23, [1970], 266.]
Рибосомы. Рибосомы служат местом синтеза белка. На электронных микрофотографиях они видны как частицы, лежащие в цитоплазме. Рибосомы бактерий имеют размеры 16x18 нм. Примерно 80-85% всей бактериальной РНК находится в рибосомах. Так как интактные рибосомы бактерий при ультрацентрифугировании оседают со скоростью, составляющей около 70 единиц Сведберга (S), их называют 70S-pибocoмами. Цитоплазматические рибосомы эукариот, за немногими исключениями, несколько крупнее, и их называют 80S-рибосомами.
Рибосомы состоят из двух субчастиц; у бактерий это субчастицы 30S и 50S (рис. 2.19), образующие 708-рибосомы. По величине и многим другим особенностям рибосомы бактерий сходны с рибосомами митохондрий и хлоропластов. Бактериальная клетка содержит примерно от 5000 до 50000 рибосом; число их тем больше, чем быстрее растет клетка. Во время активного синтеза белков на электронных микрофотографиях тонких срезов клетки можно видеть правильные цепочки рибосом. Это рибосомы, связанные наподобие бус на цепи мРНК; их называют полирибосомами или полисомами.
Различия между рибосомами бактерий (70S) и эукариот (80S) имеют решающее значение для борьбы с инфекционными болезнями; некоторые антибиотики частично или полностью подавляют синтез белка, протекающий на рибосомах 70S, но не затрагивают функции рибосом 80S (разд. 6.6).
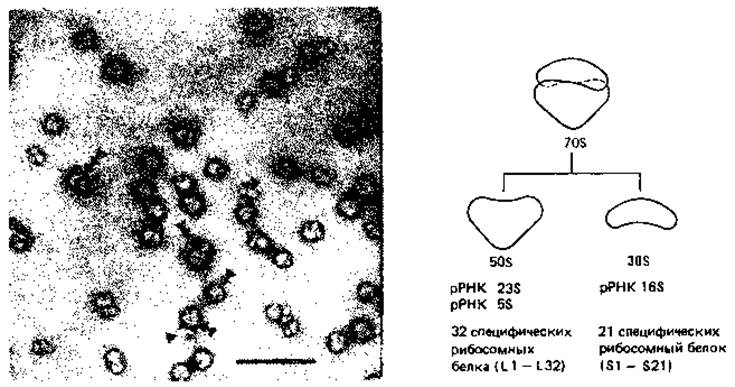
Рис. 2.19. Рибосомы бактерий. Слева - электронная микрофотография рибосом из Е. coli. Интактные рибосомы 70S помечены тремя треугольниками, субчастицы 50S - двумя, а субчастицы 30S - одним. Масштабный отрезок 100 нм. (Фото Е. Spiess.) Справа - схема построения рибосомы из субчастиц и данные об их составе.
Структура РНК. Рибонуклеиновые кислоты отличаются от ДНК как мономерами, из которых они построены, так и вторичной структурой. Центральная ось полинуклеотидной цепи состоит из рибозы и фосфорной кислоты. Из оснований представлены те же аденин, гуанин и цитозин, но вместо тимина имеется урацил. Кроме того, РНК содержит несколько редких оснований (например, псевдоурацил). РНК в клетках присутствует в одноцепочечной форме; только в отдельных участках цепи основания могут быть спарены.
Плазматическая мембрана. На электронных микрофотографиях ультратонких срезов бактерий, фиксированных четырехокисью осмия, плазматическая мембрана представляется многослойной. Она состоит из двух осмиофильных и потому темных слоев толщиной 2-3 нм каждый и промежуточного более светлого слоя толщиной 4-5 нм. По своему строению мембраны бактериальных, животных и растительных клеток очень сходны. Это дает основание говорить об универсальной «элементарной мембране» («unit membrane»).
Мембраны можно выделить, подвергнув осмотическому шоку протопласты, полученные с помощью лизоцима. Мембрана богата липидами, в особенности фосфолипидами (табл. 2.1). Составляя всего 8-15% сухого вещества клетки, мембраны содержат 70-90% всех ее липидов.
Плазматическая мембрана состоит из двойного липидного слоя. Гидрофобные концы молекул фосфолипидов и триглицеридов направлены внутрь, а гидрофильные «головки» - наружу. Благодаря гидрофобным взаимодействиям между остатками жирных кислот, входящих в состав липидов, и электростатическому взаимодействию между гидрофильны-
Таблица 2.1. Состав мембран Micrococcus luteus (lysodeikticus) и фототрофных бактерий
|
Компоненты |
Содержание, % от сухой массы мембран |
|
|
М. luteus |
Пурпурные бактерии |
|
|
Липиды |
28-37 |
40-50 |
|
нейтральные |
9 |
10-20 |
|
фосфолипиды |
28- |
30 |
|
Белки |
50 |
50 |
|
Гексозы |
15-20 |
5-30 |
ми «головками» мембрана стабилизируется. В двойной слой липидов встроены белки - так называемые интегральные белки мембран. Они «плавают» в этом слое, будучи погружены в него частично, или же пронизывают его насквозь. Другие белки прикреплены к поверхности мембраны, и их называют периферийными белками (рис. 2.20). Некоторые мембраны, по-видимому, с одной или с обеих сторон покрыты сетью вытянутых белковых молекул.
Мембрану следует представлять себе как очень мягкое, пластичное, почти жидкое образование; изолированные мембраны стремятся образовать замкнутые со всех сторон пузырьки (везикулы); кусочки мембран сливаются краями друг с другом.
Плазматическая мембрана играет важнейшую роль в обмене веществ. Она служит осмотическим барьером клетки и контролирует как поступление веществ внутрь клетки, так и выход их наружу. В мембране имеются механизмы активного транспорта и системы субстрат-специфичных пермеаз. По-видимому, липидная пленка элементарной мембраны пронизана «мостиками» (или каналами) из белков, и именно эти белки служат порами, через которые осуществляется регулируемый транспорт веществ.
Ферменты переноса электронов и окислительного фосфорилирования, находящиеся у эукариот в митохондриях, у бактерий локализуются внутри или на поверхности плазматической мембраны. Цитохромы, железо-серные белки и другие компоненты электрон-транспортной цепи находятся исключительно в мембранах. Как показало детальное изучение локализации отдельных компонентов, мембрана построена асимметрично: например, цитохром с расположен в ее наружном слое, а ATP-синтаза на внутренней стороне мембраны. Мембрана характеризуется направленным обменом веществ (разд. 7.4). По-видимому, мембраны ответственны и за другие биосинтетические процессы, такие как синтез компонентов клеточной стенки и капсулы, а также за выведение внеклеточных ферментов. Наконец, весьма вероятно, что на мембране локализуется центр репликации РНК. Жгутики тоже прикреплены к плазматической мембране.
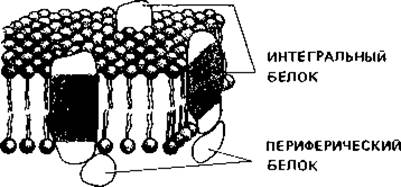
Рис. 2.20. Модель структуры плазматической мембраны. В двойной слой липидов погружены интегральные белки. Периферические белки только примыкают к поверхности мембраны.
Рис. 2.21. Мезосомы. А. Lactobacillus fermentum, электронная микрофотография ультратонкого среза после фиксации четырехокисью осмия и дополнительного контрастирования уранилацетатом. (Фото F. Schötz.) Б. Lactobacillus viridescens (syn. corynoides) с плотно упакованными трубочками, лежащими параллельно или перпендикулярно к плоскости среза, (F. Schötz, J. G. Abo-Elnaga, О. Kandier, Z. Naturforsch., 20 [1965], 790.) В. Неидентифицированная бактерия (штамм 11х), электронная микрофотография, негативный контраст (фосфорновольфрамовая кислота). (Фото Р. Hillmer, F. Amelunxen.)
Внутриклеточные мембраны и ламеллы. У некоторых бактерий мембрана охватывает цитоплазму без складок и впячиваний. У других она образует впячивания, пронизывает цитоплазму или формирует мембранные тельца. У ряда бактерий описаны мезосомы (рис. 2.21). Правда, в этом случае, вероятно, речь идет об артефактах, связанных с приготовлением препаратов.
У Nitrobacter, Nitrosomonas и N itrosococcus имеются стопки ламелл, состоящие из параллельно расположенных плоских пузырьков, часть которых связана с плазматической мембраной (рис. 2.22 и 2.24).
Особенно богаты внутриклеточными мембранами фототрофные пурпурные бактерии. На ультратонких срезах фотосинтетические внутренние мембранные системы имеют у них вид трубок, пузырьков или стопок. У Rhodospirillum rubrum или Chromatium клетка почти целиком заполнена пузырьками, которые упакованы в округлые образования (рис. 2.23). Эти пузырьки, по-видимому, возникают путем впячивания Хр - хроматофоры; S - включения серы. (Фото A-G. Kran; Б-К. Eimhjellen; В-С.С. Remsen et al., J. Bacteriol., 95 [1968], 2374.) (инвагинации) плазматической мембраны и роста ее в форме рукава. На этом рукаве на равных расстояниях образуются перетяжки, и в результате получаются пузырьки, не отделенные полностью друг от друга. Только при разрушении и гомогенизации клеток эти пузырьки освобождаются, принимая вид изолированных структур, которые раньше иногда называли «хроматофорами». У других пурпурных бактерий пузырьки сильно уплощены и образуют упорядоченные стопки (рис. 2.23, 2.24); последние по аналогии со структурой хлоропластов зеленых растений называют стопками тилакоидов.
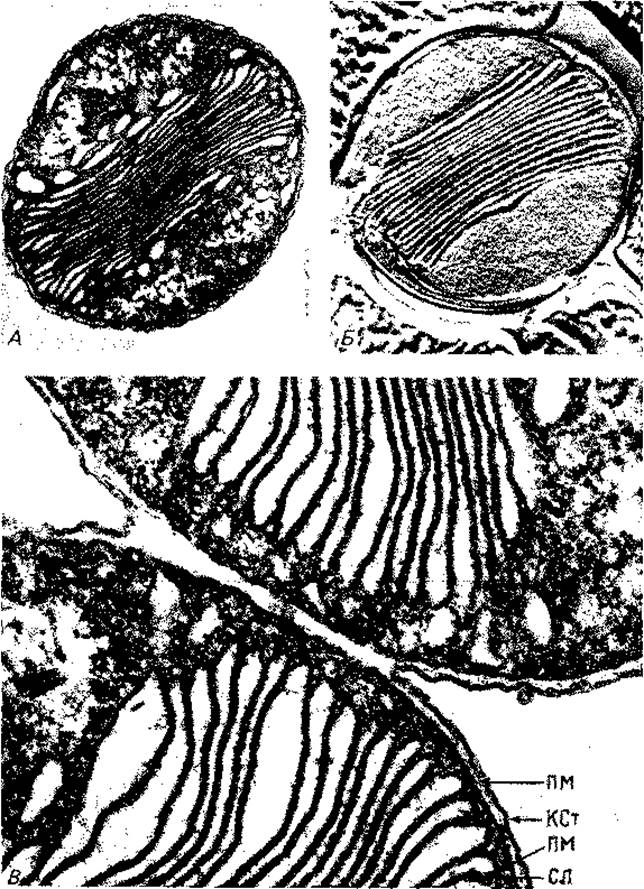
Рис. 2.22. Электронные микрофотографии нитрифицирующей морской бактерии Nitrosococcus oceanus: А и В - ультратонкие срезы (после фиксации OsO4 (22 000 х), Б - препарат, полученный методом замораживания-травления (81 000 x). (Remsen С. С., Valois F. W., Watson S.W., J. Bacteriol. 94 [1967], 422.) KCт - клеточная стенка; ПM - плазматическая мембрана; СЛ - сдвоенная ламелла.
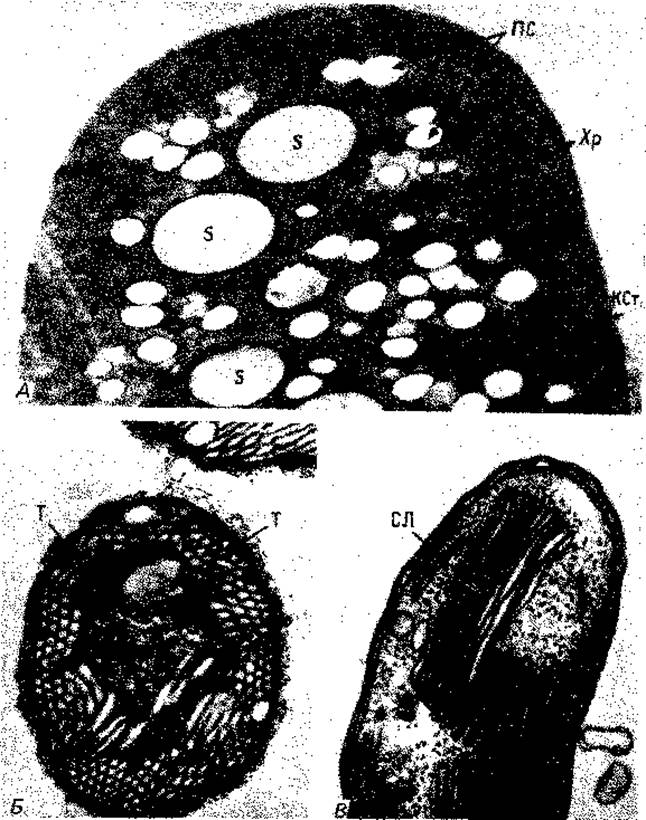
Рис. 2.23. Фотосинтетические пигменты у фототрофных пурпурных бактерий связаны с внутриклеточными мембранами. Увеличение поверхности мембран у различных видов бактерий достигается разными путями. У Chromatium okenii эти структуры имеют вид пузырьков, и их называют везикулами или хроматофорами (A). Thiocapsa pfennigii содержит тубулярные фотосинтетические мембраны (Б). У Ectothiorhodospira mobilis мембраны многократно сложены и образуют стопки ламелл (В). К Cт - клеточная стенка; ПС - полисахаридные гранулы; СЛ - стопки ламелл; Т - тубулярные фотосинтетические мембраны;

Рис. 2.24. Ectothiorhodospora mobilis со стопками фотосинтетических ламелл. Электронная микрофотография ультратонкого среза (150 000 х). ЛМ - плазматическая мембрана; Р - рибосомы; СЛ - стопка ламелл; 1 - наружный слой клеточной стенки; 2 -внутренний слой клеточной стенки; 3 и 4 - наружный и внутренний электронопрозрачные промежуточные слои.
Фотосинтетические мембраны сходны по строению и химическому составу с плазматической мембраной (табл. 2.1), но, кроме того, содержат пигменты, поглощающие свет (бактериохлорофиллы и каротиноиды), а также компоненты фотосинтетической электрон-транспортной цепи (цитохромы, убихинон) и фосфорилирующей системы.
2.2.3 Клеточная стенна
Клеточная стенка у бактерий не жесткая, как стальной панцирь, а тонкая и эластичная, как кожаная покрышка футбольного мяча. Подобно тому как мячу придает упругость надутая камера, клеточной стенке придает определенную упругость плотно прилегающий к ней изнутри протопласт. Внутреннее давление (тургор) обусловлено осмотическими факторами. Осмотическим барьером служит плазматическая мембрана: она полупроницаема и контролирует проникновение в клетку и выход из нее растворенных веществ. В отличие от плазматической мембраны клеточная стенка проницаема для солей и других низкомолекулярных соединений.
Плазмолиз. В обычных условиях концентрация сахаров и солей - осмотически активных веществ - внутри клетки выше, чем в окружающей среде. Содержимое клетки по осмотическому давлению эквивалентно 10-20%-ному раствору сахарозы, и в клетку поступает столько воды, сколько допускает растяжимость ее стенки. Если повысить осмотическое давление внешней среды (например, путем добавления сахаров или мочевины), вода будет оттягиваться из клетки. В конце концов протопласт сожмется и плазматическая мембрана отделится от клеточной стенки. Такой процесс, происходящий в гипертонической среде, называют плазмолизом. Именно явление плазмолиза у крупных бактериальных клеток позволяет нам убедиться в том, что плазматическая мембрана у них окружена клеточной стенкой. Как плазматическую мембрану, так и клеточную стенку окрашивает водорастворимый основной краситель виктория синий.
Окрашивание по Граму. Клеточная стенка, по-видимому, ответственна также за окрашивание по Граму. Способность или, наоборот, неспособность окрашиваться в темно-фиолетовый цвет при использовании метода, предложенного в 1884 г. Грамом, служит важным таксономическим признаком, с которым коррелируют другие свойства бактерий. Процедура окрашивания по Граму начинается с обработки фиксированных бактериальных клеток основным красителем кристаллическим фиолетовым. Затем следует обработка раствором иода. Иод образует с кристаллическим фиолетовым комплекс, нерастворимый в воде и плохо растворимый в спирте и ацетоне. После этого клетки «дифференцируют», обрабатывая их спиртом: грам-положительные клетки удерживают при этом комплекс краситель - иод и остаются синими, а грам-отрицательные обесцвечиваются. Для того чтобы сделать их видимыми, их дополнительно окрашивают контрастным красителем фуксином.
Если после окрашивания по Граму обработать грам-положительные клетки лизоцимом, протопласты остаются окрашенными, однако под действием спирта они обесцвечиваются. Прорастающие споры Bacillus subtilis и первые генерации клеток после прорастания спор ведут себя как грам-отрицательные организмы. Лишь позднее они становятся грам-положительными. Эти наблюдения показывают, что окрашивающий комплекс находится в протопласте или на его поверхности и что у грам-положительных бактерий его удерживает главным образом клеточная стенка, которая препятствует его экстрагированию.
Основной «каркас» стенки бактериальной клетки. Для понимания структуры клеточной стенки бактерий важно прежде всего указать на сходство ее опорного «скелета» с полимерами ß-D-глюкозы - целлюлозой и хитином.
Целлюлоза-главный компонент клеточных стенок у высших растений, водорослей и оомицетов. У бактерий целлюлоза в качестве материала клеточной стенки не встречается, однако она соединяет клетки Sarcina ventriculi в большие пакеты. Кроме того, целлюлозу выделяют Acetobacter aceti subsp. xylinum в форме тонких фибрилл в среду, и она придает пленке «уксусного гриба» («Mycoderma aceti») прочную кожистую консистенцию.
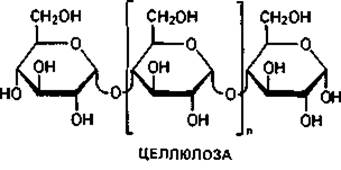
Хитин-материал наружного скелета членистоногих и некоторых других животных. Он является важнейшим компонентом клеточных стенок больших групп грибов (базидиомицетов, аскомицетов и зигомицетов). Структурными элементами хитина являются остатки N-ацетил- глюкозамина, соединенные между собой подобно глюкозным остаткам в целлюлозе, т. е. 1,4-гликозидными связями.
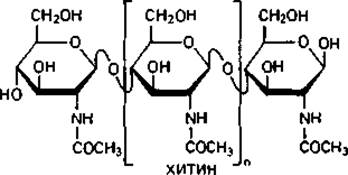
Опорный скелет бактериальной стенки тоже состоит в значительной степени из однородного полимера - пептидогликана муреина. Эта макромолекула-гетерополимер, построенный из цепочек, в которых чередуются остатки N-ацетилглюкозамина и N-ацетилмурамовой кислоты (N-ацетилглюкозаминлактата), соединенные между собой ß-1,4-гликозидными связями.
Такие неразветвленные гетерополимерные цепи образуют основу муреина. Остатки мурамовой кислоты через лактильные группы соединены пептидной связью с аминокислотами. К типичным аминокислотам муреина относятся L-аланин, D-глутаминовая кислота, мезо-диаминопимелиновая кислота или L-лизин и D-аланин. Диаминокислоты мезо- (или LL-) диаминопимелиновая кислота и L-лизин играют большую роль в межмолекулярных сшивках, так как образуют пептидные связи с участием обеих аминогрупп и, таким образом, могут связать две гетерополимерные цепи между собой (рис. 2.25). Место диаминопимелиновой кислоты или лизина могут занять орнитин или диаминомасляная кислота. Пептидными мостиками гетерополимерные цепи связаны между собой в мешкообразную гигантскую молекулу - муреиновый мешок.
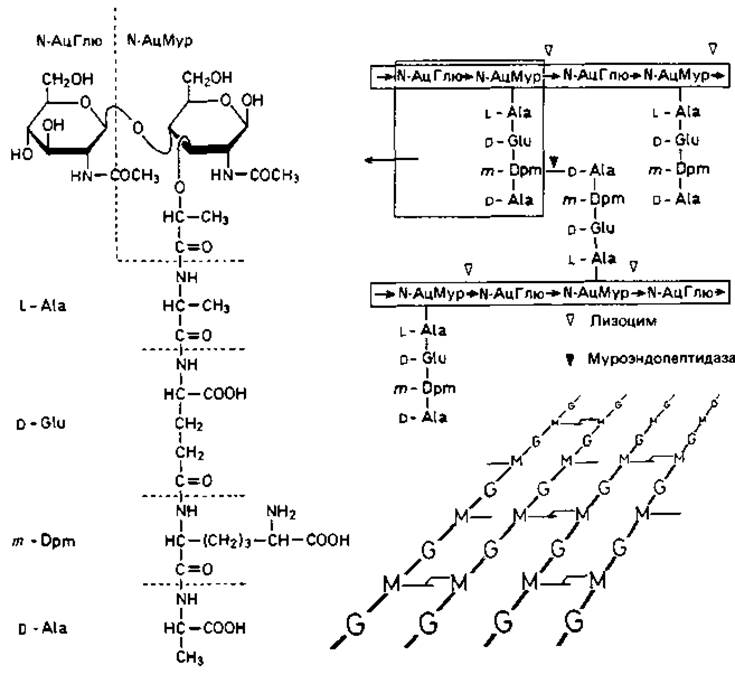
Рис. 2.25. Структура муреина Escherichia coli. Гетерополимерные цепочки, состоящие из чередующихся остатков N-ацетилглюкозамина (N-АцГлю) и N-ацетилмурамовой кислоты (N-АцМур), связаны между собой пептидными мостиками. Слева - детальное строение фрагмента, изображенного справа в рамке. Треугольниками отмечены связи, расщепляемые лизоцимом (мурамидазой) и специфической муроэндопептидазой. Справа внизу - схематическое перспективное изображение структуры однослойного поперечносшитого муреинового мешка, состоящего из N-АцГлю (G) и N-АцМур (М). m-Dpm - мезо-диаминопимелиновая кислота.
Классическая модель, согласно которой эти цепи образуют замкнутые кольца, которые в клеточной стенке палочковидной бактерии расположены как обручи или перпендикулярно к ним, явно несостоятельна. Скорее всего длина гетерополимерных цепей составляет не больше десятой части окружности бактерии. По-видимому, цепи, состоящие из 50-500 дисахаридных звеньев (N-ацетилглюкозамин + N-ацетилмурамовая кислота), связаны между собой пептидными мостиками и образуют менее регулярную сеть, чем предполагалось прежде.
Особого внимания заслуживает то, что в бактериальной стенке содержатся структуры и вещества, которых нет у животных и растений: таковы, например, чередующаяся последовательность N-ацетилглюкозамина и N-ацетилмурамовой кислоты; не встречающаяся в составе белков мезо-диаминопимелиновая кислота; D-формы аланина и глутаминовой кислоты. Эти структурные элементы составляют ахиллесову пяту бактерий, используемую врачами в борьбе с инфекцией. По компонентам и структуре клеточной стенки и биохимическим механизмам ее синтеза бактерии коренным образом отличаются от животных и растений. Поэтому лекарственные препараты, специфически воздействующие только на бактериальные стенки и на процесс их синтеза, должны быть безвредными для высших организмов.
Наличие в клеточных стенках пептидогликанового слоя - характерная особенность всех прокариот. Исключение составляют только архе-бактерии и немногие другие группы и виды.
Муреиновый мешок выполняет функцию опорного каркаса клеточной стенки. На нем откладываются и его инкрустируют различные другие вещества. По строению этого каркаса, а также по содержанию других веществ в клеточной стенке грам-положительные бактерии отличаются от грам-отрицательных.
Клеточная стенка грам-положительных бактерий. У грам-положительных бактерий доля муреиновой сетки составляет 30-70% сухой массы клеточной стенки (толщиной в 40 слоев). Вместо м - диаминопимелиновой кислоты часто содержатся LL-диаминопимелиновая кислота или лизин. У Staphylococcus aureus тетрапептидные боковые цепи мурамовой кислоты связаны между собой межпептидными (например, пента- глициновыми) цепочками. Участвующие в образовании таких структур аминокислоты варьируют от вида к виду. Видоспецифическое строение опорного каркаса представляет собой хороший таксономический признак. В клеточной стенке грам-положительных бактерий полисахариды, если они вообще имеются, связаны между собой ковалентно. Содержание белков невелико. Характерная особенность - наличие тейхоевых кислот; это цепи, состоящие из 8-50 остатков глицерола или рибитола, связанных между собой фосфатными мостиками. Некоторые из тейхоевых кислот содержат эритритол или маннитол. Тейхоевые кислоты, вероятно, через фосфат связаны с муреином по типу амида. Клеточная стенка грам-отрицательных бактерий. У грам-отрицательных бактерий муреиновая сеть однослойная (рис. 2.25) и составляет менее 10% сухой массы клеточной стенки (у Escherichia coli). Муреин содержит только мезо-диаминопимелиновую кислоту и не содержит лизина; межпептидные мостики отсутствуют. Строение муреинового мешка у всех грам-отрицательных бактерий одинаково. Наряду с этим опорным каркасом имеются большие количества липопротеинов, липополисахаридов и других липидов, которые как бы наклеены снаружи на муреиновый каркас. Они связаны ковалентно и составляют до 80% сухой массы клеточной стенки. Для сохранения стабильности липополисахаридного слоя, по-видимому, необходимы ионы кальция. У многих грам-отрицательных бактерий муреиновый слой становится доступным для воздействия лизирующего муреин фермента лизоцима только после обработки ЭДТА (этилендиаминтетраацетатом) для удаления Са2+. Этот комплексообразующий агент вызывает освобождение части липополисахаридов. Тейхоевые кислоты у грам-отрицательных бактерий до сих пор не были обнаружены.
Действие лизоцима и пенициллина. Структура клеточной стенки и муреина была выяснена в основном в связи с изучением действия лизоцима и пенициллина на бактерии. Открытый А. Флемингом (1922) лизоцим является бактерицидным ферментом, содержащимся в слезной жидкости, в носовой слизи и в яичном белке; лизоцим выделили также из бактерий (Escherichia coli, Streptomyces) и бактериофагов. При воздействии лизоцима на суспензию грам-положительных бактерий наблюдают быстрое ее просветление. Micrococcus luteus (lysodeikticus) лизируется уже при концентрации 1 мкг лизоцима на 1 мл. Для лизиса клеток Bacillus megaterium необходима концентрация лизоцима 50 мкг/мл, а многие грам-отрицательные бактерии растворяются только тогда, когда к суспензии добавлен также комплексообразующий агент (ЭДТА).
Лизоцим разрывает в муреине гликозидную связь между углеродом 1 N-ацетилмурамовой кислоты и углеродом 4 N-ацетилглюкозамина. При этом полисахаридные цепи расщепляются до дисахаридных фрагментов, состоящих из этих двух сахаров (рис. 2.25). Таким образом, лизоцим является N-ацетилмурамидазой.
Можно избежать полного разрушения бактериальных стенок, проводя лизис в изотоническом или слабо гипертоническом (0,1-0,2 М) растворе сахарозы. В этих условиях под действием лизоцима из клеток образуются чрезвычайно чувствительные к осмотическим условиям округлые «протопласты». В гипертонических и изотонических средах протопласты стабильны; в гипотонических средах они лопаются, после чего остаются лишь «тени» (остатки плазматических мембран). Протопластами следует называть только такие округлившиеся клетки, у которых нет никаких остатков клеточной стенки, т. е. нельзя обнаружить ни мурамовой кислоты, ни специфической аминокислоты клеточной стенки - диаминопимелиновой, не встречающейся в белках. Лизис клеточной стенки не приводит к нарушению метаболизма; протопласты дышат подобно интактным клеткам, образуют споры, если процесс споруляции уже был инициирован, но не адсорбируют фагов.
Наряду с лизоцимом существует много других ферментов, лизирующих муреиновый каркас. Муроэндопептидазы, чаще всего получаемые из бактерий, весьма специфическим образом расщепляют пептидные связи, участвующие в поперечной сшивке. Например, выделенная из Е. coli эндопептидаза разрывает связь между D-аланином и мезо-диамино- пимелиновой кислотой (отмеченную на рис. 2.25). Другие ферменты расщепляют связи в иных местах.
Антибиотик пенициллин действует главным образом на грам-положительные бактерии (стафилококки и пневмококки), а также и на некоторые грам-отрицательные клетки (гонококки, менингококки, энтеробактерии), убивая их. Однако его бактерицидному действию подвержены только растущие бактерии; нерастущие, «покоящиеся» клетки остаются незатронутыми. Самый примечательный феномен, наблюдаемый при воздействии пенициллина, - это появление так называемых L-форм, которые образуются из нормальных бактериальных клеток в результате несбалансированного роста в длину и в толщину. При этом исходные палочковидные клетки увеличиваются в объеме во много раз (см. разд. 3.19). На агаризованных питательных средах такие гигантские клетки могут некоторое время сохранять жизнеспособность. Если воздействовать пенициллином на растущие клетки в гипотоническом растворе, то они лопаются. В изо- и гипертонических средах палочки превращаются в шаровидные образования (рис. 2.26), получившие название L-форм или «сферопластов». Последние отличаются от протопластов тем, что сохраняют остатки клеточной стенки (анализ обнаруживает следы мурамовой и диаминопимелиновой кислот). Пенициллин нарушает процесс образования клеточной стенки.
Образование клеточной стенки. Биосинтез и встраивание структурных компонентов муреина в пептидогликановый скелет можно разделить на три этапа (рис. 2.27). Первые стадии биосинтеза осуществляются в цитоплазме. Здесь образуется пентапептид мурамовой кислоты. Синтез начинается с образования N-ацетилглюкозамин-1-фосфата; в ряде последовательных ферментативных реакций образуется лактиловый эфир, к которому присоединяются пять аминокислот. Во время этого процесса растущая молекула остается связанной с UDP (уридиндифосфатом), который служит носителем. Связывание пентапептида мурамовой кислоты с N-ацетилглюкозамином и присоединение пяти остатков глицина происходит на втором этапе синтеза на плазматической мембране. Для осуществления этого этапа гидрофильная молекула должна быть превращена в липофильную, что достигается путем замены UDP С55-полиизопреноидом ундекапренилфосфатом. Это соединение делает возможным перенос готового компонента клеточной стенки через плазматическую мембрану. На третьем этапе происходит его встраивание в пептидогликановый скелет и образование пептидных связей. Эта поперечная сшивка осуществляется путем транспептидирования, при котором расщепляется связь между двумя остатками D-аланила и освободившаяся карбоксильная группа связывается с аминогруппой лизина
второго олигопептида, а концевой D-аланин освобождается. При встраивании освобождается также ундекапренилдифосфат; он подвергается гидролизу, и получающийся ундекапренилмонофосфат используется в следующем цикле. Этот же липид служит переносчиком и при синтезе других полимеров, расположенных вне цитоплазматической мембраны, таких как полисахариды, липополисахариды и целлюлоза.

Рис. 2.26. Escherichia coli после обработки пенициллином (100 ед. на 1 мл питательной среды, 90 мин). 9000 х. (Фото Н. Frank.)
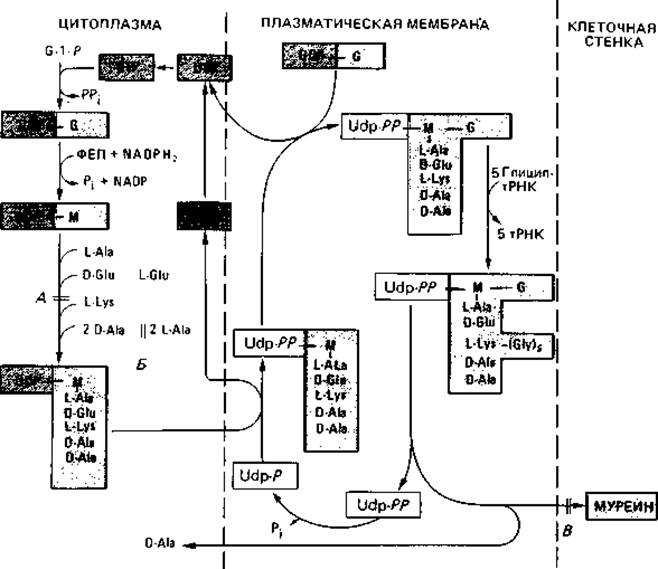
Рис. 2.27. Биосинтез муреина у Staphylococcus aureus. Три этапа синтеза разделены прерывистыми линиями. Они протекают в цитоплазме, на плазматической мембране и в клеточной стенке. G = N-АцГлю-N-ацетилглюкозамин; М = N-АцМур-N-ацетилмурамовая кислота; Удп - ундекапренил. Синтез клеточной стенки прекращается, если (А) отсутствует диаминокислота (лизин), (Б) рацемизация L-аланина в D-аланин и (или) его включение в пептид ингибированы С - циклосерином (оксамицином) или (В) пенициллин препятствует сшивке пептидных цепей.
Пенициллин не влияет на синтез структурных компонентов муреина но препятствует поперечной сшивке, осуществляемой путем транспептидирования; однако удлинению гетерополимерных цепей путем трансгликозилирования он не мешает. В результате воздействия пенициллина ряд бактерий выделяет в среду наряду с UDP-пентапептидом также и несшитые пептидогликановые цепи. Образование клеточной стенки могут нарушать и производные пенициллина; подобным же образом действуют цефалоспорины, ристоцетины, ванкомицин, бацитрацин и циклосерин. Сферопласты возникают также в присутствии глицина и D-аминокислот или в результате так называемого анаэробного лизиса.
Наружные слои клеточных стенок грам-отрицательных бактерий.
У этих бактерий поверх однослойного или самое большее двуслойного муреинового мешка располагается наружный слой клеточной стенки. На ультратонких срезах бактерий он сходен по виду с плазматической мембраной - это так называемая наружная мембрана. Этот слой стенки состоит из белков, фосфолипидов и липополисахаридов (рис. 2.28).
Со слоями муреина-по-видимому, через диаминопимелиновую кислоту - ковалентно связаны липопротеины; они ориентированы своими липофильными концами наружу и таким образом закреплены в липофильном двойном слое (благодаря гидрофобному взаимодействию). В этом слое находятся фосфолипиды и гидрофобные концы липополисахаридов; гидрофильные же концы последних обращены наружу.
Липополисахариды приобрели большое значение в бактериологической диагностике и в распознавании эпидемий. Разные штаммы Salmonella typhimurium, Shigella dysenteriae и другие возбудители кишечных заболеваний отличаются друг от друга так называемыми О-специфическими боковыми цепями липополисахаридов, образующими наружный слой клеточной стенки. Незначительные различия в составе этого слоя могут быть распознаны с помощью иммунологических методов. По серологическим реакциям в роде Salmonella удалось выделить более тысячи видов и штаммов. Химический анализ подтвердил существование различий, выявленных серологическими методами (Вестфаль). Есть местные расы сальмонелл, которые можно идентифицировать по иммунохимическим особенностям. Это часто позволяет установить, где произошло заражение больного или откуда начала распространяться эпидемия; можно, например, выяснить, где получил данный больной кишечную инфекцию - в южноамериканском или же в восточноазиатском городе.
Штаммы бактерий, выделенные из природного источника или от больного, обычно растут на агаре в форме гладких, блестящих колоний (S-формы, от англ. smooth); их поверхность благодаря наличию в ней О-слецифических полисахаридных цепей содержит много воды. Эти S- формы спонтанно превращаются в R-формы (от англ. rough), обычно образующие шероховатые плоские колонии (рис. 2.29). Очевидно, полисахаридные цепи дают бактериям определенное преимущество в процессе отбора. Например, в организме животного-хозяина бактерии могут быть устойчивы к фагоцитирующим лейкоцитам и поэтому крайне вирулентны. Только образование антител и связывание этих антител бактериальными полисахаридами создают условия для уничтожения бактерий. Огромное разнообразие О-специфических полисахаридов у патогенных бактерий можно объяснить отбором все новых мутантных типов О-антигенов; новые типы дают преимущество, так как хозяин не может обладать антителами против сотен антигенов одновременно. Липополисахариды относятся к наиболее действенным эндотоксинам бактерий, они вызывают у больных повышение температуры и понос.
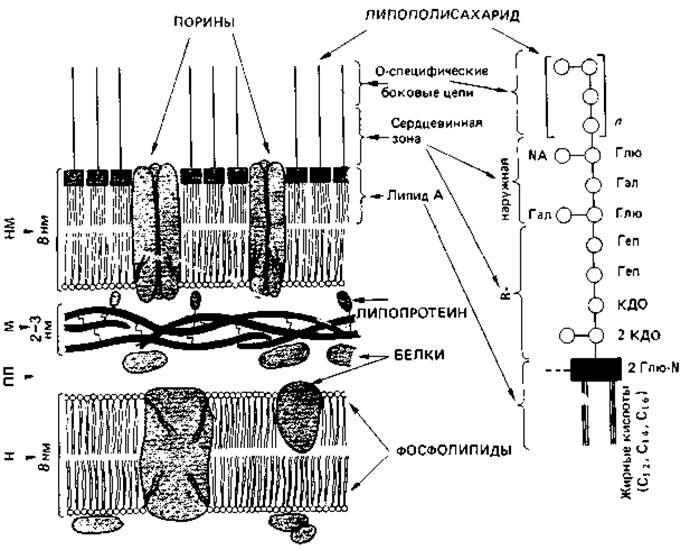
Рис. 2.28. Модель строения клеточной стенки грам-отрицательных бактерий. Непосредственно с цитоплазматической мембраной граничит муреиновый слой; с ним ковалентно связаны гидрофильные концы липопротеиновых молекул. Последние своими липофильными концами утоплены в липидный двойной слой, который содержит фосфолипиды и липид А, входящий в состав липополисахаридов. Гидрофильные О-специфические гетерополисахаридные боковые цепи полисахаридов направлены наружу (на схеме вверх). Справа представлена липополисахаридная молекула. Глю - глюкоза; Глю-N - глюкозамин; NA = N-АцГлю-N-ацетилглюкозамин; Гал - галактоза; Геп - гептоза; КДО-2-ке- то-3-дезоксиоктоновая кислота; М - муреин; НМ-наружная мембрана; ПМ - плазматическая мембрана; ПП - периплазматическое пространство.
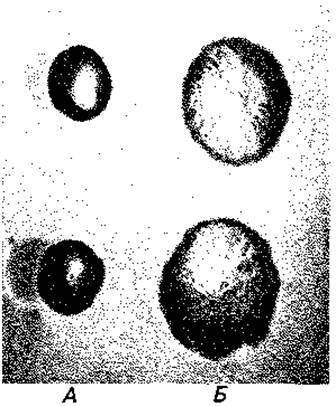
Рис. 2.29. Формы колоний бактерии Salmonella paratyphi В. А -S-форма; Б R-форма. (Фото Е. Kröger.)
Липополисахариды Salmonella typhimurium и других энтеробактерий были весьма основательно изучены. В молекуле липополисахарида следует различать три участка: липид А, сердцевинную область и О-специфическую боковую цепь (рис. 2.28). Липид А включает глюкозаминдисахарид, к гидроксигруппам которого присоединены эфирными связями жирные кислоты; эта часть молекулы обладает гидрофобными свойствами. Далее по направлению кнаружи находится R-сердцевинная зона-трисахарид, состоящий из трех остатков 2-кето-З-дезоксиоктоновой кислоты (КДО) и связанный также с фосфоэтаноламином; затем следуют две молекулы гептозы и наружная сердцевинная зона. Последняя состоит из разветвленной цепи, содержащей глюкозу, галактозу и N-ацетилглюкозамин. Эта базовая структура одинакова у всех сальмонелл. У R-мутантов молекула короче -она оканчивается трисахаридом КДО; мутанты, лишенные КДО, никогда не встречались - они, вероятно, нежизнеспособны. К сердцевинной зоне примыкают О-специфические боковые цепи; это длинные цепи из повторяющихся олигосахаридов, которые могут содержать галактозу, маннозу, рамнозу, абек- возу, фукозу, колйтозу и другие сахара в последовательности, варьирующей от штамма к штамму. Восстанавливающие С1-концы сахаров ориентированы внутрь. Наружная гетерополисахаридная цепочка штаммоспецифична и представляет (соматические) О-антигены (разд. 2.2.5). Она позволяет опознать штамм с помощью упомянутых выше иммунохимических методов.
Функция наружной мембраны. Наружная мембрана грам-отрицательных бактерий выполняет не только механические, но и важные физиологические функции. В ее двойной липидный слой, состоящий из липида А, полисахаридов и фосфолипидов, встроены белки, пронизывающие этот слой насквозь. Вероятно, эти трансмембранные белки представляют собой заполненные водой каналы - гидрофильные поры в липофильной мембране; поэтому их называют поринами. Существует несколько различных поринов. Они пропускают через мембрану гидрофильные низкомолекулярные вещества (вплоть до мол. массы порядка 6000).
Наружная мембрана плотно прилегает к муреиновому слою и связана с ним липопротеинами. Муреиновый слой, видимо, свободно проницаем для различных веществ. Промежуток между муреином и плазматической мембраной называют периплазматическим пространством. В нем находятся белки, в том числе деполимеразы (протеиназы, нуклеазы, например рестрикционный фермент EcoRI), периферические белки плазматической мембраны и так называемые связующие белки. Последние участвуют в переносе некоторых субстратов в цитоплазму и служат рецепторами хемотаксических стимулов. Периплазматическое пространство, по всей вероятности, играет также роль в осморегуляции.
2.2.4 Капсулы и слизь
На клеточные стенки многих бактерий наслаиваются снаружи более или менее толстые слои сильно оводненного материала с высоким содержанием воды - капсулы и слизь. Такие покровы не имеют для бактерий жизненно важного значения, но обладание капсулой придает некоторым патогенным бактериям резистентность к фагоцитозу и тем самым повышает их вирулентность для подопытных животных.
Капсулы. Капсулы можно увидеть с помощью светового микроскопа, если добавить к препарату такие красители, как нигрозин, конго красный или китайскую тушь, которые в капсулу не проникают. Получается негативное контрастирование; светлая капсула выделяется на темном фоне (рис. 2.30 и 2.31). Более тонкие капсулы пневмококков становятся видимыми при добавлении гомологичной антисыворотки; при этом происходит отложение белка антител. Наблюдаемая картина напоминает набухание («реакция набухания» Нейфельда). В большинстве случаев капсула состоит из полисахаридов (у Streptococcus mutans, S. salivarius, Xanthomonas, коринебактерий). Капсульные полисахариды помимо глюкозы содержат аминосахара, рамнозу, 2-кето-3-дезоксигалактоновую кислоту, уроновые кислоты и такие органические кислоты, как пировиноградная и уксусная. Капсулы некоторых видов Bacillus (В. anthracis, В. subtilis) состоят из полипептидов, в первую очередь полиглутаминовой кислоты.
Слизи. Многие компоненты капсулы выделяются в окружающую среду в виде слизи. Иногда путем встряхивания или гомогенизации бактериальной взвеси можно удалить капсулы с поверхности клеток и затем выделить слизь из питательной среды. Особенно обильное образование слизи наблюдается у многих микроорганизмов в тех случаях, когда среда содержит сахарозу. Известный пример - бактерия Leuconostoc mesenteroides (представитель гетероферментативных молочнокислых бактерий), которая быстро превращает раствор, содержащий тростниковый сахар, в декстрановый студень, за что ее на сахарных заводах называют «бактерией лягушачьей икры». Это превращение происходит вне клетки и катализируется внеклеточной гексозилтрансферазой - декстрансахарозой:
n Сахароза + (1,6-а-глюкозил)m → n Фруктоза + (1,6-а-глюкозил)m+n
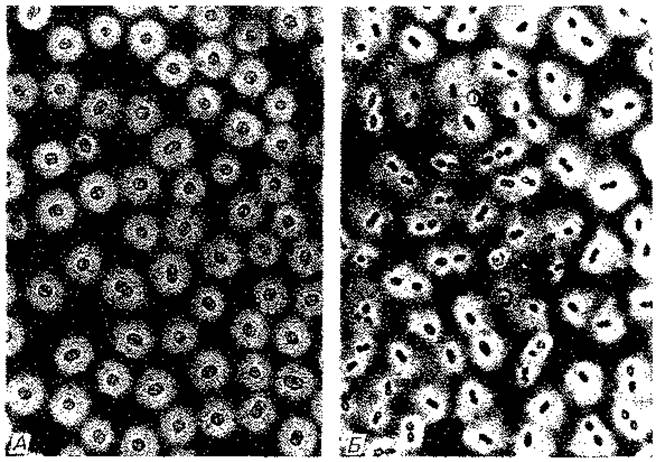
Рис. 2.30. Капсулы бактерий-пурпурной серобактерии Amoebobacter roseus (А) и азотфиксирующей бактерии Azotobacter chroococcus (Б). Клетки суспендированы в туши. (А - 1200 x; фото N. Pfennig. Б - 500 х; фото D. Claus.)
Декстран - это полисахарид, который состоит из остатков a-D-глюкозы, соединенных в положении 1,6; иначе говоря, это 1,6-а-глюкан. Параллельные полисахаридные цепочки связаны в единую сеть. Декстран входит в состав кровезаменителей, используется для повышения вязкости водных растворов и служит основой декстранового геля (сефадекса).
Рис. 2.31. Капсулы бактерий. Цепочки клеток Bacillus megaterium, суспендированные в туши. На темном фоне частичек туши капсулы выделяются как светлые зоны. Фазовый контраст, 1000 х. (Фото G. Bohlken, Diss., Göttingen, 1965.)
Стрептококки, вызывающие кариес (разрушение зубов), в том числе Streptococcus mutans и S. salivarius, выделяют другую гексозилтрансферазу, превращающую сахарозу в полифруктозы (леваны). Эти полисахариды откладываются на поверхности зубов и служат матриксом, в котором накапливаются кислые продукты брожения, вызываемого стрептококками, главным образом молочная кислота.
Влагалища (или чехлы). Влагалищами называют трубковидные чехлы нитчатых бактерий, называемых хламидобактериями (Sphaerotilus natans и Leptothrix ochracea). Они состоят из гетерополисахарида, содержащего глюкозу, глюкуроновую кислоту, галактозу и фукозу.
Направленное выделение слизи в форме стебелька обеспечивает некоторым бактериям (например, Gallionella ferrugineа) возможность ограниченного перемещения; слизь может также связывать отдельные клетки в длинные ленты (Zoogloea ramigera, рис. 2.32) или кожистые пленки (Bacteriogloeа). Acetobacter aceti subsp. xylinum выделяет целлюлозу, которая объединяет клетки в прочную кожистую пленку («Mycoderma aceti»).
Клетки Sarcina ventriculi (рис. 2.33) и Lampropedia hyalina склеиваются целлюлозой в агрегаты правильной формы. Целлюлоза в этих случаях служит связующим веществом и по своей структуре и функции отличается от веществ капсулы. Утрата способности к образованию целлюлозы в, результате мутации не влияет на способность микроорганизмов расти.
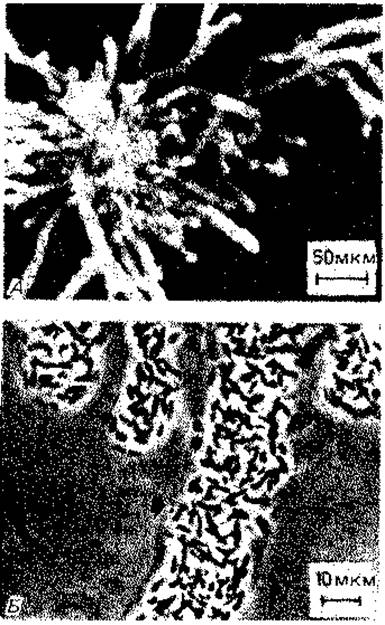
Рис. 2.32. Строение колоний Zoogloea ramigera. А - типичная форма колоний; Б - отдельные клетки в слизистом основном веществе. (Unz R. F., Dondero N. С., Canad. J. Microbiol., 13 [1967] 1671.)
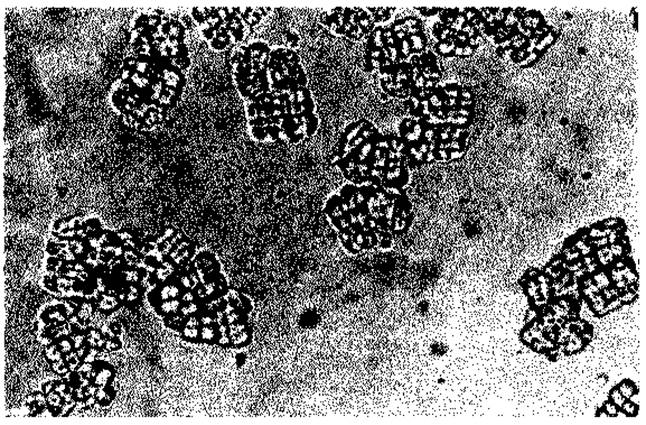
Рис. 2.33. Пакеты клеток Sarcina ventriculi, выросшие в питательной среде. (Снимок в светлом поле, 750 х; фото D. Claus.)
Биосинтез. Полисахариды, находящиеся снаружи от клеточной стенки, называют экзополисахаридами. По физическим свойствам различают капсулы и слизи. Когда экзополисахариды относительно прочно связаны с клеточной стенкой, говорят о капсулах; если же связь непрочная или ее вообще нет, говорят о слизи.
Что касается биосинтеза экзополисахаридов, то следует отметить два момента: 1) декстраны и леваны синтезируются внеклеточными ферментами из дисахаридов; 2) состав большинства экзополисахаридов независим от используемого субстрата - путь их биосинтеза сходен с механизмом построения муреина или липополисахаридов. Во всех трех процессах участвуют UTP и липид ундекапренилдифосфат (С55-полиизопреноид). Активированные уридинтрифосфатом сахара (UTP-caxapa) присоединяются к липиду-переносчику, комбинируются, образуя видоспецифические гомо- или гетерополимерные структурные компоненты будущего полисахарида, и выводятся из протопласта в наружные слои клеточной стенки, где связываются в макромолекулярный экзополисахарид.
2.2.5 Жгутики и подвижность
Подвижность бактерий может обеспечиваться различным образом. У большинства активно передвигающихся, плавающих бактерий движение обусловлено вращением жгутиков. Двигаться без жгутиков способны скользящие бактерии (к которым относятся миксобактерии, цианобактерии и некоторые другие группы) и спирохеты. О механизмах их движения будет сказано при рассмотрении соответствующих групп бактерий.
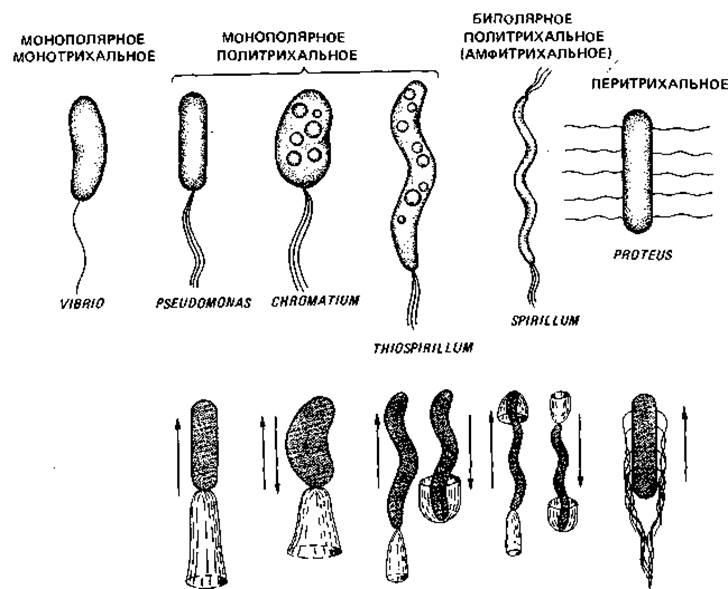
Рис. 2.34. Основные типы жгутикования и типы движения бактерий.
Расположение жгутиков. Расположение жгутиков у подвижных эубактерий - это признак, характерный для определенных групп, поэтому оно имеет таксономическое значение. У палочковидных бактерий жгутики могут прикрепляться полярно или латерально (рис. 2.34). Среди бактерий с монополярным жгутикованием лишь немногие снабжены только одним, но зато особенно толстым жгутиком - это монотрихи (Vibrio metschnikovii, рис. 2.35; Caulobacter sp.). У многих бактерий с монополярным и биполярным жгутикованием одиночный по виду жгутик в действительности представляет собой пучок из 2-50 жгутиков (политрихи). Монополярно-политрихальное расположение жгутиков называют также лофотрихальным (как у Pseudomonas, Chromatium), а биполярно-политрихальное - амфитрихальным (у Spirillum). У Selenomonas имеется один пучок жгутиков, прикрепленный сбоку (рис. 2.36, Б). При перитрихальном расположении (как у Enterobacteriaceae, Bacillaceae и некоторых других бактерий) жгутики располагаются по бокам клетки или на всей поверхности (рис. 2.36, А).
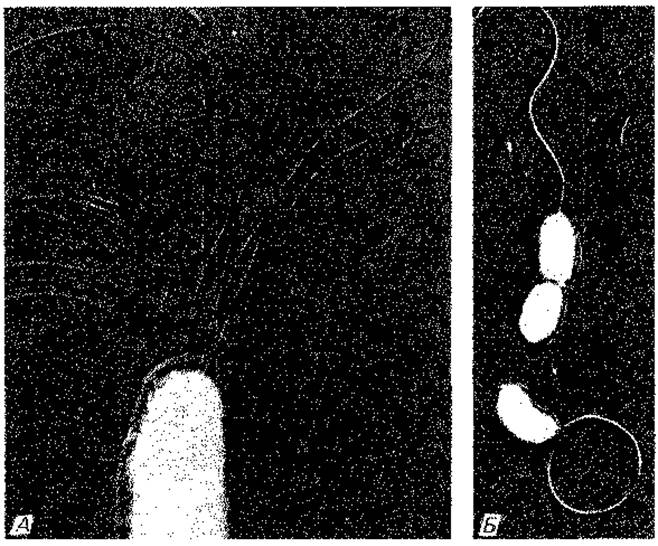
Рис. 2.35. Типы жгутикования (электронные микрофотографии). A. Aquaspirillum serpens с полярно расположенным пучком жгутиков (перитрих); 11000 х. Б. Vibrio metschnikovii с полярно расположенным одиночным жгутиком (монотрих); 7100 х. (Напыление металлом; фото W. van Iterson.)

Рис. 2.36. Типы жгутикования (электронные микрофотографии). A. Proteus mirabilis с перитрихальным расположением жгутиков (косое напыление платиной с палладием, 9500 х; фото Н. Frank). Б. Selenomonas ruminantium с латеральными жгутиками (негативный контраст, 4080 х; фото V. Kingsley.)
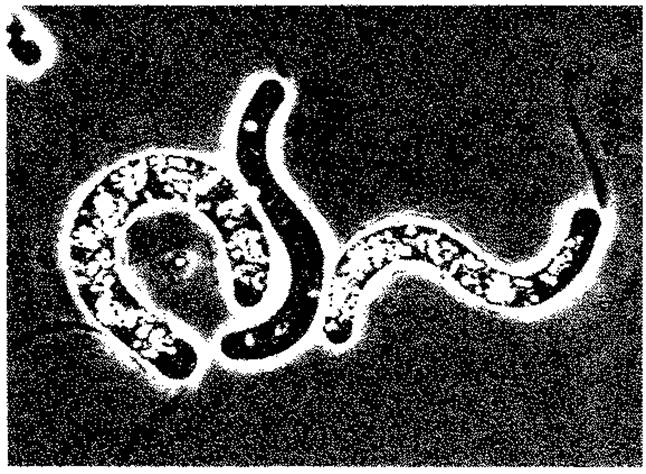
Рис. 2.37. Thiospirillum jenense. (Фазовый контраст, 1200 х ; фото N. Pfennig.)
Выявление жгутиков. Рассмотреть жгутик (или пучок жгутиков) в проходящем свете или в условиях фазового контраста удается только у немногих бактерий, например у Chrormtium okenii, Bdellovibrio, Thiospirillum (рис. 2.37). У многих других бактерий (Pseudomonas, Spirillum и др.) жгутик и зону его биения можно увидеть только в темном поле. Легче всего выявлять жгутики путем нанесения на них красителя или металла, а также с помощью электронного микроскопа.
Функции жгутиков. У большинства бактерий с полярным расположением жгутиков последние действуют подобно корабельному винту и проталкивают клетку в окружающей жидкой среде. Жгутик представляет собой спирально извитую нить, приводимую во вращательное движение «мотором», находящимся в месте ее прикрепления в плазматической мембране. Для перемещения клетки может служить одиночный жгутик или пучок жгутиков. Жгутики вращаются сравнительно быстро; например, у спирилл они совершают около 3000 оборотов в минуту, что близко к скорости среднего электромотора. Вращение жгутиков приводит к тому, что тело клетки вращается примерно с 1/3 этой скорости в противоположном направлении.
Жгутики могут спонтанно или в ответ на внешний стимул изменять направление вращения (рис. 2.34). У некоторых бактерий с полярным расположением жгутиков это приводит к тому, что клетка начинает двигаться вспять. Когда у Chromatium okenii в ответ на вспышку света направление вращения жгутиков меняется, пучок жгутиков превращается в тянущее приспособление; при этом назад клетка перемещается в четыре раза медленнее, чем вперед, и ее движение становится «кувыркающимся». У Thiospirillum jenense гигантской фототрофной спириллы - единственный полярный пучок жгутиков при обратном движении бьется уже не впереди клетки: пространство биения жгутиков теперь охватывает клетку с боков: оно как бы вывернуто наизнанку (подобно вывернутому ветром зонту). У спирилл с амфитрихальным расположением жгутиков в таком положении находится, смотря по обстоятельствам, то один, то другой пучок.
Перитрихально расположенные жгутики Escherichia coli работают как один хорошо скоординированный спиральный пучок и проталкивают клетку через среду. В тех случаях, когда направление вращения отдельных жгутиков меняется, клетка начинает «кувыркаться». По-видимому, перитрихально расположенные жгутики не могут служить тянущим приспособлением.
Бактерии, снабженные жгутиками, могут передвигаться очень быстро: Bacillus megaterium со скоростью 1,6 мм/мин, Vibrio cholerne - 12 мм/мин. Это соответствует примерно от 300 до 3000 длин тела в минуту.
Тонкое строение жгутиков. Жгутики представляют собой спирально закрученные нити. У разных бактерий они различаются по своей толщине (12-18 нм), длине (до 20 мкм), а также по длине и амплитуде витка. Эти параметры характерны для каждого вида. У некоторых бактерий могут образовываться жгутики разных типов. Нити жгутиков состоят из специфического белка флагеллина. Они построены из субъединиц с относительно малой молекулярной массой. Субьединицы располагаются по спирали вокруг внутреннего свободного пространства (подобно белковым молекулам в вирусе табачной мозаики; см. разд. 4.1). Таким образом, структура жгутика определяется свойствами белковых субъединиц.
Жгутик состоит из трех частей - описанной выше спиральной нити, «крюка» вблизи поверхности клетки и базального тельца. С помощью базального тельца жгутик закреплен в плазматической мембране и в клеточной стенке (рис. 2.38). Оно состоит из центрального стержня, на котором у грам-отрицательных бактерий находятся две пары колец. Наружная пара (кольца L и Р) расположены на уровне наружного и внутреннего слоев клеточной стенки, а внутренняя пара (кольца S и М) - на уровне наружного слоя плазматической мембраны. Так как у грам-положительных бактерий наружная пара колец отсутствует, полагают, что для вращения жгутиков необходима только внутренняя пара. Можно представить себе, что кольцо М действует как приводной диск, а кольцо S играет роль подшипника на внутренней поверхности пептидогликанового слоя. Молекулярный механизм вращательного «мотора» жгутика пока не выяснен.
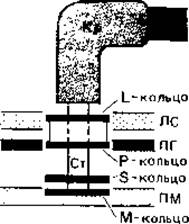
Рис. 2.38. Прикрепление жгутика к клеточной стенке и плазматической мембране у грам-отрицательной бактерии. Н - нить жгутика; Кр - крючок жгутика; ПМ - плазматическая мембрана; ЛС - липополисахаридный слой; ПГ - пептидогликановый слой; Cт - стержень.
О- и Н-аитигены. Proteus vulgaris часто распространяется по всей поверхности агара в виде тонкого серого налета (Н-форма, от нем. Hauch - налет). Такое «роение» объясняется большой подвижностью клеток. Некоторые штаммы налета не образуют (О - форма, от нем. ohne Hauch - без налета). Эти штаммы неподвижны, они лишены жгутиков. Отсюда ведет свое начало обычная терминология, принятая в бактериальной серодиагностике; антигены поверхности или вообще тела клетки (соматические) называют О-антигенами, а антигены жгутиков - Н-антигенами.
Фимбрии и пили. Поверхность некоторых бактерий покрыта большим числом (от 10 до нескольких тысяч) длинных, тонких прямых нитей толщиной 3-25 нм и длиной до 12 мкм, называемых фимбриями или пилями. Они встречаются как у жгутиконосных видов, так и у форм, лишенных жгутиков. От них следует отличать половые пили, или пили типа F, которые были обнаружены у клеток-доноров Escherichia coli К 12, т. е. у штаммов, содержащих половой фактор F (F +, Hfr). Пили F встречаются только по одной или по две на клетку, они имеют вид полых белковых трубочек длиной от 0,5 до 10 мкм.
Хемотаксис. Свободно передвигающиеся бактерии способны к таксисам-направленным движениям, определяемым внешними стимулами. В зависимости от факторов среды, вызывающих направленное движение, говорят о хемотаксисе, аэротаксисе, фототаксисе и магнитотаксисе.
Подвижные бактерии реагируют на химические раздражители-скапливаются в одних местах, а других мест избегают. Такая реакция свободно передвигающихся организмов называется хемотаксисом. Скопления бактерий образуются под действием химических факторов следующим образом (рис. 2.39). У форм с перитрихальными жгутиками возможны только два типа двигательного поведения: прямолинейное движение и кувыркание. Последнее прерывает прямолинейную пробежку и изменяет направление пути. Когда бактерия оказывается в среде с градиентом концентрации «привлекающего» ее субстрата (аттрактанта), ее прямолинейное движение длится многие секунды, если она плывет по направлению к оптимальной его концентрации; однако такое движение через несколько секунд прекратится, если бактерия плывет в противоположном направлении. Хотя направление прямолинейного движения после кувыркания оказывается совершенно случайным, тем не менее зависимость длительности такого движения от его направления приводит в конечном результате к накоплению бактерий в области оптимальной концентрации субстрата. За чувствительность к химическому стимулу и за реагирование на него ответственны хеморецепторы. В ряде случаев эти хеморецепторы действуют независимо от способности бактерий утилизировать данный субстрат. Например, некоторые мутанты продолжают совершенно нормально реагировать на определенное питательное вещество, хотя и потеряли способность его использовать.

Рис. 2.39. Хемотаксические движения. А. В нормальной (изотропной) среде бактерия плывет почти прямолинейно и кувыркается примерно через равные промежутки времени. Б. В градиенте концентрации какого-либо «привлекающего» вещества (аттрактанта) частота кувыркания уменьшается, когда клетка плывет в «правильном» направлении, т. е. в сторону оптимума концентрации. В. В градиенте отпугивающего вещества (репеллента) клетка ведет себя противоположным образом.
Аэротаксис. У подвижных бактерий можно определить тип метаболизма (аэробный или анаэробный) по их аэротаксическим движениям и скоплению на определенных расстояниях от края покровного стекла. В слое бактерий, помещенных между предметным и покровным стеклами, аэрофильные бактерии скапливаются у края покровного стекла или в непосредственной близости от оказавшихся в препарате пузырьков воздуха; это указывает на их потребность в аэробных условиях и на то, что необходимую энергию они получают за счет дыхания (рис. 2.40). Строго анаэробные бактерии будут скапливаться в центре. Микроаэрофильные бактерии, например некоторые псевдомонады и спириллы, будут держаться на определенном расстоянии от края. С помощью бактерий, проявляющих положительный аэротаксис, Энгельману удалось продемонстрировать выделение кислорода локально освещаемыми хлоропластами зеленой водоросли Spirogyra.
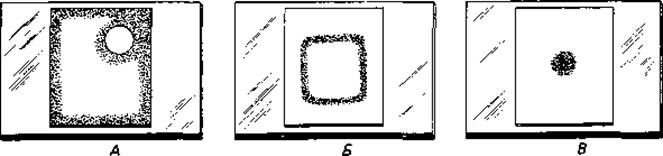
Рис. 2.40. «Фигуры дыхания» (по Бейеринку) как следствие аэротаксиса у подвижных бактерий. Аэробные бактерии скапливаются у края покровного стекла и вокруг попавших в среду пузырьков воздуха (А). Микроаэрофильные бактерии остаются на некотором расстоянии от краев покровного стекла (Б). Строго аэробные бактерии скапливаются в центре (В).
Фототаксис. Фототрофным пурпурным бактериям для получения энергии необходим свет. Не удивительно поэтому, что в результате фототаксиса они скапливаются в освещенном месте. Если выдержать в темноте препарат, в котором плотная суспензия клеток Chromatium будет равномерно распределена под покровным стеклом, а затем направить на него сфокусированный пучок света, то бактерии сосредоточатся в области светового пятна. Клетки, попавшие в это пятно случайно в результате своего беспорядочного движения, уже не могут его покинуть. Как только они попадут в темную зону, направление движения жгутиков мгновенно меняется на обратное и клетки возвращаются в освещенное место. Изменение работы жгутиков происходит так быстро, что эта реакция получила название «реакция испуга» (фоботаксис). Впрочем, для того чтобы вызвать такой ответ, достаточно даже небольшого различия в освещенности двух участков. Мелкие клетки Chromatium скапливаются уже в таком месте, где освещенность всего на 0,7% выше, чем в окружающей области. Таким образом, по своей чувствительности к световому контрасту они приближаются к сетчатке человеческого глаза (для которой соответствующий порог равен 0,4%).
Магиитотаксис. Из поверхностных слоев донного ила пресноводных водоемов, а также морей были выделены бактерии (палочки, спириллы, кокки), способные ориентироваться в магнитном поле и перемещаться в направлении линий магнитного поля. Они содержат много железа (0,4% сухого вещества) в форме ферромагнитной окиси железа (магнетита), которая находится в гранулах (магнитосомах), расположенных около мест прикрепления жгутиков. Бактерии, выделенные в северном полушарии, «ищут» север; здесь линии магнитного поля проходят под углом около 70° к горизонту вниз, в глубь водоема. Магнитотаксическое поведение направляет бактерии в глубину ила, где очень мало или вовсе нет кислорода. Так как магнитотаксические бактерии - анаэробы или микроаэрофилы, их реакция на магнитное поле понятна с точки зрения экологии. Такие клетки, завезенные в южное полушарие, в массе своей, конечно, погибнут; выживут лишь немногие «неправильно» поляризованные клетки, которые могут затем размножиться. Полярность, очевидно, генетически не зафиксирована.
2.2.6 Запасные вещества и другие внутринлеточные включения
У многих микроорганизмов в определенных условиях среды внутри клеток откладываются вещества, которые можно рассматривать как запасные-полисахариды, жиры, полифосфаты и сера. Эти вещества накапливаются, если в питательной среде содержатся соответствующие исходные соединения, но вместе с тем рост бактерий ограничен или вообще невозможен из-за недостатка каких-то отдельных компонентов питания или присутствия ингибиторов. Запасные вещества содержатся в клетках в осмотически инертной форме - они нерастворимы в воде. При условиях, благоприятных для роста, когда в этих веществах возникает потребность, они снова включаются в метаболизм. Запасные полисахариды, нейтральные жиры и поли-β-гидроксимасляная кислота могут служить источниками как энергии, так и углерода. Поэтому при отсутствии внешних источников энергии они могут продлить время существования клетки, а у спорообразующих видов - создать условия для образования спор даже в отсутствие экзогенных субстратов. Полифосфаты могут рассматриваться как резервный источник фосфата, а запасная сера-как потенциальный донор электронов.
Полисахариды. Запасные углеводы микроорганизмов еще мало изучены. У некоторых микробов при помощи цветной реакции с раствором Люголя удается идентифицировать крахмал (синяя окраска) или гликоген (коричневая окраска). Запасные полисахариды, в отличие от полисахаридов клеточной стенки, все образуются из a-D-глюкозы; молекулы глюкозы связаны между собой 1,4-а-гликозидными связями и многократно сшиты между собой (см. также рис. 14.2).
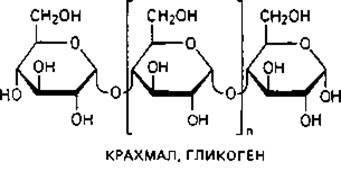
Благодаря a-глюкозидным связям полиглюкозные цепи не вытянуты в длину, а закручены винтообразно. Крахмал, который у растений откладывается в форме крахмальных зерен, состоит из амилозы и амилопектина. Доля амилозы составляет 20-30% (по весу). Именно этот компонент ответствен за синее окрашивание с иодом; эта реакция основана на встраивании иода в витки спирали (реакция включения).
Крахмалоподобное соединение у клостридиев получило название «гранулозы» или «иогена». Клетки Clostridium butyricum почти целиком заполнены мелкими гранулами этого вещества; свободен от них только тот полюс клетки, где образуется спора. Клетки Acetobacter pasteurianus и многих видов Neisseria содержат крахмал.
Гликоген, называемый также «животным крахмалом», сходен с амилопектином, но цепи его ветвятся еще сильнее (путем образования 1,6-связей); у бактерий он встречается, видимо, чаще, чем крахмал. Гликоген обнаружен также у дрожжей и других грибов, у бацилл (Bacillus polymyxa), у Salmonella, Escherichia coli (рис. 2.41) и других Enterobacteriaceae, у Micrococcus luteus и Arthrobacter.

Рис. 2.41. Включения гликогена в клетках Escherichia coli В. Накопление гликогена произошло во время 15-часовой аэрации клеток в фосфатном буфере, содержащем 0,5% глюкозы. Электронная микрофотография ультратонкого среза (четырехокись осмия - бихромат; уранилацетат; 8000 х). (Фото Р. Hillmer и F. Amelunxen.)
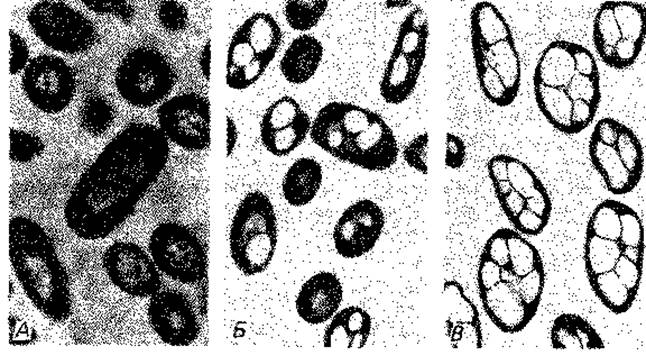
Рис. 2.42. Накопление поли-β-гидроксимасляной кислоты в клетках Alcaligenes eutrophus. Клетки взяты из культуры в фазе экспоненциального роста (А), а затем после 1 ч (Б) и 24 ч (В) ассимиляции уксусной кислоты в отсутствие источника азота. Электронные микрофотографии ультратонких срезов (четырехокись осмия-бихромат; уранилацетат - цитрат свинца; 6000 х). (Фото Р. Hillmer и F. Amelunxen.)
Жироподобные вещества. В качестве включений в клетках микроорганизмов часто встречаются гранулы и капельки жира. В световом микроскопе они видны благодаря тому, что сильно преломляют свет; их можно также окрашивать липофильными красителями - Суданом III или Суданом черным В.
«Суданофильные» гранулы многих бактерий состоят из поли-β-гидроксимасляной кислоты - полиэфира, растворимого в хлороформе, но нерастворимого в эфире и состоящего примерно из 60 остатков ß-гидроксибутирата. Доля этого вещества в сухой биомассе может достигать 80%. Поли-β-гидроксимасляную кислоту образуют многие аэробные бактерии (рис. 2.42), а также цианобактерии и анаэробные фототрофные бактерии (рис. 2.43, А). У факультативных анаэробов и строгих аэробов она накапливается, когда клетки испытывают недостаток O2 и переходят на брожение; поэтому ее можно рассматривать как полимерный внутриклеточный продукт брожения. В аэробных условиях этот продукт может быть снова вовлечен в метаболизм как источник энергии и углерода и использован в процессе дыхания.
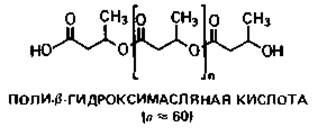

Рис. 2.43. Клетки с включениями поли-ß-гидроксимасляной кислоты. A - Chromatium океnіі; Б - Bacillus megaterium (препарат в туши). Темные включения в клетках С. океnіі - капельки серы. Снимки в светлом поле; 1000 х. (Schlegel H.G., Arch. Microbiol., 42 [1962]; Bohlken G., Diss., Göttingen, 1965.)
Нейтральные жиры (триглицериды), в особенно больших количествах откладывающиеся в вакуолях дрожжей и других грибов, сходны с жирами высших организмов. Дрожжи (Candida, Rhodotorula) могут накапливать до 80% жиров по отношению к сухому веществу.
Микобактерии, нокардии и актиномицеты накапливают в клетках иные жироподобные вещества и часто даже выделяют их в среду. Микобактерии могут содержать до 40% восков (сложные эфиры жирных кислот с длинной цепью и спиртов).
Содержание запасных жиров определяется составом питательной среды (высоким отношением С/N), и эти жиры могут быть выделены непосредственно из клеток. Количества других липидных соединений от состава среды почти не зависят. Эти липиды освобождаются лишь после гидролиза белков и полисахаридов и представляют собой компоненты липопротеинов, входящих в состав плазматической мембраны и внутренних мембран, и липополисахаридов.
Полифосфаты. Многие бактерии и зеленые водоросли способны накапливать фосфорную кислоту в виде гранул полифосфата. Такие гранулы были впервые описаны у Spirillum volutans, поэтому их называют волютиновыми гранулами; другое их название - «метахроматические гранулы» - обусловлено тем, что они вызывают характерное изменение цвета (метахромазию) у некоторых красителей (метиленового синего, толуидинового синего). Эти гранулы состоят в основном из полифосфатов с длинной цепью типа соли Грэма (полиметафосфат натрия); часто находимые при анализах циклические метафосфаты являются, по-видимому, артефактами, возникающими при распаде полифосфатов.
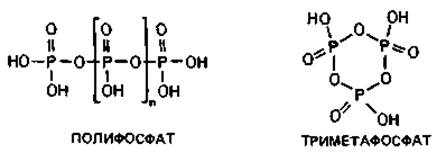
Волютиновые гранулы играют роль фосфатных депо, за счет которых клетка может при недостатке фосфора в среде осуществить еще несколько делений. Как источники энергии полифосфаты играют второстепенную роль.
Сера. У многих бактерий, окисляющих сульфид до сульфата, сера временно сохраняется в виде шариков, сильно преломляющих свет. Сера, накопленная внутри клеток, также как и выделенная клеткой наружу, находится в жидком состоянии и постепенно переходит в свою орторомбическую модификацию. Количество накопляемой серы зависит от содержания сероводорода в окружающей среде: при отсутствии H2S сера окисляется до сульфата. Для аэробных серных бактерий (Beggiatoa, Thiothrix, Achromatium, Thiovulum; рис. 2.44) сера служит источником энергии, а для анаэробных. фототрофных пурпурных серобактерий (Chromatium) - донором электронов. Включения серы, встречающиеся иногда у цианобактерий и Sphaerotilus natans, можно рассматривать как продукты обезвреживания сероводорода, часто присутствующего в местах обитания этих организмов.
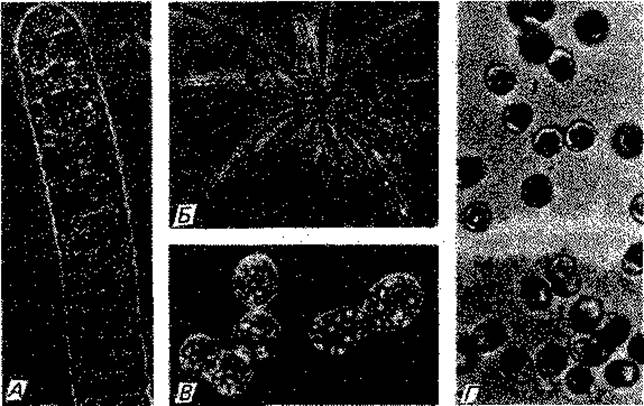
Рис. 2.44. Бесцветные бактерии, окисляющие сероводород. А. Beggiatoa gigantea с включениями серы (снимок в светлом поле, 300 х). Б. Розетки Thiothrix (фазовый контраст, 300 х ). В. Achromatium oxaliferum с включениями карбоната кальция и серы (200 х). Г. Thiovulum с включениями серы (1000 х). [Фото К. Schmidt (А, В), D. Claus (Б), J. W. М. La Riviere и Н. Schuur (Г).]
Другие клеточные включения. У Bacillus thuringiensis и родственных видов (В. laterosporus, В. medusa) рядом со спорами можно бывает видеть кристаллоподобные включения (см. рис. 3.6) - параспоральные тельца, состоящие из протоксина. Протоксин растворяется в кишечном соке чувствительных к нему насекомых (гусениц), и освобождающийся при этом токсин разрушает кишечный эпителий, что приводит к гибели гусеницы. Полученные из этих бацилл препараты, токсичные лишь для немногих групп насекомых, уже с успехом применяются для биологической борьбы с вредителями.
Газовые вакуоли. Многие водные бактерии, в особеннгсти фототрофные, но также и бесцветные (Pelonema, Peloploca), галобактерии (Нalobacterium halobium) и некоторые клостридии содержат газовые вакуоли. Они придают клеткам способность изменять свою среднюю плотность и оставаться взвешенными в воде. Благодаря такой способности некоторые бактерии могут в стратифицированных озерах держаться в определенном слое воды с оптимальными условиями для их роста, не прибегая к активному движению с помощью жгутиков. Аноксигенные (не выделяющие О2) фототрофные бактерии, в том числе пурпурные (Lamprocystis, Amoebobacter, Thiodictyori) и зеленые (Pelodictyon), растут в водоемах в анаэробной зоне (в гиполимнионе) непосредственно под слоем температурного скачка - термоклином (см. рис. 17.1). Плавучесть этих организмов, по-видимому, достаточна для того, чтобы они могли находиться во взвешенном состоянии в холодном (более тяжелом) слое воды гиполимниона, но не обеспечивает им подъемной силы, которая позволяла бы им держаться в теплом (более легком) слое воды над термоклином. Оксигенные (т. е. выделяющие О2) цианобактерии (Oscillatoria agardhii, Aphanizomenon ßos-aquae, Microcystis aeruginosa) процветают в слоях выше термоклина. Плавучесть их, по-видимому, регулируется с помощью фотосинтеза, тургора клеток, а также путем изменения числа и величины газовых пузырьков.
Каждая газовая вакуоль представляет собой скопление газовых пузырьков (везикул). Эти пузырьки имеют веретенообразную форму (цилиндры с коническими концами). Их оболочка состоит не из обычной мембраны, а из чистого белка, обладающего складчатой структурой; толщина ее составляет всего лишь 2 нм. На фотографиях можно различить ребра, расположенные на цилиндрической части пузырька подобно обручам на бочке. Оболочка построена из белковых субъединиц с молекулярной массой 14∙103. Белковые молекулы, очевидно, ориентированы таким образом, что внутренняя сторона стенки оказывается гидрофобной, а наружная-гидрофильной. В клетке имеется множество газовых пузырьков, расположенных параллельно друг другу. В световом микроскопе такое скопление газовых пузырьков (т. е. газовая вакуоль) имеет вид оптически пустого участка, сильно преломляющего свет.
Карбоксисомы. В клетках некоторых автотрофных бактерий имеются карбоксисомы. Это полиэдрические образования величиной с головку фага, в которых (иногда наряду с небольшим количеством ДНК) содержится фермент рибулозобисфосфат-карбоксилаза. Карбоксисомы найдены у Nitrosomonas, Thiobaciłlus и многих цианобактерий.
2.2.7 Эндоспоры и другие покоящиеся формы
К образованию эндоспор способна только небольшая группа бактерий. Огромное значение эндоспор связано с их термоустойчивостью. В то время как почти все остальные бактерии, а также вегетативные клетки спорообразующих видов гибнут при 80°С (при температуре пастеризации) через 10 мин, терморезистентные эндоспоры переносят значительно более сильный нагрев; некоторые споры выдерживают даже кипячение на протяжении многих часов. Трудоемкая и дорогостоящая техника стерилизации (обеззараживания) рассчитана на уничтожение эндоспор. С другой стороны, терморезистентность спор предоставляет своеобразную возможность избирательного обогащения культур спорообразующих форм. Землю или иной материал, взятый в определенном месте, на протяжении 10 мин прогревают при 80 или 100°С, что приводит к гибели вегетативных клеток; только терморезистентные споры остаются жизнеспособными и прорастают в подходящей питательной среде.
Классификация бактерий, образующих эндоспоры. Спорообразующие виды, за одним исключением, относятся к палочковидным грам-положительным бактериям. Большинство из них подвижно благодаря перитрихально расположенным жгутикам. Бактерии, принадлежащие к роду Bacillus,- строгие аэробы или факультативные анаэробы. Роды Clostridium и Desulfotomaculum объединяют анаэробные бактерии, способные к образованию спор. Клостридии получают энергию за счет брожения; виды Desulfotomaculum способны получать энергию путем анаэробного дыхания, используя сульфат в качестве акцептора электронов. Sporolactobacillus принадлежит к числу молочнокислых бактерий. Sporosarcina имеет сферические клетки, но по своим физиологическим признакам относится к бациллам. Содержание GC (см. разд. 22.1) в ДНК клеток, способных образовать споры, удивительно низко; клостридии, у которых ДНК содержит от 22 до 27 мол. % GC, оказываются в конце списка прокариот, расположенных в порядке убывания этого показателя.
Выявление эндоспор. При микроскопическом исследовании споры видны благодаря своему высокому показателю преломления-такому же, как у обезвоженного белка; это указывает на то, что в спорах большое количество богатого белком материала сконцентрировано в малом объеме. Спора содержит почти все сухое вещество материнской клетки, но занимает в 10 раз меньший объем. В сомнительных случаях вопрос о том, имеются ли в клетках истинные эндоспоры, можно решить с помощью специального окрашивания. Если препарат бактерий, фиксированный нагреванием, прокипятить с карболовым раствором фуксина, то споры прочно связывают краситель и не обесцвечиваются даже при обработке этанолом или 1 М уксусной кислотой, тогда как остальное содержимое клетки при этом становится бесцветным.
Спорообразование (споруляция). Споры образуются внутри бактериальной клетки. Этот процесс начинается с накопления белкового материала, поэтому показатель преломления в месте образования споры возрастает. Происходящие при этом метаболические превращения сопровождаются расходованием запасных веществ (поли-β-гидроксимасляной кислоты у аэробов и полисахаридов у анаэробов). В течение первых пяти часов спорообразования значительная часть белков материнской клетки распадается. При этом образуется специфичное для спор вещество - дипиколиновая (пиридин-2,6-дикарбоновая) кислота. В вегетативных клетках эта кислота не встречается. В ходе синтеза дипиколиновой кислоты происходит поглощение ионов кальция; в зрелых спорах эта кислота находится, по-видимому, в виде хелата с кальцием и может составлять 10-15% сухого вещества спор. Дипиколиновая кислота локализована в протопласте споры и имеется только в терморезистентных эндоспорах (рис. 2.45, 2.46).
Спорообразование - один из сложнейших процессов дифференцировки бактериальной клетки. Оно начинается с особого неравного деления клетки (рис. 2.45). В результате впячивания плазматической мембраны часть протопласта отшнуровывается от материнской клетки. Этот протопласт содержит часть ядерного материала - один геном. Образования клеточной стенки между обоими протопластами (как при обычном делении) здесь не происходит. Вместо этого протопласт будущей споры окружается, как бы обрастает, плазматической мембраной материнской клетки. В результате вокруг него оказываются две плазматические мембраны, и каждая из них участвует в синтезе стенки споры. Мембрана протопласта споры синтезирует снаружи от себя стенку зародышевой клетки, а мембрана, происходящая от материнской клетки, синтезирует вовнутрь кору споры (кортекс). Последняя состоит из многослойного пептидогликанового остова, который отличается от каркаса стенок вегетативных клеток помимо прочего степенью сшивки. Наружную оболочку споры образует материнская клетка; эта оболочка в значительной части состоит из полипептидов. Материнская же клетка образует еще один дополнительный тонкий полипептидный покров - экзо торий; он имеется только у немногих бактерий (например, у Bacillus cereus) и окружает спору в виде свободного чехла. Ввиду такой многослойности покровов не покажется удивительным, что на долю оболочки приходится около половины объема и соответственно сухой массы зрелой споры.
Индукция спорообразования. Споры отнюдь не являются обязательной стадией жизненного цикла бацилл; при благоприятных условиях питания бациллы могут неограниченное время размножаться делением как вегетативные клетки. Образование спор начинается лишь тогда, когда не хватает питательных веществ или когда в избытке накапливаются продукты обмена. Иными словами, оно происходит лишь в тех случаях, когда этому способствуют общие условия. Высыхание не стимулирует споруляцию. Если поместить вегетативные клетки в дистиллированную воду, можно наблюдать «эндотрофную споруляцию», т. е. образование спор за счет накопленных внутри клеток запасных веществ. В таких случаях образование спор, очевидно, вызывается недостатком экзогенного субстрата. Индукция спорообразования осуществляется в течение нескольких часов. Если, например, к суспензии вегетативных клеток Bacillus cereus var. mycoides в первые 5 ч после помещения клеток в воду добавить глюкозу, то образование спор прекратится - добавление субстрата подавляет споруляцию. Глюкоза, добавленная позднее чем через 6 ч, менее действенна: подавление спорообразования не происходит. Индукция (дерепрессия) спорообразования продолжается, и через 10-13 ч после переноса клеток в воду около 90% их образует споры. Следовательно, споруляция регулируется внешними факторами.
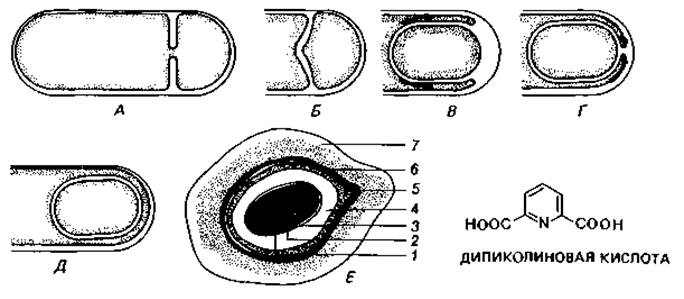
Рис. 2.45. Схема спорообразования и строения зрелой споры. А, Б - процесс отделения протопласта споры; В, Г, Д - образование предспоры; Е - зрелая спора. 1 - цитоплазма; 2 - плазматическая мембрана; 3 - клеточная стенка зародыша; 4 - кора споры; 5 - внутренняя оболочка споры; 6 - наружная оболочка споры; 7 - экзоспориум. (W. G. Murell.)
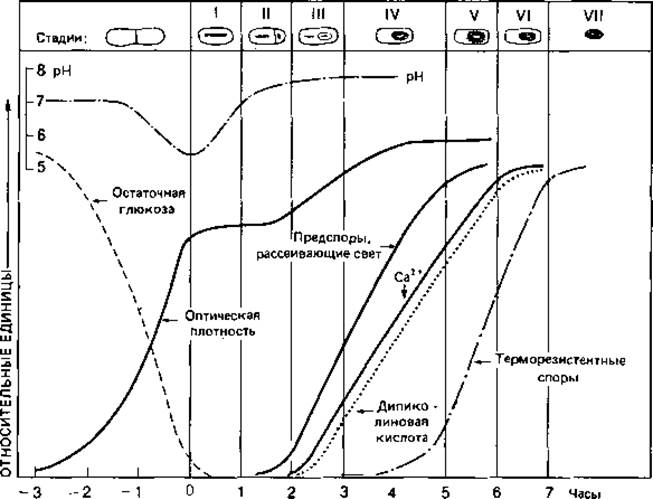
Рис. 2.46. Морфологические и физиологические изменения в процессе образования спор у аэробных бактерий. Этот процесс инициируется использованием глюкозы (нулевое время). Образование спор можно проследить по увеличению содержания кальция и дипиколиновой кислоты, а также по увеличению числа терморезистентных спор и изменению светопреломления. Определенным биохимическим сдвигам соответствуют морфологические изменения. Вверху схематически показаны стадии I — VII.
Число клеток, образующих споры, во многих случаях возрастает после добавления к среде солей марганца.
Способность образовывать эндоспоры постепенно утрачивается при многократных пересевах вегетативных клеток. Поскольку суспензии спорообразующих микроорганизмов обычно содержат и споры, и вегетативные клетди, перед каждым пересевом культуру, как правило, подвергают кратковременному кипячению. Это способствует сохранению или повышению способности клеток образовывать споры.
Свойства зрелых спор. Споры освобождаются при автолизе материнских клеток. Зрелые споры не проявляют никакой метаболической активности. Они чрезвычайно устойчивы к воздействию высокой температуры, разного рода излучений и химических агентов. Терморезистентность обусловлена очень низким содержанием воды. В спорах Bacillus megaterium всего лишь около 15% воды, т.е. примерно столько же, сколько в шерсти или сухом казеине. Лиофилизированные вегетативные клетки бактерий тоже очень термостойки. Терморезистентность спор приблизительно пропорциональна содержанию в них дипиколиновой кислоты.
Радиорезистентность спор также выше, чем у вегетативных клеток. Она примерно пропорциональна содержанию дисульфидных групп в наружном слое белка. Оболочка споры содержит главным образом белок, богатый цистеином и напоминающий кератин. Химическая же устойчивость эндоспор обусловлена непроницаемостью их оболочки для многих веществ.
Прорастание спор. В подходящих средах большинство спор прорастает. Соответствующая предварительная обработка, определенные условия хранения и прогрев могут повысить «всхожесть» спор - увеличить процент прорастания, В случае Bacillus subtilis оптимальными условиями для стимуляции прорастания спор считают семидневный период покоя и пятиминутный прогрев в воде при 60°С. Другие споры могут быть активированы кратковременным кипячением (10 мин при 100°С). Обработка тепловым шоком должна проводиться непосредственно перед высевом спор, так как процесс активации обратим. Прорастанию спор предшествует поглощение ими воды и набухание. Для прорастания активированных спор в ряде случаев необходимо присутствие глюкозы, аминокислот, нуклеозидов или других соединений. В ходе прорастания спор происходят глубокие физиологические изменения: дыхание и ферментативная активность быстро возрастают; начинается выделение аминокислот, дипиколиновой кислоты и пептидов. При прорастании спор потеря сухого вещества достигает 25-30%. Во время прорастания споры теряют свою термоустойчивость. Выходящая из споры ростовая трубка бывает окружена очень тонкой и, видимо, неполностью сформированной клеточной стенкой, так что в протопласт может, например, проникать даже ДНК (см. раздел о трансформации). Ростовая трубка может образоваться как в полярном, так и латеральном положении; в одних случаях оболочка споры при этом разрывается, в других ростовая трубка прокалывает ее (рис. 2.47).
Рис. 2.47. Прорастающие споры. 1 - полярное прорастание споры Clostridium (с экзоспорием); 2 - полярное прорастание споры Bacillus megaterium (споровые оболочки не отделились); 3 - латеральное прорастание спор у бацилл (а-В. cereus; б-В. subtilis).
Продолжительность жизни спор. Бактерии в виде спор могут длительное время находиться в состоянии анабиоза. В земле, которая прилипла к растениям из гербария Кью Гардене (Англия) и пролежала вместе с ними в сухом состоянии от 200 до 320 лет, было обнаружено лишь небольшое количество жизнеспособных спор Bacillus subtilis и В. licheniformis. В пробах почвы, хранившихся от 50 до 100 лет, были также обнаружены споры В. coagulans и В. circulans. По данным такого рода экспериментов, в сухой почве за 50 лет хранения до 90% спор теряет жизнеспособность. Судя по этому, одна тонна сухой почвы и через 1000 лет все еще будет содержать жизнеспособные споры.
В сухом состоянии многие бактерии (если не большинство из них) на протяжении ряда лет сохраняют жизнеспособность. Для консервации бактерий в коллекциях вегетативные клетки подвергают, как правило, лиофильной сушке и хранят при комнатной температуре или при низких температурах в вакууме. Как рассчитал еще Беккерель, микроорганизмы при температуре, близкой к абсолютному нулю, могут оставаться жизнеспособными на протяжении миллионов лет. Кратковременные опыты с жидким азотом и экстраполяция их результатов позволяют заключить, что такие предположения вполне оправданны. Бактерии, не переносящие лиофилизации, выдерживают многолетнее хранение в суспензиях при температуре жидкого азота.
Другие покоящиеся формы (цисты, экзоспоры, миксоспоры). Эндоспоры являются длительно переживающими формами бактерий, устойчивыми к высокой температуре, высыханию, облучению и химическим воздействиям. Помимо эндоспор у некоторых других бактерий существуют иные покоящиеся формы - экзоспоры и цисты. Образование экзоспор до сих пор наблюдалось только у метаболизирующих метан бактерий Methylosinus trichosporium1. Экзоспоры возникают путем почкования материнской клетки; они сходны по своим свойствам с эндоспорами бацилл. Некоторые бактерии образуют шарообразные толстостенные клетки, называемые цистами. При истощении пищевых ресурсов в цисту превращается вся палочковидная вегетативная клетка, а не только часть ее, как при образовании эндоспоры. Цисты видов Azotobacter, а также Methylocystis устойчивы к высушиванию, механическим нагрузкам и облучению, но не к действию высоких температур. Подобного рода превращение всей клетки в цисту лежит и в основе образования миксоспор из палочковидных вегетативных клеток Myxococcus и Sporocytophaga.
Клетки Arthrobacter (A. globiformis) плеоморфны. При обилии субстрата они растут в виде палочек; когда же субстрат иссякает, появляются кокковидные клетки. Arthrobacter относится к тем бактериям, которые способны некоторое время сохраняться в высохшей почве, пребывая в состоянии покоя; структурной дифференцировки в данном случае не выявлено.
1 Экзоспоры образует также фототрофная пурпурная бактерия Rhodomicrobium vannieln. - Прим. ред.
2.2.8 Пигменты бактерий и грибов
Колониям многих бактерий и грибов свойственна яркая окраска, обусловленная выделением окрашенного продукта в окружающую среду или же пигментацией самой клетки. Способность к образованию пигментов детерминирована генетически и поэтому может использоваться в качестве характерного признака. Окрашенные формы легче выявлять и идентифицировать. Среди пигментов могут встречаться представители различных классов веществ: каротиноиды, феназиновые красители, пирролы, азахиноны, антоцианы и др. (рис. 2.48).
Защита от света и ультрафиолетового облучения. В чашках Петри со сложной агаризованной средой, оставленных на некоторое время открытыми в пыльном воздухе, часто появляются окрашенные колонии микроорганизмов. В их окраске преобладают желтые, оранжевые и красные тона, обусловленные присутствием каротиноидов. Среди бактерий, образующих такие колонии, мы находим чаще всего представителей родов Micrococcus, Corynebacterium, Mycobacterium и Nocardia, а среди дрожжей - Rhodotorula. Обилие пигментированных форм среди «воздушной микрофлоры» объясняется тем, что пигменты играют защитную роль, предохраняя клетки от действия видимого и ближнего ультрафиолетового света. Поэтому в местообитаниях, находящихся на свету (пыль, солома), бесцветные бактерии погибают быстрее, чем пигментированные. Защитное действие пигментов в отношении лучевого повреждения можно показать также на примере оранжевой галофильной бактерии, содержащей каротиноиды, и ее бесцветных мутантов. В то время как при слабом освещении и дикий тип, и мутанты растут одинаково хорошо, на ярком солнечном свету рост бесцветных мутантов сильно тормозится. Бактерицидное действие видимого света проявляется только в присутствии молекулярного кислорода и обусловлено фотоокислением; некоторые клеточные пигменты (флавины и цитохромы) играют при этом роль катализаторов (фотосенсибилизаторов). Каротиноиды находятся в плазматической мембране и защищают чувствительные области клетки от эффектов фотоокисления.
Рис. 2.48. Некоторые пигменты, образуемые бактериями и дрожжами. Пиоцианин выделяют клетки Pseudomonas aeruginosa, а подчини - Chromobacterium iodinum. Индигоидин продуцируют различные бактерии, в том числе Pseudomonas indigofera. Продигиозин образует Serratia marcescens (прежнее название Bacterium prodigiosum), виолацеин - Chromobacterium violaceum. Пульхерримин - пигмент дрожжей Candida pulcherrima. Флеиксантофилл - главный каротиноид Mycobacterium phlei, он представляет собой каротиноид-гликозид; сарцинаксантин - основной каротиноид желтых видов Sarcina (Micrococcus luteus).
Фотосенсибилизация. Обычная чувствительность клеток к молекулярному кислороду, проявляющаяся на свету, может быть усилена. Бактерии, окрашенные витальными красителями, например метиленовым синим, эозином или акридиновым оранжевым, а затем подвергнутые действию света, отмирают быстрее, чем неокрашенные клетки. Молекула красителя поглощает свет и способна передавать его энергию молекуле О2. При этом находящаяся в обычном триплетном состоянии молекула кислорода переходит в возбужденное состояние (синглетный кислород). Этот синглетный кислород инициирует окислительные реакции, которые обычный кислород осуществить не способен (циклоаддиции, En-реакции). Фотосенсибилизацию используют в зверосовхозах и зоопарках для устранения потенциально патогенных бактерий; с этой целью добавляют в питьевую воду метиленовый синий или другие красители. Фотосенсибилизированные бактерии гибнут уже на обычном дневном свете.
Образование каротиноидов. Интенсивно-красный цвет пурпурных бактерий обусловлен присутствием красных каротиноидов (с 12-13 двойными связями и с метокси - и оксогруппами). Здесь пигменты играют не только защитную роль, но и поглощают свет для фотосинтеза, а также участвуют в рецепции света при фототаксисе. Каротиноиды вместе с бактериохлорофиллами находятся в фотосинтетически активных мембранах (тилакоидах, хроматофорах).
У многих пигментированных микроорганизмов образование пигментов (так же как и синтез фотосинтетических пигментов у высших растений) происходит только на свету. Микобактерии, в том числе патогенная туберкулезная палочка (Mycobacterium tuberculosis), образуют каротиноиды только при воздействии света. Это относится и к бактериям, растущим на ветчине или сыре. Во многих случаях пигментация зависит от состава питательной среды и от температуры.
Пульхерримин. Цвет красных дрожжей (Rhodotorula, Sporobolomyces salmonicolor) определяется в основном каротиноидами. К другому классу веществ относится пульхерримин - пигмент Candida pulcherrima. Наряду с С. reukaufii эти дрожжи можно выделить из нектароносных цветков и из плодов, а также из кишечника пчел. На средах, содержащих железо, они образуют темно-красные колонии. Их красный пиразиновый пигмент, нерастворимый в воде и других растворителях, содержит комплексно связанное железо.
Продигиозин. На средах, содержащих углеводы, часто развивается бактерия Serratia marcescens (старое название - Bacterium prodigiosum). Ярко-красная окраска ее колоний (а также клеточных суспензий) обусловлена присутствием пигмента продигиозина, у которого молекула содержит три пиррольных кольца. Этот пигмент встречается также у актиномицетов.
Индигоидин. К азахинонам (диазадифенохинонам) относится индигоидин - нерастворимый в воде синий пигмент, выделяемый в среду различными бактериями, такими как Pseudomonas indigofera, Corynebacterium insidiosum, Arthrobacter atrocyaneus и A. polychromogenes.
Виолацеин. Chromobacterium violaceum легко выделить из почвы, если положить зерна риса в чашку Петри на сильно увлажненную почву; колонии этого микроорганизма легко узнать по сине-фиолетовой окраске, обусловленной нерастворимым в воде пурпурным пигментом виолацеи- ном. Этот пигмент представляет собой производное индола, образующееся при окислении триптофана.
Феиазиновые пигменты. Многие пигменты, выделяемые водными бактериями в окружающую среду, относятся к производным феназина. Самый известный среди них - пиоцианин, образуемый клетками Pseudomonas aeruginosa (прежнее название - Р. руосуаnеа). Различные штаммы и виды псевдомонад выделяют феназин-1-карбоновую кислоту, оксихлорорафин или иодинин, а иногда все эти пигменты одновременно.
Вторичные метаболиты. Пигменты у многих микроорганизмов представляют собой вторичные метаболиты; это означает, что они не принадлежат к тем соединениям, которые имеются у всех этих организмов (см. разд. 10.4). Уже по их структуре видно, что они являются производными обычных метаболитов или структурных компонентов клетки. Некоторые пигменты обладают антибиотическими свойствами, так что многие пигментированные микроорганизмы являются продуцентами антибиотиков. Между пигментацией и образованием вторичных метаболитов существует такая тесная корреляция, что при наличии пигментов можно с большой долей вероятности ожидать образования антибиотиков и других биологически активных веществ.