РОСТ И КУЛЬТИВИРОВАНИЕ БИООБЪЕКТОВ - В. М. Самыгин - 2016
ГЛАВА 6. ВЛИЯНИЕ ФИЗИКО-ХИМИЧЕСКИХ ФАКТОРОВ НА РОСТ И МЕТАБОЛИЗМ МИКРОБНЫХ КЛЕТОК
Эффективное получение микробной биомассы или продуктов микробного синтеза во многом зависит от условий культивирования и биофизических параметров. Факторы внешней среды, действующие на микроорганизмы, делятся на абиотические и биотические. Среди наиболее значимых абиотических (физико-химических) факторов следует выделить рН, температуру инкубации бактерий, степень аэрации и окислительно-восстановительный потенциал среды, осмотическое давление и другие. Все эти факторы влияют на скорость роста, выход биомассы, метаболизм и химический состав бактерий. Причем контроль щелочно-кислотных условий, температуры и аэрации является критическим для любой бактериальной культуры, а контроль окислительно-восстановительного потенциала особенно важен при культивировании облигатно-анаэробных бактерий.
6.1. Концентрация ионов водорода
Влияние водородных ионов на биологическую активность имеет отношение либо к концентрации водородных ионов [Н+], либо к активности водородных ионов (аh). Эти два параметра взаимно пропорциональны: аh=1[Н+], где f - коэффициент активности, который может изменяться в зависимости от ионной силы или других факторов. Когда рассматриваются свойства клетки, активность водородных ионов является более существенным параметром, и действие водородных ионов принято выражать через рН.
Ионы Н+ и ОН- - наиболее подвижные из всех ионов, поэтому даже малейшие изменения их концентрации оказывают на микроорганизмы сильное влияние. Плазматические мембраны трудно проницаемы для водородных и гидроксильных ионов, поэтому внеклеточная и внутриклеточная концентрации водородных ионов не уравновешиваются между собой, и, следовательно, должен существовать трансмембранный градиент концентрации водородных ионов.
РН культуры регулируется либо рН-буфером, либо балансом между образованием и потреблением кислот, либо автоматическим добавлением кислоты или основания.
Ограничение и применение рН-буфера имеет две стороны: диапазон возможных значений рН и способности буфера к поглощению и образованию водородных ионов, а также возможное физиологическое влияние буфера. Фосфатный буфер используется обычно для областей рН от 6 до 8. Для значений рН <6 используется фталат, а для рН>8 - борат. Чтобы избежать сдвигов буферной емкости, образование кислот или оснований следует ограничивать правильным подбором состава среды. Образование кислот в культуре можно сбалансировать поглощением анионов, таких, как нитрат и ацетат, которые замещаются гидроксильными ионами. Сбалансировать образование оснований можно поглощением катионов, таких, как ионы аммония, которые замещаются ионами водорода. Часто поглощение ионов аммония является единственным источником образования кислот. Этого можно избежать, заменив аммоний мочевиной или глицином.
Ограничения вышеприведенных методов регуляции рН можно преодолеть при помощи автоматического добавления кислоты или основания в зависимости от показаний электрода. Обычно добавляют соляную или серную кислоту (или сахара, например, глюкозу) и одно из оснований - гидроокись натрия, калия или аммония.
Большинство организмов лучше всего растет, когда концентрация ионов Н+ и ОН- примерно одинакова (рН 7). Многие бактерии, например, нитрифицирующие и клубеньковые бактерии, актиномицеты, бактерии, разлагающие мочевину, предпочитают более высокие значения рН, то есть слегка щелочные среды. Лишь немногие толерантны к кислой среде (лактобациллы, Acetobacter, Sarcina) или даже ацидофильны (например, некоторые виды Thiobacillus). Грибы предпочитают низкие значения рН. Если сложные питательные среды с различным рН инокулировать почвой, то при рН 5,0 развиваются главным образом грибы, а при рН 8,0 - бактерии.
Поддержание определенного рН во время роста важно, прежде всего, для тех микроорганизмов, которые хотя и продуцируют кислоты, но не обладают к ним толерантностью (лактобациллы, Еnterobacteriасеае, многие псевдомонады). Впрочем, многие бактерии сравнительно малочувствительны к колебаниям рН в пределах от 6 до 9. Правда, при быстрых изменениях возможен кратковременный небольшой сдвиг рН, однако уже через 30 мин прежнее значение рН восстанавливается.
Происходящие при неблагоприятных значениях рН нарушения не связаны с прямым действием ионов Н+ и ОН-. Последние лишь снижают степень диссоциации слабых кислот и оснований, которые в незаряженном состоянии значительно легче проникают в клетки, чем продукты их диссоциации.
Многие бактерии в процессе роста накапливают значительные количества кислых или щелочных ионов. Хотя образование кислоты и ее потребление сбалансированы, в процессе роста могут происходить значительные изменения рН среды. Контроль за щелочно-кислотными условиями (показателем активности ионов водорода) осуществляется с помощью рН-метра. В тех случаях, когда нет необходимости в высокой точности измерений, например, при работе с обычными средами, рН определяют с помощью раствора индикаторного красителя или индикаторной бумаги. При правильном их подборе рН можно измерить с точностью до 0,2 единицы.
Некоторые рН-индикаторы часто добавляют к среде культивирования с целью выявить изменение рН в процессе роста бактерий. Для этого нужно подобрать соответствующий задаче рН-индикатор и убедиться, что он не подавляет рост микроорганизма. Все рН-индикаторы плохо растворимы в воде и используются в средах в очень низких концентрациях (менее 0,01 %). Наиболее распространенные в бактериологической практике индикаторы представлены в табл. 3.
Таблица 3. РН-индикаторы и диапазоны рН, в которых они используются
Индикатор |
Диапазон рН |
Цвет |
|
Кислая среда |
Щелочная среда |
||
Тимоловый голубой |
8,0-9,6 |
желтый |
Голубой |
Феноловый красный |
6,8-8,4 |
-«- |
Красный |
Бромтимоловый синий |
6,0-7,6 |
-«- |
Голубой |
Метиловый красный |
4,4-6,0 |
-«- |
Красный |
Для культивирования многих бактерий необходимо применять забуференные среды. При выборе соответствующего буфера исходят из:
- подходящего значения рН-буфера,
- возможности ингибирующего или токсического действия буфера,
- возможной утилизации компонентов буфера бактериальной культурой,
- возможного связывания буфером двух- и трехвалентных металлов.
Буферы, как известно, представляют собой смеси слабых кислот и
оснований. В комплексных средах буферным действием обладают кислые и основные группы таких органических молекул, как белки, пептиды и аминокислоты. Из-за присутствия различных веществ среды могут обладать буферным действием в широком интервале рН. Однако буферная емкость при любом заданном значении рН широко варьирует в зависимости от типа присутствующих в растворе органических молекул и их концентрации.
Буферы со слабыми кислотными и основными свойствами наиболее эффективны вблизи значений рН, при которых они диссоциируют на 50 %. Эта величина рН соответствует рКа(отрицательный логарифм константы диссоциации) кислоты или основания. Эффективный диапазон буфера отличается от величины рКа не более чем на одну единицу рН. В табл. 4 приведен ряд соединений, которые используются в качестве буферов в ростовой среде, а также их наиболее пригодные значения рКа при 25 °С.
Таблица 4. Значения рКа соединений, используемых в буферах
Соединение |
Значения рКа при 25°С |
||
Лимонная кислота |
3,13 |
4,76 |
6,39 |
Фталевая кислота |
2,89 |
5,51 |
|
Янтарная кислота |
4,16 |
5,61 |
|
Глицин |
9,87 |
||
Обращает внимание тот факт, что соли лимонной, фталиевой и янтарной кислот обладают буферной емкостью в широком интервале значений рН, поскольку соответствующие им кислоты содержат более одного диссоциируемого иона водорода.
Для бактериальных ростовых сред наиболее широко используются фосфатный, трис-солянокислый, цитратный и ацетатный буферы. Эти четыре буферные системы охватывают практически весь интервал значений рН, в котором могут расти бактерии. Однако следует помнить, что рН любого буфера зависит от температуры, поэтому для установления точного значения необходимо пользоваться справочной литературой. Кроме того, обычные буферы не могут стабилизировать значения рН сред, используемых для выращивания бактерий, образующих большое количество кислоты (например, молочнокислых). В этом случае кислоту следует максимально быстро нейтрализовать, добавляя к среде тщательно измельченный мел (0,3 % СаСО3), который должен быть хорошо суспендирован в агаре при его разливе по чашкам. Колонии, образующие кислоту, формируют вокруг себя зоны просветления. Кислоту также можно удалить в системе культивирования с диализом.
Щелочно-кислотные условия влияют на рост и метаболизм бактерий. Максимальная скорость роста поддерживается в интервале от 1 до 2 единиц рН, а полная область роста - в интервале от 2 до 5 единиц рН (рис. 7).
Рис.7. Влияние рН на рост клеток
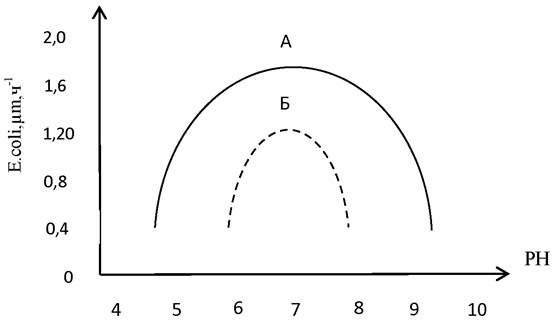
Значение рН-культуры оказывает влияние на конечные продукты анаэробного превращения источников углерода и энергии. При анаэробном метаболизме у многих бактерий при кислом значении рН наблюдается тенденция к образованию нейтральных продуктов, а при щелочных значениях рН происходит образование органических кислот. РН может оказывать влияние на природу конечного продукта сбраживания сахаров у стрептококков и молочнокислых бактерий: при кислых значениях рН это почти полностью молочная кислота, но при повышении рН образуются уксусная и муравьиная кислоты. При сбраживании сахара дрожжами при кислых значениях рН образуется этиловый спирт, а при щелочных значениях рН-глицерин и уксусная кислота. Таким образом, при более высоких значениях рН образуется больше кислых эквивалентов на каждый моль субстрата.
В периодической культуре Е. coli, выращенной на гидролизате казеина, оптимум рН для индукции декарбоксилаз аминокислот лежит в кислой области (рН 5), а оптимум рН для индукции дезаминаз - в щелочной области (рН 8). Стало быть, метаболические изменения способствуют регуляции рН среды, сдвигая его в сторону нейтральных значений.
РН-среды благодаря своему действию на диссоциацию соединений, обладающих кислотными и основными свойствами, может оказывать влияние на ингибиторные или токсичные свойства этих соединений. Например, токсичность слабых кислот, таких, как уксусная, часто зависит от рН. Свободные кислоты обладают более высокой растворимостью в липидах, чем ионизированные формы. Следовательно, снижение рН должно способствовать проникновению кислот в клетку.
Зависимость от рН для вторичного метаболизма может отличаться от зависимости для роста и первичного метаболизма. Значение рН во время роста оказывает существенное влияние на природу клеточной поверхности или материал оболочки. Антигенный состав микроорганизмов меняется при изменении рН культуры. У чумного микроба так называемый «антиген 4» образуется только при значениях рН ниже, чем 6,9, а оптимум находится около 5,9. Морфология гифов мицелиального плесневого гриба рода Pénicillium также зависит от рН. При рН 6 образуются длинные тонкие нити, а при увеличении рН до 7 гифы укорачиваются, утолщаются и вакуолизируются. Эти результаты свидетельствуют о том, что состав клеточной стенки плесневого гриба изменяется в зависимости от рН и при высоких значениях рН стенки бывают более слабыми и легко разрываются.
6.2. Температура
Среди значимых факторов при культивировании микроорганизмов известная роль отведена температурному режиму, колеблющемуся в широких пределах. Верхний температурный предел для жизни микроорганизмов пока не установлен. Вероятно, он находится в диапазоне от 110° до 200 °С, так как при более высоких температурах разрушаются аминокислоты и нуклеотиды.
Температура инкубации значительно влияет на скорость всех клеточных реакций. Кроме того, температура влияет на природу метаболизма клеток, их потребности в питательных веществах и состав биомассы.
Полезная область температуры, близкая к оптимальной, обычно довольно узка, а максимальная температура роста нередко лишь на несколько градусов (от 3 до 5 °С) выше оптимальной. Вместе с тем минимальная температура роста может быть на 20-40 °С ниже оптимальной.
При осуществлении температурного контроля на практике придерживаются следующих правил:
- во время инкубации измеряют температуру в различных частях термостата термометрами, помещенными в колбы или пробирки с водой;
- поскольку температура и влажность значительно варьируют, для усиления воздушных конвекционных токов пользуются феном. Культуру в термостате располагают таким образом, чтобы она не попала в «мертвое» воздушное пространство;
- если необходима постоянная циркуляция воздуха, пользуются термостатами, которые обеспечивают высокую относительную влажность.
В целом при температурах роста несколько выше максимальных бактерии не только замедляют свой рост, но и быстро гибнут. Для большей безопасности культуру лучше инкубировать ниже ее температурного оптимума, в пределах колебаний заданной температуры термостата.
Уменьшение скорости роста при верхних экстремальных температурах может быть следствием как нарушения метаболической регуляции, так и отмирания клеток. В случае отмирания клеток скорость роста жизнеспособной биомассы (х) выражается уравнением:
dx/dt = (μ - к) х,
где μ - удельная скорость роста и к - удельная скорость отмирания.
Повышение температуры в конечном итоге приводит к разрушению структуры белка, что, в свою очередь, оказывает влияние на сродство между субстратом и ферментом.
Снижение температуры роста бактерий может привести к большому увеличению (на 10-20 %) экономического коэффициента (выхода биомассы), рассчитанного по источнику углерода и энергии. Температура может оказывать влияние на путь превращений источников энергии и глюкозы. Например, у Lactobacillus brevis окисление глюкозы при 24 °С идет по пути гетероферментативного молочнокислого брожения, а при 37 °С для окисления глюкозы требуется фруктоза в качестве акцептора водорода (с образованием маннита).
При изменении температур может изменяться потребность в факторах роста. В качестве классического примера следует назвать Yersinia pestis, который во время роста при 37 °С требует больше различных аминокислот, чем при 28 °С.
Влияние температуры на вторичный метаболизм и на сверхсинтез промежуточных продуктов обмена может отличаться от влияния температуры на рост. Так, в хемостатной культуре рода Aspergillus, лимитированной глюкозой, скорость образования меланина (пигмент коричневого и черного цвета растительных и животных тканей - продукт окислительных превращений тирозина) увеличивалась почти в два раза при изменении температуры культивирования с 23 до 37 °С, скорость же роста оставалась при этом постоянной (0,05 ч-1). Температура, оптимальная для синтеза пенициллина некоторыми грибами, ниже температуры, оптимальной для их роста.
Изменение температур культивирования оказывает влияние на РНК, белок и липидный состав клеток бактерий и дрожжей. При одной и той же скорости роста содержание РНК в бактериях или дрожжах при снижении температуры увеличивается в несколько раз. Общее содержание белка в дрожжах при изменениях температуры может увеличиваться или уменьшаться в зависимости от природы лимитирующего субстрата. В липидах дрожжей при снижении температуры повышается содержание ненасыщенных жирных кислот. Вероятно, при изменении температуры липиды мембранной структуры постоянно модифицируются так, чтобы сохранялась их функция.
При изменении температуры происходят качественные и количественные изменения антигенного состава бактерий. Например, продукция капсульного антигена F1 у чумного микроба, связанного с вирулентностью возбудителя, происходит наиболее интенсивно при 37 °С, тогда как оптимум роста у этого микроорганизма приходится на 28 °С.
Жгутики у иерсиний обнаруживались только при пониженной температуре (6-25 °С), а максимальное их образование отмечено при 6-12 °С. После нескольких пересевов иерсиний в питательном бульоне в условиях аэрации при 37 °С высоковирулентные штаммы становились авирулентными, а у вакцинного штамма EV при 37° изменялся ЛПС и уменьшалось количество белка внешней мембраны.
Влияние температуры на рост биомассы и ее активность объясняется, по-видимому, воздействием на структуру клеточных компонентов, особенно белков и липидов. Ответная реакция на первичное воздействие включает множество вторичных эффектов, связанных с механизмами регуляции метаболизма, специфичностью ферментативных реакций, клеточной проницаемостью и составом клеток. Вторичные эффекты в определенной степени могут нейтрализоваться особыми условиями окружающей среды.
6.3. Потребность в кислороде
Проблема обеспечения культур кислородом при глубинном выращивании с высокой концентрацией биомассы приобрела важное значение, начиная с 40-х годов ХХ-го века главным образом из-за практической необходимости получения в промышленном масштабе антибиотиков и пекарских дрожжей.
Кислород входит в состав воды и вместе с ней поступает в распоряжение клеток. Кроме того, он содержится в СО2 и многих органических соединениях. Главная функция О2 состоит в том, что он служит конечным акцептором электронов при аэробном дыхании, при этом кислород восстанавливается до воды. В вещество клетки атомы кислорода, происходящие из О2, включаются только в том случае, если источниками углерода служат метан, углеводороды с длинной цепью или ароматические углеводороды.
Всем облигатным аэробам в качестве акцептора электронов необходим молекулярный кислород. Для бактерий, растущих на агаровой среде или в тонких слоях жидкости в присутствии воздуха, кислорода обычно вполне достаточно. В жидких средах при большом объеме жидкости аэробные бактерии могут расти толь на поверхности, так как в более глубоких слоях по мере удаления от поверхности условия приближаются к анаэробным.
Для нормального роста аэробных микроорганизмов в глубоких слоях жидкой культуры требуется аэрация. Микроорганизмы способны использовать только растворенный кислород, который является таким же питательным компонентом, как глюкоза или аммоний, однако в отличие от большинства подобных компонентов он довольно плохо растворим (<10 мг/л).
В то время как минеральные соли и органические вещества можно добавлять к среде в концентрациях, обеспечивающих рост бактерий на протяжении нескольких часов и даже дней, с молекулярным кислородом этого сделать нельзя, так как растворимость его очень мала. Литр воды, находящейся при 20 °С в равновесии с атмосферным воздухом, содержит всего лишь 6,2 мл, или 0,28 ммоль, О2. Такого количества достаточно для окисления не более 0,046 ммоль, или 8,3 мг, глюкозы (т. е. примерно одной тысячной общего количества глюкозы, содержащегося в обычных питательных средах). Поэтому в среде невозможно создать значительный запас кислорода - кислород приходится добавлять непрерывно.
Следовательно, для бактерий, выращиваемых в жидких средах, кислород может быстро стать лимитирующим фактором, если не принимаются специальные меры, обеспечивающие его постоянную подачу и растворение в среде во время роста бактерий.
При аэрации жидкой культуры следует обращать внимание на следующие основные факторы:
- доступность кислорода на границе раздела фаз питательная среда - газ. Сосуд с культурой следует закрывать пробкой или крышкой из пористого материала, чтобы обеспечивался максимальный газообмен.
- для аэрации жидких культур пользуются либо обычным воздухом, либо смесью О2, N2 и СО2.
- скорость перехода молекулярного кислорода в раствор возрастает с увеличением поверхности раздела между газовой и жидкой фазами и с повышением парциального давления О2в газовой фазе. Кроме того, повышению концентрации растворенного кислорода способствует увеличение объема, подаваемого в биореактор воздуха и добавление некоторых химических реагентов (например, перфторуглеводородов).
Для увеличения поверхности раздела прибегают к различным способам:
- культивированию в тонком слое;
- перемешиванию жидкости путем встряхивания (прямого или кругового);
- пропусканию воздуха через жидкость под давлением с помощью газораспределителя (стеклянные фильтры);
- перколяции (процеживание, фильтрация), то есть медленному непрерывному отсасыванию воздуха из сосуда через отвод, при этом воздух извне будет поступать в сосуд через трубку;
- механическому перемешиванию.
Однако следует помнить, что даже в хорошо аэрируемых ферментерах кислород не всегда распределен равномерно. Удобным объектом для демонстрации этого явления могут служить факультативно-анаэробные бактерии, переходящие при недостатке О2 к брожению (Escherichia coli) или нитратному дыханию (Pseudomonas denitrificans).
Скорость поглощения кислорода (СПК) выражается в миллимолях на литр в минуту и легко определяется химически по скорости окисления сульфита в сульфат растворенным кислородом в присутствии медного катализатора.
Предварительное аэрирование жидкой питательной среды, используемой для культивирования микроорганизмов, повышает конечный выход биомассы. Увеличить парциальное давление растворяемого газа (кислорода) можно за счет повышения общего давления в ферментере или подачи чистого кислорода, или воздуха, обогащенного кислородом.
Однако повысить давление в действующих ферментерах зачастую невозможно ввиду того, что их конструкция рассчитана для работы только при атмосферном давлении. Повышенное давление и рециркуляция газовой фазы приводит к накоплению больших количеств углекислоты в газовой фазе ферментера и появлению возможности ингибирования роста культуры компонентами газовой фазы.
6.4. Окислительно-восстановительный потенциал
Степень анаэробиоза наиболее удобно измерять с помощью окислительно-восстановительного потенциала (Eh) или редокс-потенциала водной среды (rН). Eh - это мера способности раствора отдавать или принимать электроны, то есть окисляться или восстанавливаться. Eh выражают в единицах разности электрического потенциала (в вольтах): чем больше положительна эта величина, тем выше концентрация окислителя по отношению к восстановителю в растворе, и наоборот. Способность среды противодействовать изменениям Eh аналогичная буферным свойствам растворов.
Обычно в средах за увеличение Eh ответственен кислород; при высоких положительных значениях Eh, обусловленных присутствием растворенного кислорода, подавляется рост всех анаэробных бактерий. В то же время положительные значения Eh, обусловленные присутствием в среде других веществ, могут не препятствовать росту даже строгих анаэробов. Устойчивость к Eh разных анаэробных бактерий различна. Однако в стандартной среде рост большинства анаэробных бактерий подавляется при величинах Eh выше -100 мВ. Для выращивания строгих анаэробов важно создание более восстановленных условий, чем те, которые обеспечиваются простым удалением кислорода из культуральной среды.
Eh раствора наиболее точно можно измерить электрометрически. Кроме того, чтобы найти Eh сред и культур, особенно для анаэробных бактерий, используют окислительно-восстановительные красители. Эти красители обратимо окисляются и восстанавливаются, причем в окисленном состоянии они окрашены, а в восстановленном - бесцветны. Разные красители восстанавливаются при различных значениях Eh. Величина Eh, при которой краситель окислен или восстановлен на 5 0 % при рН 7,0, называется стандартным окислительно-восстановительным потенциалом (E0).
В табл. 5 перечислены некоторые наиболее распространенные красители и их стандартные окислительно-восстановительные потенциалы.
Таблица 5. Стандартные окислительно-восстановительные потенциалы красителей при рН 7,0 и 30 °С
Краситель |
E0, мВ |
Метиленовый синий |
11 |
Индигодисульфонат |
-125 |
Феносафранин |
-252 |
Весь диапазон Eh от полного окисления до полного восстановления, который охватывается окислительно-восстановительным красителем, составляет около 120 мВ при постоянном значении рН. Например, метиленовый синий (E0 = 11 мВ при рН 7,0) почти полностью окислен (окрашенный) при Eh = 71 мВ и почти полностью восстановлен (бесцветный) при Eh = -49 мВ.
Окислительно-восстановительный потенциал зависит от рН. Например, метиленовый синий при рН 5,0, 7,0 и 9,0 восстановлен на 50 % при Eh, равном соответственно 101, 11 и -50 мВ. Точная зависимость E0 от величины рН связана с видом красителя. Для большинства красителей E0 увеличивается от 30 до 60 мВ при падении рН на единицу, и наоборот.
Многие анаэробные бактерии могут быстро снижать Eh среды, их способность к росту в среде зависит от физиологического состояния и количества инокулята. Задержка роста после инокуляции наблюдается до тех пор, пока клетки не снизят потенциал до уровня, при котором они могут расти. Этим зачастую объясняется отсутствие бактериального роста при внесении в среду малых посевных доз. Чтобы снизить окислительновосстановительный потенциал до оптимального уровня, в среды добавляют восстанавливающие агенты. При этом следует помнить, что добавляемые вещества должны быть нетоксичны в используемых концентрациях. Восстанавливающие агенты, широко используемые при культивировании анаэробов, приведены в табл. 6.
Таблица 6. Восстанавливающие агенты, применяемые при культивировании анаэробов
Соединения |
Е0, мВ |
Концентрация в среде |
Тиогликолат натрия |
<-100 |
0,05% |
Цистеин х HCl |
-210 |
0,025% |
Na2S х 9 H2O (или H2S) |
-571 |
0,025% |
Динамика окислительно-восстановительного потенциала клеток в процессе периодического культивирования является одним из наиболее удобных показателей для обнаружения эффекта ингибирования. В культурах бактерий обнаружены два типа изменений Еh. Первый тип характерен для непрерывно растущих культур и выражается в постепенном падении Еh пропорционально плотности культуры. Второй тип изменений Еh происходит в критических для жизнедеятельности бактерий ситуациях и связан с воздействием на электрод поверхности клеток и растворимых редокс- агентов.
Изменения второго типа, носящие характер скачка Еh в область отрицательных значений, регистрировались при исчерпании в среде глюкозы, аммония, при переходе с одного источника углерода и энергии или азота на другой, в синхронных культурах в момент деления клеток, при температурном шоке растущих клеток, при введении в среду культивирования слабых проникающих кислот, снижающих внутриклеточный рН. Профиль скачка Еh зависит от рН среды, концентрации в среде одних ионов (К+, SO2-4) и не зависит от концентрации других (Na+, Са2+, Сl-). Изменения редокс-потенциала могут быть вызваны воздействием соединений на внутриклеточный рН: ацетатом или пропионатом и др.