Основи імунології - Курс лекцій М. В. Скок - Київ 2002
Розділ І. Імунохімія
Лекція 5. Взаємодія антиген-антитіло та методи її вивчення
Головною функцією антитіл (АТ) є специфічне зв’язування антигену (АГ). Це зв’язування нековалентне (утворюються електростатичні, водневі, гідрофобні, Ван-дер-Ваальсові зв’язки), обернене і може бути описаним кінетичною формулою хімічної реакції першого порядку:
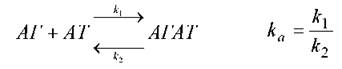
де k1 - константа асоціації, а k2 -константа дисоціації комплексу антиген-антитіло (АГАТ). Їх співвідношення характеризує ефективність утворення комплексу і називається константою афінності, ka. Швидкість прямої та зворотної реакції можна розрахувати. Коли реакція досягає рівноваги, v1 = v2 і kа може бути розраховано як
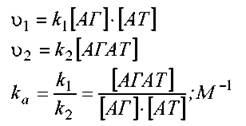
Із цього рівняння видно, що kа виражається у зворотних молях і дорівнює оберненій концентрації вільного антигену, при якій у рівновазі зайнята антигеном половина зв’язуючих центрів антитіл, [АТ]=[АГАТ].
Про специфічне зв’язування починають говорити, коли kа перевищує 105 М-1, тобто коли швидкість утворення комплексу перевищує швидкість його розпаду на 5 порядків. Для високоафінних антитіл kа > 108 M-1.
Константа афінності є важливою характеристикою антитіл, тому її треба вміти розраховувати. Для цього розроблено декілька математичних підходів, декілька рівнянь, найбільш вживаним є рівняння Скетчарда. Воно оперує такими поняттями як:
[В] (bound) - концентрація зв’язаного антигену;
[F] (free) - концентрація вільного антигену;
n - кількість центрів зв’язування антитіл (ціле антитіло має два центри зв’язування, а Fab фрагмент - один).
Рівняння Скетчарда:
![]()
Уявимо, що до розчину антитіл ми поступово додаємо антиген. При цьому спочатку весь антиген зв’язується і [F] << [В]. По мірі додавання антигену [B] збільшується, але збільшується і [F], тому співвідношення [B]/[F] зменшується. Графічно це виражається як лінійна залежність В/F від В, і ка може бути розраховано як тангенс кута нахилу прямої (Рис. 3А).
Згідно із запропонованим рівнянням, графік Скетчарда - це пряма лінія. Однак при аналізі сироваткових антитіл виявилося, що графік Скетчарда, побудований за експериментальними даними, має нелінійну форму, тобто по мірі зростання концентрації антигену ка зменшується (Рис. 3Б). Це явище пов’язане із гетерогенністю сироваткових антитіл. Сироваткові антитіла - це суміш антитіл із різною афінністю до антигену. Коли ми додаємо до розчину антитіл перші порції антигену, в реакцію вступають найбільш афінні антитіла, для зв’язування яких потрібна найменша концентрація антигену. По мірі зростання концентрацій антигену його починають зв’язувати все менш афінні антитіла, і реальний графік Скетчарда - це інтегральна крива kа усіх популяцій сироваткових антитіл (а їх може бути до 300 на одну антигенну детермінанту). Прямий, класичний вид графіка Скетчарда можна отримати тільки для моноклональних (мієломних чи гібридомних) антитіл. Крім того, слід взяти до уваги, що ми маємо справу із бівалентними антитілами (а у випадку IgM - із п’ятивалентними). Зв’язування двох Fab не є рівнозначним: зв’язування першого може полегшити або, навпаки, ускладнити зв’язування інших.
Більшість природних антигенів не є моновалентними, а несуть декілька антигенних детермінант. Тому у фізіологічних умовах можна говорити не про афінність взаємодії у чистому вигляді, а про інтегральну, усереднену величину спорідненості антигену до антитіла, яка отримала назву авідності. Реально авідність вище суми афінностей, що до неї входять. Це легко бачити із математичних рівнянь.
Термодинамічно, kа визначається різницею вільної енергії ΔG між станами антигену і антитіл, коли вони не взаємодіють, і після утворення комплексу. R - газова постійна, а Т - абсолютна температура. Для реакції антиген-антитіло ΔG = -31,5 - -43,2 КДж/моль (порівняно із -229,53КДж/моль для утворення двох ковалентних зв’язків Н-О у молекулі води), тобто реакція іде із зменшенням вільної енергії і є енергетично вигідною. Надлишок енергії використовується на необхідні конформаційні зміни в антигені та антитілі для досягнення оптимальної комплементарності. Зважаючи на те, що як антигенні детермінанти антигену, так і активні центри антитіл мають підвищену атомну мобільність, стає зрозумілим, що вони взаємно конформують один одного. Для зв’язування двох антигенних детермінант двома активними центрами антитіл сума звільненої енергії пропорційна сумі логарифмів, тобто величини kа не складаються, а перемножуються.
Підвищення авідності при мультивалентному зв’язуванні антигену з антитілом має велике фізіологічне значення для підвищення ефективності зв’ язування бактерій, їх токсинів, вірусів і т. і.
Експериментальне визначення Ка.
Згідно із рівнянням Скетчарда, визначити Ка можна, якщо вміти вимірювати концентрацію вільного і зв’язаного антигену у декількох точках титрування антитіл антигеном. Для цього можуть бути використані декілька експериментальних підходів.
1. Рівноважний діаліз.
Цей метод був запропонований для визначення Ка зв’язування антитіл із низькомолекулярними гаптенами, що можуть бути діалізовані через напівпроникну мембрану. Суть методу полягає в тому, що антиген вносять у дві камери, розділені мембраною. Між ними встановлюється концентраційна рівновага. При внесенні антитіл до камери 1 частина антигену зв’язується з ними і концентрація вільного антигену зменшується. Ініціюється переніс вільного антигену в камеру 1 із камери 2 і встановлюється нова рівновага. Тепер концентрація антигену у камері 2 дорівнює концентрації вільного антигену у камері 1, а кількість зв’язаного антигену можна розрахувати як різницю початкової концентрації внесеного і вільного антигену. Додаючи різні концентрації антитіл, можна знайти концентрації вільного і зв’язаного антигену для декількох точок і побудувати графік Скетчарда. Саме таким чином було вперше розраховано Ка для мієломних антитіл.
2. Гасіння флуоресценції.
Цей метод використовують тоді, коли зв’язування антигену змінює оптичні параметри антитіл, наприклад, гасить флуоресценцію залишків триптофану в активному центрі. Кожному значенню концентрації антигену відповідає своє значення флуоресценції і можна розрахувати концентрації вільного і зв’язаного антигену.
Методи визначення Ка є частиною великої групи методів вивчення взаємодії антигену з антитілом, які використовуються також для визначення присутності і кількості антигенів і антитіл у біологічних сумішах. Вони необхідні, наприклад, для діагностики різних фізіологічних станів організму. Так, діагностика вагітності - це часто визначення трофобласт-специфічного глобуліну у крові чи сечі жінки. Діагностика багатьох ендокринних порушень потребує точного визначення рівня того чи іншого гормону. При інфаркті міокарду однією із найбільш ранніх ознак некротичного процесу, що відбувається, є поява в крові міоглобіну серцевого м’язу, рівень якого корелює із об’ємом ураження. Використання для цього саме імунохімічних методів є переважним, оскільки вони базуються на високій специфічності взаємодії антиген-антитіло. Використання моноклональних антитіл дозволило максимально стандартизувати ці методи, зробити їх надійними та відтворюваними. З іншого боку, визначення антитіл у сироватках чи інших біологічних рідинах теж часто є необхідним, наприклад, для оцінки успішності вакцинації. Визначення антитіл проти віруса СНІДу є головним діагностичним тестом на зараження цим вірусом. Таким чином, визначення антигенів та антитіл часто є необхідним у клінічній практиці. Воно потребує дуже чутливих методів, тому що більшість гормонів, ростових факторів та антитіл знаходяться в організмі у слідових кількостях. Саме тому в останні десятиріччя багато уваги приділялося розробці чутливих методів визначення антигенів і антитіл.
Методи імунохімічного аналізу.
1. Преципітація.
Класичну преципітацію в розчині можна спостерігати при наявності полівалентного антигену та принаймні бівалентних антитіл. При поступовому додаванні антигену до антитіл (або навпаки) при певному їх співвідношенні розчин замутнюється утворенням осаду - преципітату. При подальшому додаванні антигену (антитіл) преципітат зникає. Поява преципітату обумовлена утворенням високомолекулярних комплексів, просторової сітки, що складається із багатьох молекул антигену і антитіл. Як при надлишку антигену, так і при надлишку антитіл утворюються низькомолекулярні розчинні комплекси (Рис.4). Співвідношення антиген-антитіло, коли спостерігається утворення преципітату, називається точкою еквівалентності.
Преципітат у розчині побачити і зафіксувати не так просто, тому було розроблено методи преципітації у гелі. Це дуже наочний метод. Він не має тієї чутливості, що сучасні радіоімунні чи імуноферментні методи, але у свій час відіграв значну роль в імунохімічному аналізі.
Суть методу полягає у тому, що реакція антиген-антитіло відбувається в агаровому чи агарозному гелі, структура якого дозволяє дифузію як антигену, так і антитіл. При досягненні точки еквівалентності в гелі утворюється дуга преципітації, яку легко побачити просто оком або підсилити спеціальними барвниками. При зміні концентрації антигену або антитіл в розчині, що вноситься, положення дуги преципітації змінюється. За формою та положенням дуги можна визначити приблизну концентрацію антитіл чи антигену, їх гомогенність (при наявності декількох антигенів і антитіл утворюється декілька дуг), а також спорідненість різних антигенів.
Є декілька модифікацій цього методу.
1) Радіальна дифузія по Манчіні, коли один із компонентів вносять безпосередньо в гель, а другий - в лунку, вирізану в гелі. Дифузія антигену (антитіла) із лунки утворює при досягненні точки еквівалентності кільце преципітації, радіус якого залежить від концентрації антигену і антитіл.
2) Преципітація в гелі по Ухтерлоні. Обидва компоненти вносять у лунки, вирізані в гелі, і вони дифундують назустріч одне одному. Утворюються дуги преципітації, положення і форма яких залежать від концентрації антигену і антитіл.
3) Імуноелектрофорез - поєднання електрофорезу та імунопреципітації. У класичному варіанті, антиген вносять у лунку, з якої він мігрує під дією електричного струму і розподіляється на фракції в гелі. Антитіла вносять у канавку, що вирізано вздовж геля. Фракції антигену дифундують назустріч антитілам і утворюють дуги преципітації, кількість і положення яких характеризують даний антиген і антитіла. Такий підхід використовують для аналізу суміші антигенів в біологічних рідинах, або складних бактеріальних антигенів.
4) Модифікацією імуноелектрофорезу є ракетний електрофорез, у якому антиген розділяється електрофоретично, а гель, куди він потім дифундує, містить антитіла. Дуги преципітації в такому випадку утворюються у вигляді ракет; чим більше концентрація антигену, тим вище »ракета».
5) При перехресному імуноелектрофорезі спочатку розділяють електрофорезом антиген, а потім електричний струм накладають в перпендикулярному напрямку в гель, що містить антитіла. Це вже більш кількісний метод, тому що за площею пику можна розрахувати концентрацію антигену.
2. Аглютинація.
Якщо антитіла додавати не до розчинного, а до корпускулярного антигену (наприклад, до клітин бактерій), то утворюється не преципітат, а аглютинат. У природних умовах це механізм знищення бактерій, а в експерименті він може бути використаний для визначення у суміші наявних антигенів чи антитіл. Як корпускулярний антиген часто використовують еритроцити. Ці червоні клітини крові утворюють аглютинат, який добре видно неозброєним оком. Певна річ, так можна виявити тільки антитіла до антигенів еритроцитів. Щоб розширити можливості цього методу, еритроцити модифікують бажаним антигеном. Так, методом гемаглютинації можна визначити антитіла до будь-якого розчинного антигену. Замість еритроцитів, можна взяти забарвлені кульки, наприклад, частки полімерного латексу, модифікованого потрібним антигеном; тоді це називається латекс-аглютинацією.
3. Аналіз антигенів та антитіл за допомогою мітки.
Методи преципітації в агарі дозволяють визначати мікрограмові кількості антигену. Революційним кроком в імунохімічному аналізі стало використання радіоактивних міток, започатковане у 70-х роках, яке дозволило підвищити чутливість методу на шість порядків: стало можливим визначати пікограмові кількості антигену.
Першим ізотопом, яким стали мітити білки, був 131І. Робота з ним була складною і небезпечною, тому що цей ізотоп випромінює жорстку гамма-радіацію і має дуже короткий період напіврозпаду - 8 діб. Пізніше перейшли на більш зручний ізотоп 125І, який дає м’яке гамма- і бета-випромінювання і має період напіврозпаду півтора місяці. Він легко приєднується до тирозинових залишків в білках і по сьогодні широко використовується в експериментах. Якщо треба помітити білок, що синтезується в досліджуваних клітинах, використовують метіонін, мічений 35S, який додається в культуральне середовище і включається у синтезовані білки; це так і називається - біосинтетична мітка.
Радіоімунний аналіз (РІА) є потужним методом визначення kа. Суть його полягає в тому, що антиген, мічений радіоактивним ізотопом, може бути легко кількісно ідентифікований у будь-якій суміші. Завданням є розділити зв’язаний і вільний антиген. Для цього часто використовують метод преципітації у розчині; осад відділяють від розчинного антигену центрифугуванням. Полегшити утворення преципітату можна за допомогою других антитіл (анти-імуноглобулінових) або висадивши комплекс сульфатом амонію. Цей підхід має певні обмеження, оскільки деякі антигени теж висаджуються сульфатом амонію. Можна також використати нерозчинні частки (найчастіше використовують гранули агарози), до яких пришито якійсь агент, що зв’язує антитіла та їхні комплекси з антигеном. До таких агентів відносяться білки А і G. Ці білки входять до складу мембран стафілококків і мають властивість міцно зв’язувати імуноглобуліни певних класів за їх Fcфрагмент. Експеримент проводять таким чином. Спочатку до антигену додають специфічні антитіла, інкубують деякий час разом, щоб утворився комплекс, а потім додають гранули агарози з білком А (G) і комплекси антиген-антитіло відділяють від антигену, що не зв’язався, шляхом центрифугування. В осаді визначають зв’язаний антиген, а в супернатанті - вільний.
В останні двадцять років широко розповсюджено сорбційні імунологічні методи. Суть їх у тому, що один із компонентів системи антиген-антитіло сорбують на твердій фазі (полістиролі або нітроцелюлозі). Комплекс антиген-антитіло теж утворюється на твердій фазі і може бути відділений від вільного антигену шляхом простого відмивання.
Радіоімунні методи є високочутливими, але все ж таки небезпечними для людей, що їх використовують, і потребують спеціальних мір захисту від радіації, спеціальних заходів по захованню радіоактивних відходів. Розпад ізотопів теж накладає обмеження на їх використання. Тому багато зусиль було прикладено для того, щоб розробити метод, який по чутливості не уступав би радіоімунному, але був більш зручним і небезпечним. Такими виявилися імуноферментні методи.
Суть цих методів полягає в тому, що антитіла ковалентно кон’югують із ферментом, продукт реакції якого легко визначити по забарвленню, флуоресценції, зміні кислотності чи електричного потенціалу.
Перевага ферментної мітки над радіоактивною полягає у тому, що ферменти:
- нешкідливі для здоров’я людини;
- стабільні при зберіганні;
- реакція розвивається з часом і кількість накопиченого продукту реакції з часом зростає.
Найбільш поширені ферменти, які використовують для мітки, - пероксидаза та лужна фосфатаза. Субстратом пероксидази є перекис водню. Як правило, до реакції додають так званий хромогенний субстрат, який перетворюється у спряженій реакції продуктом розкладення перекису водню. В результаті утворюється забарвлений продукт, який можна ідентифікувати просто оком, під мікроскопом або фотометрично, в залежності від типу експерименту. Для пероксидази такими субстратами є, наприклад, о-фенилендіамін, діамінобензидин та α-хлоро-1-нафтол.
Постановка експериментів.
1. Мічений антиген. Визначення концентрації антигену у біологічному матеріалі.
Мічений антиген змішують із специфічними антитілами у різних співвідношеннях, щоб отримати криву зв’язування і визначити кількість антигену, необхідну для зв’язування всіх антитіл (Рис. 5А). Вибирають таку концентрацію антигену, щоб зв’язування антитіл знаходилося в лінійному діапазоні кривої, як правило, 50% від насичення. Далі, змішавши мічений антиген і антитіла у такому співвідношенні, починають додавати немічений антиген - отримують криву конкуренції зв’язування міченого антигену неміченим. (Рис. 5Б). Якщо тепер, замість неміченого антигену, додати пробу, що містить невідому кількість антигену, по кривій конкуренції можна розрахувати, скільки антигену міститься у пробі.
У цьому методі, так само, як і для визначення kа, необхідно розділити мічений антиген, що зв’язався з антитілами, і вільний антиген. Для цього також використовують преципітацію або сорбційні підходи. Як правило, для цього використовують радіоактивно мічений антиген.
2. Мічені антитіла. Визначення антитіл.
Найбільш поширеним зараз є метод сорбційного імуноферментного аналізу (ІФА), який англійською мовою називається красивим словом ELISA (enzyme-linked immunosorbent assay). Суть його полягає в тому, що антиген сорбують на поверхні лунки полістирольного планшету. Сорбція неспецифічна і йде за фізико-хімічними законами. Природа зв’язків білків із поверхнею пластика досі не з’ясована. Якщо антигену недостатньо, щоб закрити всі потенційні центри зв’язування, другим кроком лунку блокують нейтральним білком (наприклад, сироватковим альбуміном). Потім додають розчин, що містить антитіла. Антитіла зв’язуються з сорбованим антигеном, а ті, що не зв’язалися, відмиваються (спеціальним розчином або просто водою). Тепер необхідно виявити антитіла, що зв’язалися. Для цього, як правило, використовують другі антитіла (антитіла проти перших антитіл), мічені ферментом. Їх теж інкубують у лунках, відмивають ті, що не зв’язалися, а потім додають розчин субстрату. Фермент починає перетворювати його, і накопичення забарвленого продукту пропорціональне кількості зв’язаних других, а значить, і перших антитіл (Рис. 6А).
У такій постановці експерименту теж можна визначати антиген. Якщо разом із першими антитілами додати розчинний антиген, то він буде конкурувати із сорбованим за зв’язування з антитілами, і антитіл на твердій фазі зв’яжеться тим менше, чим більше додано розчинного антигену (Рис. 6Б.)
Для визначення антигену поширений також так званий сендвіч-метод, коли перші антитіла сорбують на пластик, додають пробу, що містить антиген, а потім антитіла до іншої антигенної детермінанти антигену, що також зв’язуються з ним. Ці антитіла можуть бути міченими самі по собі або бути проявленими другими міченими антитілами (Рис. 6В). Кількість зв’язаних «верхніх» антитіл пропорційна кількості антигену в пробі.
Використання других антитіл має своєю метою підсилення кінцевого сигналу, що реєструється в імуноферментному аналізі, і, відповідно, підвищення чутливості методу, оскільки з однією молекулою перших антитіл може зв’язатися декілька молекул мічених других антитіл. Якщо використання других антитіл за якихось причин є небажаним, використовують інші ампліфікаційні системи, наприклад, білки А і G або дуже популярну зараз комплементарну пару авідин-біотин.
Авідин - білок курячого яйця, який має властивість міцно зв’язувати вітамін Н (біотин). Використовують також стрептавідин, який видобувають із стрептококків. Біотин легко приєднати до антитіл, а виявити його наявність можна за допомогою міченого авідину (стрептавідину). Метод можна ускладнити, додавши ще один крок: біотинільовані антитіла, стрептавідин, біотинільована пероксидаза. Чим більше кроків, тим сильніше ампліфікація сигналу, але й тим більше потенційних ускладнень. В цілому, імуноферментні методи менш чутливі, ніж радіоімунні, але у кращих зразках вдавалося досягти порівняної чутливості, особливо при використанні субстратів, що флуоресцують або мають хемілюмінесценцію. Зараз існує широкий вибір комерційних продуктів, що дозволяють виконувати будь-який варіант аналізу. Розроблене спеціальне обладнання для швидкої обробки великої кількості проб, багато процесів автоматизовано.
Принцип сорбційного ІФА використовується не тільки у вигляді ELISA. Замість полістирольного планшету може бути використано іншу тверду фазу, наприклад нітроцелюлозу, яка теж неспецифічно зв’язує білки. Метод у такому випадку називається імуно-дот (від англійського dot - плямка). Використання нітроцелюлози як носія дозволило поєднати імунохімічні методи із електрофорезом - у вигляді так званого імуноблоту (Western blot). В такому випадку антиген розділяють на фракції електрофорезом в поліакриламідному гелі, білки переносять на нітроцелюлозу шляхом простої дифузії або електропереносу, а потім їх проявляють антитілами за тими ж принципами, що і в ELISA. Відміною є те, що в разі імуноблоту використовують інші хромогенні субстрати - ті, що дають нерозчинний продукт, який залишається зв’язаним із нітроцелюлозою.
Як тверду фазу можна використати кульки латексу, на які сорбують антиген чи антитіла. І, нарешті, такі ж підходи використовують, коли антиген природно зв’язаний із твердою фазою: на поверхні чи всередині клітин. На такому принципі побудовані методи імуноцитохімії та проточної цитофлюориметрії.
Якщо антиген міститься на поверхні клітин, їх обробляють антитілами на холоді або після фіксації параформальдегідом. Другі антитіла (або авідин чи білок А) можуть бути міченими ферментом (тоді їх спостерігають під мікроскопом за появою забарвлення), радіоактивною міткою (тоді кількість зв’язаних антитіл міряють лічильником) або флюорохромом. В останньому випадку клітини можна аналізувати просто під флуоресцентним мікроскопом, або методом проточної цитофлюориметрії. Пристрій, створений для такого виду аналізу, називається цитофлюориметр. Він має у своєму складі лазер, у промені якого клітини і розділяються на ті, що світяться, і ті, що ні. Їх можна навіть відсортувати на окремі популяції. Можна також помітити клітини одразу двома чи трьома ( в останніх варіантах навіть чотирма) різними антитілами, зв’язаними із різними флюорохромами. Як правило, вони збуджуються світлом однієї довжини хвилі, а випромінюють у різних діапазонах. Так можна визначати експресію на клітині відразу декількох антигенів.
Для того, щоб визначити, які антигени є у клітини всередині, її треба зробити прониклою для антитіл (як правило, антитіла всередину клітини самі не проникають). Для цього клітини фіксують сумішшю, що містить етанол. Саме так можна побачити під мікроскопом плазматичні клітини, наповнені антитілами.
Щоб ідентифікувати клітини, які секретують антитіла, використовують модифікацію ELISA, що отримала назву ELISPOT. В цьому методі клітини витримують на нітроцелюлозних фільтрах, вкритих антигеном. Секретовані антитіла зв’язуються із антигеном навкруги клітини і після проявлення другими антитілами і субстратом проявляються як кола або плями. Цей метод з’явився як спрощений варіант методу локального гемолізу у гелі, який був дуже поширений ще десять років тому. У тому варіанті клітини вносили в агаровий гель, що містив еритроцити (самі по собі або модифіковані антигеном). Антитіла, що було секретовано, зв’язувалися із еритроцитами, і після обробки комплементом у цих місцях утворювалися зони гемоліза еритроцитів - світлі плями на червоному тлі геля. (Саме таким методом було знайдено гібридоми, що секретували специфічні антитіла, в експерименті Кьолера). ELISPOT теж можна проводити в агарі в лунках полістирольних планшетів.
Таким чином, принцип імунохімічного аналізу антигенів і антитіл має багато модифікацій і може бути використаний для вирішення багатьох експериментальних та діагностичних завдань. Для кожного конкретного завдання підбирають підходящу модифікацію, виходячи із потреб чутливості і можливостей ідентифікації кінцевого продукту.