Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Структура глобулярных белков
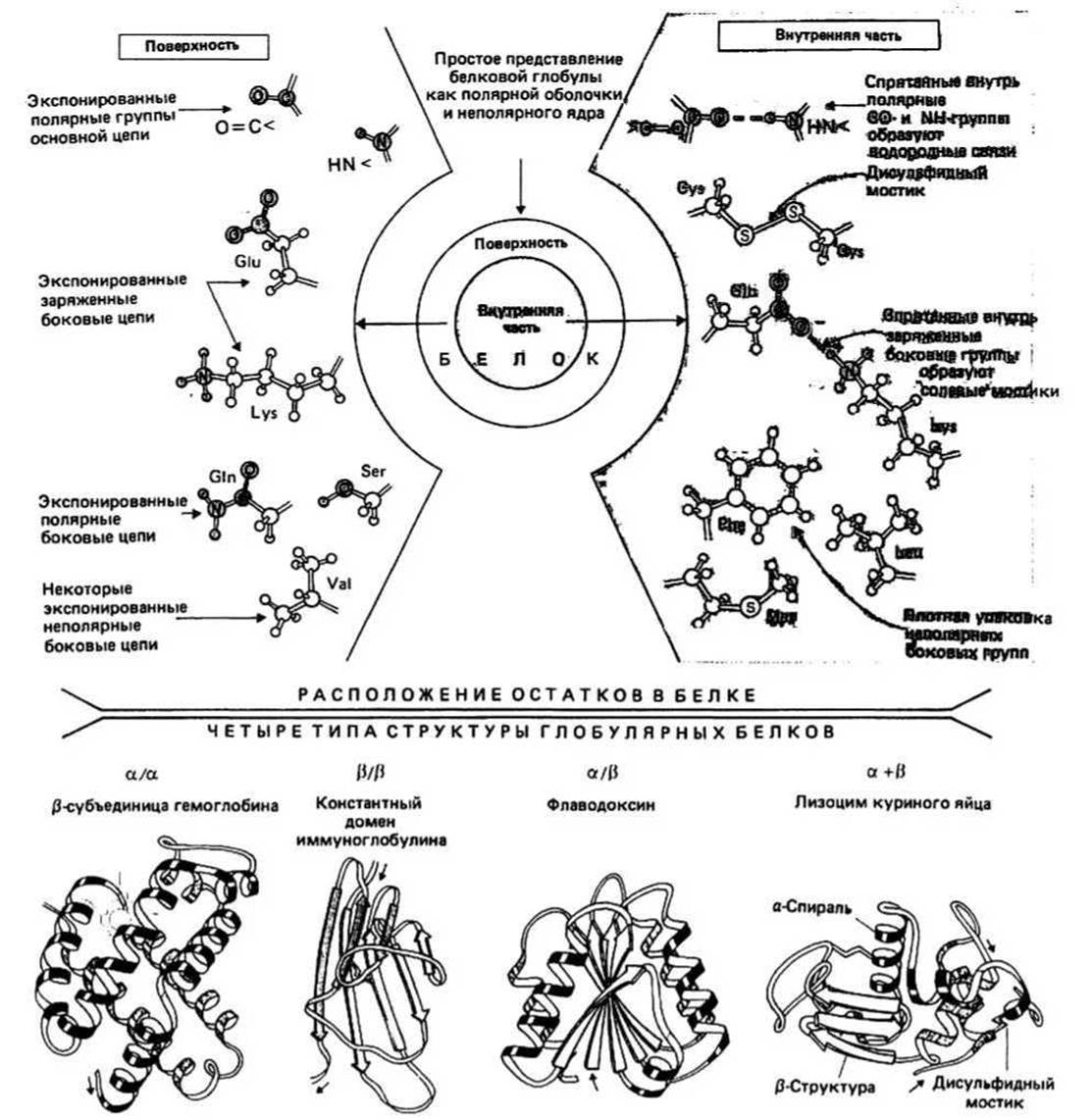
Рис. 10.1.
Под третичной структурой белка понимают расположение в пространстве всех атомов одиночной полипептидной цепи. Некоторые белки состоят из нескольких полипептидных цепей. Каждая цепь — это одна субъединица, или мономер. Димеры содержат две полипептидные цепи, тримеры — три, а тетрамеры — четыре. Молекулы гемоглобина представляет собой типичный тетрамер, в котором имеются две идентичные сс-цепи и две идентичные ß-цепи.
Термин четвертичная структура белка означает взаимное расположение в пространстве мономеров, формирующих молекулу белка, который состоит из нескольких субъединиц.
С помощью рентгеноструктурного анализа белковых кристаллов расшифрована трехмерная структура более ста различных белков. Положение большинства атомов, за исключением атомов водорода, может быть определено с точностью 0,1 нм. До сих пор кристаллографическими методами изучались в основном водорастворимые глобулярные белки, поэтому все, что будет сказано далее, касается именно этого класса белков.
На поверхности белковой глобулы сосредоточены в основном полярные группы и заряженные атомы, предпочитающие взаимодействовать с водным окружением. Сюда относятся полярные группы >N—H и >С=О основной цепи, заряженные атомы боковых цепей остатков Gli-, Aspa, Lys+ и Arg+ и полярные боковые цепи таких остатков, как Ser, Thr, Asn, Gin и др. Между противоположно заряженными группами (например, между Gli- и Lys+) на поверхности белковой глобулы иногда образуются ионные связи, которые называются солевыми мостиками (гл. 7). Кроме того, на поверхности имеется некоторое количество неполярных атомов.
Внутренняя часть белковой глобулы представляет собой неполярную среду, защищенную от контактов с окружающим растворителем благодаря плотной упаковке атомов. Гидрофобное ядро образовано неполярными группами, входящими главным образом в состав алифатических и ароматических боковых цепей Ala, Val, He, Leu, Met, Phe и Тrр. Полярной или заряженной группе энергетически невыгодно находиться в таком гидрофобном окружении, если она при этом не взаимодействует с другой полярной группой или с атомом, имеющим противоположный заряд. Поэтому оказавшиеся внутри глобулы >N — Н- и >С=О-группы основной цепи образуют между собой водородные связи, формируя в результате а-спирали и ß-слои. Точно так же находящиеся внутри глобулы противоположно заряженные группы (например, Gli- и Lys+) образуют ионные связи, известные под названием солевых мостиков.
Дисульфидный мостик — это ковалентная связь между двумя цистеиновыми остатками. Такие мостики встречаются в некоторых секреторных белках (гл. 6). Мостик может быть расположен как внутри глобулы, так и на ее поверхности. Во многих белках нет дисульфидных мостиков, хотя имеются цистеины в восстановленной форме.
Эксперименты по ренатурации показывают, что биологически активный белок после денатурации может самопроизвольно свернуться в исходную конформацию с восстановлением своей активности. Следовательно, при физиологических условиях состояние белка, имеющего нативную трехмерную структуру, термодинамически стабильно, т. е. соответствует минимуму свободной энергии. Более того, эти эксперименты говорят о том, что информация, необходимая для сворачивания белка в нативную конформацию, заложена в его аминокислотной последовательности.
Поэтому в принципе можно теоретически предсказать трехмерную структуру любого белка, исходя из его аминокислотной последовательности. Это было бы полезно в тех случаях, когда нельзя определить конформацию молекулы кристаллографическим методом. Хотя точность предсказания вторичной структуры белка (гл. 9) теперь довольно высока, предсказание третичной структуры остается нерешенной проблемой молекулярной биологии.
Сворачивание молекулы белка из развернутого состояния должно осуществляться либо одним, либо очень немногими путями. Пусть белковая молекула состоит из 50 остатков, каждый из которых может принимать 10 разных конформаций. Тогда общее число возможных конформаций составит 1050, и если характерное время молекулярных перестроек составляет 10-13 с, то для того чтобы перепробовать все конформаций хотя бы по одному разу, потребуется примерно 1037 с (~1030 лет). Следовательно, должен существовать направленный путь сворачивания белка, ограничивающий этот перебор. Одно из предположений заключается в том, что отдельные участки белковой молекулы, например а-спирали, формируются в первую очередь и служат как бы центрами конденсации для остальных частей молекулы.
Стабильность свернутой молекулы белка в водном окружении крайне низка: для лизоцима из белка куриного яйца она составляет 40 кДж/моль. Основной движущей силой процесса сворачивания является энтропийный, гидрофобный эффект (гл. 7), вследствие которого неполярные группы стремятся выйти из водного окружения и оказаться внутри глобулы. К дальнейшей стабилизации структуры, по-видимому, приводит образование внутренних водородных связей, а также дисульфидных и солевых мостиков. Существует и энтропийный эффект, препятствующий сворачиванию. Этот эффект обусловлен тем, что для свернутой молекулы белка число разрешенных конформаций основной и боковых цепей меньше, чем у развернутой, а уменьшение числа конформаций энтропийно невыгодно (т.е. приводит к уменьшению энтропии).
Одни участки полипептидной цепи, находящиеся внутри свернутой белковой глобулы, являются а-спиралями или же (ß-структурами, другие принимают нерегулярные, но вполне определенные конформаций (coil-участки). Полипептидная цепь, образующая белковую глобулу, свернута довольно сложным образом. Это иллюстрирует рис. 10.2, где при помощи отрезков, соединяющих последовательные Са-атомы, изображена молекула лизоцима. (Сравните такое представление структуры белка с более упрощенным, приведенным на рис. 10.1).
Домены в крупных белках при сворачивании полипептидной цепи часто образуются две или более пространственно разделенные области, называемые доменами. По своей структуре каждый домен напоминает отдельный небольшой белок. Обычно в одном домене содержится от 40 до 300 остатков. В молекуле иммуноглобулина (гл. 40) как тяжелая, так и легкая цепи образуют несколько доменов, один из которых, константный домен легкой цепи, изображен на рис. 10.1.
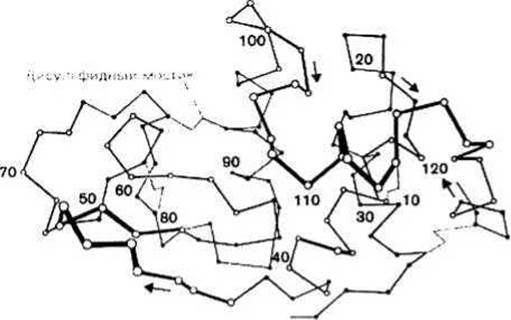
Рис. 10.2.
Все домены можно подразделить на четыре класса: а/а, ß/ß, а/ß и а + ß, в зависимости от взаимного расположения в цепи а-спиральных и ß-структурных участков. Примеры доменов каждого класса приведены на рис. 10.1; полипептидная цепь изображена в виде ленты, при этом а-спиральные участки представлены спиралями, ß-структурные — стрелками, а нерегулярные — светлыми петлями. Боковые цепи не показаны, хотя во всех белках пространство между атомами основной цепи заполнено атомами боковых цепей. а/а-Домены состоят в основном из а-спиралей, ß-участки в них практически отсутствуют. а- Спирали упакованы таким образом, что неполярные боковые цепи оказываются спрятанными внутрь. В ß/ß-доменах имеется несколько ß-цепей и нет (или почти нет) а-спиралей. Этот класс доменов представлен на рисунке константным доменом молекулы иммуноглобулина, состоящим из двух упакованных вместе ß-слоев. На диафамме видно, что ß-слои не плоские, а слегка скручены. В а/ß-доменах а- и ß- участки чередуются вдоль цепи. Часто ß-участки образуют параллельный ß-слой, окруженный а-спиралями. В а + ß-доменах а- и ß-участки обычно располагаются в разных сегментах полипептидной цепи.
Упаковка субъединиц в мультимерном (состоящем из нескольких субъединиц) белке осуществляется благодаря взаимодействиям того же типа, что и при образовании третичной структуры белка. Обычно субъединицы бывают упакованы довольно симметрично (хотя не всегда имеет место полная симметрия), как, например, в молекуле гемоглобина, где четыре субъединицы располагаются в вершинах тетраэдра (гл. 15).
Внутренняя подвижность белков. Из экспериментов известно, что белки не являются жесткими структурами: отдельные их части перемещаются друг относительно друга, что позволяет говорить о внутренней подвижности белков. Во многих глобулярных белках, включая четыре белка, представленных на рис. 10.1, атомы основной цепи способны смещаться на 0,01 нм относительно среднего положения, а боковые цепи, находящиеся на поверхности белковой глобулы, имеют еще большую подвижность.