Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Структура фибриллярных белков

Рис. 11.1.
ФИБРИЛЛЯРНЫМИ называются белки, имеющие сильно вытянутую форму. Благодаря присущей этим белкам жесткости или эластичности они часто выполняют в живых организмах структурные функции.
Конформацию полипептидной цепи большинства фибриллярных белков можно отнести к одному из трех типов регулярной вторичной структуры: к коллагеновой спирали, (ß-слою, обнаруженному во многих разновидностях шелка, и к а-спиральной структуре, характерной для а-кератинов и тропомиозина.
КОЛЛАГЕН наиболее распространенный белок млекопитающих, образует основу сухожилий, костей, кожи, зубов и хрящей. Структурной единицей коллагенового волокна является тропоколлагеновая молекула, состоящая из трех полипептидных цепей, каждая из которых содержит около 1000 аминокислотных остатков. В зависимости от функции коллагена его полипептидные цепи либо идентичны, либо имеют довольно близкие последовательности.
Аминокислотный состав коллагена необычен. Во-первых, примерно одну треть всех остатков составляют остатки глицина, и, во-вторых, имеется большое число остатков пролина. Кроме того, в коллагене встречаются остатки двух аминокислот, обычно не обнаруживаемых в белках, — гидроксипролина и гидроксилизина. Боковые цепи этих аминокислот содержат гидроксильную (—ОН) группу, присоединенную к одному из углеродных атомов вместо атома водорода. Гидроксилирование осуществляется специфическими ферментами после включения пролина или лизина в полипептидную цепь коллагена.
Аминокислотная последовательность большей части цепи коллагена представлена регулярно повторяющимися единицами Gly—X—Y, где X и Y могут быть произвольными аминокислотными остатками. Пролин (Pro) чаще встречается в положении X, тогда как гидроксипролин (Hyp) — преимущественно в положении Y. Типичный фрагмент последовательности коллагена выглядит следующим образом:
—GLy— Pro—Hyp—Gly—Pro—Met—Gly—Pro- —Hyp—Gly—Leu—Ala-
Такая регулярная последовательность принимает конформацию, называемую коллагеновой спиралью. В участках из первых 16 остатков у N-конца и из последних 25 остатков у С-конца полипептидной цепи коллагена подобной регулярности в чередовании аминокислотных остатков не обнаруживается. Эти сегменты, называемые телопептидами, имеют конформацию, отличную от коллагеновой спирали. Одиночная пептидная цепь коллагена принимает форму спирали, в которой расстояние между аминокислотными остатками вдоль оси составляет 0,29 нм, а на один виток спирали приходится немного менее трех остатков. Спираль оказывается левой в том смысле, что если пальцы левой руки расположить так, чтобы они прослеживали путь G1—X2—Y3—G4, то большой палец будет указывать направление от N- к С-концу. Между атомами основной цепи одиночного полипептида водородных связей не образуется. Тем не менее такая конформация (значительно более вытянутая, чем а-спираль, у которой расстояние между остатками составляет 0,15 нм) оказывается предпочтительной для полипептидной цепи, содержащей массивные пирролидиновые кольца остатков пролина и гидроксипролина.
Термин тройная коллагеновая спираль применяется для описания структуры регулярной части молекулы тропоколлагена. В тройной коллагеновой спирали три одиночные коллагеновые цепи уложены параллельно и закручены одна вокруг другой, образуя похожую на канат витую структуру. Такое закручивание оказывается возможным благодаря наличию у левых одиночных коллагеновых спиралей правой сверхспирализации, которую можно наблюдать по результирующему смещению А-цепи при переходе от G1 к G4 (G1 и G4 — это глициновые остатки, стоящие соответственно в первом и четвертом положениях). Одиночная цепь коллагена содержит примерно 1000 остатков, а длина молекулы тропоколлагена составляет при этом около 300 нм.
Глицин - единственный остаток, который может располагаться вблизи оси тройной спирали, поскольку имеющегося там свободного пространства недостаточно для размещения любой другой, большей по объему боковой цепи. На один виток одиночной цепи приходится примерно три остатка, поэтому в каждом третьем положении аминокислотной последовательности должен стоять глицин. Боковые цепи остатков X и Y направлены в сторону от оси тройной спирали и могут быть большими по объему. В тройной спирали существуют водородные связи между >N—Н-группой каждого внутреннего глицинового остатка и >С=О- группой другой цепи.
Сборка коллагена начинается с синтеза в фибробластах молекул проколлагена. Проколлаген — это предшественник коллагена, имеющий дополнительные пептиды на В- и С-концах. В фибробластах молекулы проколлагена самопроизвольно сворачиваются в тройные спирали, в каждой из которых С-концы трех цепей связываются друг с другом дисульфидными мостиками. В таком виде тройные спирали секретируются из клетки и затем после удаления дополнительных пептидов проколлагена с помощью фермента, проколлагеновой пептидазы, превращаются в молекулы тропоколлагена.
Микрофибрилла представляет собой совокупность уложенных параллельно молекул тропоколлагена, каждая из которых сдвинута в продольном направлении относительно соседней на 67 нм (этот сдвиг называется D-уступом). Кроме того, между С-концом одной молекулы и N-концом следующей существует промежуток длиной 40 нм. Микрофибриллы, ассоциируя друг с другом, образуют фибриллу, а несколько фибрилл — коллагеновое волокно (рис. 11.2). Коллагеновые волокна стабилизируются с помощью ковалентных сшивок между полипептидными цепями и в результате оказываются слаборастяжимыми и весьма прочными, так как сколько-нибудь заметное удлинение волокон требует разрыва этих сшивок.
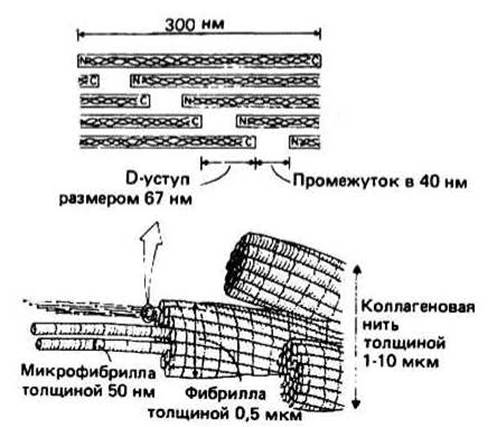
Рис. 11.2.
Соединительные ткани в таких образованиях, как кости, сухожилия и хрящи, обычно имеют сложную структуру и состоят из коллагена и других молекул, главным образом неорганических. В сухожилиях, как было показано, в промежутке между соседними коллагеновыми молекулами откладывается кальций. Аналогичная ситуация имеет место и в костях.
Шелк чаще всего имеет структуру антипараллельного ß-слоя, в котором ß-цепи уложены вдоль оси волокна. Во многих разновидностях шелка расстояние между ß-слоями поочередно составляет то 0,35, то 0,57 нм. Аминокислотная последовательность представляет собой в основном многократное повторение фрагмента Gly—Ala—Gly—Ala—Gly—Ser. Боковые цепи всех Ala и Ser при этом располагаются с одной стороны ß-слоя, а с другой стороны выступают атомы водорода глициновых остатков. ß-Слои упакованы таким образом, что друг с другом контактируют одноименные их поверхности. Расстояние между слоями, контактирующими по «глициновым» поверхностям, составляет 0,35 нм, а по поверхностям, в которых выступают остатки Ala и Ser, — 0,57 нм. Волокна шелка малорастяжимы, поскольку любое достаточно большое удлинение приводит к разрыву ковалентных связей в полипептидной цепи. Некоторая растяжимость тем не менее наблюдается и может быть обусловлена нарушением регулярности аминокислотной последовательности и появлением в цепи остатков с массивными боковыми группами, таких, как Туг, Arg, Asp и Glu. А этих местах ß-структура нарушается, полипептидная цепь принимает нерегулярную конформацию и может быть растянута без разрыва ковалентных связей.
КЕРАТИН — важный белковый компонент волос, шерсти, ногтей, когтей и перьев. В одной из форм, называемой а-кератином, в основе структуры полипептидной цепи лежит правая а-спираль. Предположение о том, что кератин имеет а-спиральную конформацию, было высказано Полингом и Кори для объяснения полученных Астбюри в 30-х годах данных по дифракции рентгеновских лучей на волокнах кератина. Однако шаг кератиновой спирали составил 0,51 нм, что меньше шага стандартной ос-спирали, равного 0,54 нм. Это связано с тем, что в кератине две, а возможно и три цепи закручиваются одна вокруг другой, образуя некую витую (coiled-coil) структуру, называемую протофибриллой. 11 протофибрилл формируют микрофибриллу, а пучок микрофибрилл — кератиновое волокно. а-Кератины легкорастяжимы, поскольку при вытягивании разрываются водородные связи и полипептидные цепи приобретают ß-структурную конформацию. При этом образуются межцепочечные водородные связи и формируются ß-слои. Кератины с такой структурой называются ß-кератинами.
ТРОПОМИОЗИН — лок, обнаруживаемый в мышцах (гл. 36) и состоящий из двух закрученных одна вокруг другой а-спиралей, подобно тому как это имеет место в а-кератине.