Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Нуклеиновые кислоты и гены
Структура ДНК

Рис. 18.1. Двойная спираль ДНК.
ДНК — дезоксирибонуклеиновая кислота — это биологическая макромолекула, носитель генетической информации во всех эукариотических и прокариотических клетках и во многих вирусах.
Исследования на пневмококках, проведенные Эвери, Мак-Леодом и Мак-Карти в 1944 г., свидетельствовали о том, что именно ДНК является генетическим материалом. Они рассмотрели две формы бактерий — инфекционную (вирулентную, обозначаемую S), образующую гладкие колонии на агаре, и мутантную, невирулентную (обозначаемую R), образующую шероховатые колонии. Эвери и его коллеги показали, что ДНК, выделенная из убитых теплом S-бактерий, способна трансформировать невирулентную R-форму в вирулентную, причем вирулентность трансформированных R-бактерий передавалась следующим поколениям. Отсюда следовало, что ДНК несет генетическую информацию.
Исследования бактериофага Т2, проведенные Херши и Чейзом в 1952 г., позволили получить дополнительные данные о генетической роли ДНК. Эти авторы пытались выяснить, какой компонент вируса - ДНК или белок — ответствен за заражение бактерий Е. coll. Они растили вирус в присутствии радиоактивных изотопов 32Р (чтобы пометить ДНК) и 35S (чтобы пометить белок) и инфицировали этим вирусом Е. coll. Оказалось, что инфицирующим агентом являются молекулы, содержащие 32Р. Таким образом, было показано, что информация, необходимая для образования новых вирусных частиц, содержится в вирусной ДНК.
ДВОЙНАЯ СПИРАЛЬ - МОДЕЛЬ СТРУКТУРЫ ДНК — была построена Уотсоном и Криком в 1953 г. Согласно этой трехмерной модели, молекула ДНК состоит из двух полинуклеотидных цепей, которые образуют правую спираль1 относительно одной и той же оси; отсюда название - двойная спираль. Направление цепей взаимно противоположное. Сахарофосфатный остов располагается по периферии двойной спирали, а азотистые основания находятся внутри, и их плоскости перпендикулярны оси спирали.
1 Точнее — винтовую линию. — Прим. ред.
Между основаниями образуются специфические водородные связи, в результате чего осуществляется так называемое уотсон-криковское спаривание. Аденин всегда образует водородные связи с тимином, а гуанин с цитозином. Таким образом, более объемные пурины всегда спариваются с пиримидинами, имеющими меньшие размеры. Это приводит к тому, что расстояния между С1'-атомами дезоксирибозы в двух цепях оказываются одинаковыми для AT- и CG-nap и равными 1,085 нм. В результате AT- и GC-пары включаются в двойную спираль без какого-либо заметного изменения геометрии остова.
Под комплиментарностью понимают взаимное соответствие последовательностей оснований в противоположных цепях ДНК. Если в одной цепи в каком- то месте стоит аденин, то в другой в этом месте должен находиться тимин, и наоборот, так чтобы между основаниями могли образовываться специфические водородные связи. Аналогично, если в одной из цепей в каком-то месте стоит гуанин, то в другой должен находиться цитозин, и наоборот. Комплементарность очень важна для копирования (репликации) ДНК (гл. 20, 21).
Соотношения между числом разных оснований в ДНК, установленные, установленные Чаргаффом и др. в 50-х годах, сыграли важную роль в построении двойной спирали. Чаргафф обнаружил, что у ДНК самого разного происхождения количество аденина равно количеству тимина, а количество гуанина — количеству цитозина, т.еА ≡ Ти G ≡ С. Эти равенства являются следствием избирательного спаривания оснований.
Геометрия двойной спирали такова, что соседние пары оснований находятся друг от друга на расстоянии 0,34 нм и повернуты на 36° вокруг оси спирали. На один виток спирали приходится, следовательно, 10 пар оснований (360°/36° = 10), и шаг спирали равен 3,4 нм (10 ∙ 0,34 нм). Диаметр двойной спирали равен примерно 20 нм. В двойной спирали ДНК образуются желобки. Это связано с тем, что сахарофосфатный остов расположен дальше от оси спирали, чем основания. В двойной спирали имеются два желобка — большой и малый.
Рентгенограммы волокон ДНК, полученные Франклин и Уилкинсом между 1950 и 1953 гг., дали очень важную для построения двойной спирали информацию. Идеализированная дифракционная картина (рис. 18.2) имеет вид креста из рефлексов (пятен), образующегося из-за регулярности структуры ДНК. Расстояние между слоевыми линиями отвечает периоду 3,4 нм, т. е. шагу двойной спирали, а сильный рефлекс на 10-й слоевой линии — периоду 0,34 нм, т. е. расстоянию между парами оснований. Эти параметры относятся к В-форме ДНК (см. ниже).
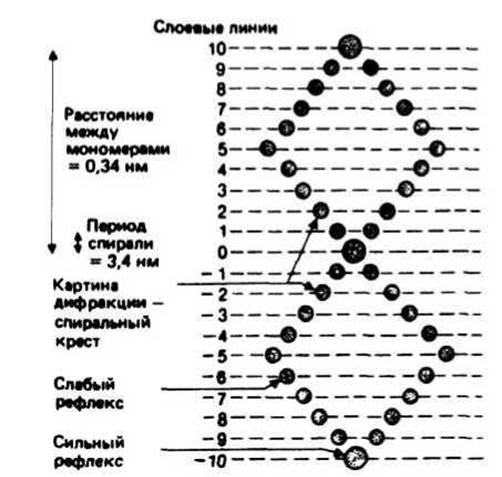
Рис. 18.2. Идеализированная картина дифракции от волокна ДНК. Анализ результатов этих измерений привел к построению модели ДНК.
Стабильность двойной связи обусловлена разными взаимодействиями. Отчасти за нее ответственны водородные связи между основаниями. Однако, по-видимому, более важную роль играет межплоскостное взаимодействие — стэкинг. При этом обеспечиваются не только выгодные вандерваальсовы контакты между атомами, но и возникает дополнительная стабилизация благодаря перекрыванию π-орбиталей атомов контактирующих оснований. Стабилизация осуществляется также за счет благоприятного гидрофобного эффекта, проявляющегося в том, что неполярные основания защищены от непосредственного контакта с растворителем. Напротив, сахарофосфатный остов с его полярными группами и заряженными атомами экспонирован, что также стабилизирует структуру.
Полиморфизм ДНК — это способность двойной спирали принимать различные конформации. Рентгеноструктурные исследования кристаллов полинуклеотидов1 выявили три основных типа структур — А-, В- и Z-формы. В-ДНК— это стандартная уотсон-криковская структура, в которой плоскости пар оснований перпендикулярны оси двойной спирали. В А-ДНК плоскости пар оснований повернуты примерно на 20° от нормали к оси правой двойной спирали. На виток спирали здесь приходятся 11 пар оснований. А-ДНК образуется при высушивании волокон В-ДНК. Z- ДНК — это левая спираль с 12 парами оснований на виток. Буква Z указывает на зигзагообразную форму сахарофосфатного остова ДНК в этой форме. Плоскости оснований примерно перпендикулярны оси спирали. В клетке ДНК обычно находится в В-форме, но отдельные ее участки могут находиться в А-, Z- или даже в иной конформации1.
1 Коротких полинуклеотидов, так называемых олигонуклеотидов. — Прим. ред.
Определение нуклеотидной последовательности ДНК (секвенирование) теперь не занимает много времени, и это крупное достижение позволило молекулярным биологам решить очень важную задачу определения структуры генов (гл. 26— 28). Широко применяются два метода секвенирования: метод химического расщепления Максама и Гилберта и метод обрыва цепи Сэнгера и др. Каждый из них может использоваться для секвенирования фрагментов ДНК длиной лишь несколько сотен оснований. Поэтому первый этап состоит в расщеплении длинных цепей (например, целых хромосом) на фрагменты, с которыми можно вести дальнейшую работу. Для этой цели применяют рестрицирующие ферменты. Рестрицирующие ферменты выделены из бактерий и бывают двух типов. При секвенировании используются только ферменты типа II, которые расщепляют (разрезают) двухцепочечную ДНК в местах со специфической последовательностью оснований, обычно имеющей размер 4—6 пар оснований (гл. 30). Рестрицирующих ферментов очень много, и каждый из них специфичен к определенной последовательности оснований. Например, фермент ЕсоRI из Е. coli разрезает последовательность в местах, обозначенных стрелками:
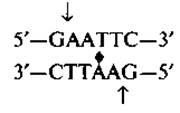
Главная особенность последовательностей оснований, расщепляемых рестрицирующими ферментами, заключается в том, что они, как правило, являются палиндромами: последовательности обеих цепей, прочитываемые от 5'- к 3'-концу, оказываются одинаковыми. Такие последовательности обладают осью симметрии 2-го порядка, обозначенной на рисунке знаком ♦.
1Образование Z-формы, крестообразных и иных структур стимулируется сверхспирализацией ДНК. — Прим. ред.
В случае метода химического расщепления сначала метят 5-конец молекулы ДНК радиоактивным 32РО4 с помощью фермента полинуклеотидкиназы. Затем ДНК обрабатывают соответствующими реагентами, расщепляющими эту цепь около определенных оснований. Такое расщепление проводят в ходе четырех параллельных реакций в условиях, когда разрыв происходит после А в одной из реакций, после G в другой, после С в третьей и после С и Т в четвертой. Условия реакций таковы, что получаются смеси, содержащие фрагменты всевозможной длины, отсчитываемой от меченого 5'-конца до каждой точки цепи, где находится данное основание. Например, если G находится в положениях 1, 5, 7 и 19 во фрагменте из 20 оснований, то одна из смесей, полученных в ходе деградации, будет содержать радиоактивные фрагменты длиной 5, 7 и 19 оснований, а также свободный G. С помощью электрофореза в полиакриламидном геле каждую из четырех смесей разделяют на фрагменты разной длины. Затем гель помещают на фотопленку, на которой появляется почернение в тех местах, где находился радиоактивный материал (этот процесс называется радиоавтографией). Последовательность оснований прямо считывается с пленки, как это показано, например, на рис. 19.3.
Метод обрыва цепи использует другой подход. Он основывается на синтезе радиоактивно меченной комплементарной цепи ДНК с использованием в качестве матрицы нативной ДНК (гл. 20, 21). Синтез осуществляется с помощью фермента ДНК-полимеразы I (гл. 20, 21). В реакционной смеси присутствуют четыре немеченных дезоксирибонуклеозидтрифосфата, из которых строится комплементарная цепь ДНК. Однако помимо них в системе находится модифицированная форма одного из оснований (его 2'3'-дидезоксианалог), при включении которой рост цепи прекращается. В результате синтезируются цепочки ДНК всевозможной длины. Используются четыре реакционные смеси, в каждую из которых добавляют помимо четырех мономеров аналог одного из оснований в качестве терминатора роста цепи. Затем цепи в каждой смеси разделяют с помощью гель-электрофореза и проводят радиоавтографию. С полученной фотопленки непосредственно считывают последовательность оснований. Метод Сэнгера и др. был развит на основе более раннего, так называемого плюс-минусметода, в котором также использовался синтез комплементарных цепей ДНК.