Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Нуклеиновые кислоты и гены
Трансляционный аппарат клетки

Рис. 24.1.
Трансляция — это процесс декодирования мРНК, в результате которого информация с языка последовательности оснований мРНК переводится на язык аминокислотной последовательности белка. В этом разделе описан трансляционный аппарат клетки; механизм трансляции рассмотрен в гл. 25.
Синтез белка осуществляется путем последовательной поликонденсации отдельных аминокислотных остатков, начиная с амино-(1М)-конца полипептидной цепи, в направлении к карбоксильному (С)-концу. Декодирование мРНК происходит соответственно в направлении 5' —> 3'.
Декодирование происходит при специфическом связывании антикодона транспортной РНК (тРНК) с соответствующим кодоном мРНК (гл. 19). До такого взаимного узнавания кодона и антикодона к тРНК присоединяется соответствующий аминокислотный остаток: образуется аминоацил-тРНК. Этот процесс называется активацией тРНК. Синтез белка происходит в рибосоме. Все этапы этого процесса осуществляются с помощью множества разных ферментов и других белков (таких, например, как факторы инициации)(гл. 25).
Активация тРНК — это присоединение аминокислоты к 3'-концевому аденозину молекулы тРНК с образованием аминоацил-тРНК. Этот процесс катализируется ферментом аминоацил-тРНК — синтетазой, и для каждой аминокислоты существует по крайней мере один такой фермент-катализатор. Источником энергии для этого процесса служит гидролиз АТР. Реакция выглядит следующим образом:
![]()
Аминокислота в аминоацил-тРНК соединена эфирной связью (—О—) с 2'- либо 3'-ОН-группой аденозина (рис. 24.2). Связывание фермента аминоацил-тРНК — синтетазы со своей и только своей аминокислотой обеспечивается с очень высокой точностью: неправильная активация тРНК приведет к тому, что в полипептидную цепь включится в данном месте не та аминокислота, которая должна была бы быть. Существует еще один механизм проверки правильности активации, часто называемый механизмом корректорской правки; суть его состоит в том, что соответствующая синтетаза автоматически катализирует деацилирование любой неправильно активированной тРНК, в результате которого последняя диссоциирует на исходные составные части, т. е. на свободную аминокислоту и свободную тРНК.
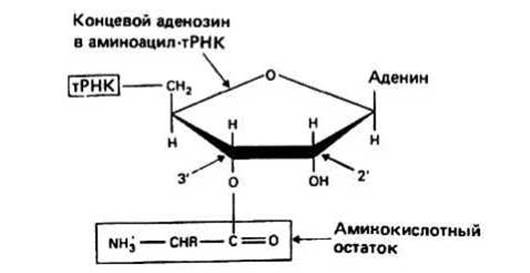
Рис. 24.2.
Рибосома — это органелла, состоящая из двух субчастиц, на которой происходит синтез белка. Каждая субчастица представляет собой сложный комплекс из белков и молекул РНК. В течение всего процесса синтеза белка растущая полипептидная цепь, мРНК и очередная аминоацил-тРНК остаются прикрепленными к рибосоме. Коэффициент седиментации рибосом прокариот типа Е. coli составляет примерно 70S, а у эукариот для рибосом, обнаруживаемых в цитоплазме, он равен 80S. Митохондрии и хлоропласты — органеллы, присутствующие в эукариотических клетках, — обладают своими собственными рибосомами с коэффициентом седиментации 70S, которые во всем подобны рибосомам прокариот.
Д иссоциация рибосомы на большую и малую субчастицы in vitro происходит при низкой концентрации Mg2+. 708-рибосома прокариот состоит из 50S- и ЗОБ-субчастиц, а SOS-рибосома эукариот - из 60S- и 408-субчастиц. Эти субчастицы могут в свою очередь диссоциировать на составные части — белок и рРНК (рис. 24.3) — при соответствующей химической обработке. Весовое отношение рРНК: белок для рибосом из прокариот и эукариот составляет соответственно 2:1 и 1:1.
У некоторых молекул рРНК определена нуклеотидная последовательность. При анализе этих последовательностей обнаружены участки, в которых может происходить спаривание оснований и которые могут участвовать в образовании вторичной структуры, подобно тому как это происходит в стеблях молекулы тРНК (гл. 19).
Многие рибосомные белки являются основными благодаря наличию большого числа боковых цепей Arg+ и Lys+. По всей вероятности, многие из этих положительно заряженных групп взаимодействуют с отрицательно заряженными фосфатными группами молекул рРНК, что и стабилизирует комплекс белок— нуклеиновая кислота.

Рис. 24.3.
Самосборку целой функциональной рибосомы из составляющих ее белков и рРНК удалось осуществить in vitro. Это говорит о том, что сложная структура рибосомы обусловлена исключительно взаимодействиями между входящими в ее состав молекулами.
Строение рибосомы изучали с помощью электронного микроскопа. На рис. 24.4 представлены две взаимно перпендикулярные проекции 708-рибосомы из Е. coli. «Габаритные» размеры рибосом прокариот составляют примерно 20 нм в наименьшем измерении и 30 нм в наибольшем. Более крупные (80S) рибосомы эукариот подобны по форме своему аналогу из клеток прокариот, но примерно в 1,15 раза больше в любом измерении (соответственно 23 нм х 35 нм).
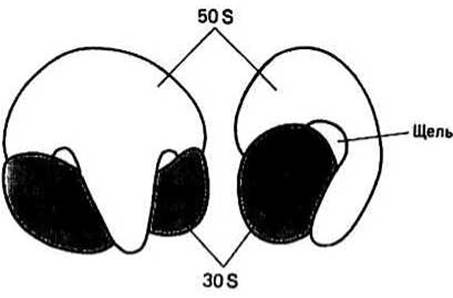
Рис. 24.4
Участки связывания на рибосоме — это места, к которым присоединяется та или иная молекула, участвующая в трансляции. Между большой и малой субчастицами рибосомы остается узкая щель (рис. 24.4), занимаемая молекулой мРНК. Подойдя к рибосоме, очередная молекула аминоацил-тРНК соединяется с участком, называемым участком (сайтом) Л. Другой участок, обозначаемый Р, связывается с молекулой пептидил-тРНК, несущей синтезируемую цепочку (гл. 25).
Полисома. или полирибосома, представляет собой молекулу мРНК с несколькими расположенными на ней активными рибосомами, на каждой из которых синтезируется молекула белка (рис. 24.1).
Если говорить в самых общих чертах, то синтез белка начинается с того момента, когда образуется комплекс, состоящий из большой и малой субчастиц рибосомы, мРНК и соответствующей аминоацил-тРНК. Далее целая рибосома движется вдоль мРНК от 5'- к 3'-концу. Такое перемещение сопровождается ростом полипептидной цепи. После того как синтез полипептидной цепи полностью завершен, она отходит от рибосомы, которая в свою очередь отщепляется от мРНК и диссоциирует на большую и малую субчастицы. Эти субчастицы могут теперь участвовать в синтезе другой молекулы белка; подробнее весь процесс описан в следующей главе.