Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Нуклеиновые кислоты и гены
Трансляция генетического кода
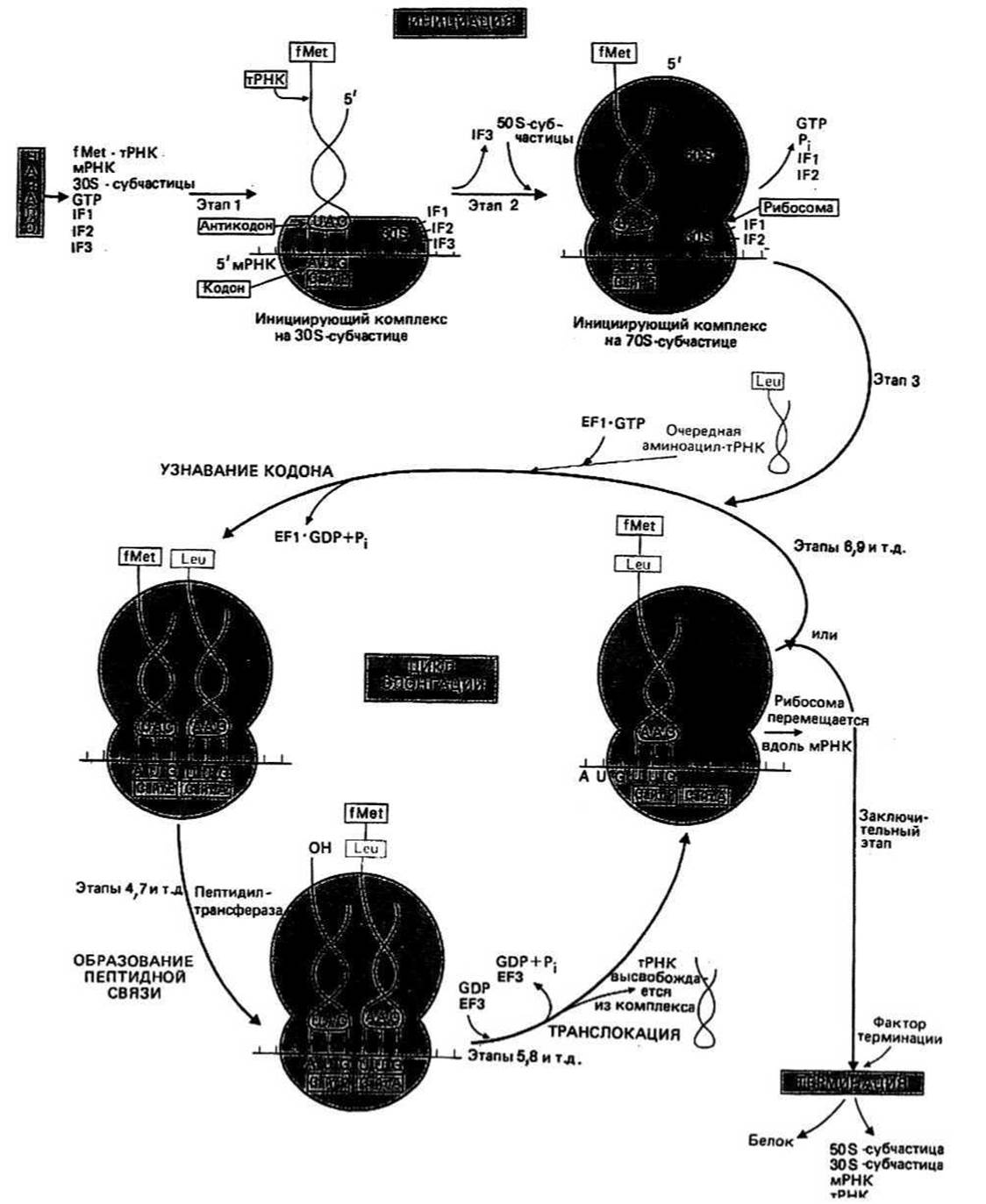
Рис. 25.1.
Механизм трансляции у прокариот мы опишем на примере Е. coli
Стартовым сигналом к началу синтеза белка служит расположенный на мРНК кодон AUG, кодирующий метионин (Met) [иногда это кодон GUC для валина (Val)]. В растущей полипептидной цепи первым аминокислотным остатком всегда будет либо Met, либо Val. Тогда возникает законный вопрос: каким образом клетка отличает стартовый сигнал от кодонов AUG или GUC, расположенных в середине молекулы мРНК? Эта проблема решается с помощью модифицированной формы Met (или Val) и специальной инициирующей тРНК (см. ниже).
Формилметионин (fMet) и является той модифицированной формой Met, с которой начинается синтез белка. Он присоединяется к молекулам тРНК определенного типа (тРНК.), отличным о тРНКМе, посредством которых Met включается в срединную часть полипептидной цепи. И тРНКг, и тРНКМе (узнают кодон AUG, но лишь тРНКг способна присоединяться к стартовому кодону AUG.
Инициация синтеза белка начинается с момента образования инициирующего комплекса на 30S-cyбчастице, состоящего из мРНК, ЗОЭ-субчастицы рибосомы и молекулы аминоацил-тРНКг с присоединенным fMet, которая связывается с участком Р. Следующим шагом является присоединение 508-субчастицы, в результате чего образуется 705-инициирующий комплекс. Источником энергии для инициации синтеза белка служит реакция гидролиза GTP до GDP и Pj. На этом этапе необходимы еще несколько белков, называемых факторами инициации (IF1, IF2 и IF3). Элонгация — это последовательное включение аминокислотных остатков в состав растущей полипептидной цепи. Каждый акт элонгации состоит из трех этапов: 1) узнавание кодона, 2) образование пептидной связи и 3) транслокация (рис. 25.1).
Узнавание кодона заключается в связывании антикодона очередной молекулы аминоацил-тРНК с кодоном свободного участка А на рибосоме. Чтобы прикрепиться к рибосоме, тРНК с присоединенной к ней аминокислотой должна сначала образовать комплекс с белком, называемым фактором элонгации EF-Tu, или EF1, который предварительно должен быть активирован с помощью GTP. После того как произойдет связывание всего комплекса TPHK-EFI ∙ GTP с участком А рибосомы, осуществляется гидролиз GTP до GDP и Рь удовлетворяющий энергетические потребности на этом этапе элонгации. Фактор EF1 ∙ GDP, неспособный более связываться с тРНК, покидает рибосому, на которой остается аминоацил-тРНК. Регенерацию активированного фактора EF1 катализирует второй фактор элонгации, EF-Ts, или EF2, который замещает GDP в неактивированном комплексе, в результате чего образуется комплекс EF1 ∙ EF2. Схема, иллюстрирующая эту последовательность событий, представлена на рис. 25.2.

Рис. 25.2.
Образование пептидной связи происходит лишь тогда, когда оба участка, А и Р, заняты молекулами аминоацил-тРНК. Часть 508-субчастицы представляет собой фермент пептидилтранферазу, катализирующий образование пептидной связи согласно схеме, представленной на рис. 25.3. В результате этой реакции растущая полипептидная цепь оказывается присоединенной к тРНК участка А, а тРНК участка Р высвобождается из комплекса с пептидом и несет на 3'- конце группу —ОН (рис. 25.3).
Транслокация включает три акта, катализируемых еще одним фактором элонгации, EF-G(EF3), и энергетически сопряженных с гидролизом GPT. Сначала тРНК участка Р, не связанная с пептидом, покидает рибосому, затем молекула полипептидил-тРНК переходит с участка А на Р и, наконец, рибосома перемещается вдоль мРНК на три нуклеотидных остатка в сторону 3'-конца. В результате этих трех актов освобождается участок А и экспонируется очередной кодон, что позволяет начаться следующему циклу элонгации.
Терминация т. е. окончание синтеза, происходит по команде кодонов UAA, UGA или UAG. В природе не существует таких молекул тРНК, антикодоны которых соответствовали бы этим кодонам. Вместо продолжения синтеза цепи происходит терминация, катализируемая специальными белками, которые названы факторами терминации и которые узнают терминирующие кодоны, когда свободен участок А. Эти факторы изменяют специфичность фермента пептидилтрансферазы таким образом, что происходит гидролиз связи между концевым пептидом и тРНК, а освобожденная полипептидная цепь диффундирует от рибосомы. Вслед за этим происходит диссоциация комплекса мРНК—рибосома. Далее рибосома диссоциирует на 30S- и 505-субчастицы. После реассоциации этих субчастиц с другой молекулой мРНК весь цикл синтеза белка начинается сначала. i K\i!( VIMIUIM ТРАНСЛЯЦИЯ У ЭУКАРИОТ, осуществляющаяся в цитоплазме, включает такие же этапы, что и трансляция у прокариот. Основным отличием здесь является то, что первым остатком в растущей полипептидной цепи является Met, а не fMet. Тем не менее и в этом случае есть два типа молекул тРНК, узнающих кодон AUG: один — когда кодон инициирующий, а другой — когда он кодирует Met, который должен быть присоединен в середине растущей полипептидной цепи. В роли факторов инициации и элонгации выступают различные белки. Еще одно существенное отличие состоит в том, что в цитоплазме эукариот рибосомы более крупные (80S).
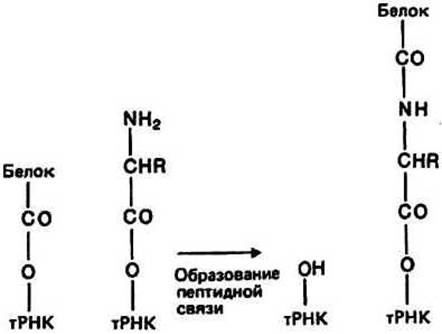
Рис. 25.3.
У митохондрий и хлоропластов трансляция осуществляется в самих этих органеллах. Рибосомы, которые они содержат, представляют собой 708-частицы и похожи на рибосомы бактерий. При инициации используется fMet.