Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Клетки и молекулы за работой
Мышцы и их сокращение
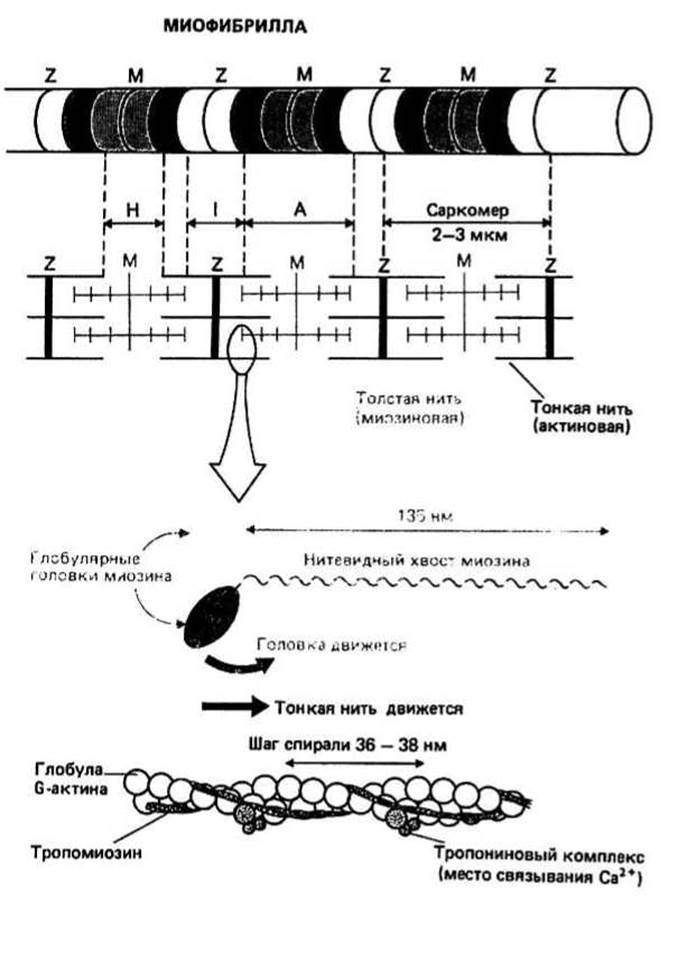
Рис. 37.1.
Мышцы позвоночных разделяют на гладкие и поперечнополосатые. Гладкие мышцы, которые при исследовании под микроскопом выглядят малоструктурированными, являются непризвольными, т. е. не находятся под контролем воли; обычно это медленно сокращающиеся мышцы, связанные с внутренними органами. Поперечнополосатые мышцы, выглядящие под микроскопом фибриллярными, бывают двух типов — скелетные и сердечная. Сердечная мышца управляется нервами и гормонами таким образом, что она производит регулярные и самоподдерживающиеся сокращения. Скелетные мышцы являются произвольными, и, хотя они также управляются нервами и гормонами, механизм их регуляции отличается от механизма регуляции сердечной мышцы. Это раздел посвящен тонкому строению скелетных поперечнополосатых мышц.
ПОПЕРЕЧНОПОЛОСАТЫЕ МЫШЦЫ. Клетки, образующие эти мышцы, могут достигать нескольких миллиметров в длину и окружены электрически возбудимой мембраной — сарколеммой. Как правило, каждая такая клетка содержит несколько ядер и митохондрий, погруженных в жидкую фазу — саркоплазму. В каждой клетке имеются многочисленные тяжи, называемые миофибриллами, которые являются органеллами, отвечающими за сокращение.
Миофибрилла — длинная тонкая структура с перемежающимися светлыми и темными участками, что и придает мышце исчерченность под фазово-контрастным микроскопом. Светлые области — это так называемые изотропные полосы, или 1-полосы (I-диски), а темные — анизотропные полосы, или А-полосы (А-диски). В центральной части А-полосы имеется несколько менее темный участок, называемый Н-зоной, а в середине этой зоны проходит узкая темная полоска — линия М. Каждая I-полоса делится надвое тонкой темной Z-линией. Отрезок от одной Z-линии до другой рассматривают как структурный элемент миофибриллы, саркомер, многократно повторяющийся на всем ее протяжении.
Мышечные нити являются основными компонентами миофибриллы. Они бывают двух типов: толстые нити имеют диаметр 15 нм и содержат в основном нитевидный белок миозин, а тонкие имеют 7 нм в диаметре и состоят из актина, тропомиозина и тропонина. При исследовании под электронным микроскопом на поперечных срезах I-полосы видны только тонкие нити, а на срезах Н-зоны А-полосы — только толстые нити. В остальных, очень темных, участках А-полосы обнаруживаются и толстые, и тонкие нити, образующие правильную гексагональную систему, в которой каждую толстую нить окружают шесть тонких.
Сокращение саркомера может приводить к уменьшению его длины от приблизительно 2,5 мкм до приблизительно 1,7 мкм. Длина А-полосы остается при этом постоянной, а I-полоса укорачивается. Это может быть объяснено с помощью так называемой модели скользящих нитей, согласно которой длина ни тонких, ни толстых нитей при сокращении саркомера не изменяется, а сближение Z-линий происходит за счет скольжения нитей относительно друг друга (рис. 37.2).
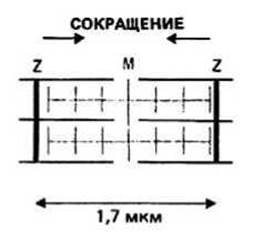
Рис. 37.2.
Миозин, основной компонент толстых нитей, построен из двух больших и четырех малых полипептидных цепей. Каждая большая цепь состоит из двух частей: вытянутого «хвоста», имеющего а-спиральную конформацию, и глобулярной «головки». Хвосты обеих больших цепей заплетены друг вокруг друга, образуя сверхскрученную структуру длиной 140 нм. Глобулярная головка каждой большой цепи находится в комплексе с двумя малыми цепями; весь комплекс также является глобулярным. Таким образом, молекула миозина имеет две глобулярные головки и один фибриллярный двухцепочечный хвост (рис. 37.3).
Актин, основной компонент тонких нитей, находится в миофибриллах в форме F-актина (F-фибриллярный). F-актин — это полимер, а мономерные единицы, из которых он построен, называются G-актином (G-глобулярный). По своей структуре F-актин похож на две нитки бус, в которых бусинками служат молекулы G-актина; нитки закручены друг вокруг друга в спиральную структуру с шагом 36—38 нм.
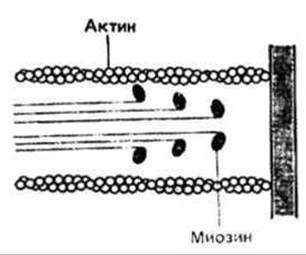
Рис. 37.3.
Тропомиозин также является компонентом тонких нитей. Молекула тропомиозина представляет собой тяж длиной 40 нм, образованный двумя переплетающимися ос-спиральными полипептидными цепями. Тропомиозин связан с F-актином. Каждая молекула тропомиозина охватывает семь G-актиновых глобул, причем соседние его молекулы немного перекрываются между собой, так что образуется непрерывная тропомиозиновая цепь, идущая вдоль F-актинового волокна. Поскольку F-актин состоит из двух ниток, с ним, надо думать, связаны и две тропомиозиновые цепочки.
Тропонин, еще один компонент тонких нитей, является комплексом трех белков: тропонина I, тропонина Г и тропонина С. Он имеет в целом более или менее глобулярную форму и располагается на F-актине через правильные промежутки, равные примерно 38 нм.
АТФ обеспечивает мышечное сокращение энергией. Глобулярные головки миозина связывают АТР и быстро гидролизуют его, но не так легко освобождают продукты гидролиза — ADP и Pj. F-актин, который связывается с миозином, образуя комплекс, называемый актомиозином, ускоряет отсоединение ADP и Рj от миозиновых головок. Освободившиеся АТР-связывающие участки актомиозинового комплекса могут связать новые молекулы АТР, но, как только это происходит, индуцируется диссоциация актомиозина на актин и миозин. Такой цикл может повторяться многократно — в присутствии достаточного количества АТР. Описанное взаимодействие актина и миозина лежит в основе молекулярного механизма мышечного сокращения.
Цикл наклона головок миозина при мышечном сокращении включает в себя четыре стадии (рис. 37.4).
1. Миозин в толстых нитях содержит связанные ADP и Рі, но не связан с актином тонких нитей.
2. При поступлении сигнала к сокращению глобуляр ные миозиновые головки со связанными ADP и Рі прикрепляются к актину (образуется актомиозин).
3. Образование актиомиозина ускоряет освобождение ADP и Рі, что сопровождается наклоном головок миозина; при наклоне головки происходит скольжениеь все еще прикрепленной к ней тонкой актиновой нити вдоль толстой, что приводит к укорочению саркомера.

Рис. 37.4.
4. АТР связывается с миозиновыми головками в актомиозине, и это приводит к отсоединению актина от миозина, после чего гидролиз АТР миозином возвращает систему к первой фазе цикла.
Регуляция мышечной активности опосредуется ионами кальция (Са2+). При низких концентрациях Са2+ тропонин и тропомиозин препятствуют взаимодействию актина с миозином. Когда приходит нервный испульс (гл. 36) и происходит деполяризация мембраны мышечных клеток, внутриклеточный уровень Са2+ повышается, это вызывает Са2+-зависимое изменение конформации тропонина, которое передается тропомиозину, и в результате тропомиозин меняет свое положение на актиновой нити так, что её связывающие участки становятся доступными для головок миозина.