МІКРОБІОЛОГІЯ - М.Г. Сергійчук - 2008
Розділ 4. ГЕНЕТИКА БАКТЕРІЙ
ГЕНЕТИЧНІ РЕКОМБІНАЦІЇ
При генетичних рекомбінаціях відбувається часткове об'єднання геномів двох клітин, тобто в бактерій спостерігається аналог статевого процесу. Він відрізняється від статевого процесу в еукаріотичних форм тим, що в бактерій не утворюються гамети і не відбувається злиття двох клітин або повне об'єднання геномів. Лише частина генетичного матеріалу клітини донора передається реципієнтній клітині. Утворюється неповна зигота - мерозигота. Генетичний матеріал реципієнтної клітини називають ендогенним, а фрагмент, який переноситься, - екзогенним. Але головна подія статевого процесу - обмін генетичним матеріалом відбувається, і такий процес отримав назву генетичної рекомбінації. У процесі заміщення беруть участь ферменти, які розрізають молекулу ДНК, - ендонуклеази рестрикції (рестрикта- зи) і ферменти, які з'єднують нові ланцюги ДНК, - лігази. ДНК, яка утворилася у процесі генетичної рекомбінації, називають рекомбінантною. У нащадків рекомбінантів спостерігається помітне різноманіття ознак, викликане змішуванням генів. Різноманіття ознак, яке виникає в рекомбінантів, важливе для еволюції і є головною перевагою статевого розмноження.
У бактерій утворення рекомбінантних хромосом відбувається за рахунок трьох способів перенесення генетичної інформації: трансформації, кон'югації і трансдукції.
Трансформація (лат. transformatio - перетворення) - це процес перенесення генетичного матеріалу від донора (лат. donare - дарувати) до реципієнта (лат. recipiens - приймати) за участю ізольованого фрагмента ДНК.
Явище трансформації у 1928 р. вперше описав Ф. Гриффітс, який працював із пневмококами - збудниками пневмонії. Культура Streptococcus pneumoniae в R-формі (II серотип, безкапсульний штам) була авірулентною, а ця ж культура в S-формі (III серотип, капсульований штам) викликала захворювання. При інфікуванні мишей змішаною культурою (живі клітини R-форми + вбиті прогріванням клітини S-форми) вони гинули від пневмонії, а з крові загиблих тварин виділялися вірулентні пневмококи з капсулою S III типу (рис. 4.10). Це свідчило про те, що вбиті клітини S III типу передавали спадкову здатність до утворення капсул S III типу R-клітинам, які, у свою чергу, передавали її своїм нащадкам.
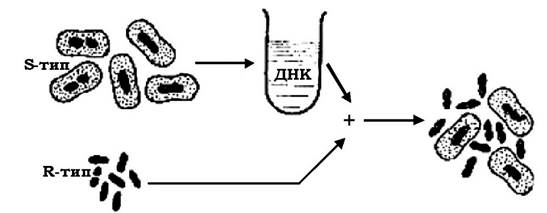
Рис. 4.10. Схематичне зображення трансформації у пневмококів
Природа факторів, які індукують трансформацію бактерій, тривалий час залишалася невідомою. Лише в 1944 р. О. Евери, К. Мак-Леод і М. Мак-Карті встановили хімічну природу трансформувального фактора пневмококів, яким виявилася ДНК. Це відкриття стало вирішальним доказом того, що спадкова інформація локалізована в ДНК.
Можливість передачі ознак через вільну ДНК було виявлено згодом для деяких представників роду Haemophilus, Neisseria, Rhizobium, Bacillus та інших бактерій. Цим шляхом передаються такі ознаки, як резистентність до отрут, синтез типоспецифічних капсульних полісахаридів, специфічних білкових антигенів, прототрофність щодо окремих амінокислот, вітамінів, здатність до утворення бульбочок, пігментоутворення та ін. Але дуже рідко буває, що при трансформації клітина набуває більше однієї нової ознаки.
Не всі клітини бактерій здатні сприймати ДНК донорів. Клітини, які проявляють таку здатність, називають компетентними. Компетентність - це здатність клітин поглинати ДНК і включати її у склад свого геному. Механізми компетентності вивчені недостатньо, але доведено, що компетентні клітини синтезують білок, функцію якого теж до кінця не встановлено. Він може бути компонентом мембрани, який каталізує проходження ДНК у клітину, або ферментом, який розщеплює компоненти клітинної стінки і відкриває рецепторні ділянки для ДНК. Цей білок отримав назву фактора компетентності (cpf). Виявлено існування інших факторів, пов'язаних із компетентністю, наприклад iF-фактор, який проявляє нуклеазну активність. Обидва фактори інгібуються еритроміцином, який пригнічує білковий синтез. Стан компетентності в різних видів бактерій має різну тривалість, але в середньому він становить ~15 хв.
Деякі бактерії, наприклад кишкова паличка, є некомпетентними. Для відтворення трансформації у таких бактерії необхідна попередня їхня обробка (дія іонів Са2+, глибоке заморожування і відтаювання тощо), яка б підвищувала проникність клітинної стінки для трансформувальної ДНК.
Ефективно трансформація відбувається в дослідах із бактеріями одного виду, які мають різний генотип. Так, шляхом трансформації у різних штамів одного виду бактерій можна замістити гени дикого штаму на мутовані. Трансформацію можна спостерігати і в бактерій різних видів. Проте чим більше вони віддалені генетично, тим складніше відтворюється даний феномен. Але існування міжвидової трансформації не викликає сумніву.
Трансформувальну активність проявляють двонитчасті фрагменти ДНК, молекулярна маса яких не менше 0,5-1,0 х 106. Процес трансформації можна поділити на декілька стадій (рис. 4.11):
- адсорбція молекули трансформувальної ДНК на бактеріальній клітині. Тривалість цієї стадії 5-10 хв. Якщо протягом цього часу подіяти ДНКазою, то процес трансформації не відбувається. Дія ферменту через 10 хв після початку досліду не перериває трансформації;
- проникнення ДНК у клітину-реципієнт;
- з'єднання трансформувальної ДНК із гомологічною ділянкою хромосоми реципієнта з наступною рекомбінацією.
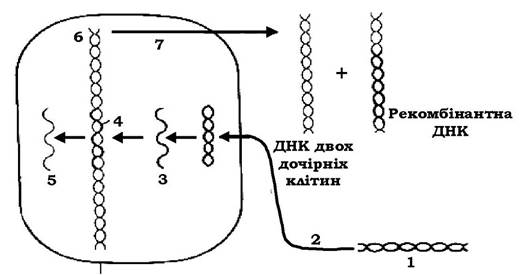
Рис. 4.11. Один із можливих способів трансформації:
1 - ДНК донора; 2 - активне поглинання; 3 - ДНК донора стає одноланцюговою; 4 - ланцюг ДНК донора заміщує вихідну, але не ідентичний ланцюг ДНК реципієнта; 5 - витіснений фрагмент реципієнтної ДНК з часом руйнується; 6 - гібридизація ДНК; 7 - реплікація гібридної ДНК
Таким чином, при вивченні явища трансформації бактерій було відкрито значення нуклеїнових кислот як носіїв спадкової інформації.
Кон'югація (лат. conjugatio - сполучення, спарювання) - це процес обміну генетичним матеріалом між двома клітинами при їх фізичному контакті. Уперше це явище в 1946 р. описали Дж. Ледерберг і Е. Татум. Висновки про можливість обміну генетичним матеріалом між бактеріями автори виконали на моделі ауксотрофних мутантів Escherichia coli, кожен з яких окремо не був здатний синтезувати два різних фактори, необхідні для їх існування. Один подвійний мутант
був не здатний синтезувати вітамін біотин (bio-) і амінокислоту метіонін (met-), а другий - амінокислоти треонін (thr-) і лейцин (leu-). Ці мутанти не росли на мінімальному середовищі. Якщо на те саме мінімальне середовище висівали суміш обох мутантів, то колонії з'являлись, а клітини цих колоній проявляли спадкову здатність синтезувати всі необхідні для них фактори росту, тобто вони належали до типу bio+met+thr+leu+. Отже, відбувся якийсь обмін генетичною інформацією. Згодом за допомогою електронної мікроскопії було встановлено, що клітини E. coli можуть безпосередньо контактувати одна з одною, тобто кон'югувати (рис. 4.12). Такі клітини з'являлися з частотою ~1 х 106.
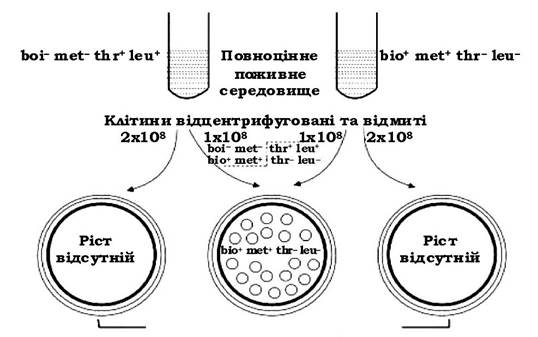
Рис. 4.12. Рекомбінація внаслідок кон'югації двох взаємодоповнювальних мутантів Escherichia coli
Це були генетичні рекомбінанти, які виникли внаслідок об'єднання генетичного матеріалу двох реципрокно дефектних (взаємодоповнювальних) батьківських клітин. Використання подвійних мутантів як батьківських форм виключало появу ревертантів, тому що вірогідність одночасної реверсії за двома генами становить ~10-14-10-16 на генерацію.
Аналогічні дослідження зі схрещування, в яких один із батьківських штамів був стрептоміцинрезистентним, дозволили зробити висновок про направлене перенесення генетичного матеріалу. Якщо клітини після схрещування висівали на середовище, яке містило стрептоміцин, то рекомбінанти виникали лише в тих випадках, коли штамреципієнт був стрептоміцинрезистентним і виживав. Як поводить себе при цьому інший штам, було не принципово - головне, щоб він встиг виконати функцію передачі генетичного матеріалу.

Рис. 4.13. Електронна мікрофотографія двох кон'югуючих клітин
Звідси випливало, що генетичний матеріал переноситься в одному напрямку - від донора ("чоловічий" штам) до реципієнта ("жіночий" штам); весь процес рекомбінації і розщеплення ознак відбувається в реципієнтних клітинах.
Донорська здатність клітин визначається генами, локалізованими в невеликій кільцевій молекулі ДНК, яку називають статевим фактором або F-фактором (англ. fertility - плодовитість). За величиною він відповідає приблизно фаговій ДНК. Це своєрідна плазміда, яка кодує білок специфічних пілей (F- або статеві пілі). F-пілі полегшують контакт клітин. Клітини, які не мають F-фактора, функціонують як реципієнти (F-- клітини) і кон'югують лише з чоловічими. Клітини, які мають статевий фактор р+-клітини), здатні функціонувати і як донори, і як реципієнти, тобто процес кон'югації можливий при взаємодії клітин F+ x F- або F+ x F+ і не можливий за наявності лише клітин F- - типу.
Молекула ДНК плазміди складається з двох ланцюгів. При кон'югації один із ланцюгів дволанцюгової ДНК F-фактора проникає через статеву фімбрію із клітини донора (F+) у клітину реципієнта (F-). У клітині донора цей фактор зберігається, поки у клітині реципієнта синтезується її власна копія. Так поступово популяція F--клітин набуває F+-типу. Клітини-донори можуть спонтанно втрачати F-фактор і ставати, таким чином, F--клітинами.
Приблизно в одному випадку з 105 F-фактор здатний інтегруватися в молекулу хромосомної ДНК клітини-хазяїна (рис. 4.14). Тоді при кон'югації переноситься не лише F-фактор, але й частина хромосомної ДНК. Цей процес займає ~90 хв, але клітини можуть розходитися і раніше, до повного обміну ДНК. Такі донорські штами постійно передають всю або більшу частину своєї ДНК іншим клітинам і називаються Hfr-штамами (англ. high frequency of recombination - висока частота рекомбінації), тобто гени, локалізовані у хромосомі донорської клітини, із високою частотою передаються реципієнтним клітинам.

Рис. 4.14. Перетворення бактерій F+ у Hfr:
кільцева ДНК F-фактора, яка несе сайт О (а), спаровується з ДНК кільцевої бактеріальної хромосоми між генами ton і lac (б). Реципрокний кросинговер між фактором F і бактеріальною хромосомою приводить до інтеграції фактора F у хромосому (в), що супроводжується утворенням Hfr-штаму, який при кон'югації з клітиною F- переносить першим ген ton і останнім ген lac
При кон'югації в локусі інтеграції F-фактора відбувається розрив хромосоми, вона стає лінійною і в такому стані переноситься в реципієнтну клітину із проксимального О-кінця, протилежного щодо місця інтеграції F-фактора. Перенесення маркерів здійснюється послідовно по довжині хромосоми, останнім передається статевий фактор. За цей період часто порушується цілісність (відбувається розрив) хромосоми або кон'югаційного містка, і F-фактор у Hfr- клітин майже не передається F--клітинам.
F'-клітини - це проміжні "чоловічі" клітини, в яких статевий фактор перебуває в автономному стані і має різні ділянки бактеріальної хромосоми, наприклад ознаку зброджування лактози F' lac (див. рис. 4.15). Перенесення генів статевим фактором отримало назву сексдукид.
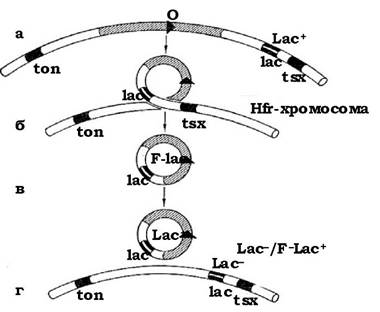
Рис. 4.15. Утворення статевого фактора F', який несе ген lac бактеріальної хромосоми, або F-lac:
фактор F, який включився в хромосому Hfr між генами ton і lac (а), утворює неправильну петлю (б) унаслідок чого lac-ділянка хромосоми інтегрується в петлю (в), яка несе гени фактора плодовитості. Реципрокний кросинговер приводить до утворення кільцевого фактора F з геном lac (г)
Кон'югаційний місток не стійкий, він легко розривається, не порушуючи життєздатності клітин, які кон'югують. Відповідно в процесі перенесення може порушуватися цілісність хромосоми. Усе це пояснює досить нечасту передачу фактора F від Hfr-клітин до F--бактерій, оскільки для цього остання має вміщувати як початкову, так і кінцеву ділянку хромосоми донора.
Процес перенесення генетичного матеріалу під час кон'югації вивчений переважно для представників родини Enterobacteriaceae: родів Escherichia, Shigella, Salmonella, а також у Pseudomonas aeruginosa. Як було встановлено, кон'югація може бути:
- внутрішньовидова - між штамами одного виду;
- міжвидова - між видами одного роду (серед шигел);
- міжродова - між видами різних родів, наприклад між кишковою паличкою і сальмонелами.
Трансдукція - це процес перенесення генетичного матеріалу від клітини донора до клітини реципієнта за участю бактеріофага. Тобто фаг відіграє роль "гамети", переносячи в реципієнтну клітину фрагмент ДНК клітини-донора.
Відомо три основних типи трансдукції: загальна (неспецифічна), локалізована (специфічна) і абортивна. При неспецифічній трансдукції можуть передаватися будь-які фрагменти ДНК від клітин-донорів до клітин-реципієнтів за участю помірних трансдукуючих фагів. Перенесений фагом фрагмент ДНК донора здатний інтегруватися в гомологічну ділянку клітини-реципієнта шляхом рекомбінації.
Продемонструвати неспецифічну трансдукцію можна на прикладі двох мутантів Salmonella typhimurium, які відрізнялися між собою за однією ознакою. Якщо інфікувати штам-донор (met+) помірним фагом Р22, а потім, після лізису, внести вільний фаг у суспензію клітин штама-реципієнта (met-), то деякі клітини набувають ознаки met+ (див. рис. 4.16). При цьому штам-реципієнт (L-22) є лізогенним для фага Р22. Якщо вільний фаг Р22 інфікує клітини штаму-донора (L-2), то він їх лізує, унаслідок чого вивільнюються нормальні фагові частинки, деякі з яких мають фрагменти ДНК донора. При інкубації такого фаголізату із клітинами штаму-реципієнта L-22 фаг інфікує ці клітини. Але оскільки цей штам для нього не є лізогенним, то його лізис не відбувається і фрагменти донорської ДНК, які містяться в ньому, сприймаються клітинами. Якщо ця донорська ДНК має ген, якого не вистачає реципієнтній клітині (або за яким вона є дефективною), то наслідком може бути комплементація (взаємодоповнення). Перенесений фагом фрагмент ДНК донора інтегрується в гомологічну ділянку ДНК клітини-реципієнта шляхом рекомбінації.
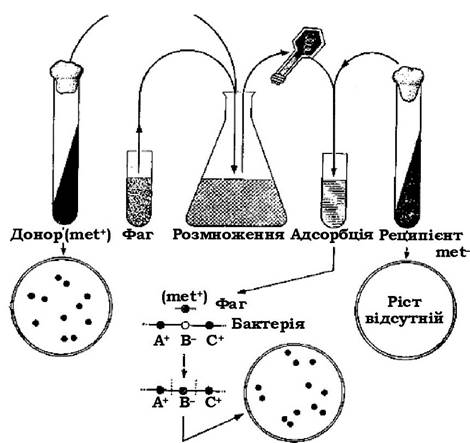
Рис. 4.16. Схема дослідження трансдукції з використанням прототрофного штаму met+ як донора та ауксотрофного мутанта met- як реципієнта
Таким чином, у трансдукції беруть участь клітина-донор, трансдукуючий фаг і клітина-реципієнт. Бактерія-донор визначає специфічність трансдукуючої ознаки, а фаги лише переносять генетичний матеріал до клітини-донора. У процесі неспецифічної трансдукції фаги переносять різні гени, які кодують здатність зброджувати вуглеводи, утворювати джгутики в нерухомих форм бактерій, резистентність до антибіотиків, спороутворення, синтез амінокислот, ферментів, вітамінів та ін.
Трансдукуючі фаги, як правило, дефектні, оскільки фагова частинка не може містити всю власну ДНК і фрагмент бактеріальної хромосоми. За допомогою важкої ДНК (міченої 5-бромурацилом) було виявлено, що деякі трансдукуючі фрагменти містять лише бактеріальну ДНК. Передбачається, що при дозріванні фага у клітині бактерії-донорі в капсиді включаються замість фагової ДНК фрагменти бактеріальної хромосоми. Кожна така фагова частинка здатна трансдукувати лише один бактеріальний ген або кілька близько розташованих генів. Кількість бактеріальної ДНК, яка відповідає всій фаговій, становить не більше 1-2 % всієї кількості ДНК, яку має бактеріальна клітина. Частота спільної трансдукції двох бактеріальних генів є одним із критеріїв відстані між ними, що може бути використано при складанні хромосомних карт.
При специфічній (локалізованій) трансдукції фаг переносить від клітин-донорів до бактерій-реципієнтів лише певні гени. Це пов'язано з тим, що утворення трансдукуючого фага відбувається шляхом з'єднання його ДНК лише з певними бактеріальними генами, які розташовані на хромосомі донорської клітини поряд із профагом (зчеплена група генів). Наприклад, фаг λ розташовується на бактеріальній хромосомі поряд із ділянкою gal (ферментація галактози) і специфічно трансдукує ген gal+ у клітини реципієнтів gаl-, або ген bio, який детермінує синтез біотину, оскільки на бактеріальній хромосомі вони зчеплені з фаговою ДНК (рис. 4.17). Фаг φ 80 розташовується поряд із ділянкою try і трансдукує гени синтезу триптофану.
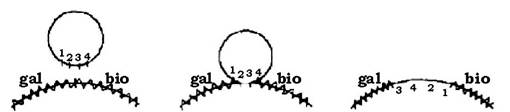
Рис. 4.17. Схема входження ДНК профага λ у хромосому бактеріальної клітини
При взаємодії таких фагів із реципієнтними клітинами відбувається їхня лізогенізація і входження гена клітини-донора в хромосому бактерії-реципієнта разом з ДНК дефектного фага. Бактерії, лізогенізовані дефектним фагом, стають несприйнятливими до наступного інфікування тим же вірулентним фагом.
При абортивній трансдукції привнесений фагом фрагмент хромосоми донора не включається в хромосому клітини-реципієнта, а локалізується в її цитоплазмі і може в такому стані функціонувати. Під час ділення трансдукованої клітини фрагмент ДНК-донора може передаватися лише одній із двох дочірніх клітин, тобто успадковується однолінійно, і в кінцевому результаті втрачається в потомстві.
Процес передачі ознак за допомогою трансдукції вперше було виявлено у Salmonella typhimurium, згодом описано в багатьох бактерій: Escherichia, Shigella, Bacillus, Pseudomonas, Staphylococcus, Vibrio та ін.
Усі три процеси - трансформація, кон'югація, трансдукція, такі різні за формою, виявилися однаковими за суттю: унаслідок кожного з них відбувається перенесення фрагменту ДНК від однієї клітини до іншої. При трансформації вільна ДНК вводиться в бактерію- реципієнт, при трансдукції фаг захоплює фрагмент хромосоми бактерії-донора і передає реципієнту, при кон'югації відбувається перенесення ділянки ДНК шляхом утворення цитоплазматичного містка. У ході всіх трьох процесів генетичної рекомбінації переноситься, як правило, не вся хромосома, а її фрагмент.