МІКРОБІОЛОГІЯ - М.Г. Сергійчук - 2008
Розділ 5. МЕТАБОЛІЗМ МІКРООРГАНІЗМІВ
МЕХАНІЗМИ АСИМІЛЯЦІЇ АЗОТУ ТА СІРКИ МІКРООРГАНІЗМАМИ
Фіксація молекулярного азоту. Азотофіксація - це використання атмосферного газоподібного молекулярного азоту N2 як джерела азоту для біосинтезу. У результаті азотофіксації молекулярний азот відновлюється до амонію, який включається в біосинтез амінокислот. Цей процес характерний лише для бактерій (вільноіснуючих та симбіотичних) та деяких археїв (табл. 5.8), у яких наявний специфічний складний фермент - нітрогеназа (нітрогеназний комплекс).
Нітрогеназний комплекс складається з двох типів білків:
1. Перший компонент - молібдофередоксин (MoFd, MoFe-білок) або динітрогеназа. М.м. - 220000. Складається з чотирьох білкових субоди- ниць, з'єднаних з MoFe-кофактором. MoFe-кофактор містить 18 атомів заліза та два атоми молібдену. До нітрогеназного комплексу входить одна молекула молібдофередоксину, який слугує для відновлення N2 шляхом "двоелектронного перенесення».
2. Другий компонент - азофередоксин (AzoFd, Fe-білок) або редуктаза динітрогенази. М.м. - 55000. Складається з двох білкових субодиниць та містить чотири атоми заліза. До нітрогеназного комплексу входять дві молекули азофередоксину, який слугує переносником електронів, що йдуть на відновлення молібдену молібдофередоксину.
Оскільки молекула N2 має потрійний зв'язок, вона дуже інертна. Її відновлення у промислових умовах здійснюють при температурі 500 0С та тиску 30 МПа. Бактерії здійснюють азотофіксацію за звичайних умов, але витрачають на це велику кількість енергії. Так, згідно з рівнянням:
N2 + 8е- + 8Н+ + 16 АТФ = 2NН3 + Н2 + 16 АДФ + 16 Фн
для відновлення однієї молекули молекулярного азоту бактерії необхідно 16 молекул АТФ та вісім відновлених еквівалентів. За рахунок енергії, що виділяється при гідролізі АТФ, істотно знижується ОВП нітрогеназного комплексу (з -290 до -400 мВ), тобто нітрогеназа набуває властивостей "супервідновника". Відновлені еквіваленти використовуються для поста- дійного відновлення N2 до 2NH3. Оскільки паралельно з утворенням амонійного азоту відбувається виділення молекулярного водню, процес потребує восьми електронів. Джерелами електронів можуть бути органічні сполуки у хемоорганотрофних азотофіксаторів (Azotobacter, Klebsiella, Clostridium), неорганічні сполуки в хемолітотрофів (Alcaligenes, Methanosarcina, Methanococcus), а також екзогенні донори електронів у фотосинтетиків (Cyanobacteria, Chromatium, Chlorobium, Rhodospbillum, Heliobacter). Електрони подаються на нітрогеназний комплекс через низькопотенційні переносники: фередоксини чи флаводоксини.
Таблиця 5.8. Деякі азотофіксувальні мікроорганізми
Вільноіснуючі аероби |
|||
Органотрофи |
Фототрофи |
Літотрофи |
|
Azotobacter spp. Klebsiella Beijerinckia Bacilluspolymyxa Mycobacteriumflavum Azospirillumlipoferum Citrobacterfreundii Methylotrophus(більшість) |
Cyanobacteria (більшість) |
Alcaligenes Thiobacillus (деякі види) |
|
Вільноіснуючі анаероби |
|||
Органотрофи |
Фототрофи |
Літотрофи |
|
Clostridium spp. Desulfovibrio Desulfotomaculum |
Chromatium Chlorobium Rhodospirillum Rhodopseudomonas Rhodomicrobium Rhodobacter Heliobacterium |
Methanosarcina Methanococcus |
|
Симбіонти |
|||
з бобовими рослинами |
з небобовими рослинами |
||
сої, гороху, конюшини утворюють асоціації бактерії родів Rhizobium, Bradyrhizobium |
утворюють асоціації актиноміцети роду Frankia |
||
Згідно з теорією Штифеля процес азотофіксації відбувається так, як показано на рис. 5.38.
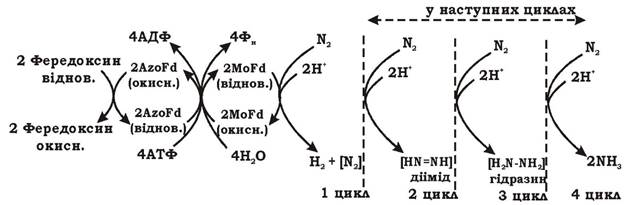
Рис. 5.38. Схема азотофіксації:
AzoFd - азофередоксин; MoFe — молібдофередоксин
1. З відновленого фередоксину електрони подаються на азофередоксин (Fe-білок) і відновлюють його.
2. Азофередоксин передає електрони на молібден молібдофередоксину, а сам при цьому окиснюється. Молібден молібдофередоксину (MoFe- білок) відновлюється з Мо(VІ) до Mo(IV). Паралельно з цим за рахунок гідролізу АТФ відбувається пониження ОВП нітрогеназного комплексу з -290 до -400 мВ. Молібдофередоксин стає супервідновленим.
3. Атом заліза в молекулі молібдофередоксину з'єднується з N2, утворюючи комплекс N=N-Fe (нітрид).
4. У молекулі молібдофередоксину (MoFe-білок) відбувається поетапне відновлення N2 за рахунок окиснення Mo(IV) до Мо(VІ). Процес проходить через такі емпіричні проміжні продукти:
a) N=N + 4e- → HN=NH (діімід) + Н2;
b) HN=NH + 2е-→ H2N-NH2 (гідразин);
c) H2N-NH2 + 2е-→ 2NH3 (аміак).
Утворення молекулярного водню активує молібдофередоксин перед процесом відновлення молекулярного азоту. Н2 в атмосферу практично не виділяється, а розкладається гідрогеназою на протони та електрони. Електрони подаються на дихальний ланцюг. У результаті клітина отримує додаткову енергію, а молекулярний кисень, що оточує клітину, швидше відновлюється. Це захищає нітрогеназний комплекс від інгібування киснем.
Для активної азотофіксації бактерія повинна підтримувати азофередоксин у супервідновленому стані. Зрозуміло, що молекулярний кисень, який має ОВП +810 мВ, незворотно окиснює нітрогеназний комплекс. Тому в аеробних азотофіксаторів існують спеціальні механізми захисту нітрогенази від кисню:
1. Дихальний захист ґрунтується на тому, що бактерії (Azotobacter) швидко видаляють кисень із довкілля завдяки високоактивному розгалуженому дихальному ланцюгу. Спеціальні гілки такого ланцюга мають лише один пункт фосфорилювання і специфічну термінальну цитохром-d-оксидазу. Вони використовуються для швидкого відновлення кисню при критичному збільшенні його концентрації навколо клітини.
2. Конформаційний захист нітрогенази забезпечується особливим захисним конформаційним білком. При загрозі інактивації киснем він з'єднується з нітрогеназою. При цьому нітрогеназа тимчасово втрачає свою активність, але отримує стійкість до кисню. При зниженні концентрації кисню нітрогеназа повертається в активний стан.
3. Морфологічна адаптація - це утворення гетероцист у нитчастих ціанобактерій (Anabena). Азотофіксація здійснюється лише спеціальними клітинами гетероцистами, які оточені щільною клітинною стінкою і не виділяють О2 при фотосинтезі.
4. Симбіотичний захист характерний для симбіотичних азотофіксу- вальних бактерій (Rhizobium). Вони індукують синтез у клітинах рослини - симбіонта білка леггемоглобіну, який зв'язує кисень, знижуючи його парціальний тиск.
5. Негативний аеротаксис дозволяє рухливим азотофіксаторам уникати середовища з підвищеною концентрацією кисню.
Асиміляційна нітратредукція (асиміляційна амоніфікація) — це відновлення нітратного азоту (N5+) до амонійного (N3-) з метою включення його в біосинтез амінокислот та інших сполук. Вона характерна для рослин, водоростей, грибів та багатьох прокаріотів і є одним із фундаментальних біологічних процесів. Асиміляційна амоніфікація відбувається за аеробних умов, за відсутності в середовищі амонію, але наявності нітрату. Оскільки на відновлення молекули нітратного азоту до амонійного витрачається вісім електронів, які могли б взяти участь у синтезі АТФ у дихальному ланцюзі, процес вважається енерговитратним. У бактерій і грибів електрони надходять з НАДФН2, у вищих рослин - з відновленого фередоксину чи з води при її фотолізі. Нітрат відновлюється до амонію за кілька етапів:
NO3- → NO2- → NH2OH → NH4+ → R-NH2
Відновлення нітрату до нітриту здійснюється ферментом - асиміляційною нітратредуктазою (позначається як NAS). Цей фермент, на відміну від нітратредуктаз NAR та NAP, що беруть участь у нітратному диханні (дисиміляційній нітратредукції), міститься в цитоплазмі. NAS складається з двох субодиниць (NasA та NasC). Його синтез репресується амонієм і специфічно індукується нітратом або нітритом.
Нітрит відновлюється до амонію можливо через гідроксиламін (гіпотетичний проміжний продукт). Амоній включається в біосинтез амінокислот.
Шляхи включення амонію до складу амінокислот. Формування аміногрупи в амінокислоті може відбуватися прямим амінуванням (безпосереднім приєднанням амонію до вуглецевого скелету амінокислоти) або в результаті трансамінування.
Спосіб прямого амінування залежить від кількості амонію в середовищі. Розрізняють два шляхи:
1. Глутаматний шлях функціонує при високій концентрації (>1 мМ) амонію в довкіллі.
2. Глутаміновий шлях функціонує при низькій концентрації (<0,5 мМ) амонію в довкіллі.
Глутаматний шлях асиміляції NH4+ здійснюється в одну реакцію, каталізується ферментом глутаматдегідрогеназою та не потребує витрат АТФ:
α-Кетоглутарова кислота + NH3 + НАДФН2 → Глутамінова кислота + НАДФ+ + Н2О
Глутаміновий шлях асиміляції NH4+ здійснюється у дві реакції через проміжний продукт глутамін, каталізується ферментами глутамінсинтетазою і глутаматсинтетазою та потребує витрат АТФ:
Глутамінова кислота + АТФ + NH3 → Глутамін + АДФ + Фн (глутамінсинтетаза)
Глутамін + α-Кетоглутарова кислота + НАДФН2 → 2 Глутамінова кислота + НАДФ+ (глутаматсинтетаза)
Сумарна реакція глутамінового шляху:
α-Кетоглутарова кислота + NH3 + АТФ + НАДФН2 → Глутамінова кислота + АДФ + НАДФ+ + Фн
Трансамінування - це перенесення аміногрупи з глутамінової кислоти на оксокислоти (кислоти, що містять оксогрупу =С=О), які є безпосередніми попередниками синтезу амінокислот. Реакція каталізується ферментами амінотрансферазами (трансаміназами). Прикладом такої реакції може бути синтез аспарагінової кислоти зі щавлево-оцтової:
Глутамінова кислота + ЩОК → α-Кетоглутарова кислота + Аспарагінова кислота
У деяких реакціях біосинтезу донором аміногрупи може бути аспарагінова кислота.
Асиміляційна сульфатредукція - це відновлення сульфатної сірки (S+6) до сульфідної (S2-) з метою включення в біосинтез амінокислот цистеїну та метіоніну, нуклеїнових кислот і різних коферментів. Вона поширена в метаболізмі рослин, водоростей, грибів та прокаріотів, але відсутня в паразитних прокаріотів та еукаріотів. Існує два шляхи асиміляційної сульфатредукції:
1. Шлях характерний для бактерій та грибів (рис. 5.39, а).
2. Шлях характерний для ціанобактерій та аеробних еукаріотів (рис. 5.39, б).
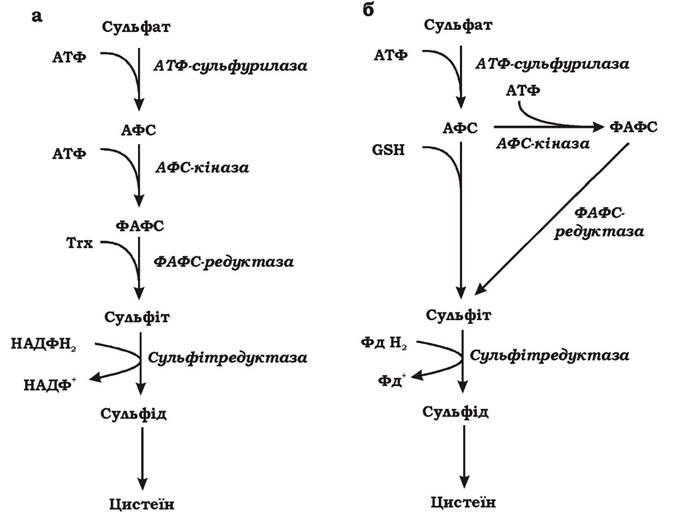
Рис. 5.39. Шлях асиміляційної сульфатредукції в Escherichia coli (а) та ціанобактерій (b):
Trx - тіоредоксин; АФС - аденозин-5'-фосфосульфат; ФАФС - аденозин-3'-фосфат-5'-фосфосульфат; GSH — глутатіон
На першому етапі в обох шляхах інертний сульфат активується за допомогою АТФ з утворенням аденозин-5'-фосфосульфату (АФС), так само, як і при дисиміляційній сульфатредукції. Реакція каталізується ферментом АТФ-сульфурилазою.
У випадку бактеріальної асиміляційної сульфатредукції (рис. 5.39, а) наступним кроком є повторне фосфорилювання АФС з використанням АТФ за допомогою АФС-кінази та утворення аденозин-3'-фосфат- 5'-фосфосульфату (ФАФС). Потім ФАФС відновлюється тіоредоксином до сульфіту і, нарешті, за допомогою НАДФН2 до сульфіду.
У ціанобактерій і вищих рослин (рис. 5.39, б) АФС може відновлюватися до сульфіту як через проміжний продукт ФАФС, так і безпосередньо за допомогою глутатіону (GSH - тетрапептид, утворений трьома амінокислотами: цистеїном, глутаміновою кислотою та гліцином). Сульфіт відновлюється до сульфіду за допомогою фередоксину.
Асиміляційна сульфатредукція відбувається з витратою АТФ і електронів.