ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА 19. ОСНОВЫ ИММУНИТЕТА
Иммунитет — это состояние повышенной устойчивости организма к живым телам и веществам, несущим признаки генетической чужеродности. Эти чужеродные субстанции называются антигенами. Антигенами могут быть микроорганизмы, чужеродные клетки, ткани и продукты их жизнедеятельности. Реагирование против чужеродных субстанций осуществляет иммунная система организма. Помимо иммунной системы существуют неспецифические факторы защиты, действие которых не зависит от антигенных особенностей чужеродного агента. Современная иммунология рассматривает категории специфического иммунитета и неспецифической защиты как единый функциональный комплекс, элементы которого находятся в постоянной взаимосвязи.
Возможность возникновения заболевания в результате того или иного вредного воздействия зависит от реактивности организма, т. е. способности обезвредить фактор, вызывающий заболевания, например, микроб или его токсин, вывести его из организма и компенсировать полученный ущерб. Реактивность зависит от состояния макроорганизма (пола, возраста, состояния иммунной системы, наличия других заболеваний), условий его существования (режима питания, условий труда и быта), а также от качества и интенсивности воздействия вредного фактора (например, вирулентности микроорганизма, инфицирующей дозы, места внедрения).
Резистентность к действию вредных факторов связана с генетическими и анатомо-физиологическими особенностями макроорганизма и зависит от его индивидуального состояния. Снижают резистентность психические травмы, голодание, авитаминозы, радиация, отравление алкоголем, никотином, наркотиками.
19.1 Неспецифические факторы защиты
Сопротивляемость организма инфекциям зависит не только от его способности развивать иммунный ответ, т. е. высокоспециализированную форму защиты, но и от неспецифических факторов, направленных против микроорганизмов вне зависимости от их антигенного состава. Механические факторы (кожа, слизистые оболочки, лимфатические узлы) препятствуют проникновению микробов внутрь организма и его распространению. Химические факторы губительно воздействуют на микробные клетки. К последним относятся кислая среда желудка, желчь кишечника, жирные кислоты пота и отделяемого сальных желез, лизоцим, содержащийся в слюне, слезах и отделяемом слизистых оболочек, антимикробные вещества, продуцируемые лимфоцитами и клетками печени, интерферон и др.
19.1.1 Воспаление
Сложным комплексом неспецифических защитных реакций является воспаление, которое включает ряд изменений, прежде всего капиллярных кровеносных сосудов и соединительной ткани, возникающих в ответ на болезнетворный раздражитель. При воспалении наблюдается изменение структуры ткани и ее физиологических функций, выделение жидкости из сосудов (экссудация) и разрастание (пролиферация) соединительной ткани. Воспаление характеризуется повышением температуры, покраснением и припухлостью воспаленного очага, и болезненными ощущениями. Расширение сосудов и утечка плазмы сопровождается выпадением фибрина, который закупоривает сосуды, тем самым ограничивая распространение по ним микробов. В очаге воспаления скапливаются фагоцитирующие лейкоциты, которые захватывают микробные клетки. Активации лейкоцитов способствуют особые вещества, освобождающиеся из тканей, — лейкотоксин, лейкопенический фактор, гистамин и др. Скопление лейкоцитов в зоне воспаления приводит к образованию защитного вала, препятствующего распространению микробов из очага воспаления. Наблюдающиеся в зоне воспаления повышение температуры, снижение pH (ацидоз) за счет накопления молочной кислоты, понижение парциального давления кислорода (гипоксия), оказывают неблагоприятное влияние на микроорганизмы.
Воспаление вызывается самыми разнообразными раздражителями (тепло, механическое повреждение, микробная инфекция), его симптомы обусловлены особыми веществами — медиаторами воспалительных реакций, (гистамин, кинины, лейкотриены, простагландины, цитокины и др.), которые вызывают расширение сосудов, увеличение сосудистой проницаемости, сокращение гладкой мускулатуры, активируют фагоцитоз.
Повышение температуры, наблюдающееся при воспалении или лихорадочном состоянии, связано с освобождением эндогенного пирогена из лейкоцитов, который воздействует на терморегуляторные центры головного мозга. Высвобождению эндогенного пирогена способствуют различные активаторы, в том числе бактериальные эндотоксины, клетки бактерий и вирусные частицы.
19.1.2 Система комплемента
Система комплемента принимает участие в реакциях неспецифической защиты и в реакциях иммунного ответа. Это комплекс растворимых белков плазмы крови и белков клеточной поверхности, взаимодействие которых опосредует различные биологические эффекты: лизис клеток, хемотаксис и опсонизацию при фагоцитозе, стимуляцию воспаления и реакций гиперчувствительности. Большая часть этих белков синтезируется гепатоцитами и макрофагами. Они циркулируют в крови в неактивной форме, а при определенных условиях активируются путем каскада ферментативных реакций. Классический путь активации начинается со связывания фракции комплемента С1 комплексом антиген — антитело, далее активируются другие компоненты, в результате чего образуется литический комплекс.
Альтернативный путь начинается с фракции СЗв и включает каскад реакций с участием пропердина. При этом образуется комплекс белков, который связывается с гликоконъюгатами поверхности микробных клеток, в результате чего происходит их лизис в отсутствие антител. Многие микроорганизмы способны защищать себя от действия комплемента: они имеют поверхностные структуры, устойчивые к лизису или способные подавлять систему комплемента, например, сиаловые кислоты стрептококков, нейссерий, трепонем.
19.1.3 Система пропердина
Мощным неспецифическим фактором защиты организма является система пропердина:
это белки плазмы крови, содержащие отдельные компоненты и ионы магния, которые способны обезвреживать многие бактерии и вирусы;
лизин выделяется тромбоцитами, обладает бактерицидными свойствами, термостабилен;
адгезионные молекулы — группа гликопротеинов, обеспечивающих адгезию клетки к клетке и движение к очагу воспаления лейкоцитов, которые как бы скользят по поверхности эндотелия стенки сосуда. Кроме того, они принимают участие в фагоцитозе, циркуляции и взаимодействии лимфоцитов и в цитотоксических реакциях;
кинины — группа линейных полипептидов, которые составляют класс так называемых тканевых или локальных гормонов. Каждый из них выделяется локально системой диффузно расположенных клеток организма, они не имеют специализированных секретирующих желез и инактивируются в месте своего высвобождения. Наиболее важные из них — ангиотензины, брадакинин, вещество Р;
цитокины — группа различных протеинов, которые высвобождаются клетками млекопитающих и действуют на другие клетки через специфические рецепторы. Ответная реакция клетки-мишени зависит от ее природы и природы цитокина: пролиферация и дифференциация клеток, воспаление, гемопоэз. Цитокины, продуцируемые лимфоцитами, называют лимфокинами, они передают сигналы между различными популяциями лимфоцитов и участвуют в регуляции иммунного ответа. К цитокинам относятся также фактор роста, колониестимулирующий фактор, интерфероны, фактор некроза опухоли;
нормальные антитела содержатся в крови, продукция их не связана с заболеванием, они оказывают антимикробное действие, способствуют фагоцитозу;
интерфероны (ИФН) — группа видоспецифических белков и гликопротеинов, синтезируемых клетками организма в ответ на воздействие интерфероногенов — вирусов, бактерий, их структурных элементов, синтетических полирибонуклеотидов и других веществ, которые вызывают дерепрессию генов, кодирующих ИФН.
19.1.4 Интерфероны
ИФН, как и другие цитокины в организме, выполняют контрольно-регуляторные функции, направленные на сохранение клеточного гомеостаза, важнейшие из них — антивирусная, противоопухолевая, иммуномодулирующая и радиопротекторная. ИФН угнетают размножение вирусов, стимулируя образование в клетке комплекса белков, блокирующих трансляцию вирусной иРНК. Противоопухолевая защита зависит от способности ИФН активировать цитотоксические лимфоциты, макрофаги и естественные киллеры. Кроме того, они активируют интерфероногенез (прайминг) и образование антител.
Определенные факторы направлены не на микробы или их токсины, а на восстановление нарушенных функций макроорганизма. Например, при многих инфекционных заболеваниях возникает расстройство кровообращения из-за потери тонуса артериол. Под влиянием возбуждения сосудистой системы микробными агентами происходит повышение кровяного давления, которое компенсирует потерю тонуса артериол. Повышенная температура тела губительно действует на некоторые микроорганизмы, кроме того, она активирует метаболизм фагоцитов и разрушение ими микробных клеток. Усиливается выделительная функция почек, дыхательного тракта, кишечника, слюнных и потовых желез, что способствует освобождению организма от разных вредных факторов. Все эти явления представляют собой комплекс защитно-адаптационных реакций, получивших название стресса. Факторами, вызывающими состояние стресса (стрессорами) могут быть холод, тепло, радиация, психические травмы, патогенные микробы и их токсины. Под влиянием стрессоров гипофиз начинает выделять адренокортикотропный гормон (АКТГ), стимулирующий функцию надпочечников, которые под влиянием АКТГ начинают усиленно выделять гормон типа кортизона. Кортизон снижает реактивность ткани, уменьшает воспаление и угнетает образование антител. Гормональные препараты типа АКТГ и кортизона применяют при лечении некоторых заболеваний, когда необходимо определенным образом воздействовать на течение воспалительного процесса.
19.1.5 Фагоцитоз
Фагоцитоз — наиболее древняя по происхождению форма защиты. Она выражается в явлении захватывания и переваривания фагоцитами посторонних частиц, в том числе бактерий и разрушенных клеток. Это явление открыто русским ученым И. И. Мечниковым. Все фагоцитирующие клетки не окрашены, поэтому их называют лейкоцитами или в отличие от эритроцитов белыми клетками крови, их характеристика приведена в таблице 39.
19.2 Характеристика фагоцитирующих клеток
Процесс фагоцитоза начинается со стадии узнавания и адгезии посторонней частицы (например, микробной клетки) на мембране фагоцита. При этом из фагоцита вытягиваются и сливаются друг с другом псевдоподии (ложноножки), так что микроб оказывается заключенным внутри вакуоли (фагосомы), которая затем сливается с лизосомой фагоцита. В результате микроорганизм погибает под действием биоцидных факторов фагоцита (О2, Н2О2, НСlO) и разрушается с помощью его гидролитических ферментов. Фагоцитоз, при котором происходит гибель и разрушение поглощенных клеток, носит название завершенного. Наряду с этим при некоторых инфекциях (гонорея, туберкулез, лепра, лейшманиоз, коклюш, брюшной тиф, туляремия, бруцеллез, микозы) наблюдается незавершенный фагоцитоз, при котором микроорганизмы поглощаются фагоцитами, но не погибают, а иногда размножаются. Это связано с тем, что некоторые микробы выделяют вещества, блокирующие процесс фагоцитоза. К ним относятся микробные токсины, вещества капсулы, специфические белки, лейкоцидины, токсины. Активируют фагоцитоз соли кальция, магния, электролиты, комплемент, антитела. Кроме того, микроорганизмы могут избегать разрушения вследствие того, что они покидают фагосому до ее слияния с лизосомой и становятся недоступными для литических ферментов.
Фагоциты, кроме разрушения чужеродных клеток, еще и выполняют важную функцию антигенпредставляющих клеток иммунной системы для дальнейшего развития специфического иммунного ответа.
Естественные клетки-киллеры (ЕКК) — это лимфоциты, обладающие цитотоксичностью по отношению к клеткам-мишеням (опухолевым, содержащим вирусы и другие паразиты). Они не обладают фагоцитирующей активностью, но убивают свою жертву с помощью цитотоксических веществ. Их действие неспецифично в отличие от антиген-специфических Т-киллеров (см. ниже). Среди лейкоцитов крови человека ЕКК составляют от 2 до 12%.
19.3 Иммунитет
Иммунитет отличается высокой специфичностью своих реакций, основанной на тонких структурно-химических различиях антигенов и соответствующих им антител (иммуноглобулинов), образующихся в ответ на попадание антигена в организм [34].
По происхождению иммунитет подразделяют на врожденный (его также называют наследственным или видовым) и приобретенный. Видовой иммунитет — это невосприимчивость некоторых видов животных к болезням, поражающим другие виды. Например, люди не болеют кроличьим насморком, куриной холерой; животные не подвержены венерическим заболеваниям. Видовой иммунитет является следствием длительной эволюции взаимоотношений микроба и макроорганизма и зависит от их биологических особенностей, сформировавшихся в ходе естественного отбора. Степень напряженности видового иммунитета может быть абсолютной и относительной. Например, у крыс в клетках нет рецепторов к дифтерийному токсину, поэтому они обладают абсолютной устойчивостью к дифтерии. Для других животных восприимчивость к некоторым инфекционным заболеваниям можно повысить, воздействуя на них какими-либо неблагоприятными факторами, например, изменяя температуру тела, вводя гормоны, иммунодепрессанты, подвергая их ионизирующей радиации. В этом случае говорят об относительном врожденном иммунитете.
Приобретенный иммунитет по наследству не передается. Он формируется по отношению к конкретному виду возбудителя и является строго специфическим. Приобретенный иммунитет подразделяют на естественный и искусственный, а каждый из этих видов в свою очередь делится на активный и пассивный. Естественный активный иммунитет возникает после перенесенного заболевания или после инфицирования без клинических признаков заболевания. Естественный пассивный иммунитет — это иммунитет новорожденных, которые получают его от матери в период внутриутробного развития. Его продолжительность невелика — около 6 месяцев. Искусственный активный иммунитет возникает после активной иммунизации, т. е. введения вакцин и анатоксинов; искусственный пассивный — после введения иммунных сывороток или сывороточных препаратов (иммуноглобулинов).
19.4 Антигены
Антигенами называют все вещества, которые несут признаки генетической чужеродности и при введении в организм вызывают развитие специфических иммунологических реакций. Антигенность присуща белкам, многим полисахаридам, гликоконъюгатам (гликопротеинам, липополисахаридам), некоторым искусственным высокополимерным соединениям.
Для того чтобы антиген вызвал в организме иммунный ответ, он должен обладать достаточной молекулярной массой (обычно не менее 5-10 кД).
Основные понятия, характеризующие антиген: антигенность (способность вызывать иммунный ответ), иммуногенность (способность вызывать иммунитет, т. е. невосприимчивость к инфекции) и специфичность.
Специфичность определяется особенностями химической структуры антигена, благодаря которым один антиген отличается от другого. Химическая группировка молекулы антигена, определяющая его специфичность, называется антигенной детерминантой (эпитопом). Например, антигенная специфичность белка определяется его первичной и надмолекулярными структурами, а также поверхностно расположенными группами, которые могут служить антигенными детерминантами. В молекулах гликоконъюгатов эпитопом часто является полисахарид. Специфичность антигена выражается в том, что он реагирует только с теми антителами и иммунными лимфоцитами, которые возникли в ответ на его введение.
Гаптены — это вещества, обладающие специфичностью, но не вызывающие иммунного ответа при введении в организм. Однако с готовыми антителами они взаимодействуют. Гаптены приобретают свойства полноценных антигенов после соединения с крупномолекулярными веществами (белками, полисахаридами или искусственными полиэлектролитами). Соединение происходит за счет ковалентных связей или электростатических сил. Свойствами гаптенов могут обладать многие лекарственные препараты (амидопирин, хинидин, продукты распада пенициллина и др.), которые, взаимодействуя с белками организма, могут вызывать иммунный ответ — лекарственную аллергию.
Видовая специфичность — это специфичность, благодаря которой представители одного вида отличаются от особей другого вида. Например, различается состав сывороточных белков у человека и животных, что может быть использовано на практике, например, в судебной медицине.
Групповая специфичность обусловливает разницу среди особей одного вида. Антигены, благодаря которым особи одного вида различаются между собой, называются изоантигенами. К изоантигенам относятся антигены, которые содержатся в эритроцитах и определяют группы крови человека.
Состав молекул главного комплекса гистосовместимости (МНС — от англ. Major Histocompatibility Complex) уникален для каждого организма и определяет его биологическую индивидуальность, что позволяет отличать «свое» (гистосовместимое) от «чужого» (несовместимого). Молекулы I и II классов — это гликопротеины, которые контролируют иммунный ответ и участвуют в реакциях цитотоксичности, осуществляемой Т-лимфоцитами. Молекулы I класса МНС представлены на поверхности всех ядросодержащих клеток, молекулы IIкласса — преимущественно на мембране иммунокомпетентных клеток (макрофагов, В-лимфоцитов, активированных Т-лимфоцитов). Гены III класса МНС кодируют отдельные компоненты системы комплемента.
Типоспецифичность определяет антигенные различия внутри одного вида микроорганизмов (серовары). Например, известно более 80 сероваров пневмококков, различающихся своими полисахаридными антигенами.
Гетероспецифичность обусловлена наличием гетероантигенов — общих для представителей разных видов антигенных детерминант. Общие антигены встречаются у весьма отдаленных видов: у человека и возбудителя чумы, вируса гриппа и других микроорганизмов. Это так называемые мимикрирующие антигены. При сходстве антигенных структур микро- и макроорганизма формирование иммунного ответа нарушено, например, в миокарде человека имеются химические структуры, сходные с антигенами стрептококков, поэтому антитела против стрептококков способны атаковать ткани сердца, что служит причиной осложнений после перенесенной скарлатины.
Антигенная структура микробной клетки представляет большой научный и практический интерес, поскольку антигены бактерий используют с целью создания вакцинных препаратов для воспроизведения искусственного иммунитета и для серологической диагностики инфекционных болезней. В состав бактериальной клетки и вирусной частицы входят сложные комплексы веществ, обладающих антигенной активностью. К ним относятся высокомолекулярные соединения белковой природы, полисахариды, липополисахариды и т. п. Антигенными свойствами обладают органоиды клеток: жгутики, мембраны, цитоплазма, рибосомы, клеточная стенка. Токсины бактерий также являются сильными антигенами.
У подвижных бактерий различают Н-антигены (жгутиковые) — термолабильные, разрушающиеся при температуре 56-80°C, состоящие из белков, и О-антигены (соматические) — термостабильные, выдерживающие нагревание до 80-100°C, имеющие липопротеидную природу.
У капсульных бактерий, например, клебсиелл, пневмококков и др. существуют полисахаридные капсульные антигены.
Антиген вирулентности (Vi) также относится к капсульным, он описан у вирулентных видов энтеробактерий, например, у сальмонелл.
Протективный антиген не является постоянной частью микробной клетки. Он образуется в зараженном организме и обладает особенно сильным иммуногенным действием.
Антигены рибосом явились основой для разработки нового типа вакцины.
Антигены вирусов — белки, гликоконъюгаты, нуклеопротеиды, специфичны для вируса, или содержат компоненты клетки хозяина (липиды, углеводы). Многие вирусы содержат особый антиген — гемагглютинин, который выявляется в реакции гемагглютинации. Эта реакция основана на способности вирусного гемагглютинина агглютинировать эритроциты человека и животных и позволяет выявить наличие вируса в исследуемом субстрате.
Реакция гемадсорбции основана на способности эритроцитов адсорбироваться на клетках, пораженных вирусом. Обе реакции проходят без участия антител, поэтому не являются иммунологическими. Однако гемагглютин способен вызывать образование антител, которые могут быть обнаружены в реакции торможения гемагглютинации.
19.5 Антитела
Антитела — это особые белки (гликопротеины), которые образуются в организме позвоночных животных и человека при введении антигенов и обладают способностью вступать с ними в специфическую связь. Антигены, связанные с антителами, обезвреживаются и удаляются из организма.
Особое значение имеет способность антител соединяться со специфической молекулой антигена, «узнавать» даже самые тонкие различия в ее структуре, например, не только замену в молекуле белка одной аминокислоты на другую, но даже замену стереоизомеров органических соединений. Специфичность антител связана с различием в их химическом строении, т. е. в последовательности аминокислот полипептидных цепей, составляющих их структуру. Наряду с тонкими различиями в структуре антител, определяющими их иммунологическую специфичность, антитела имеют общие характерные особенности строения.
Антитела имеют глобулярную структуру и называются иммуноглобулинами. Основу структуры любого антитела (рис. 79) составляет комплекс из четырех полипептидных цепей — двух одинаковых тяжелых и двух одинаковых легких. Тяжелые цепи обозначают буквой Н (heavy — тяжелый), а легкие — буквой L (light — легкий). Тяжелые и легкие цепи удерживаются вместе дисульфидными мостиками. Они уложены таким образом, что на поверхности образующейся структуры возникают два одинаковых участка, которые обозначаются Fab. Эти участки содержат центры связывания антигена. Третий участок Fc содержит структуры, обеспечивающие связывание антител с определенными клетками, несущими на своей поверхности рецепторы Fc-фрагмента, например, лейкоцитами, тучными клетками. Центры связывания антигена (активные центры) соответствуют эпитопам антигена (подходят друг другу как замок и ключ). Взаимодействие антигена с антителом осуществляется за счет электростатических, гидрофобных взаимодействий и сил Ван-дер-Ваальса. Молекулы полных антител имеют как минимум два центра связывания с антигеном. Антитела, имеющие только один центр связывания, называют неполными.
Рис. 79. Структура мономера молекулы иммуноглобулина [35, 36].
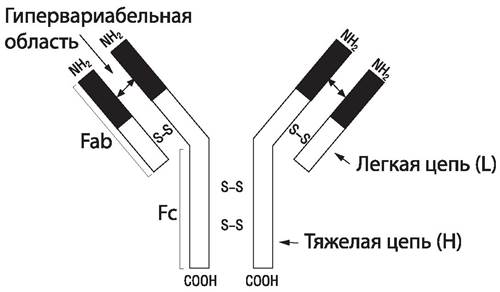
Как тяжелые, так и легкие цепи в своей структуре имеют две категории областей: вариабельные (V) и постоянные (С) по содержанию составляющих их аминокислот. Вариабельная область связана со специфичностью антител. Она находится в участке Fab, тогда как постоянная область — в участке Fc. Вторичная структура иммуноглобулинов — α-спираль, перемежающаяся сложными β-структурами — «клубками», возникающими при сшивании аминокислотных остатков каждой цепи. Эти клубки называют доменами, они находятся на тяжелых и легких цепях вариабельных и константных участков. Активные центры антител формируются доменами вариабельных участков, которые располагаются в гипервариабельных областях тяжелых и легких цепей.
Иммуноглобулины представляют собой гетерогенную группу белков, их гетерогенность связана с существованием разных типов тяжелых и легких цепей. У человека имеется два типа легких цепей: к и λ, (каппа и лямбда) и 5 классов тяжелых цепей α, γ, μ, δ, ε. В соответствии с классами тяжелых цепей иммуноглобулины подразделяют на 5 классов (IgG, IgM, IgA, IgD, IgE), различающихся по своим физико-химическим свойствам и биологической активности (табл. 40).
Таблица 40. Основные свойства иммуноглобулинов
Свойства |
IgG |
IgA |
IgM |
IgD |
IgE |
Молекулярная масса, кД |
150 |
160-400 |
900 |
180 |
190 |
Константа седиментации, ед. Сведеберга |
7 |
7 |
19 |
7 |
8 |
Период полураспада в сыворотке, сут. |
21 |
6 |
10 |
3 |
2 |
Углеводы, % |
3 |
7 |
12 |
13 |
11 |
Функции: |
|||||
активация комплемента |
++ |
+- |
++++ |
- |
- |
опсонизация |
++++ |
+ |
- |
- |
- |
противовирусная активность |
++ |
+++ |
+ |
? |
? |
сенсабилизация тучных клеток |
- |
- |
- |
- |
+ |
IgM — пентамер из 5 субъединиц, имеет 10 центров связывания с антигеном. Филогенетически наиболее древний, наиболее ранний, обнаруживаемый при первичном попадании антигена в организм, основной класс, синтезируемый у новорожденных и младенцев.
IgG составляют до 75% всех иммуноглобулинов, это основной класс, защищающий организм от бактерий, вирусов, токсинов и обеспечивающий формирование пассивного иммунитета у плода, поскольку только эти иммуноглобулины способны преодолевать плацентарный барьер.
IgA существует в двух видах — сывороточном и секреторном. Большая часть IgA — это секреторные иммуноглобулины (slgA), у которых два или три мономера соединены секреторным фрагментом, защищающим иммуноглобулин от разрушения ферментами. slgA присутствуют в слюне, слезах, молоке, секретируются на поверхности эпителия и слизистых оболочек, усиливая их защитные функции.
IgE специфически взаимодействуют с тучными клетками и базофильными лейкоцитами и принимают участие в развитии аллергических реакций. Их защитные функции направлены в основном против гельминтов.
IgD функционируют как мембранные рецепторы антигена на В-лимфоцитах.
Кроме различных классов (изотипов) иммуноглобулинов, между ними существуют аллотипические и идиотипические различия. Аллотипы (маркеры константной области) генетически детерминированы и наследуются. Идиотины определяют индивидуальную характеристику каждого антитела. Идиотипические маркеры (антигенные детерминанты) локализуются в гипервариабельных областях и соответствуют антигенсвязывающим участкам антител. Все молекулы иммуноглобулинов, продуцируемые одним клоном лимфоцитов, несут один и тот же идиотип и называются моноклональными антителами. Источником разнообразия идиотипов служат мутации ДНК, кодирующей вариабельные участки, нематричный синтез ДНК между рекомбинирующими сегментами и сдвиг точки соединения сегментов на несколько нуклеотидов.
Иммунитет, опосредованный антителами, находящимися в плазме крови и других жидкостях организма, называется гуморальным. Его механизм связан со способностью антител нейтрализовать возбудитель и его токсины, посредством опсонизации, антитоксического действия, активации комплемента и других воздействий на инфекционный агент. Опсонизация происходит путем связывания антител с поверхностью микробной клетки. Такой комплекс активно поглощается фагоцитом при взаимодействии Fc-фрагмента антитела с соответствующим Fc-рецептором фагоцита. Антитела способны взаимодействовать с рецепторами клеток, связывающими бактерии или вирусы, препятствуя их адгезии и проникновению в клетки организма-хозяина. Кроме того, антитела обладают каталитической активностью, действуя как гидролазы и оксидоредуктазы, принимают участие в нейтрализации инфекционного агента.
19.6 Иммунная система
Иммунная система представляет собою совокупность лимфоидных органов и лимфоидных клеток, которые распространяются по всему телу организма и связаны системой кровообращения, лимфотока и единой системой иммунорегуляции. Иммунная система обладает уникальной способностью вырабатывать молекулы антител, специфичные для каждого антигена. Органы иммунной системы подразделяются на первичные — центральные (костный мозг и тимус) и вторичные — периферические (селезенка, лимфатические узлы, скопления лимфоидной ткани).
Первичные — центральные органы иммунной системы обеспечивают ее самообновление. В них происходят процессы пролиферации клеток — предшественников, их дифференцировка и созревание, в результате чего они превращаются в иммунокомпетентные клетки, выходят в циркуляцию и заселяют периферические органы иммунной системы.
Костный мозг — место образования полипотентной стволовой клетки, которая дает начало разным росткам кроветворения, в том числе миеломоноцитарному и лимфоцитарному. В костном мозге образуются цитокины; у млекопитающих это возможное место созревания В-лимфоцитов (см. ниже).
Тимус (вилочковая железа) — место созревания и дифференциация Т-лимфоцитов. Тимус активно вырабатывает лимфоциты в период эмбриогенеза, достигает максимального размера у большинства позвоночных вскоре после рождения, затем постепенно инволюционирует. У человека самая высокая продукция Т-лимфоцитов сохраняется до двух лет жизни, затем быстро падает. Однако количество Т-лимфоцитов сохраняется на достаточном уровне, т. к. это долгоживущие клетки, кроме того, они способны пролимферировать в ответ на встречу со специфичным антигеном. В процессе созревания и дифференциации предшественники Т-лимфоцитов из костного мозга поступают в корковый слой тимуса, постепенно мигрируют внутрь и приобретают свои маркеры, контактируя с клетками тимуса и продуцируемыми ими медиаторами (специфическими пептидами) и цитокинами.
В тимусе происходит элиминация потенциально аутореактивных клеток. Основная функция зрелых Т-лимфоцитов — распознавание чужеродных антигенов, но не антигенов собственного организма (аутоантигенов). Элиминация состоит в том, что Т-лимфоциты, имеющие рецепторы для аутоантигенов (их в популяции 95-98%), получают сигнал для апоптоза, а Т-клетки, обладающие рецепторами для чужеродных антигенов — сигнал для пролиферации. Апоптоз (программированная гибель) — это процесс распада клетки на отдельные фрагменты, которые могут быть использованы для построения других клеток.
Вторичные — периферические органы иммунной системы — это место встречи иммунокомпетентных клеток с антигеном, его распознавания и развития специфического иммунного ответа (взаимодействия иммунокомпетентных клеток и синтеза иммуноглобулинов).
Лимфатические узлы распространены по всему телу организма. Один лимфоузел имеет массу около 1 г и содержит приблизительно 2 х 109 лимфоцитов. Каждый час из него выходит в лимфу количество лимфоцитов, равное его утроенному весу. Он отфильтровывает микробные клетки и другие частицы, в нем развивается иммунный ответ на антигены, попадающие в лимфу.
В селезенке развивается иммунный ответ на антигены, попадающие в кровь. Она удаляет из крови чужеродные частицы, а также состарившиеся и поврежденные эритроциты. При удалении селезенки ее функцию берут на себя лимфоидные органы, у таких пациентов иммунитет ослаблен.
Лимфоидная ткань ассоциирована со слизистой оболочкой кишечника, глотки, дыхательных путей, мочеполового тракта. Ее функция — активация В-лимфоцитов, продуцирующих иммуноглобулины классов А и Е.
19.7 Иммунокомпетентные клетки
Иммунокомпетентные клетки — это клетки, принимающие участие в иммунном ответе. Они постоянно циркулируют между кровью, лимфой и лимфоидными органами, чтобы обеспечить встречу со «своим» антигеном, т. к. каждый антиген распознается лишь небольшой частью популяции лимфоцитов. Лимфоциты — единственные клетки, способные распознавать антиген и отвечать на контакт с ним. Индивидуальные лимфоциты специализированы: они способны (коммитированы) отвечать лишь на определенную группу структурно сходных антигенов. Эта коммитированность существует еще до первого контакта с антигеном и выражается в наличии у лимфоцита мембранных рецепторов, специфичных для детерминант определенного антигена. Лимфоциты являются исключительно неоднородной популяцией клеток: считают, что число рецепторов лимфоцитов с различными антигенсвязывающими центрами составляет не менее 10 6. Кроме того, лимфоциты различаются по их функциям в процессе иммунного ответа и другим физиологическим особенностям.
В-лимфоциты получили свое название потому, что исследования, проведенные на птицах, показали, что местом их дифференциации является особый лимфоидный орган — бурса (сумка) Фабрициуса. У млекопитающих это лимфоидный орган, о локализации которого пока нет единого мнения (костный мозг, лимфоидная ткань слизистой оболочки кишечника).
В-лимфоциты в ходе иммунного ответа дифференцируются в клетки, продуцирующие иммуноглобулины. Они распознают антигенные детерминанты с помощью рецепторов, представляющих иммуноглобулины классов D или М. Кроме того, они обладают другими рецепторами, для распознавания сигналов в процессе иммунного ответа. Они способны распознавать антиген в растворе и связывать белковые, полисахаридные и липопротеиновые антигены.
Срок жизни большей части популяции В-лимфоцитов (около 85%) составляет не более 10 дней, около 14% живут 4-6 недель, около 1% живут десятилетиями, это клетки иммунологической памяти.
Т-лимфоциты — основные клетки иммунологической памяти, они различаются по своим функциям, дифференцируются по поверхностным маркерам, определяемым серологическими методами.
Т-эффекторы СД8+ продуцируют многочисленные цитокины, которые способствуют их дифференциации и пролиферации, а также активируют В-лимфоциты и макрофаги.
Цитотоксические лимфоциты (CTL, Т-киллеры) имеют маркер СД8+, они появляются в результате активации и пролиферации Т-эффекторов под воздействием антигена. При размножении паразита (микобактерии туберкулеза, грибы, простейшие, вирусы) внутри клетки хозяина его антигены образуют комплекс с антигенами МНС I класса, который распознается рецепторами CTL. В ответ CTL активируются, т. е. приобретают способность убивать инфицированную клетку с помощью пресинтезированных цитотоксинов: фрагментинов и перфоринов. Первые индуцируют апоптоз клетки-мишени, вторые представляют собою белки, образующие поры, нарушающие проницаемость мембраны клетки-мишени и прокладывающие путь фрагментинам. Контакт CTL и клетки-мишени непродолжителен, после чего CTL движется к новой жертве. Клетки с маркером СД8+ обладают и супрессорной активностью, т. е. регулируют интенсивность иммунного ответа и предотвращают развитие аутоиммунных реакций.
Регуляторные СД4+ лимфоциты или Т-хелперы (ТН) подразделяют на две группы: ТН-1 (воспалительные) активируют макрофаги и принимают участие в реакциях гиперчувствительности замедленного типа; ТН-2 активируют В-лимфоциты в процессе иммунного ответа.
Макрофаги обеспечивают неспецифическую защиту за счет фагоцитоза и играют важную роль в развитии иммунного ответа как антигенпроцессирующие и антигенпредставляющие клетки. Они происходят из стволовой клетки костного мозга, проходят стадии циркулирующих в крови промоноцита и моноцита и мигрируют в ткани (стадия гистиоцита или тканевого макрофага). Они несут на своей поверхности рецепторы (маннозы, липополисахаридов), необходимые для захвата микробных клеток, а также рецепторы Fc-области иммуноглобулинов и комплемента, необходимые для осуществления реакций с участием антител.
Макрофаги и цитотоксические лимфоциты осуществляют клеточный иммунный ответ (реакции гиперчувствительности замедленного типа, уничтожение собственных инфицированных и опухолевых клеток).
Дендритные клетки происходят из костного мозга и заселяют нелимфоидные ткани. Дендритные клетки эпидермиса кожи и в слизистых оболочках дыхательных путей называются клетками Лангерганса. Участвуют в иммунном ответе как антигенпредставляющие клетки. Сходны с макрофагами, но фагоцитирующей активностью обладают только их незрелые формы.
19.8 Цитокины
Цитокины — это полипептиды, продуцируемые иммунокомпетентными клетками и в то же время являющиеся эффекторами этих клеток, действующими на их метаболизм, пролиферацию и секрецию. Их основные функции: контроль пролиферации клеток, контроль воспалительных реакций, регуляция клеточного и гуморального иммунного ответа, противовирусная активность и цитотоксичность.
Многие из них полифункциональны (табл. 41). Нарушение активности или синтеза цитокинов приводит к заболеваниям [34]. Некоторые цитокины получают методами генетической инженерии и используют как лечебные препараты.
Таблица 41. Основные типы цитокинов
Цитокин |
Источник |
Мишень |
Эффекты |
ИЛ-1 |
Макрофаги, В-клетки, NK-клетки |
Т-клетки, В-клетки, макрофаги |
Активация лимфоцитов и макрофагов, гипертермия, острофазная реакция*, усиление клеточной адгезии |
ИЛ-2 |
Т-клетки |
В-клетки, ТН, NK-клетки, макрофаги |
Активация лимфоцитов и макрофагов, стимуляция секреции лимфокинов |
ИЛ-3 |
Т-клетки |
Стволовые клетки |
Пролиферация |
ИЛ-4 |
Т-клетки |
В-клетки, макрофаги |
Пролиферация лимфоцитов, активация макрофагов, влияние на переключение класса синтезируемых АТ : способствует продукции lgG1 и IgE подавляет синтез lgG2 и lgG3 |
ИЛ-5 |
Т-клетки |
В-клетки, стволовые клетки |
Пролиферация, дифференцировка, переключение на синтез IgA, эозинофилия |
ИЛ-6 |
Макрофаги, фибробласты, опухолевые клетки |
В-клетки, макрофаги, миелоидные предшественники |
Пролиферация, стимуляция секреции lg, острофазная реакция |
ИЛ-7 |
Клетки стромы |
Пре-В-клетки, Т-клетки |
Пролиферация |
ИЛ-8 |
Сосудистый эндотелий |
Нейтрофилы |
Подавление адгезии лейкоцитов |
ИЛ-9 |
Т-клетки |
Т-клетки, тучные клетки |
Пролиферация |
ИЛ-10 |
Т-клетки |
Т-клетки |
Пролиферация |
ГМ-КСФ |
Т-клетки, моноциты |
Стволовые клетки, моноциты, гранулоциты |
Пролиферация, дифференцировка |
α-ФНО |
Макрофаги, Т-клетки, NK-клетки |
В-клетки, макрофаги, нейтрофилы |
Рост и дифференцировка, активация, усиление адгезии, кахексия |
β-ФНО (лимфотоксин) |
Т-клетки |
Клетки опухоли |
Цитотоксичность |
МИФ |
Тгзт |
Макрофаги |
Подавление миграции |
МАФ |
Тгзт |
Макрофаги |
Активация |
ФХМ |
Тгзт |
Макрофаги |
Стимуляция хемотаксиса |
ФП |
Тгзт |
Лимфоциты |
Перенос клеточно-опосредованного иммунитета |
ФИЛ |
Тгзт |
Нейтрофилы |
Ингибирование миграции |
Перфорин |
ЦТЛ |
Клетки опухоли, клетки трансплантата |
Лизис |
α-ИФН |
Лейкоциты |
Клетки организма |
Торможение репликации вирусов |
β-ИФН |
Фибробласты |
Клетки организма |
Торможение репликации вирусов |
γ-ИФН |
Т-клетки |
Макрофаги, NK-клетки, и другие клетки |
Активация, торможение репликации вирусов |
Примечание: ГМ-КСФ — гранулоцитарно-моноцитарный колониестимулирующий фактор; ИЛ — интерлейкин; ИФН — интерферон; МИФ — макрофагингибирующий фактор; МАФ — макрофагактивирующий фактор; ФХМ — фактор хемотаксиса макрофагов; ФП — фактор переноса; ФИЛ — фактор, ингибирующий миграцию лейкоцитов; ФИО — фактор некроза опухоли; Тгзт — Т-эффекторы гиперчувствительности замедленного типа; ЦТЛ — Т-цитотоксические клетки; NК — естественные киллеры; Т-х — Т-хелперы. *Острофазная реакция — связанное с острым воспалением увеличение сывороточной концентрации определенных белков (С-реактивного белка, амилоида А, гаптоглобина, церулоплазмина, компонентов комплемента).
19.9 Формирование иммунного ответа
Процессинг антигена — это его модификация (ферментативная обработка, например, микробной клетки), в результате которой: а) антигенная детерминанта делается доступной для лимфоцитов; б) крупные белковые молекулы превращаются в пептиды, при этом сглаживаются конформационные различия, что требует меньшего разнообразия Т-рецепторов; в) глубокий протеолиз делает возможным распознавание внутренних антигенных структур микробной клетки, которые меньше, чем внешние, подвержены мимикрии под «свое». Функцию процессинга и представления антигена Т-лимфоциту выполняют макрофаги, В-лимфоциты, дендритные клетки, купферовские клетки печени и др. Процессированный антиген в комплексе с молекулой МНС II класса экспрессируется на поверхности антигенпредставляющей клетки и распознается Т-хелпером.
Взаимодействие иммунокомпетентных клеток (рис. 80). Узнавание Т-хелпером антигенного комплекса приводит к его активации, в результате которой лимфоцит синтезирует ИЛ-1; под действием ИЛ-1 происходит синтез ИЛ-2, стимулирующего пролиферацию.
Рис. 80 Взаимодействие иммунокомпетентных клеток. Антиген: а — В-клеточный эпитоп, б — Т-клеточный эпитоп; 1 — антигенпредставляющая клетка (макрофаг); 2 — неактивированный Т-хелпер; TCR — Т-клеточный рецептор; 3 — активированный Т-хелпер: ЦР — цитокиновый рецептор; 4 — В-лимфоцит.
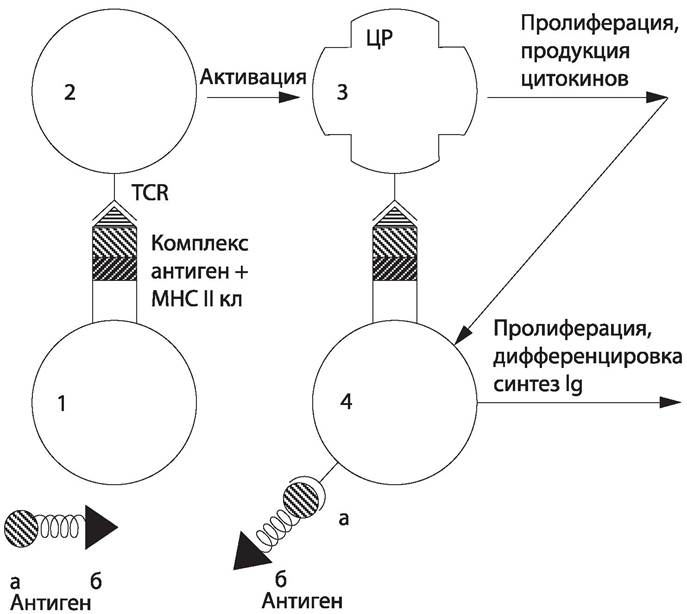
В-лимфоцит распознает «свой» антиген, перерабатывает его и представляет на своей поверхности его фрагмент в комплексе с молекулой МНС II класса. Этот комплекс распознается активированным Т-хелпером, который в ответ секретирует ряд интерлейкинов (ИЛ-2, ИЛ-4, ИЛ-5, gИФH), под действием которых В-клетка размножается, образуя клон плазматических клеток. Плазматические клетки синтезируют иммуноглобулины, их секрецию стимулирует ИЛ-6, выделяемый активированными Т-хелперами.
19.10 Аллергия
Обычно, говоря об иммунитете, имеют в виду полезные для организма защитные реакции. Однако следствием иммунных реакций могут быть и патологические изменения в организме. Эта измененная реактивность, возникающая под влиянием антигенов, носит название аллергии, а вызывающие ее вещества — аллергенами. Аллергены подразделяют на бытовые (пыль пуховых подушек, эпидермис и шерсть домашних животных), растительные (пыльца), производственные (пыль хлопка, шерсти, красители, лаки и т. д.); пищевые (яйца, земляника, цитрусовые, шоколад и др.), лекарственные (ацетилсалициловая кислота, сульфаниламиды, антибиотики и др.). Аллергические реакции подразделяют на 5 основных типов.
19.10.1 Аллергический реакции 1 типа
Реакции 1 типа (анафилактические) могут быть вызваны пыльцой растений, органическими компонентами пыли. Аллергены активируют специфическую популяцию Т-хелперов, которые в свою очередь активируют В-лимфоциты, вырабатывающие IgE. Эти антитела способны прочно связываться с Fc-рецепторами клеток-мишеней (тучные клетки, базофилы).
Повторно попадающий в организм аллерген взаимодействует с IgE, фиксированными на клетках, что сопровождается цепной реакцией клетки-мишени, которая начинает выделять медиаторы (гистамин, кинины, гепарин, факторы хемотаксиса), воздействующие на клетки гладкой мускулатуры, кровеносных сосудов, желез внутренней секреции. В результате развивается клиническая картина анафилактических заболеваний, симптомы которых зависят от локализации сенсибилизированных клеток: ринит, конъюнктивит, бронхиальная астма, анафилактический шок.
19.10.2 Аллергические реакции II типа
Аллергические реакции II типа называют цитотоксическими, они связаны с выработкой IgG против антигенных компонентов мембран клеток организма. Такими компонентами могут быть аутоантигены клеток организма или антигены, вторично фиксированные на клеточных мембранах, например, лекарственные аллергены. Комплекс IgG с этими антигенами способен связывать комплемент и активировать его по классическому пути. В результате клетка погибает (комплементзависимый цитолиз). Таков механизм аллергических реакций к пенициллину, сульфаниламидам, при переливании крови, отторжении трансплантата, аутоиммунных заболеваниях. В то же время реакции этого типа играют защитную роль, обеспечивая элиминацию поврежденных, опухолевых и инфицированных паразитами клеток.
19.10.3 Аллергические реакции III типа
Реакции III типа — это реакции, обусловленные образованием иммунных комплексов (ИК). Образование ИК является перманентно протекающей физиологической реакцией, а патологические реакции на ИК могут быть связаны с нарушением механизмов их уничтожения клетками фагоцитарной системы. ИК способны активировать компоненты плазмы (системы комплемента, свертывания крови, хемотаксис) и определенные клетки (гранулоциты, тромбоциты и др.). Активированные клетки выделяют биогенные амины, ферменты, кинины и другие медиаторы, обусловливающие патологический процесс. В зависимости от вида антигена и его локализации, наблюдаются различные клинические проявления заболевания.
Эндогенные антигены вызывают аутоиммунные заболевания: системную красную волчанку, ревматоидный артрит, пузырчатку и др. Ответ на экзогенные антигены проявляются как сывороточная болезнь, феномен Артюса, ряд инфекционных заболеваний. Сывороточная болезнь развивается при введении сывороток и других лекарственных препаратов, ее клинические проявления — артрит, эндокардит, гломерулонефрит и др. Феномен Артюса — это местная реакция, которая развивается в локусе попадания антигена (укус насекомых, введение лекарственных препаратов) на коже и прилегающих тканях. С образованием ИК связан патогенез инфекционных заболеваний различной этиологии: вирусных (гепатит В, корь), бактериальных (стрептококковых, менингококковых, вызванных микоплазмами и др.), протозойных (малярия, трипаносомоз), гельминтозов. Кроме того, ИК участвуют в патогенезе опухолевых заболеваний и при отторжении трансплантата.
Рассмотренные три типа аллергических реакций обусловлены антителами и развиваются через несколько минут после введения антигена, поэтому их называют реакциями немедленного типа. Они существенно отличаются от реакций IV типа, опосредованных клетками, или реакций гиперчувствительности замедленного типа (ГЗТ), которые проявляются не ранее 6-8 час., обычно через 24-48 час. после введения антигена. Основой этих реакций является не гуморальный, а клеточный иммунитет. В реакции принимают участие Т-лимфоциты, несущие специфические для данного антигена рецепторы. В результате распознавания комплекса антигена с молекулами МНС II класса начинается пролиферация лимфоцитов, высвобождение лимфокинов и реализация цитотоксического эффекта. Лимфокины (фосфолипиды, пептиды) — медиаторы клеточного иммунитета активируют макрофаги или непосредственно воздействуют на клетки-мишени. Активированные макрофаги обладают повышенной фагоцитарной и микробоцидной активностью. Активированные лимфоциты (Т-киллеры) вступают в тесный контакт с клеткой-мишенью, обусловленный одновременным связыванием антигена и молекул МНС соответствующими рецепторами. Активируются ферменты Т-лимфоцита, нарушающие проницаемость мембраны клетки-мишени, которая в результате лизируется. Контакт Т-лимфоцита и клетки-мишени продолжается около 1 часа, лимфокины появляются в течение 1-12 час, а первые некрозы — через 24-48 час.
Т-клеточная цитотоксичность проявляется при противоопухолевом, противовирусном и трансплантационном иммунитете. Гиперчувствительность замедленного типа развивается при туберкулезе, лепре, бруцеллезе, пневмококковых и стрептококковых инфекциях, дифтерии, микозах, гельминтозах. Возможно развитие ГЗТ при контакте с гаптенами — химическими веществами, в том числе лекарственными, которые образуют комплексные антигены с белками кожи.
19.10.4 Аллергические реакции IV типа
Аллергические реакции IV типа выполняют не только патогенетические, но и защитные функции, повышая активность клеточного иммунитета. На этом принципе построена активная иммунизация против туберкулеза, когда детям в первые часы их жизни вводят ослабленную культуру туберкулезной палочки (вакцину BCG), которая повышает реактивность организма и предотвращает развитие заболевания.
Сенсибилизированные Т-лимфоциты годами сохраняются в организме и при повторном попадании антигена вступают с ним в реакцию. На этом основаны кожные диагностические реакции на инфекционные заболевания (туберкулез, микозы).
В естественных условиях часто наблюдаются комбинированные формы клеточных и гуморальных аллергических реакций.
19.10.5 Аллергические реакции V типа
Реакции V типа обусловлены образованием антител к рецепторам или медиаторам определенных физиологических реакций, например, к рецепторам гормонов, в результате чего нарушается гормональная регуляция организма.
Лечение и профилактика аллергии предусматривает выявление аллергенов и прекращение контактов с ними, применение препаратов, угнетающих иммунный ответ (иммунодепрессантов), при анафилаксии — неспецифических средств (новокаин, димедрол, кальция хлорид), или используют метод десенсибилизации. Одним из способов десенсибилизации является дробное введение антигена. Небольшие порции антигена, вводимого дробно, связывают циркулирующие в крови антитела и предотвращают развитие аллергической реакции. Иммунные комплексы возможно удалить с помощью плазмофореза. На производстве необходимо соблюдать меры безопасности для предотвращения контакта с аллергенами (микробными клетками, их продуктами, химическими веществами). Эти меры предусматривают герметизацию оборудования, автоматизацию процессов производства, индивидуальные меры защиты.
19.11 Толерантность и аутоиммунитет
Толерантность (неотвечаемость) обеспечивает отсутствие иммунного ответа на собственные антигены организма, т. е. иммунная система толерантна к подавляющему большинству антигенов тканей организма (аутоантигенов). В ряде случаев наблюдают отсутствие ответа на чужеродный антиген. Состояние толерантности поддерживают разнообразные механизмы: Т-супрессоры, генетическая рестрикция иммунного ответа, уничтожение клонов Т- и В-лимфоцитов, экспрессирующих соответствующий рецепторный идиотип, ограничение антигенпредставляющих клеток и лимфоцитов.
Толерантность к аутоантигенам естественна. Искусственная толерантность к чужеродным антигенам может быть достигнута иммунизацией по определенной схеме: дробным введением антигена в возрастающих количествах или однократное введение высокой дозы антигена.
Аутоиммунитет
При нарушении толерантности к собственным антигенам развиваются аутоиммунные заболевания, например, системная красная волчанка, ревматоидный артрит. Известно несколько механизмов отмены толерантности.
1. Повреждение клеточных мембран, например, при вирусных инфекциях.
2. Попадание в организм антигена, эпитопы которого близки к эпитопам аутоантигена (мимикрирующие антигены).
3. Связывание чужеродных антигенов с клетками организма (см. аллергические реакции III типа).
4. Острая травма тканей может привести к освобождению антигенов, обычно изолированных от иммунной системы, например, повреждение глаза может вызвать иммунную реакцию на его антигены, которые будут распознаны как чужеродные.
5. Активация иммунокомпетентных клеток митогенами.
6. Расстройство регуляции иммунной системы (дефицит супрессорных клеток, атипичная экспрессия молекул МНС II класса).