ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ III. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ ФАРМАЦЕВТИЧЕСКОГО ПРОИЗВОДСТВА
ГЛАВА 22. ИСТОЧНИКИ И ПУТИ МИКРОБНОЙ КОНТАМИНАЦИИ В ФАРМАЦЕВТИЧЕСКОМ ПРОИЗВОДСТВЕ
22.1 Общая характеристика типовых источников микробной контаминации в фармацевтическом производстве
К числу основных производств биологически активных веществ (БАВ) относят производство лекарственных субстанций, готовых лекарственных средств и иммунобиологических препаратов для медицины и ветеринарии, а также производство различных нелекарственных веществ, используемых в народном хозяйстве.
Биотехнологическое производство представляет собой сложный многоступенчатый технологический процесс, включающий получение полупродукта, субстанции БАВ и готовой продукции.
Полупродуктом называют частично обработанное сырье или лекарственные вещества, которые должны пройти дальнейшие стадии производственного процесса прежде, чем они станут лекарственным продуктом.
Лекарственным веществом или субстанцией называют стандартизованное химическое соединение (вещество), обладающее лечебными или профилактическими свойствами, разрешенное к применению и предназначенное для изготовления лекарственных средств.
Готовое лекарственное средство (ГЛС) — это лекарственное средство, предназначенное для отпуска индивидуальному потребителю в удобной для применения (дозированной) форме. В готовой лекарственной форме лекарственное вещество проявляет максимальное терапевтическое действие, обладает минимальным побочным эффектом, является удобным для применения и хранения.
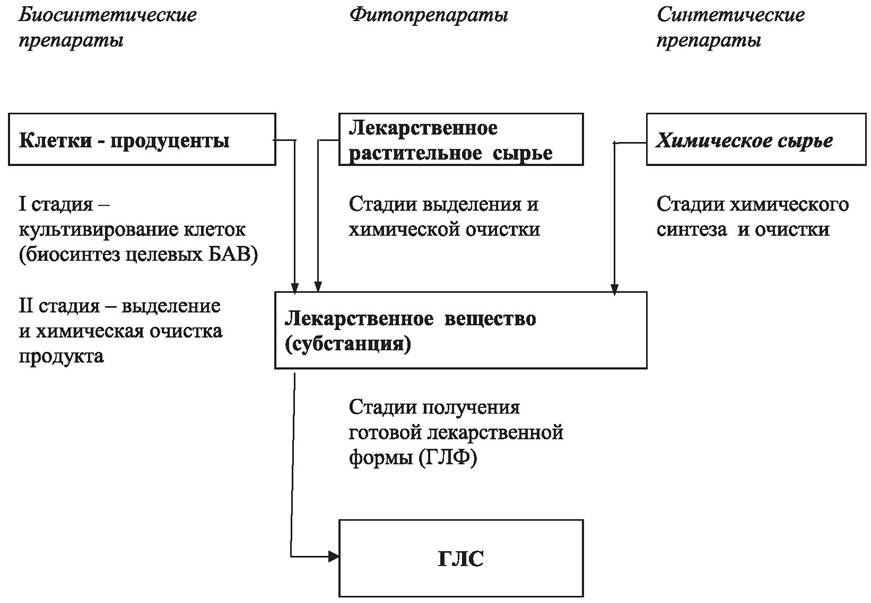
Лекарственные вещества (субстанции) получают химическим синтезом, путем выделения и химической очистки из растительного сырья или с использованием клеток-продуцентов (бактерий, грибов, растений и животных) (рис. 81). Особенности организации технологических процессов влияют на микробную контаминацию субстанции и в конечном итоге — готовой продукции.
Рис. 81. Основные технологические процессы получения готовых лекарственных средств (ГЛС)
При всем многообразии технологических схем получения разных по происхождению лекарственных веществ основными (типовыми) источниками попадания микроорганизмов в сферу биотехнологических производств являются:
— технологическое оборудование;
— сырье и вспомогательные вещества на всех стадиях производства, хранения и транспортировки продукции;
— тара и упаковочные материалы;
— вода, используемая в производстве;
— технологический и вентиляционный воздух;
— персонал, занятый в производстве.
Для производства с участием клеток-продуцентов в дополнении к перечисленным особое значение, как источники микробного загрязнения имеют питательная среда и добавки, пеногасители, посевной материал. В зависимости от характера производства и технологической стадии удельный вес вышеуказанных факторов в контаминации (contamine — загрязнение) может существенно изменяться.
22.2 Зависимость микробной контаминации от качества эксплуатации технологического оборудования
Значение оборудования и коммуникаций в возможной контаминации продуктов биосинтеза особенно велико при культивировании клеток продуцентов. Процесс должен осуществляться в асептических условиях [42].
Ферментационный комплекс включает аппарат для культивирования (ферментатор) и совокупность примыкающих к нему коммуникаций, арматуры, контрольно-измерительных приборов и др. Трубопроводы для подачи материальных потоков (стерильного воздуха, пара, питательной среды и добавок) достигают десятков километров. Вся эта система должна обеспечить стерильность внутреннего объема ферментатора. Разгерметизация ферментационного комплекса во время работы является одной из причин микробной контаминации. Это может произойти в результате несоответствия технического уровня оборудования требованиям эффективной герметизации, в результате чего микроорганизмы из окружающего воздуха будут попадать во внутренние полости аппаратов и арматуры.
Конструкционные особенности оборудования и коммуникаций не всегда обеспечивают стерилизуемость всех точек внутренних полостей. Например, особого внимания требует придонная часть ферментатора, где скапливается конденсат, а также трубные окончания для отбора проб из ферментатора и штуцеры для внесения посевного материала. При стерилизации температура в этих зонах будет ниже, чем во всем объеме ферментатора, что может стать причиной нестерильности. Важен правильный подбор материала, из которого изготавливают оборудование. Необходимо использовать такие материалы, внутренние поверхности которых не подвергаются биоповреждению и биообрастанию. Одним из условий, исключающих опасность биообрастания, является высокое качество обработки (полирования) внутренних поверхностей оборудования.
Целесообразным является замена природных фильтрующих материалов на синтетические, менее благоприятные для размножения микроорганизмов. Например, при использовании бельтинговой ткани в процессе фильтрации в новых образцах содержание клеток составляет менее 500, а в образцах, выстиранных для повторного использования до 104 на 1 см2поверхности.
Причинами загрязнения объектов производства через технологическое оборудование являются также неудовлетворительная подготовка его к работе (некачественная мойка и дезинфекция, неэффективная стерилизация) и нарушение правил его эксплуатации.
22.3 Зависимость микробной контаминации от сырья и вспомогательных материалов
Сырье для производства лекарственных веществ может быть по происхождению минеральным, растительным, животным и синтетическим [43, 44]. Наиболее загрязненным является сырье животного и растительного происхождения.
22.3.1 Микробиота животного сырья
Сырье животного происхождения используют в качестве основного при получении органопрепаратов. Например, из поджелудочной железы свиней получают панкреатин, щитовидной железы крупного рогатого скота — тиреоидин, сердечной мышцы — цитохром С, тимуса — тималин и т. д. Органы убойных животных служат основой для многих питательных сред. В производстве вирусных вакцин используют культуры клеток почек обезьян, морских свинок, собак, а также эмбрионы: куриные, утиные, перепелиные и др.
Органы и ткани животных могут содержать большое количество микроорганизмов, включающих представителей нормальной микробиоты животного и микроорганизмов, попавших в соответствующий орган гематогенным путем при жизни животных в результате снижения сопротивляемости его организма при длительном голодании, утомленности и т. п. Микроорганизмы могут попадать в ткани после гибели животных, а также в процессе обработки с инструментов, рук, одежды рабочих при первичной разделке туши, при хранении и транспортировке.
По качественному составу микробиота животного сырья может включать сапротрофные, патогенные и условно-патогенные, преимущественно аэробные и факультативно-анаэробные бактерии, бактерии группы кишечной палочки (БГКП) — родов Proteus, Aeromonas, Salmonella, Clostridium perfringens, Bacillus cereus. Их количество может достигать 10-105 клеток на 1 см3 поверхности. Многие микроорганизмы длительно сохраняются в сырье при замораживании. Например, сальмонеллы сохраняют жизнеспособность в мороженом мясе 13 месяцев, в яйцах — 12 месяцев. Животное сырье может содержать различные вирусы. Так, в культурах клеток обезьян, используемых для производства многих вакцин, обнаруживали аденовирусы, энтеровирусы, вирус герпеса обезьян, вызывающие заболевания у человека. Поэтому предусмотрено проведение дополнительного вирусологического контроля с использованием специальных методов.
22.3.2 Микробиота лекарственного растительного сырья
Лекарственным растительным сырьем (ЛРС) называют высушенные части лекарственных растений, не подвергавшиеся химической обработке. К ним относят корни, корневища, кору, цветы, листья, плоды, почки и др. В настоящее время используют около 200 видов растений для получения на их основе лекарственных препаратов.
Лекарственные растения, как и все другие, являются естественной средой обитания микроорганизмов (глава 3). Их микробиоту подразделяют на эпифитную (epi — над, phyton — растение) и фитопатогенную (pathos — болезнь, страдание). К эпифитным относят микроорганизмы, развивающиеся в норме на поверхности растения и не наносящие ему вреда. Такие микроорганизмы не проникают внутрь тканей, растут за счет обычных выделений и органических загрязнений поверхности растения. Они устойчивы к фитонцидам, высушиванию и ультрафиолетовому облучению, препятствуют проникновению фитопатогенных микроорганизмов в растительные ткани. Наибольшее количество эпифитной микробиоты составляет Erwinia herbicola — антагонист возбудителей мягкой гнили овощей. В норме обнаруживают Pseudomonas fluorescens. Phytomonas spp., Chromobacterium spp., Bacillus mesentericus, небольшое количество грибов.
Состав микробиоты зависит от вида растения, возраста, высоты стебля, типа почвы, условий произрастания. При повышении влажности численность эпифитных микроорганизмов возрастает, при понижении влажности — уменьшается. К фитопатогенным микроорганизмам относят бактерии, грибы, вирусы. Наиболее распространенные заболевания растений, вызываемые бактериями (бактериозы) и грибами (микозы) приведены в таблице 46.
Таблица 46. Основные возбудители бактериозов и микозов растений
Микроорганизм |
Заболевание |
|
Бактериозы |
Erwinia carotovora |
|
E. amylovora |
Некрозы и мокрые гнили |
|
Pseudomonas syringae |
Пятнистость |
|
Xanthomonas spp. |
Сосудистые заболевания |
|
X. vesicatoria |
Черная пятнистость |
|
X. beticola |
Туберкулез |
|
Corynebacterium spp. |
Сосудистые и паренхиматозные заболевания |
|
Agrobacterium spp. |
Опухоли (галлы) |
|
A. tumefaciens |
Рак корней и корнеплодов |
|
Микозы |
Myxomycota: |
|
Plasmodiophora brassicae |
Кила капусты |
|
Chytridiomycota: |
||
Synchytrium endobioticum |
Рак картофеля |
|
S. taraxaci |
Галлы на листьях одуванчика |
|
Olpidium brassicae Oomycota: |
Черная ножка капусты |
|
Phytium debarianum |
Корневая гниль всходов |
|
Phytophtora infestans |
Гниль картофеля |
|
Plasmopara viticola Ascomycota: |
Ложная мучнистая роса винограда (милдью) |
|
Erysiphe graminis |
Мучнистая роса злаков |
|
Podosphaera leucotricha |
Мучнистая роса яблони и груши |
|
Claviceps purpurea |
Спорынья на злаках |
|
Sclerotinia spp. |
Белая гниль |
|
Venturia spp. Basidiomycota: |
Парша |
|
Ustilago maydis |
Пузырчатая головня кукурузы |
|
U. tritici |
Пыльная головня пшеницы |
|
Urocystis occulta |
Стеблевая головня ржи |
|
Puccinia graminis |
Стеблевая ржавчина злаков |
|
Gymnosporangium sp. |
Ржавчина плодовых деревьев |
|
Phragmidium disciflorum Deuteromycota: |
Ржавчина шиповника |
|
Fusarium oxysporum |
Фузариоз |
|
Botritis cinerea |
Серая гниль плодов |
|
Verticillium spp. |
Увядание и сухая гниль |
|
Cladosporium spp. |
Бурая пятнистость |
|
Ramylaria spp. |
Белая пятнистость |
Вирусы, вызывающие болезни растений (вирозы), являются причиной появления мозаики (пятнистой расцветки листьев и плодов) и желтухи, которая проявляется в карликовости растения и появлении измененных боковых побегов и цветков.
К признакам поражения ЛРС микроорганизмами можно отнести следующие.
1. Гниль сухая и мокрая (размягчение и разрушение отдельных участков тканей растения) в результате развития бактерий и грибов.
2. Белый налет (мучнистая роса) на листьях и побегах — результат размножения грибов.
3. Пожелтение, пятнистость вызывают грибы и бактерии.
4. Чернь, которая проявляется в возникновении на листьях и побегах черной, легко удаляющейся пленки в результате размножения грибов.
5. Ожоги — почернение побегов, листьев, плодов, цветов происходит в результате размножения бактерий Erwinia amylovora.
6. Деформация — изменение формы органов растения (искривление побегов, курчавость), как результат поражения грибами.
7. Опухоли — местное увеличение объемов ствола ветвей, корней и корневищ за счет гиперплазии клеток в месте повреждения бактериями, грибами или механическим путем.
8. Мозаика листьев — появление бледноокрашенных угловатых пятен, чередующихся с нормально окрашенными участками, результат поражения вирусами.
У пораженного растения происходят изменения клеточных структур и химического состава тканей, содержание биологически активных веществ снижается, использование такого сырья невозможно.
Кроме представителей эпифитной и фитопатогенной микробиоты, в ЛРС могут попадать посторонние микроорганизмы на всех стадиях его переработки, т. е. в процессе сбора, высушивания, измельчения, в процессе придания удобной для использования формы гранул или брикетов, в процессе упаковки, транспортировки и хранения.
При хранении повышенная влажность (>60%) и температура (>20°C) способствуют дополнительному размножению микроорганизмов. Это может привести к порче ЛРС вследствие развития грибов рода Aspergillus, Penicillium и других широко распространенных микроорганизмов-космополитов. В таких условиях резко снижается содержание действующих веществ. Например, листья наперстянки под действием микробиоты утрачивают 50% своей активности, а листья ландыша — 30%.
При использовании контаминированного ЛРС микробы-загрязнители попадают в субстанцию и готовую лекарственную форму. Особое значение имеет использование такого ЛРС для приготовления водных вытяжек: настоев, отваров и других лекарственных форм в домашних условиях.
Отрицательными последствиями использования, контаминированного ЛРС могут быть снижение или полная утрата терапевтической ценности, развитие аллергических реакций, возникновение инфекционных заболеваний, попадание токсических продуктов. Среди последних особенно опасны токсины грибов (Fusarium, Penicillium, Aspergillus и др.), вызывающие микотоксикозы.
Чтобы исключить отрицательные последствия попадания микроорганизмов загрязнителей с сырьем и вспомогательными материалами, введены требования к микробиологической чистоте этих объектов фармацевтического производства (табл. 47).
22.4 Вода как один из видов сырья и вспомогательных материалов
Воду в производстве лекарственных веществ используют в качестве основного и вспомогательного материала. Вода является компонентом питательных сред и готовых лекарственных форм. Ее используют в технологии выделения и очистки БАВ, для санитарной подготовки помещений и оборудования, а также для приготовления растворов дезинфектантов и антисептиков. В технологических процессах используют питьевую воду из центральных систем хозяйственно-питьевого водоснабжения и очищенную воду, получаемую на производстве методами дистилляции, ионного обмена, обратного осмоса, электродиализа. В производстве стерильных лекарственных препаратов используют воду для инъекций, которую получают из очищенной воды.
В Американской фармакопее предусмотрено использование воды питьевой, воды очищенной (для производства нестерильных лекарственных средств (НЛС), стерильной воды очищенной (для лекарственных средств наружного применения); воды для инъекций, стерильной воды для инъекций, стерильной бактериостатической воды (с добавлением биоцидов), стерильной воды для ингаляционных препаратов. Это разнообразие связано с тем, что качество воды оказывает существенное влияние на качество лекарственных препаратов.
Качество воды и систем ее подготовки, распределения и хранения являются критическими точками контроля при рассмотрении факторов, влияющих на безопасность фармацевтической продукции.
Качество воды регламентирует нормативно-техническая документация: ГОСТ, Санитарные правила и нормы 2.1.4.1074-01, фармакопейные статьи на воду очищенную (ФС 42.2619.97) и воду для инъекций (ФС 42.2620.97). В воде очищенной не допускается присутствие более 100 клеток микроорганизмов в 1 мл воды, исключая представителей семейства Enterobacteriaceae, Staphylococcus aureus и Pseudomonas aeruginosa. Вода для инъекций должна быть апирогенной и содержать не более 10 КОЕ в 100 мл.
В процессе хранения в промышленных резервуарах количество микроорганизмов быстро увеличивается и может достигать 105-106 клеток бактерий в 1 л. Legionella pneumophilaспособна размножаться в воде при 570С. Арматура и аппаратура, которая используется для хранения и распределения воды (насосы, трубопроводы, клапаны, счетчики воды и т. п.) могут быть колонизированы микроорганизмами, образующими биопленку на их внутренних поверхностях, устойчивыми к действию биоцидов и представляющими опасность как источник микробной контаминации. Поэтому уделяют особое внимание организации системы водоподготовки. Трубопроводы могут быть изготовлены из нержавеющей стали, полимерных материалов особого изготовления или стекла. Их соединение и расположение должно обеспечивать возможность стерилизации путем пропускания чистящих и стерилизующих растворов со скоростью не менее 1,5 м/с в трубах наибольшего диаметра системы. Вода должна храниться при температуре не ниже 80 °С и циркулировать в распределительной системе со скоростью 1-2 м/с для предотвращения образования биопленки. Для предупреждения биообрастания стенок сосудов используют режим рециклинга.
Таблица 47. Микробиологическая чистота субстанций и вспомогательных веществ, используемых при производстве лекарственных препаратов [29].
Категория |
Субстанции, вспомогательные материалы |
Рекомендуемые нормы |
1.2. |
Субстанции для производства |
|
1.2.А |
Стерильных лекарственных препаратов, которые не подвергаются стерилизации |
Субстанции должны быть стерильными |
1.2.Б |
Стерильных лекарственных препаратов, которые подвергаются стерилизации Нестерильных лекарственных препаратов, относящихся к Категории 2 |
✵ Общее число аэробных бактерий и грибов (суммарно) не более 102КОЕ в 1 г (мл) ✵ Отсутствие энтеробактерий, устойчивых к желчи, в 1 г (мл) ✵ Отсутствие Pseudomonasaeruginosa в 1 г (мл) ✵ Отсутствие Staphylococcusaureus в 1 г (мл) |
2.2 |
Субстанции синтетического происхождения для производства нестерильных лекарственных препаратов |
✵ Общее число аэробных микроорганизмов — не более 103КОЕ в 1 г (мл) ✵ Общее число грибов — не более 102 КОЕ в 1 г (мл) ✵ Отсутствие Escherichia coli — в 1 г (мл) |
3.2 |
Субстанции природного происхождения (растительного, животного или минерального) для производства нестерильных лекарственных препаратов |
✵ Общее число аэробных микроорганизмов — не более 104КОЕ в 1 г (мл) ✵ Общее число грибов — не более 102 КОЕ в 1 г (мл) ✵ Отсутствие Escherichia coli — в 1 г (мл) ✵ Отсутствие бактерий рода Salmonella в 25 г (мл) ✵ Отсутствие Pseudomonasaeruginosa в 1 г (мл) ✵ Отсутствие Staphylococcusaureus в 1 г (мл) ✵ Энтеробактерий, устойчивых к желчи, — не более 102 КОЕ в 1 г (мл) |
4.2 |
Вспомогательные вещества (мука пшеничная, крахмал, тальк и т. д.) |
✵ Общее число аэробных микроорганизмов — не более 103КОЕ в 1 г (мл) ✵ Общее число грибов — не более 102 КОЕ в 1 г (мл) ✵ Отсутствие Escherichia coli — в 1 г (мл) ✵ Отсутствие бактерий рода Salmonella в 25 г (мл) ✵ Отсутствие Pseudomonasaeruginosa в 1 г (мл) ✵ Отсутствие Staphylococcusaureus в 1 г (мл) ✵ Энтеробактерий, устойчивых к желчи, — не более 102 КОЕ в 1 г (мл) |
Примечания к таблице 47:
1. В нормативных документах могут быть указаны в виде исключения и другие нормы в зависимости от состава ЛС и особенностей технологического процесса их производства.
2. При обнаружении во время проведения испытания других патогенных бактерий, кроме указанных выше, считают, что качество лекарственных средств, субстанций и вспомогательных веществ не соответствует требованиям по показателю «Микробиологическая чистота».
22.5 Зависимость микробной контаминации объектов производства от воздуха
Воздух производственных помещений может быть атмосферным, поступающим без предварительной очистки, и вентиляционным, подаваемым через системы воздухоподготовки. Технологический воздух используют для аэрирования при культивировании клеток-продуцентов, для транспортировки технологических жидкостей и сыпучих материалов из одних объемов в другие и для сухожаровой стерилизации материалов первичной упаковки (например, ампул для инъекционных растворов).
Причинами попадания микроорганизмов в объекты производства с воздухом могут быть первичная высокая контаминация атмосферного воздуха, особенно если он попадает без предварительной очистки, и неэффективная работа системы воздухоподготовки. В зависимости от уровня требований, предъявляемых к микробной чистоте воздуха, уже на стадии проектирования выбирают необходимое число ступеней очистки.
22.6 Вспомогательные вещества в производстве ГЛС
Вспомогательные вещества используют в технологии получения ГЛС и для проявления максимальной биологической активности препарата в организме человека. В технологии их применяют в качестве наполнителей для получения необходимой массы таблетки (глюкоза, лактоза, сахароза, крахмал, хлорид натрия и др.); для коррекции вкуса (глюкоза, сахароза); для пролонгирования действия препаратов (некоторые масла, например, хлопковое); для придания необходимой лекарственной формы (масло какао для изготовления свечей или желатин для капсул). Многие из них могут содержать значительное количество микроорганизмов.
22.7 Упаковочный материал и его роль в контаминации ГЛС
Различают первичную или индивидуальную упаковку, которая непосредственно контактирует с препаратом, вторичную, объединяющую некоторое количество первичных упаковок и транспортную, в которой продукцию доставляют к месту хранения или реализации.
Первичная упаковка ГЛС представляет собой контейнер или емкость, обеспечивающие длительную защиту препарата от воздействия окружающей среды, в том числе экзогенной контаминации и влаги. К материалам первичной упаковки относят флаконы, ампулы из стекла, тюбики-капельницы из полиэтилена, контурно-ячейковые упаковки из поливинилхлорида, пленки, алюминиевую фольгу. Обсемененность зависит от природы материала, его микробостойкости и влажности. Не рекомендуется использовать упаковочные материалы, неустойчивые к биодеградации (бумагу, картон, корковые пробки).
Упаковочные материалы с гладкой непроницаемой поверхностью обычно имеют низкий уровень микробного загрязнения, но в условиях неправильного хранения их могут активно колонизировать микроорганизмы. Например, в стеклянных контейнерах при хранении во влажных условиях обнаруживают споры бацилл, грибов.
Одной из основных причин, по которым упаковочный материал может стать источником микробной контаминации, является адаптивная способность микроорганизмов использовать их как субстраты в метаболических процессах.
22.8 Карантин
Предупредить возможность распространения микроорганизмов из загрязненного источника позволяет придание партиям сырья, вспомогательных, упаковочных, маркировочных материалов, полупродуктов и готового продукта, статуса карантина, который предполагает их хранение отдельно или каким-либо иным способом, исключает их применение или реализацию до тех пор, пока не будет принято решение о выдаче разрешения на их использование.
22.9 Зависимость микробной контаминации от персонала
Люди являются активным источником контаминации микробными и пылевыми частицами [40, 42]. Основными причинами этого могут быть:
1) наличие различной и многочисленной микробиоты тела человека (постоянной и случайной);
2) выполнение технологических операций людьми, страдающими заболеваниями желудочнокишечного тракта, кожи, дыхательных путей, являющимися микробоносителями и имеющими индивидуальную повышенную потливость или сухость кожи;
3) отсутствие или плохое состояние технологической одежды;
4) несоблюдение персоналом требований к личной и производственной гигиене, а также несоблюдение правил поведения в ходе выполнения технологического процесса;
5) неправильный подбор персонала без учета характера производства и индивидуальных особенностей работающего.
Попадание микроорганизмов в сферу производства от персонала может происходить:
1) воздушно-капельным путем с выделениями из полости рта и верхних дыхательных путей;
2) воздушно-пылевым и контактным путями с участков кожи, не защищенных одеждой (лица, шеи, рук, волосяного покрова);
3) воздушно-пылевым и контактным путями с индивидуальной технологической одежды.
Из верхних дыхательных путей человека в окружающее пространство выделяется значительное количество микроорганизмов: так, при чихании на расстоянии 10 м и более распространяется до 100 × 103 жизнеспособных клеток бактерий и вирусных частиц, со слюной до 100 × 106 кл/мл слюны, с секретом полости носа — до 10 × 106 кл/мл.
Наиболее обсемененными участками кожи являются открытые участки кожи: кисти рук, кожа (под ногтями), лицо (у крыльев носа), шея. Количество механических и микробных частиц зависит от характера выполняемых в процессе производства движений. В течение 1 мин. человек, не двигаясь, выделяет в окружающую среду до 10 × 103 механических и микробных частиц; в положении сидя с легкими движениями рукой и головой — до 500 × 10 3, а при интенсивной работе — до 106.
Постоянная нормальная микробиота не может быть удалена механическим путем при обмывании. В процессе работы она быстро восстанавливается вследствие обильного потоотделения, которое способствует выходу микроорганизмов из пор сальных и потовых желез. Наиболее обсемененными являются руки, особенно первые фаланги 3-х рабочих пальцев, ладонная впадина, кожа у запястья, межпальцевые пространства. Другие участки кожи отличаются по содержанию микроорганизмов. Количество аэробных бактерий, содержащихся на 1 см2 кожи головы составляет около 1,5 х 106; в подмышечной области — 2,4 х 106; на лбу — 0,2 x 106.
Заключение
Сырье животного происхождения может быть контаминировано сапротрофными, патогенными и условно-патогенными микроорганизмами: бактериями группы кишечной палочки, видами родов Proteus, Bacillus, Salmonella и др., а также содержать различные вирусы.
Лекарственное растительное сырье может содержать фитопатогенные (Pseudomonas, Xanthomonas, Erwinia и др.) и эпифитные бактерии, плесневые грибы (Penicillium, Aspergillus и др.).
Для предупреждения микробной порчи сырья следует строго соблюдать условия его хранения (температура, влажность и др.).
Микробиологическая чистота субстанций и вспомогательных веществ, используемых при производстве лекарственных препаратов, рекомендуется Фармакопеей.
Качество питьевой воды регламентирует СанПиН, воды очищенной и воды для инъекций — ФС.