ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ III. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ ФАРМАЦЕВТИЧЕСКОГО ПРОИЗВОДСТВА
ГЛАВА 24. БОРЬБА С МИКРОБАМИ-КОНТАМИНАНТАМИ ФАРМАЦЕВТИЧЕСКОЙ ПРОДУКЦИИ
24.1 Действие физических и химических факторов на микроорганизмы
Микроорганизмы обладают значительно большей толерантностью к физическим и химическим факторам окружающей среды, чем растения и животные. Некоторые из бактерий способны размножаться при температуре от -12°C до +104°C, в диапазоне значений рН от 1 до 13, гидростатическом давлении от 0 до 1400 атм, не погибают при интенсивном облучении, живут в дистиллированной воде и в насыщенных растворах солей. Вместе с этим каждый вид микроорганизмов имеет свои наследственно закрепленные зоны влияния конкретных воздействий: оптимальные, подавления роста, гибели.
24.1.1 Физические факторы, благоприятные для роста микроорганизмов
Температура. Различают 3 группы микроорганизмов, которые различаются по диапазону температур, наиболее приемлемым для их роста и размножения: психрофилы(холодолюбивые) имеют зону оптимального роста 10-15°C, это свободноживущие микроорганизмы или паразиты холоднокровных животных. Среди психрофилов есть и патогенные для человека, например, Yersinia enterocolytica. Этот микроорганизм способен быстро размножаться на пищевых продуктах в условиях бытового холодильника, причем низкие температуры (менее 10°C) способствует отбору вирулентных штаммов. Аналогичными свойствами обладают психрофильные варианты клебсиелл и псевдомонад.
Мезофилы обитают, главным образом, в организме человека и теплокровных животных. Оптимальная температура их роста составляет 30-37°C, максимальная 43-45°C, а минимальная 15-20°C. В окружающей среде они обычно не размножаются. Для термофилов (теплолюбивых микроорганизмов) зона оптимального роста 50-60°C, верхняя зона задержки роста 75°C, а нижняя 45°C. Термофилы не способны размножаться в живом организме и поэтому не имеют медицинского значения, однако некоторые виды термофилов считают перспективными для биотехнологии как продуценты БАВ. Термофилы обитают в горячих источниках, участвуют в процессах самонагревания навоза, сена, зерна. Наличие большого количества термофилов в почве свидетельствует о ее загрязненности навозом и компостом. Экстремальные термофилы обитают в горячих источниках при температуре до 104°С.
Реакция среды. Для большинства бактерий оптимальными для роста и размножения являются среды с нейтральным значением рН (рН 6,8-7,0), для грибов слабо кислые с рН 5,0-6,0. В процессе размножения происходит сдвиг рН обычно в сторону кислых значений, рост замедляется и затем может наступить гибель клеток. Механизм повреждающего действия рН состоит в денатурации ферментов гидроксильными ионами и нарушении осмотического барьера клеточных мембран.
Влажность. Среды с большим количеством воды являются благоприятными для активного размножения микроорганизмов. Снижение влажности среды способствует переходу клетки в стадию покоя, а затем и к гибели. Устойчивы к высушиванию капсульные формы микроорганизмов, споры и цисты. Высушивание под вакуумом из замороженного состояния — лиофилизацию — используют для продления жизнеспособности и консервирования микроорганизмов. Лиофилизированные культуры и иммунобиологические препараты длительно сохраняются, не изменяя своих свойств.
24.1.2 Чувствительность микроорганизмов к повреждающим факторам
В результате действия повреждающих факторов наступает гибель микроорганизмов. Микробная клетка считается погибшей, если она потеряла способность к воспроизводству. Различают бактерицидное, фунгицидное и вирицидное действие, вызывающее гибель соответствующих объектов. Для оценки эффективности летального действия того или иного фактора используют показатель D10 — время выдержки при заданной температуре или доза радиации, при которой происходит снижение концентрации клеток в 10 раз, т. е. гибель 90% клеток в популяции.
24.1.3 Воздействие на микроорганизмы высоких температур
Повышенная температура вызывает денатурацию и разрушение жизненно важных молекул клетки; при стерилизации паром под давлением протекают реакции гидролиза, сухим жаром — окислительные реакции.
По показателю устойчивости (резистентности) различают следующие группы микроорганизмов:
1) чувствительные — неспорообразующие бактерии, плесневые грибы, вирусы;
2) слаборезистентные — вирусы гепатитов, споры Clostridium perfringens;
3) высокорезистентные — C. tetani;
4) чрезвычайно резистентные — споры Bacillus subtilis, C. botulinum;
5) наиболее резистентные — споры B. stearothermophilus, почвенных термофилов, прионы.
Термоустойчивость одних и тех же микроорганизмов может изменяться в зависимости от наличия влаги и свойств среды, в которой они находятся. Чувствительность микроорганизмов одного вида к высокой температуре зависит от нескольких причин:
1) от штаммовых различий, например, время гибели спор C. tetani при обработке паром при 100°C составляет 5-90 мин;
2) от фазового состояния клеток, связанного с активностью их метаболических процессов;
3) от агрегатного состояния клеток, а именно наличия скопления (конгломератов), более устойчивых, чем отдельные клетки;
4) от вида термической обработки: при одинаковой температуре сухой нагрев менее эффективен, чем влажный; отмирание микроорганизмов во влажной среде наступает вследствие денатурации нуклеиновых кислот, белков, повреждения мембран; при воздействии сухого жара происходит активация окислительных процессов (пиролиз);
5) от состава среды термообработки, так как многие органические и неорганические вещества обладают защитным действием на клетку, например, NaCl, соли магния, жиры, поверхностно-активные вещества и др;
6) от значения рН среды, например, при 100°С некоторые споровые микроорганизмы при рН 6-7 погибают за 2,5 час, а при рН 3-3,5 — за 30 мин.
24.1.4 Влияние на микроорганизмы лучистой энергии
Антимикробным действием обладает ионизирующее и неионизирующее излучение. К неионизирующим относят инфракрасное (ИК) и ультрафиолетовое (УФ) облучения. ИК-лучи обладают сравнительно большой длиной волны и поэтому их энергия невелика. Они оказывают, в основном, тепловое воздействие.
УФ-лучи обладают более высокой энергией, они способны вызывать фотохимические изменения и в молекулах субстрата, и в клетках микроорганизмов. Наиболее эффективны лучи с длиной волны 250-260 нм. Различные виды и формы микроорганизмов не одинаково чувствительны к одной и той же дозе облучения. Повышенной устойчивостью отличаются пигментные микроорганизмы и споровые формы бактерий и грибов. Эффективность воздействия УФ - излучения зависит от дозы облучения, т. е. от количества энергии, поглощенной клеткой, от характера облучаемого объекта и условий воздействия (рН среды, влажности субстрата, температуры, наличия защищающих клетки веществ).
Механизм губительного действия УФ -облучения связан с образованием димеров тиминовых и других пиримидиновых оснований ДНК, что сопровождается прекращением репликации и последующей гибелью клетки. Следует помнить о явлении фотореактивации под действием дневного света, активирующего ферменты, которые катализируют расщепление димеров, что приводит к восстановлению жизнедеятельности клетки. Кроме прямого воздействия УФ-излучения возможно и опосредованное в результате образования озона, перекиси водорода и других бактерицидных веществ в обрабатываемом субстрате.
К ионизирующим относят γ-излучение и ускоренные электроны. Источником γ-излучения являются радиоактивные элементы Со60, Cs137. Радиоустойчивость разных микробных видов существенно различается. Обычно клетки грамотрицательных микроорганизмов более чувствительны по сравнению с грамположительными, наименее устойчивы вегетативные клетки, более резистентны грибы и дрожжи, далее — бактериальные споры, вирусы. Известен микроорганизм Micrococcus radiodurans (радиоустойчивый), приспособившийся к жизни в реакторах атомных электростанций. Радиопоражаемость клеток одного вида зависит от возраста клеток (молодые клетки более чувствительны, чем сформировавшиеся), от состава среды и поглощенной дозы облучения.
Поглощенной дозой излучения называют количество энергии, поглощенное единицей массы среды, через которую проходит излучение. Единицей измерения дозы излучения является рад (radiation absorbed dose — абсорбированная доза радиации), 1 рад эквивалентен величине 100 эрг/г, 1 Мрад = 106 рад = 10 Кгр (килогрэй).
Для радиочувствительных микроорганизмов D10 <1 кГр, для радиорезистентных D10 составляет 2,3 кГр. Стерилизующей дозой является 25-35 кГр. Гибель клеток обусловлена протеканием многочисленных химических реакций, в которых участвуют продукты радиолиза воды, образовавшиеся в клетке и в субстрате — это высокоактивные свободные радикалы атомарного кислорода, перекиси.
24.1.5 Воздействие на микроорганизмы химических веществ с неспецифической антимикробной активностью
Эффективность действия химического вещества на микроорганизм зависит от его вида и штамма. Некоторые химические вещества обладают широким спектром антимикробного действия. Примером высокоэффективного вещества является этилена оксид, одинаково воздействующий на споровые и вегетативные формы. Штаммовые отличия в чувствительности микроорганизмов к химическим воздействиям могут быть генотипическими и фенотипическими. Изменения в генотипе часто обусловлены плазмидами и транспозонами, обеспечивающими чувствительность (резистентность) к химическим воздействиям. Фенотипические различия связаны с составом среды, рН, температурой, концентрацией клеток в объекте. Факторами, определяющими эффективность действия химического вещества на клетки, являются концентрация вещества, состав среды, время контакта с микроорганизмом, температура.
24.2 Асептика. Антисептика. Стерилизация.
Асептика — это комплекс мероприятий, направленных на предупреждение попадания микробов на (в) какой-либо объект: операционное поле, микробиологический бокс, определенные производственные помещения, стерильный раствор или препарат (растворы для инъекций, глазные капли). Работа микробиологов, хирургов и работников, связанных с изготовлением и использованием лекарственных препаратов, проводится с применением методов асептики. Создание асептических условий предусматривает дезинфекцию помещений, стерилизацию аппаратов, инструментов и материалов.
Антисептика обозначает использование химических веществ (антисептиков), убивающих или подавляющих микробов, находящихся в контакте с макроорганизмом.
Стерилизацией называют процесс полного уничтожения или удаления из объекта всех жизнеспособных форм микроорганизмов. При стерилизации фармацевтической продукции требуется обеспечить высокий уровень гарантированной стерилизуемости объектов. Наиболее часто применяемым стандартом является гарантия того, что после стерилизации партии препарата, из 106 единиц, количество нестерильных единиц будет равно или менее 1, то есть вероятность нестерильности объекта составляет 10-6 при сохранении биологических свойств препарата.
При выборе промышленного метода стерилизации руководствуются определенными критериями.
1) Учитывают устойчивость объекта к стерилизующему воздействию (термическую, радиационную, светоустойчивость). После стерилизации не допускается снижение биологической активности препарата более, чем на 1-2% по сравнению с исходным уровнем.
2) Учитывают эффективность воздействия на различные микроорганизмы или эффективность их удаления из объекта стерилизации.
3) Выбранный метод должен иметь максимальную гарантию безопасности для работающих и жителей прилегающих к предприятию районов (это особенно важно при использовании установок радиационной стерилизации).
4) Для проведения стерилизации необходимо иметь соответствующие технологические установки (автоклавы, сухожаровые, газовые стерилизаторы и др.)
5) Выбранный метод должен быть экономически выгодным.
В промышленности используют две группы методов стерилизации, основанные на уничтожении или удалении микроорганизмов. Для уничтожения присутствующих в объекте микроорганизмов применяют термическую, химическую и лучевую стерилизацию. Удаляют микроорганизмы из объекта путем мембранной фильтрации.
24.2.1 Термическая стерилизация
Объектами являются оборудование, коммуникации, арматура, питательные среды, добавки, готовые лекарственные формы (инъекционные и инфузионные растворы термоустойчивых веществ), материалы первичной упаковки для стерильной продукции, установки для стерилизующего фильтрования, технологическая одежда.
Теплоносителями могут быть: водяной пар под давлением, текучий пар, сухой горячий воздух. Острый пар подается непосредственно в объект (аппарат), глухой пар — в рубашку стерилизатора. Стерилизацию термостабильных растворов проводят в стерильных укупоренных флаконах или ампулах в автоклавах при избыточном давлении 0,11 МПА, что соответствует температуре 121°С в течение 8-15 мин в зависимости от объема препарата. Эффективность автоклавирования составляет 10-6. Установки для стерилизующего фильтрования стерилизуют в течение 45 мин при температуре 121°С, а технологическую одежду при такой же температуре в течение 40-60 мин.
Некоторые термоустойчивые инъекционные препараты стерилизуют текучим паром при 100°С в течение 30 мин. Материалы первичной упаковки для стерильных препаратов (ампулы, флаконы) можно стерилизовать сухим горячим воздухом при 180°С 2 часа. Эффективность такого метода стерилизации составляет 1012. Длительное время стерилизации плохо сказывается на показателях качества стекла, поэтому для материалов первичной упаковки используют другие режимы обработки: 300°С — 20 мин или 350°С — 2 мин. Стерилизацию ведут в потоке стерильного воздуха, очищенного от механических частиц, при этом одновременно со стерилизацией проходит и депирогенизация обрабатываемых объектов.
24.2.2 Стерилизация газами и химическими растворами
Объектами стерилизации являются термолабильные медицинские изделия из резины и полимерных материалов, лечебные пленки, линзы, резиновые соски, тюбики для глазных капель. Основным действующим веществом является этилена оксид. Это соединение используют в смеси со взрывобезопасными газами — двуокисью углерода, или бромистым метилом, для улучшения движения газа внутри объекта. Эффективность стерилизации составляет 10-2, обработку осуществляют в герметично закрывающихся аппаратах типа автоклава, к которым присоединен баллон с газом.
Антимикробная активность зависит от концентрации биоцида, времени обработки, температуры и влажности среды обработки. Оптимальными условиями являются: концентрация газа 50-100 мг/л, время 1-6 ч, температура 50-60°С, влажность — 30-60%.
Сдерживает широкое применение этого метода высокая токсичность этилена оксида для персонала и его способность взаимодействовать с компонентами объекта. После стерилизации для удаления этилена оксида проводят активную или пассивную десорбцию. При активной десорбции стерильную продукцию продувают стерильным воздухом, при пассивной — выдерживают в течение 20 сут.
Для стерилизации (дезинфекции) аппаратов для диализа рекомендован формальдегид. Он менее опасен, чем этилена оксид, не горюч, его утечку можно контролировать по запаху; транспортировка формальдегида в виде водного раствора относительно безопасна (не требует баллонов).
24.2.3 Радиационная и УФ стерилизация
Объектами радиационной стерилизации являются изделия из полимерных материалов: контейнеры для инфузионных растворов, системы для взятия и переливания крови, одноразовые шприцы, чашки Петри из полимерных материалов, бакпечатки.
Эффективность радиационной стерилизации 10-3. Обработку проводят в специальных камерах проходного типа, стерилизуют в потоке γ-излучения 2 раза по 5 мин. Стерилизующаяся доза 25 — 30 кГр. Сдерживает широкое применение этого метода наличие прямого и косвенного повреждающего действия радиации на объект.
В промышленности УФ-стерилизацию используют очень ограниченно. Например, в производстве некоторых вакцинных препаратов, или для стерилизации полимерных планшетов с сухими биохимическими реактивами для экспресс-идентификации микроорганизмов. УФ-облучение в процессах фармацевтического производства используют для снижения содержания микроорганизмов в воздухе производственных помещений в сочетании с обработкой химическими веществами.
24.2.4 Стерилизующая фильтрация жидкостей
Объектами являются термолабильные растворимые компоненты питательных сред и добавки (40% раствор глюкозы, растворы аммиака, фенилуксусной кислоты), термолабильные растворимые лекарственные субстанции (полупродукты), термолабильные парентеральные лекарственные препараты, иммунобиологические препараты, органические растворители, растворы дезинфицирующих веществ. Эффективность стерилизации 10-3.
Обязательным является проведение предварительной фильтрации через мембраны с порами 5 мкм и 0,5 мкм, а затем раствор подают на стерилизующую фильтрацию через мембрану с порами 0,22 мкм. Для предфильтрации можно использовать фильтры из пористых или керамических материалов. Однако их существенными недостатками являются опасность попадания частиц фильтрующего материала в фильтрат, а также адсорбция некоторых веществ (белков) материалом фильтра. Для стерилизующего фильтрования используют микрофильтрационные мембраны, удаляющие частицы размером 0,1-10 мкм. Однако для удаления вирусов из термолабильных жидкостей используют ультрафильтрационные мембраны, задерживающие частицы размером 0,001-0,1 мкм. Мембраны изготавливают из различных полимерных материалов: эфиров целлюлозы, полиамида, лавсановой пленки. Для удобства использования выпускают в виде патронов или дисков.
Для достижения эффективной стерилизации необходимо предварительно проверить размер пор мембраны, герметичность установки и правильно выбрать режим фильтрования (продолжительность работы, давление (вакуум).
Размер пор мембран оценивают микробиологическим методом с использованием клеток Brevundimonas diminuta, диаметр которых составляет 0,3 мкм (для фильтров с диаметром пор 0,22 мкм). Для фильтров с диаметром пор 0,45 мкм тест-организмом служит Serratia marcescens, размер клеток которого не превышает 0,5 мкм. Концентрация взвеси составляет 107 клеток в 100 мл.
Герметичность установки проверяют пузырьковым тестом. Точка пузырька — это минимальное давление воздуха или газа, необходимое для вытеснения жидкости с поверхности фильтра. Для предотвращения неконтролируемого размножения микроорганизмов на фильтре и возникновения пирогенности инъекционного раствора, следует максимально сократить время от начала фильтрации до получения стерильного раствора. В соответствии с требованиями GMP это время не должно превышать 8 ч.
Исходная контаминация растворов, подаваемых на стерилизующую фильтрацию, должна быть минимальной, не более 100 клеток в 1 мл раствора. С увеличением концентрации будет возрастать возможность попадания в фильтрат микроорганизмов мелких размеров, имеющих извитую форму или лишенных жесткой клеточной стенки.
24.3 Контроль эффективности работы стерилизующих устройств
Для контроля соблюдения выбранного режима стерилизации используют несколько групп методов. Технические методы контроля предусматривают периодическую проверку показаний манометров, термометров, термопар, дозиметрических устройств. Такой контроль проводят поверочные службы на предприятии.
Химические методы контроля основаны на использовании различных веществ, изменяющих свой цвет или физическое состояние при стерилизации, в частности, имеющих соответствующую температуру плавления. Запаянные ампулы с порошком, предварительно смешанным с красителем, помещают в стерилизационную камеру. При достижении в камере определенной температуры порошок плавится, образуя равномерно окрашенный расплав (табл. 54).
Таблица 54. Температура плавления химических веществ-индикаторов.
Название вещества |
Температура плавления, °С |
Бензонафтол |
110 |
Антипирин |
115 |
Резорцин |
118 |
Бензойная кислота |
121 |
Некоторые химические индикаторы изменяют цвет под воздействием этилена оксида или определенной дозы ионизирующего излучения. Имеются индикаторы, реагирующие на температуру и время стерилизации, индикаторы, регистрирующие полноту удаления воздуха из автоклава и др.
Наиболее полную информацию о соблюдении режима стерилизации дают методы биологического контроля. Показателем служит гибель тестмикроорганизмов, используемых в качестве контроля, при этом тест-культура должна быть устойчивой к стерилизующему воздействию (табл. 55).
Таблица 55. Биологические, рекомендуемые EP 2002 для мониторинга процессов стерилизации
Метод стерилизации |
Вид микроорганизма |
Инокулюм |
D |
Пар под давлением,121°С |
Bacillus stearothermophilus |
>5,5 x 103 |
>1,5 мин |
Сухой жар, 160°С |
Bacillus subtilis var. niger |
>1 x 105 |
5-10 мин |
Водорода пероксид и надуксусная кислота |
Bacillus stearothermophilus |
>5 x 105 |
- |
Этилена оксид* (ЕtOх) |
Bacillus subtilis var. niger |
>5 x 105 |
>2.5 мин |
Формальдегид |
Bacillus subtilis var. niger |
>5 x 105 |
- |
Ионизирующее излучение |
Bacillus pumilus |
>1 x 107 |
1,9 кГр |
Примечание: * — при температуре 54 °С, относительной влажности 60%, концентрации ЕtOх 600 мг/мл.
Биоиндикатор для контроля работы автоклава представляет собой суспензию спор Bacillus stearothermophilus 106/мл в жидкой питательной среде мясопептонный бульон с добавлением индикатора бромкрезолового пурпурного. Ампулу помещают в автоклав вместе со стерилизуемым объектом. После стерилизации биоиндикатор помещают в термостат при 55°C. При неэффективной стерилизации оставшиеся жизнеспособными споры прорастают, дают изменение цвета индикатора рН среды, а в результате размножения клеток среда становится мутной. Недостаток использования биоиндикаторов по сравнению с химическими состоит в ретроспективности ответа. Для его преодоления создана система, предусматривающая определение фермента α-глюкозидазы, свидетельствующего о жизнеспособности спор и определяемого с помощью реакции превращения нефлуоресцирующего субстрата во флуоресцирующий продукт за 1 час. Эта система рекомендована для контроля стерилизации паром под давлением.
Общие требования к организации контроля работы стерилизующих устройств:
1) контроль должен быть постоянным в связи с возможными дефектами в работе стерилизующих устройств;
2) средства контроля должны устанавливаться в наименее благоприятных для стерилизующего действия местах;
3) при использовании биоиндикаторов необходимо строго соблюдать меры предосторожности, чтобы исключить попадание индикаторных микроорганизмов в сферу производства.
24.4 Стерилизация в аптеках
В соответствии с приказом МЗ РФ № 309 от 21.10.97 «Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)» утверждены следующие режимы и методы стерилизации отдельных объектов:
✵ паровой метод (табл. 56);
✵ воздушный метод (табл. 57);
✵ химический метод (табл 58).
Таблица 56. Паровой метод (водяной насыщенный пар под избыточным давлением).
Наименование объекта |
Давление пара в стерилизационной камере, МПа (кгс/см2) |
Режим стерилизации* Рабочая температура в стерилизационной камере, °С |
Время стерилизационной выдержки, мин. |
Условия проведения стерилизации в паровом стерилизаторе |
Срок хранения стерильности |
номин. Пред. отклонения знач. |
номин. Предел знач. отклонения |
номин. знач. Пред.откл. |
|||
Стеклянная посуда, ступки, изделия из: стекла, текстиля (халаты, вата, марля, фильтровальная бумага), коррозионо-стойкого материала |
0,20 (2,0) ±0,02 (±0,2) 0,11 (1,1) ±0,02 (±0,2) |
132 ±2 120 ±3 |
20 +2 45 +3 |
Стерилизацию проводят без упаковки или в стерилизационной коробке в упаковке из 2-х слойной пергаментной бумаги марки А или В или в стеклянных банках |
Срок сохранения стерильности изделий в упаковке 3 дня |
Изделия из резины, латекса и отдельных полимерных материалов (полиэтилен высокой плотности, ПВХ-пластикаты, Фильтры из фторопласта и полиядерные из лавсана) |
0,11 (1,1) ±0,02 (±0,2) |
120 ±3 |
45 +3 |
Стерилизацию проводят или/или — без упаковки — в стерилизационных коробках — в двойной мягкой упаковке из бязи — в пергаментной бумаге марки А или В — в стеклянных банках, колбах |
* Контроль температурного режима паровой стерилизации осуществляют максимальным термометром со шкалой 150°С или термопарами. В качестве химического термотеста используют смесь бензойной кислоты с фуксином (10:1), температура плавления 121°С.
Таблица 57. Воздушный метод стерилизации (сухой горячий воздух)
Наименование объекта |
Режим стерилизации* Рабочая температура в стерилизационной камере, °С номин. знач. пред. откл. |
Время стерилизационной выдержки, мин номин. знач. пред. откл. |
Условия проведения Срок сохранения стерилизации стерильности в стерилизаторе |
Стеклянная посуда, ступки, изделия из стекла, металла и силиконовой резины |
180 +2 -10 160 +2 -10 |
60 +5 150 |
Стерилизации подвергают Изделия хранятся сухие изделия. 3 суток. Без Стерилизацию проводят: упаковки должны — в упаковке из бумаги быть использованы (мешочной или непосредственно влагопрочной) после стерилизации — или без упаковки в открытых емкостях |
Примечание: Аптечную посуду после снижения температуры в стерилизаторе до 60-70°С вынимают и тотчас закрывают стерильными пробками.
* Контроль воздушной стерилизации осуществляют с помощью индикаторной бумаги (на основе термоиндикаторной краски №6), которая изменяет цвет при 160°С или используют химические термотесты: сахароза, тиомочевина, температура плавления 180°С; гидрохинон, температура плавления 170°С.
Таблица 58. Химический метод стерилизации
Наименование объекта |
Биоцид |
Режим стерилизации температура, °С время выдержки, мин номин. знач. пред. откл. номин. знач. пред. откл. |
Условия проведения стерилизации |
Срок сохранения простерилизованного изделия |
Изделия из стекла и коррозионо- стойких металлов и сплавов, полимерных материалов, резины |
6% раствор* Перекись водорода (ГОСТ 177-88) |
18 - 360 3 50 32 180 35 |
Закрытые емкости из стекла, пластмассы или покрытые эмалью (эмаль без повреждения) Стерилизацию проводят при полном погружении изделия в раствор на время стерилизационной выдержки, после чего изделие промывают стерильной водой в стерильной емкости |
В стерильной емкости (стерилизационная коробка), выложенной стерильной простыней — 3 суток |
*Технология, контроль качества и срок годности раствора водорода перекиси 6%, изготовляемого в аптеках (Методические указания утв. 18.07.1996).
24.5 Промышленная дезинфекция
Дезинфекцией называют комплекс мероприятий, направленных на уничтожение микроорганизмов на объектах внешней среды с помощью механических, физических и химических средств и воздействий. В медицине под дезинфекцией понимают процесс уничтожения преимущественно патогенных микроорганизмов в объектах окружающей среды с целью прервать передачу инфекционного агента от больного человека к здоровому. В условиях производства важно избавиться и от сапротрофных микроорганизмов, причем число их видов возрастает в соответствии с нормативными требованиями к микробной чистоте объектов производства.
Объектами промышленной дезинфекции являются воздух производственных помещений, поверхности помещений, оборудования, коммуникаций. Частным случаем дезинфекции можно считать промышленную антисептику. Это отдельная область дезинфекции, которая предусматривает использование химических веществ неспецифического антимикробного действия (антисептиков) для уничтожения или подавления размножения микроорганизмов на поверхности кожи (реже слизистых оболочках) персонала, занятого в производстве.
В медицине сущность антисептических мероприятий заключается в использовании антимикробных препаратов при обработке ран, полостей, операционного поля, рук персонала для борьбы с возбудителями инфекционных заболеваний. Дезинфекцию на предприятиях химико-фармацевтической промышленности осуществляют в ходе подготовки к работе с целью достижения необходимого уровня микробной чистоты помещений (при создании помещений определенных классов чистоты), оборудования и готового продукта.
Антисептики используют в комплексе санитарно-гигиенических мероприятий при подготовке персонала к работе и в ходе выполнения технологического процесса (в асептических производствах).
24.6 Методы дезинфекции
Различают механическую, физическую и химическую дезинфекцию. При механической дезинфекции микроорганизмы только удаляют с объекта, а не уничтожают, что происходит при влажной уборке, стирке, проветривании.
К физическим методам относят ультрафиолетовую (УФ) обработку. Используют дуговые, газоразрядные низкого давления, бактерицидные лампы ДБ-15, ДБ-30, ДБ-60 (в зависимости от мощности), с длиной волны излучения 253,7 нм. Срок службы лампы составляет 1500-2000 ч. К концу срока мощность и, следовательно, эффективность воздействия на микроорганизмы снижается на 50% от исходного уровня. Лампы прямого действия используют только в отсутствие персонала, а рассеянного света (экранированные) можно применять в процессе работы. Экранированные лампы размещают не ниже 2 м от уровня пола. Гибель микроорганизмов происходит в верхних слоях воздуха, а нижние слои обеззараживаются за счет конвекции. Повышают эффективность обработки специальные устройства для рециркуляции воздуха. Поток воздуха из помещения пропускают через камеру, в которую вмонтированы лампы УФО, и возвращают после обработки в то же помещение. Специальные лампы повышенной мощности позволяют проводить дезинфекцию методом вспышки (например, для обработки 30 м3 воздушной фазы требуется всего 2 мин, для 60 м3 — 5 мин).
К ограничениям использования УФО относится токсическое действие на персонал выделяющихся озона (О3) и оксида азота (NО), а также неблагоприятное действие на сетчатку глаз.
Кроме того, используют термические методы дезинфекции (кипячение, обработка водяным паром, сухим горячим воздухом).
К химической дезинфекции относят обработку объекта химическими веществами-дезинфектантами: обмывание, протирание, погружение, орошение при распылении дезинфектанта (аэрозольная обработка). Аэрозольная обработка позволяет уменьшить расход дезинфектанта и его разрушающее воздействие на обрабатываемую поверхность, обработать труднодоступные места. Эффективность воздействия повышается с уменьшением размера аэрозольных частиц. Оптимальным является размер частиц 1-10 мкм, сопоставимый с размером микробных клеток.
Требования, предъявляемые к химическим дезинфектантам и антисептикам:
1). Хорошая растворимость или способность смешиваться с водой с образованием стойких смесей.
2). Низкая токсичность и отсутствие раздражающего действия на кожу и слизистые оболочки персонала.
3). Широкий спектр антимикробной активности, с ее проявлением в максимально короткое время.
4). Способность хорошо смачивать объекты и не оказывать на них коррозирующего или другого разрушающего действия.
5). Стабильность в процессе хранения.
6). Наличие разрешения на использование вещества в качестве дезинфектанта в химико-фармацевтической промышленности.
Ограничение использования дезинфектантов в химико-фармацевтической промышленности определяется их безвредностью для персонала и наличием методов удаления следов этих веществ из объекта.
24.7 Основные группы дезинфектантов и цели их использования
Окислители
Наиболее широко используют растворы H2О2 в связи с эффективным действием не только на вегетативные клетки, но и на споры. При низких концентрациях растворы нестабильны. Повышает эффективность воздействия нагревание до 40-50°С Н2О2 используют для обработки помещений и коррозионностойкого оборудования из стекла и полимерных материалов в концентрации 3-6% в сочетании с моющими веществами. Аэрозольно можно распылять 6% раствор Н2О2 для деконтаминации воздуха помещений.
Надуксусную кислоту в 0,3-0,5% растворе используют для обработки помещений и коррозионностойкого оборудования из расчета 300 мл/м 2. Все работы по приготовлению рабочих растворов и дезинфекции проводят в защитной одежде, перчатках и респираторе.
Галогенсодержащие вещества
Для целей дезинфекции используют хлорную известь и хлорамин Б в виде 5-10% растворов для обработки коррозионностойкого оборудования, в концентрации 0,2% — для обработки емкостей и трубопроводов подачи инъекционной воды.
Поверхностно-активные вещества (ПАВ)
Наиболее широко используют катионные ПАВ, к которым принадлежит вся группа четвертично-аммониевых соединений (ЧАС): бензалкониума хлорид, цетилпиридиния хлорид, дегмин, димицид, катамин АВ и др. Катамин АВ применяют в виде 0,5-1% раствора, расход составляет 0,5 л на 1 м2 поверхности. После 30 мин. экспозиции удаляют вещество промыванием поверхности водой. Используют для дезинфекции оборудования, в том числе и коррозионнонестойкого. Полимерный комплекс катамина АВ — катапол, обладает пониженной по сравнению с исходным веществом токсичностью и рекомендуется для дезинфекции воздуха в виде аэрозоля, для обработки рук, поверхности оборудования и др.
ПАВ не действуют на споры бацилл, однако в смеси с Н2О2 обладают спороцидной активностью (например, ПВК — раствор катамина АВ, содержащий Н2О2 грилен, перамин — смеси ЧАС с Н2О2).
Поверхностную активность проявляют моющие средства, также обладающие антимикробным действием. В химико-фармацевтической промышленности используют «Прогресс», «Сульфонол», «Афол» и др.
Бигуаниды, например, биглюконат хлоргексидина используют в виде 0,1-0,2% растворов из расчета 200 мл на 1 м2 для дезинфекции помещений и оборудования и для аэрозольной обработки воздуха. Биглюконат хлоргексидина выпускают в виде 20% раствора (гибитан), а также под торговыми названиями «Пливасепт» (5% раствор с добавлением ПАВ) и Пливасепттинктура (5% хлоргексидина биглюконата в смеси с 80° этиловым спиртом).
Альдегиды
Глутаровый альдегид используют для дезинфекции в виде 2% раствора в смеси с активатором (препарат «Глутарал»), а также в смеси с глиоксалем и ЧАС (препарат «Лизоформин 3000»). Формальдегид — высокореакционноактивное вещество, в связи с выраженным раздражающим действием на кожу и слизистые оболочки для целей дезинфекции его применяют крайне редко.
Для обработки рук персонала используют следующие препараты:
Дегмин — ЧАС гексаметиленимина и высокомолекулярных спиртов — 1% водный раствор.
«Рецептура С-4» — смесь растворов Н2О2 и муравьиной кислоты. Используют раствор «рецептуры С-4» с массовой долей 2,4%.
Этиловый спирт в виде 76% раствора.
24.8 Микробная контаминация растворов антисептиков и дезинфектантов
Почти все антимикробные вещества, применяемые для дезинфекции (антисептики), могут содержать микробы-контаминанты, основными из них являются псевдомонады.
Микроорганизмы попадают в растворы в процессе их приготовления, хранения и использования. Источниками являются исходные сухие вещества, концентрированные безводные жидкости, вода и другие растворители, стабилизаторы, другие вспомогательные вещества, емкости для хранения.
Вторичная контаминация может появиться в результате неправильного хранения и использования: при открытом хранении, заборе растворов из емкостей с использованием грязного оборудования и т. п.
Последствием использования контаминированных растворов дезинфектантов и антисептиков является опасность загрязнения готового продукта и распространение полирезистентных штаммов микроорганизмов. Поэтому необходимо строгое соблюдение правил приготовления растворов дезинфектантов в соответствии с требованиями ОМР:
1) для приготовления растворов использовать воду марки «очищенная»;
2) использовать предварительно вымытую посуду;
3) растворы дезинфектантов должны храниться ограниченное (строго определенное) время;
4) не допускается внесение свежеприготовленного раствора в частично использованный;
5) необходима периодическая смена дезинфектанта (ротация) для исключения селекции устойчивых штаммов;
6) в производстве стерильных ГЛС антисептики и дезинфектанты должны быть стерильными. Стерилизуют растворы фильтрацией через мембраны с диаметром пор 0,45 мкм.
24.9 Дезинфекция в аптеках
В соответствии с приказом МФ РФ № 309 «Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)» для дезинфекции различных объектов утверждены термические (табл. 59) и химические (табл. 60) методы и средства.
Таблица 59. Термические средства и режимы дезинфекции
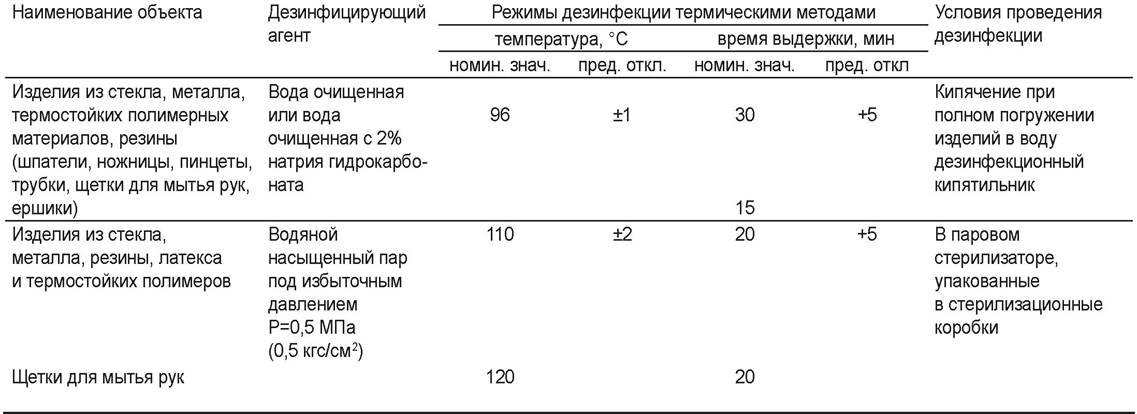
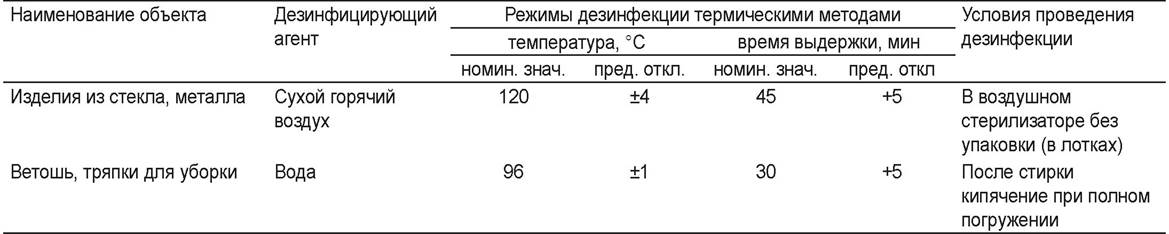
Таблица 60. Химические средства и режимы дезинфекции
Наименование объекта |
Дезинфирующее средство |
Концентрация, % |
Экспозиция, мин |
Способ обработки |
Помещения, предметы обстановки, оборудование (стены, двери, пол, жесткая мебель) |
1) хлорамин Б 2) хлорамин Б с 0,5% моющего средства 3) гипохлорит натрия 4) гиполхлорит натрия, получаемый в электрохимической установке ЭЛМА-1 5) перекись водорода с 0,5% моющего средства |
1 0,75 1 0,5 3 |
30-60 60 60 |
2-кратное протирание или орошение поверхностей из расчета 300 мл/м2 Орошение 2-кратное протирание с интервалом 15 мин 200 мл/м2 Орошение из расчета 300 мл/м2. Для мебели с последующим протиранием сухой чистой ветошью |
Коврики из пористой резины |
1) хлорамин Б с 0,5% моющего средства 2) перекись водорода с 0,5% моющего средства |
0,75 3 |
30 30 |
Погружение в раствор То же |
Коврики из поролона |
Перекись водорода с 0,5% моющего средства |
3 |
30 |
То же |
Уборочный инвентарь, ветошь |
1) хлорамин Б 2) дихлор 1 3) хлордезин 4) гипохлорид натрия 5) гидрохлорид натрия, получаемый в электрохимической установке ЭЛМА-1 6) перекись водорода с 0,5% моющего средства |
1 2 1 1 0,25 3 |
60 60 60 60 60 120 |
Погружают в раствор, промывают и сушат То же То же Погружение из расчета 4-5 л на 1 кг сухого веса вещей Замачивание, прополаскивание с последующей стиркой и высушиванием Замачивание |
Руки персонала** |
1) этиловый спирт 2) раствор хлоргексидина биглюконата в 70% этиловом спирте 3) раствор йодопирона (иодоната, иодвидон) 4) хлорамин Б (применяется при отсутствии других препаратов |
70 0,5 1 0,5 |
После мытья с мылом протирают марлевой салфеткой, смоченной раствором Препарат наносят на ладони в количестве 5-8 мл и втирают в кожу рук Руки погружают в раствор и моют в течение 2 мин, затем дают высохнуть |
|
Обувь |
1) хлорамин Б 2) хлорамин Б с 0,5% моющего средства 3) перекись водорода с 0,5% моющего средства 4) раствор формальдегида 5) раствор уксусной кислоты |
1 0,75 3 40 40 |
2-кратное протирание В пакете с ваткой, смоченной раствором, нейтрализованным раствором аммиака или щелочью |
** После окончания работы руки обмывают теплой водой и обрабатывают смягчающими средствами.
Заключение
Асептика — это комплекс мероприятий, направленных на предупреждение попадания микробов на какой-либо объект. Асептические условия создаются с помощью дезинфекции и стерилизации.
Антисептика — это уничтожение или подавление роста микробов, находящихся в контакте с человеком, с помощью химических веществ — антисептиков.
Стерилизация — это процесс полного уничтожения или удаления из объекта всех жизнеспособных микроорганизмов.
Основные виды стерилизации: термическая (сухой жар или пар под давлением), химическая (газами или растворами биоцидов), радиационная (у-излучение) и фильтрация через мембранные фильтры.
Контроль стерилизации осуществляют химическим и биологическим методами.
Дезинфекция — это комплекс мероприятий, направленных на уничтожение грибов на (в) объектах внешней среды с помощью механических, физических и химических средств.
Основные группы дезинфектантов: окислители (Н2О2 и др.), галогены (хлорная известь, хлорамин Б и др.), поверхностно-активные вещества, альдегиды и спирты.
При неправильном приготовлении и хранении растворы дезинфектантов могут быть контаминированы, например, псевдомонадами.