ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ III. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ ФАРМАЦЕВТИЧЕСКОГО ПРОИЗВОДСТВА
ГЛАВА 25. ПРИНЦИПЫ GMP И GPP В ФАРМАЦЕВТИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ
Фармацевтическая промышленность Российской Федерации поддерживает высокие стандарты управления качеством при разработке, производстве и контроле лекарственных средств. Система государственной регистрации гарантирует, что все лекарственные средства оценены уполномоченным органом, чтобы обеспечить их соответствие современным требованиям безопасности, качества и эффективности [38, 39].
Производитель лекарственных препаратов должен производить лекарственные препараты так, чтобы гарантировать их соответствие своему назначению, требованиям регистрационного досье или протоколу клинического исследования и исключить риск для пациентов, связанный с безопасностью, с неудовлетворительным качеством или эффективностью. Основные принципы управления качеством, правил надлежащего производства и контроля качества и управления рисками для качества взаимосвязаны. Правила надлежащего производства и контроля качества применяются ко всем стадиям жизненного цикла продуктов: производство лекарственных препаратов для клинических исследований, перенос технологии, промышленное производство, прекращение производства лекарственных препаратов. Фармацевтическая система качества может распространяться и на такую стадию жизненного цикла продуктов, как фармацевтическая разработка.
25.1 Правила GMP в обеспечении качества лекарственных средств
Каждый производитель лекарственных средств (ЛС) и фармацевт несет огромную ответственность перед потребителями, т. е. больными: лекарственные средства должны строго соответствовать назначению, а пациенты не должны подвергаться риску из-за нарушения требований по их безопасности, качеству и эффективности. Для выполнения таких требований на предприятие должна быть организована система обеспечения качества. Обеспечение качества — это широкая концепция, охватывающая все параметры,
которые по отдельности или совместно влияют на качество продукции.
Система обеспечения фармацевтического качества в производстве лекарственных средств гарантирует:
1) проведение разработки препаратов с учетом требований правил производства и лабораторной практики;
2) составление четкой документации на все производственные и контрольные операции;
3) обеспечение производства, поставки, и использования соответствующих исходных и упаковочных материалов;
4) изготовление и проверку готовой продукции в соответствии с принятыми инструкциями;
5) хранение готовой продукции таким способом, который не влияет на уровень качества;
6) проведение самоинспекции и/или аудита (контроля сторонней организации) качества, которые повышают эффективность системы обеспечения качества.
Правила GMP являются частью фармацевтической системы обеспечения качества, гарантирующей, что продукция производится и контролируется в соответствии со стандартами качества.
25.2 Общие представления о системе правил GMP
Одним из основных показателей качества фармацевтической продукции является безопасность для больного. Этот принцип осуществляется на всех этапах разработки, испытания, производства и реализации ЛС (рис. 82).
Рис. 82. Этапы разработки, испытаний, производства и реализации ЛС-жизненный цикл лекарственного средства.
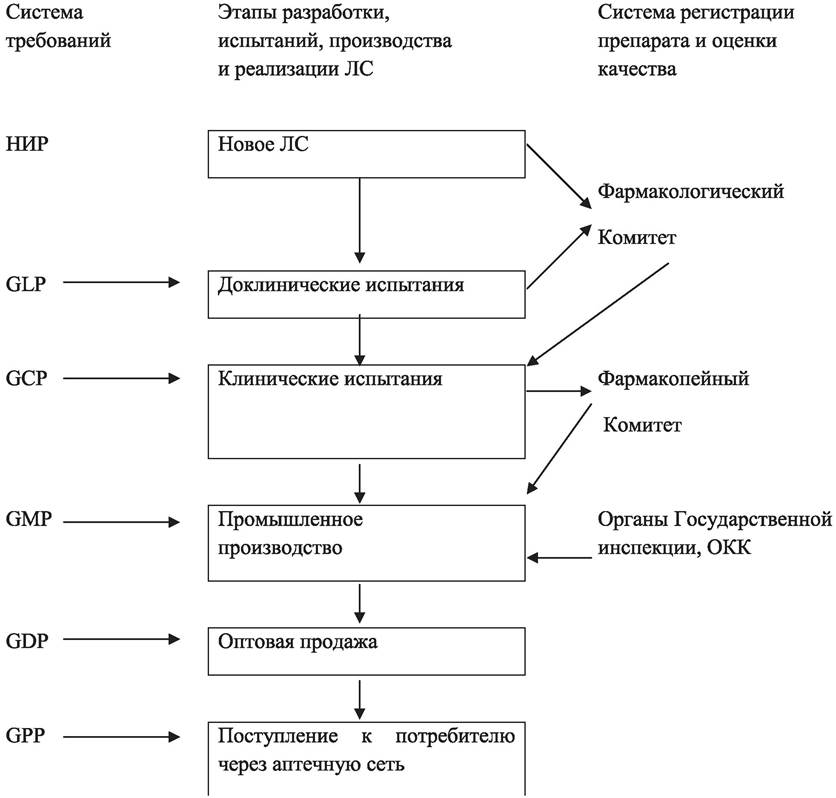
Правила GMP (в дословном переводе «Правила надлежащего, доброкачественного производства») направлены на решение двуединой задачи: (1) они являются гарантами качества производимой продукции, (2) направлены на уменьшение риска, свойственного любой фармацевтической продукции, который не может быть полностью исключен при проверке на соответствие стандартам качества.
Некачественные лекарства не только представляют опасность для здоровья людей, но и наносят материальный ущерб государству и индивидуальным потребителям. Некачественные лекарства могут содержать токсичные вещества, добавленные неумышленно. Препарат, не содержащий действующих веществ в достаточном количестве, не будет давать ожидаемого терапевтического эффекта.

Правила GМР распространяются на все аспекты разработки нового препарата, проектирования, производства, начиная с исходных материалов, помещений и оборудования и заканчивая подготовкой персонала и его личной гигиеной. Для каждого процесса, способного влиять на качество готового продукта, должны быть в наличии детальные инструкции.
Правила GМР содействуют расширению возможностей экспорта медикаментов. Большинство стран согласно импортировать и направлять на реализацию только лекарства, произведенные с соблюдением правил GМР.
В настоящее время к системе правил присоединились 140 государств, в том числе и Россия.
Основные положения GМР:
1. Четкое описание всех производственных этапов, их систематическая проверка.
2. Обоснование всех критических производственных этапов и существенных изменений процессов в соответствии с НАССР.
3. Соблюдение требований к персоналу, условиям производства и помещениям, оборудованию, материалам, емкостям и этикеткам.
4. Составление указаний и описание действий должны быть даны в ясной и однозначной письменной форме и относиться специально к имеющимся установкам.
5. Составление протоколов ведется с указанием всех производственных ступеней, записью и проверкой любых отклонений.
6. Сбыт продукции осуществляется таким образом, чтобы любую угрозу качеству свести к минимуму.
7. Наличие системы отзыва продукции.
8. Проверка претензий и причин нарушения качества для принятия соответствующих мер.
Преимуществами ОМР являются:
1) профилактический подход к проблеме обеспечения качества;
2) комплексный и системный подход;
3) улучшение имиджа производителя;
4) экономическая выгода в долгосрочном плане.
Изготовление некачественных препаратов не приводит к экономии средств. В долгосрочной перспективе поиск и исправление ошибок требуют больших затрат, чем их предотвращение.
Цель GМР — избежать ошибок. Внедрение GМР является инвестицией в высококачественные медикаменты. Изготовление и распространение низкокачественных лекарств приводит к утрате доверия ко всем участникам лекарственного обеспечения, в том числе и к производителю.
Российские правила GМР изложены в разделах ОСТ 42-510-98 «Правила правильного производства», они являются общим руководством, устанавливающим порядок организации производственного процесса и проведения контроля, и содержат минимальные практические указания по правильному ведению производства. Они являются обязательными для всех производителей лекарственных средств.
25.3 Микробиологические требования к организации производства фармацевтической продукции
Всю фармацевтическую продукцию по показателю микробиологической чистоты подразделяют на стерильную и нестерильную.
Стерильные препараты производят в асептических условиях, которые должны исключать их загрязнение микроорганизмами, пирогенными веществами и механическими частицами.
Технологические процессы в производстве стерильных препаратов могут предусматривать проведение стерилизации на завершающей стадии производства (финишная стерилизация) или стерилизацию на промежуточных стадиях. К последней группе относят:
✵ термолабильные препараты, стерилизуемые методом мембранного фильтрования с последующим дозированием;
✵ глазные мази, не стерилизуемые в конечной упаковке (алюминиевых тубах);
✵ глазные капли с последующим заполнением стерильного раствора в тюбики-капельницы (предварительно простерилизованные ионизирующим излучением или химическим методом).
К производству таких препаратов предъявляют особые требования по созданию асептических условий, которые изложены в Приложении к правилам.
Нестерильные препараты производят в неасептических условиях, приближенных к асептическим. Требуемый уровень микробиологической чистоты обеспечивается проведением соответствующих мероприятий, включающих организацию производственных помещений, выбор и эксплуатацию оборудования, и микробиологический контроль производства и готовой продукции, подбор и гигиеническую подготовку персонала.
Персонал фармацевтических предприятий является одним из основных источников контаминации ГЛС и полупродуктов механическими частицами и микроорганизмами.
Весь персонал, работающий на предприятии, должен иметь знания и опыт, необходимые для выполнения соответствующих обязанностей, а также должен быть ознакомлен с правилами GМР.
Состояние здоровья персонала является важным фактором в системе обеспечения качества ГЛС, поскольку человек может быть источником инфекции или способствовать ее переносу. Весь персонал, занятый на производстве, должен проходить регулярные медицинские осмотры. К работе в чистых помещениях не должны допускаться люди, страдающие аллергическими и кожными заболеваниями, повышенным отделением перхоти, а также курящие. Временно (до нормализации состояния здоровья) к работе не допускаются больные инфекционными заболеваниями и сотрудники, имеющие загар или различные повреждения кожи. Персонал должен ставить в известность руководителей о любых недомоганиях (острых респираторных, кожных) способных оказать нежелательное воздействие на качество ЛС.
Личная гигиена персонала. Персонал, работающий в производстве стерильных лекарственных средств, должен строго соблюдать правила личной гигиены: регулярно принимать душ, мыть голову не реже 2-х раз в неделю. Подготовка персонала к работе должна осуществляться в определенном порядке. Во время работы необходимо носить технологическую одежду, соответствующую выполняемым производственным операциям (ГОСТ Р 52538-2006).
Во время работы запрещается использование косметики, а также запрещается носить часы и ювелирные изделия, вносить в производственные помещения личные вещи, запрещается принимать пищу и хранить еду, личные лекарства.
Правила поведения персонала. В производстве стерильных лекарственных средств необходимо строго ограничивать число работающих до минимально необходимого уровня. Запрещается бесцельное хождение во время работы. Все движения должны быть медленными и плавными. Запрещаются разговоры на посторонние темы; устное общение с людьми, находящимися вне производственных помещений, осуществляется через телефон или селектор. Запрещается смех, крики, так как при этом увеличивается число выделяемых изо рта микроорганизмов. Нельзя поднимать и использовать упавшие на пол во время работы предметы. Запрещается использование карандашей, перьевых ручек, разрешается применение шариковых ручек или фломастеров, которые один раз в смену протирают салфеткой из специальной ткани, смоченной этиловым спиртом.
Обо всех нарушениях и неблагоприятных изменениях санитарного режима персонал должен сообщать руководителю.
Неправильная подготовка и поведение персонала приводит к резкому снижению показателей микробиологической чистоты.
25.4 Управление рисками для качества
При производстве и применении лекарственного препарата, включая его компоненты, в определенной степени обязательно присутствуют риски [38, 39]. Риски для качества являются только одной составляющей общего риска. Важно понимать, что качество продукции следует поддерживать в течение жизненного цикла продукции, таким образом, чтобы характеристики, имеющие значение для качества лекарственного препарата, оставались такими же, как у лекарственных препаратов, использовавшихся при клинических исследованиях. Эффективный подход к управлению рисками для качества может в дальнейшем гарантировать пациенту высокое качество лекарственного препарата с помощью установления в ходе разработки и производства предупреждающих методов идентификации и контроля возможных проблем, связанных с качеством. Управление рисками для качества основывается на научном и практическом подходе к принятию решений. Оно предусматривает документально оформленные, понятные и воспроизводимые методы по осуществлению этапов процесса управления рисками для качества на основании имеющихся знаний относительно оценки вероятности, тяжести и иногда способности к выявлению рисков.
Управление рисками для качества — это систематический процесс для общей оценки, контроля, информирования и обзора рисков для качества лекарственного препарата на протяжении его жизненного цикла. Модель управления рисками для качества представлена на рис. 82. настоящего документа.
Рис. 83. Общая схема типового процесса управления рисками для качества.
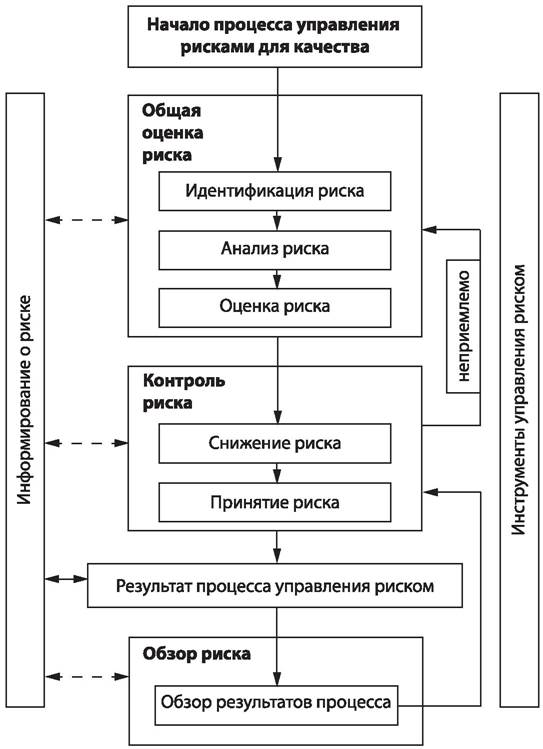
На приведенной схеме не указаны точки принятия решений, поскольку решения могут быть приняты в любой точке процесса. Эти решения могут возвращать на предыдущий этап для поиска дальнейшей информации, чтобы откорректировать модели рисков или даже прекратить процесс управления риском из-за информации, являющейся основанием для такого решения. Примечание: «неприемлемо» на рис. 83 настоящего документа касается не только законодательных, административных или надзорных требований, но также необходимости пересмотреть процесс общей оценки рисков. Общая оценка рисков состоит из идентификации опасностей, а также анализа и оценки рисков, связанных с воздействием этих опасностей (как указано ниже). Общую оценку рисков для качества начинают с четкого описания проблемы или аспекта риска. Если рассматриваемый риск четко определен, будет легче установить соответствующий инструмент управления риском. Результатом общей оценки рисков является либо количественная оценка рисков, либо качественное описание диапазона рисков. Если риски выражены количественно, используют числовое выражение вероятности. Управление рисками для качества в технологическом процессе необходимо проводить в критических контрольных точках, которые определяются с использованием системы НАССП.
Анализ опасностей и (Hazard Analysis and Critical Control Points — HACCP) является системным, предупреждающим и профилактическим инструментом для обеспечения качества, надежности и безопасности продукции. Это структурированный подход с применением технических и научных принципов для анализа, оценки, предупреждения и контроля рисков или неблагоприятных последствий опасности, которые являются результатом планирования, разработки, производства и применения продукции.
HACCP может быть применен для определения рисков, связанных с физической, химической и биологической опасностью (в том числе микробной контаминацией), и управления ими. HACCP наиболее полезен, если понимание продукции и процесса является достаточно полным для обеспечения идентификации критических контрольных точек. Результатом HACCPявляется информация относительно управления рисками, облегчающая мониторинг критических точек не только в ходе производственного процесса, но и на других этапах жизненного цикла.
HACCP состоит из следующих семи этапов:
1. проведение анализа безопасности и определение предупреждающих мер для каждой стадии процесса;
2. определение критических контрольных точек;
3. установление критических пределов;
4. установление системы проверки критических контрольных точек;
5. определение корректирующих мероприятий, которые должны быть проведены, если при мониторинге установлено, что критические контрольные точки являются неконтролируемыми;
6. введение системы подтверждения, что система HACCP работает эффективно;
7. установление системы хранения записей.
25.5 Принципы GPP в обеспечении качества лекарственных средств
Обеспечение качества ЛС — одна из важнейших задач современной фармации. Для стандартизации и унификации процесса обеспечения качества ЛС на этапе непосредственного их поступления к пациентам (т. е. в розничном звене распределения ЛС) признается необходимым использование принципов и методов стандартов «Надлежащая Аптечная Практика» (Good Pharmacy Practice — GPP).
Важнейшим показателем качества ЛС является их соответствие требованиям Фармакопеи по микробиологическим показателям. С этой целью в аптеках, где ЛС изготовляются по рецепту врача, предусмотрен микробиологический контроль.
Объектами микробиологических исследований являются:
1) вода дистиллированная;
2) инъекционные растворы до стерилизации;
3) инъекционные растворы после стерилизации;
4) глазные капли после стерилизации;
5) глазные капли, приготовленные в асептических условиях на стерильных основах;
6) сухие лекарственные вещества, используемые для изготовления инъекционных растворов;
7) аптечная посуда, пробки, прокладки, прочие вспомогательные материалы;
8) инвентарь, оборудование, руки и санитарная одежда персонала;
9) воздушная среда.
Отбор проб и микробиологический анализ производят сотрудники лицензированных лабораторий соответствующих санитарно-эпидемиологических учреждений.
Микробиологические показатели качества дистиллированной воды и ЛС должны соответствовать требованиям Фармакопеи.
Критерии оценки микробной обсемененности воздуха приведены в табл. 62.
Таблица 62. Критерии оценки микробной обсемененности воздуха помещений аптек.
№ п/п |
Наименование помещений |
Условия работы |
Общее кол-во колоний микроорганизмов в 1 м3 воздуха |
Кол-во золотистого стафилококка в 250 дм3воздуха |
Кол-во плесневых и дрожжевых грибов в 250 дм3воздух |
1 |
Асептический блок, стерилизационная (чистая половина) |
до работы после работы |
не выше 500 не выше 1000 |
не должно быть не должно быть |
не должно быть не должно быть |
2 |
Ассистентская, фасовочная, дефектарная, материальная |
до работы после работы |
не выше 750 не выше 1000 |
не должно быть не должно быть |
не должно быть не должно быть |
3 |
Моечная |
во время работы |
не выше 1000 |
не должно быть |
до 12 |
4 |
Зал обслуживания |
во время работы |
не выше 1500 |
до 100 |
до 20 |
Большое значение имеют внешний вид и поведение персонала аптеки. Опрятность и чистота одежды, рук, прическа, соблюдение гигиенических навыков играют большую санитарно-просветительную роль. Аптечный работник является личным примером культуры поведения для посетителей, с которыми он постоянно общается.
Каждый аптечный работник на работе должен постоянно носить халат и головной убор (шапочку или косынку), которые обязан менять не реже 2 раз в неделю. Придя на работу, следует надеть халат, тщательно вымыть руки с мылом и обработать дезинфицирующим раствором, волосы полностью убрать под головной убор. Хранить личную и производственную одежду необходимо раздельно. Аптечные работники должны иметь сменную обувь. В течение рабочего дня надо следить за чистотой рук, спецодежды, своего рабочего места, ежедневно менять полотенце для рук.
Перед посещением туалета аптечный работник должен снять халат, а после посещения тщательно вымыть руки с мылом и обработать их дезинфицирующим раствором. Все это производится в предуборной, где должны быть раковина с подводкой холодной и горячей воды, емкость с дезинфицирующим раствором,
воздушная электросушилка, вешалки для полотенца и для халата.
Запрещается выходить в халатах за пределы производственных помещений и тем более за пределы аптеки, входить в производственные помещения без халата, носить в его карманах предметы личного пользования, за исключением чистого носового платка, хранить в одном шкафу личную и производственную одежду.
Уход за кожей и поддержание ее чистоты является одним из основных требований личной гигиены. Особое внимание следует обращать на состояние подногтевых пространств.
Работники, изготавливающие лекарства в асептических условиях, должны особенно строго соблюдать правила личной гигиены. Изготовление стерильных лекарств должно производиться в условиях тщательного соблюдения правил личной гигиены. Следует надевать специально наглухо закрытый (хирургический) халат, иметь отдельный головной убор и обувь, стерильную марлевую повязку. Смена одежды производится в предасептической (шлюз).
Обработка рук персонала. Обработку рук производят в специально предназначенных местах. Запрещается мыть руки над раковиной для мытья аптечной посуды.
Для механического удаления загрязнений руки моют теплой проточной водой в течение 1-2 мин. мылом с высокой пенообразующей способностью (банное, детское, хозяйственное). Затем руки ополаскивают водой для удаления мыла и обрабатывают дезрастворами.
В асептическом блоке руки моют мылом в течение 1-2 мин., затем ополаскивают, обрабатывают дезраствором, вытирают насухо. После этого надевается стерильная технологическая одежда. Обработку рук повторяют, если работа длится более 4-х часов.
Для дезинфекции рук используют спирт этиловый 70% или другие спиртосодержащие препараты (АХД- 2000, октонидерм, октонисепт), раствор хлоргексидина биглюконата 0,5% (в 70% этиловом спирте), раствор йодофоров: йодопирон, йодонат, йодовидона 1%, при отсутствии других препаратов используют 0,5% раствор хлорамина Б.
При обеззараживании рук спиртосодержащими препаратами их протирают марлевой салфеткой, смоченной раствором. При использовании растворов хлоргексидина или йодофоров препарат наносят на ладони в количестве 5-8 мл и втирают в кожу рук. При обработке рук раствором хлорамина их погружают в 0,5% раствор и моют в течение 2 мин., затем дают рукам высохнуть.
По окончании работы руки обмывают теплой водой и обрабатывают смягчающими средствами: смесью из равных частей глицерина, спирта, 10% раствора аммиака и воды, которую пред применением тщательно встряхивают. Возможно применение смягчающих средств, готовых кремов.
25.6 Хранение в аптечных учреждениях лекарственных средств
Порядок хранения лекарственных средств и изделий медицинского назначения регламентирован Приказом Министерства здравоохранения от 13.11.1996 г. №337.
Соблюдение утвержденного порядка позволяет обеспечить сохранение высокого качества лекарств и создать безопасные условия труда фармацевтов при работе с ними.
Правильное хранение лекарств основано на правильной и рациональной организации складирования, строгом учете его движения, регулярном контроле сроков годности лекарств.
Очень важно поддерживать оптимальную температуру и влажность воздуха, соблюдать защиту определенных препаратов от света.
Нарушение правил хранения лекарств может привести не только к снижению эффективности их действия, но и нанести вред здоровью.
Чрезмерно длительное хранение лекарств (даже при соблюдении правил) недопустимо, так как изменяется фармакологическая активность препаратов.
Инструкция по организации хранения лекарственных средств и изделий медицинского назначения распространяется на все аптеки и аптечные склады.
Оборудование помещений хранения должно обеспечивать сохранность лекарств. Эти помещения обеспечиваются противопожарными средствами, в них поддерживаются необходимые температура и влажность воздуха.
Большую роль играет чистота воздуха помещений хранения лекарств, для этого они должны быть оборудованы приточно-вытяжной вентиляцией или в крайнем случае форточками.
Если аптеки расположены в климатических зонах с резкими колебаниями температуры и влажности, их оборудуют кондиционерами. В помещениях хранения лекарств должно быть достаточное количество шкафов, стеллажей, поддонов и т. д. Стеллажи должны находиться на расстоянии 0,5-0,7 м и от наружных стен, не менее 0,25 м от пола и 0,5 м от потолка. Расстояние между стеллажами должно быть не менее 0,75 м, проходы должны быть хорошо освещены. Чистота помещений аптек и складов обеспечивается влажной уборкой не реже 1 раза в день с применением разрешенных моющих средств.
В зависимости от физических и химических свойств лекарственных средств, воздействия на них факторов внешней среды их подразделяют на лекарства, требующие защиты от влажности, света, высыхания, повышенной и пониженной температуры, красящие и пахучие, дезинфицирующие вещества.
Лекарства, хранящиеся в защищенном от света месте, — антибиотики, настойки, экстракты, витамины, кортикостероиды, растительное сырье, нитросоединения, амино- и амидосоединения, производные фенола, фенотиазина — препараты хранят в таре из светозащитных материалов.
Защита лекарственных средств от влаги нужна таким гигроскопичным веществам и препаратам, как сухие экстракты, растительное сырье, соли азотистой, азотной, фосфорной кислот, антибиотики, ферменты. Эти лекарственные средства хранят в сухом помещении в плотной таре из стекла, металла, алюминиевой фольги, пластмассы.
В защите от высыхания и улетучивания нуждаются такие вещества, как спиртовые настойки, густые экстракты, жидкие спиртовые концентраты, эфирные масла, растворы аммиака, хлористого водорода, формальдегида, карболовой кислоты, спирт этиловый, перекись водорода, гидрокарбонат натрия, хлорамин В. Такие препараты необходимо хранить в герметичной таре из стекла, металла, алюминиевой фольги в прохладном месте.
В защите от воздействия повышенной температуры нуждаются многие лекарства (антибиотики, гормональные препараты, гликозиды, витамины, мази на жировой основе, иммунобиологические препараты). В инструкции по применению препарата указана температура хранения: комнатная (+18-20°С), прохладная (+12-15 °С). Иногда требуется низкая температура хранения (например, для АТФ +3-5°С).
Иммунобиологические препараты хранят раздельно по наименованиям, сериям, с учетом срока их
годности. Температура хранения этих средств указана в инструкции. Не реже 1 раза в месяц иммунобиологические препараты подвергаются визуальному контролю.
Хранение антибиотиков обычно проводится при комнатной температуре в промышленной упаковке, если в инструкции нет других указаний.
Органопрепараты хранят в сухом прохладном и темном месте при температуре от 0 до ±15°С (если нет других указаний на этикетке).
Красящие и пахучие лекарственные средства и парафармацевтическую продукцию (такие как бриллиантовый зеленый, индигокармин, метиленовый синий) хранят в специальном шкафу в плотно укупоренной таре раздельно по наименованиям. Для работы с веществами каждого наименования выделяют отдельные весы, шпатель, ступку и другой инвентарь.
Хранение готовых лекарственных средств проводится с учетом свойств составляющих их ингредиентов.
Лекарственные средства с истекшим сроком годности хранятся отдельно и подлежат переконтролю (после получения результатов анализа).
Таблетки и драже необходимо хранить отдельно от других средств в заводской упаковке в сухом и при необходимости в защищенном от света месте.
Инъекционные препараты хранят в прохладном темном месте в шкафу или изолированном помещении.
Жидкие лекарственные формы (настойки, сиропы и др.) хранят в герметичной таре, наполненной доверху в темном и прохладном месте. При выпадении осадка настойки можно отфильтровать. Она считается пригодной к применению после проверки ее качества.
Плазмозаменяющие и дезинтоксикационные растворы хранят отдельно при температуре от 0 до +14°С в темном месте.
Экстракты подлежат хранению в стеклянной таре с навинчивающейся крышкой и пробкой с прокладкой в темном месте при температуре +12-15 °С.
Линименты, мази, суппозитории подлежат хранению в темном и прохладном месте в хорошо укупоренной таре.
Лекарственное растительное сырье хранят в сухом, хорошо вентилируемом помещении в хорошо закрытой таре.
Резаное сырье должно находиться в тканевых мешках, порошки — в двойных мешках (многослойный бумажный — внутренний, тканевый — наружный), в картонных упаковках. Иногда допускается упаковка из полимерных материалов.
Листья наперстянки, почечный чай и другие гигроскопичные травы и плоды хранят в стеклянной плотно укупоренной таре.
Растительное лекарственное сырье периодически контролируют согласно требованиям Фармакопеи.
Если сырье поражено плесенью, вредителями или теряют нормальную окраску и запах, его в зависимости от степени поражения или бракуют, или (после обработки) используют.
Более строгими являются сроки хранения и контроля у растительного сырья, содержащего сердечные гликозиды.
Дезинфицирующие средства хранят в прохладном темном месте, в герметично укупоренной таре, вдали от мест хранения пластмассовых, металлических и резиновых изделий, от помещений получения дистиллированной воды.
Существуют правила хранения наркотических и высокотоксичных лекарственных средств, изделий медицинской техники, огнеопасных и взрывоопасных веществ, которые здесь не рассматриваются.
Заключение
Безопасность лекарственного средства (ЛС) для больного обеспечивается системой требований и контроля на всех этапах разработки, испытания, производства и реализации ЛС.
Правила GMP (Good Manufacturing Practice) являются гарантами качества производимой продукции и направлены на уменьшение риска, который не может быть полностью исключен при проверке на соответствие стандартам качества. Правила GMP охватывают всю сферу производства, в том числе они включают микробиологические требования к производству стерильных и нестерильных ЛС: организация производственных помещений, выбор и эксплуатация оборудования, контроль производства и готовой продукции, подбор и гигиеническая подготовка персонала.
Принципы и методы стандартов GPP (Good Pharmacy Practice) используют для стандартизации и унификации процесса обеспечения качества ЛС на этапе их поступления пациентам, т. е. в розничном звене их распределения.
В аптеках, где ЛС изготавливаются по рецепту врача, предусмотрен микробиологический контроль воды дистиллированной, инъекционных растворов, глазных капель, веществ, используемых для их изготовления, посуды, инвентаря и воздуха.