Молекулярная биология. Практическое руководство - Великов В.А. 2013
Клонирование генов
Лигирование ДНК вектора и гена
Рестрикционные фрагменты ДНК вектора и гена нужно ковалентно объединить в одну двухцепочечную кольцевую молекулу ДНК, ввести вектор
с «чужеродной ДНК» (англ. foreign DNA либо transgene) в клетку E.coli и размножить полученный клон. В качестве клеток-хозяев используют и другие бактерии, а также пивные дрожжи Saccharomyces cerevisiae. В отличие от E.coli в клетках этих эукариотических микроорганизмов возможен посттрансляционный процессинг эукариотического белка («созревание»). Микробиологические манипуляции с бактериями и дрожжами схожие.
Лигирование («сшивание») фрагментов ДНК проводят с помощью фермента ДНК-лигазы. Для этого смешивают рестрицированную одной и той же рестриктазой ДНК плазмиды и гена, добавляют лигазный буфер, ДНК-лигазу фага Т4, АТФ и инкубируют смесь при 16°С от 2 ч для рутинного лигирования до 12 ч для лигирования с целью получения библиотек генов.
Такая «рекомбинация in vitro» даёт рекомбинантную (гибридную) ДНК.
ДНК-лигаза фага Т4 катализирует образование фосфодиэфирной связи между 3’-OH группой и 5’-фосфатом на соседних (сближенных, «отожжённых») комплементарных «липких концах» в присутствии АТФ и ионов Mg2+:
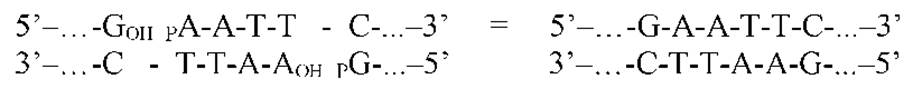
Некоторые рестриктазы имеют разные сайты узнавания, но дают одинаковые липкие концы. При таком лигировании полученная ДНК не будет резаться ни одной из двух использованных рестриктаз. Но гибридный сайт может резаться третьей рестриктазой. Так, фермент SauIIIA разрежет сайт, полученный при лигировании BamHI- и BglII- рестрикционных фрагментов ДНК (см. прил. 3).
Приведена стандартная процедура лигирования ДНК-рестриктов, широко используемая при создании искусственных генетических программ.
Материалы и оборудование
ДНК-лигаза фага Т4, ДНК фагмиды pBluescript II SK+, обработанная рестриктазой BamHI, ДНК плазмиды pSUP106:nptI-sacB-sacR, гидролизованная рестриктазой BamHI или малый фрагмент плазмиды.
Растворы
- 10х буфер для Т4 ДНК-лигазы: 400мМ Tris-HCl, рН 7,8; 100мМ MgCl2; 100мМ ДТТ; 5мМ АТФ.
- Среда 2YT (тема 1)
- Канамицин. Раствор 100 мг/мл в воде.
Методика
1. Смешать рестрицированную ДНК плазмиды и гена в соотношении от 1:2 до 1:10. Молярное количество ДНК вставки должно превышать количество
молекул ДНК вектора для «конкуренции» за вектор с целью повышения выхода рекомбинантов. Существует оптимум концентраций вектора и вставки. Использование слишком низких концентраций вставки вызовет преимущественное самолигирование вектора, слишком высоких - преимущественное образование конкатемеров. Общая концентрация ДНК в реакционной смеси не должна превышать 10 мкг/мл.
2. Добавить к смеси 10х лигазный буфер а - 2 мкл, ДНК-лигазу фага Т4 в количестве 1-2 единиц б, довести до 20 мкл деионизованной водой.
3. Инкубировать смесь при 16°С от 2 до 12 ч в.
4. Переосадить лигазную смесь спиртом.
5. Провести трансформацию клеток E.coli с отбором клонов на канамицине.
6. Отобранные клоны проанализировать на наличие рекомбинантной ДНК электрофорезом и рестрикцией (возможен скрининг и с помощью ПЦР).
Примечания
а ДНК-лигаза фага Т4 удовлетворительно работает во многих рестриктазных буферах после добавления 0,5мМ АТФ. Проявляет при этом 75-100% активности. Т.е. после рестрикции можно сразу ставить лигазную реакцию. Подавляют рестриктазную активность в этом случае предварительным прогревом образца.
б Для лигирования по тупым концам необходимо брать 5 ед. ДНК-лигазы. При таком лигировании дополнительно в лигазную смесь добавляют 2 мкл 50% ПЭГ-4000 или 1 мкл 100мМ спермидина для вязкости, уменьшения флуктуаций слоев жидкости.
в В новых векторах серии TOPOTM ТА Cloning® Kit (InvitrogenTM, Life Technologies) для лигирования ДНК применяют ДНК-топоизомеразу I. Эти векторы очень удобны для клонирования ПЦР-продуктов, которые не нужно при этом подвергать предварительной рестрикции, либо наращивать концы из PolyA. Время лигирования составляет 5-10 мин.